Способ трансэтерификации для получения синтетического производного хлорофилла или бактериохлорофилла
Иллюстрации
Показать всеИзобретение относится к способу получения синтетического производного хлорофилла (Chl) или бактериохлорофилла (BChl) общей формулы I:
где X=0
путем взаимодействия в анаэробных условиях производных Chl, BChl, имеющих в положении С-132 группу СООСН3, а в положении С-172 - группу COOR2, в присутствии тетраэтилортотитаната, при этом для получения соединений I, где R1≠R2, процесс ведут в апротонном растворителе, таком как свободный от пероксида тетрагидрофуран и диметилформамид, а при получении соединений I, где R1=R2,в качестве растворителя используют R1OH. Способ позволяет упростить процесс получения различных производных хлорофилла: Chl, BChl, которые могут быть использованы как сенсибилизаторы; либо могут служить в качестве мостика/спейсера для связывания других подходящих молекул с макроциклом Chl/BChl. 2 с. и 11 з.п. ф-лы, 2 табл., 2 ил.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым производным хлорофилла и бактериохлорофилла, к их получению, применению в способах фотодинамического лечения (PDT) in vivo, для диагностики и фотодинамического уничтожения вирусов и микроорганизмов in vitro.
ОПРЕДЕЛЕНИЯ И СОКРАЩЕНИЯ
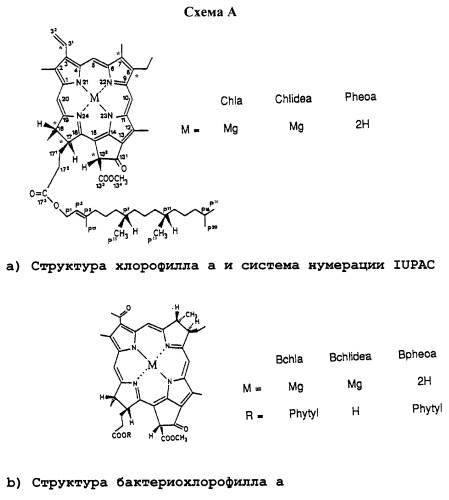
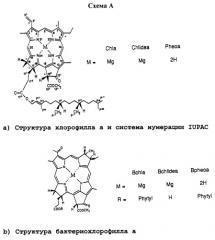
ВСhl = бактериохлорофилл а (Мg-содержащий 7,8,17,18-тетрагидропорфирин формулы (а) в приводимой ниже схеме А, в которой М означает Мg, и имеющий фитиловую или геранилгераниловую группу в положении 173, СOOСН3 группу в положении 132, атом Н в положении 132, ацетилгруппу в положении 3 и этилгруппу в положении 8).
Производное ВСhl = производное BChl с модификациями в макроцикле, в центральном атоме металла и/или на периферии.
BChlide = бактериохлорофиллид а (свободная от С-172 карбоновая кислота, полученная из BChl).
BPhe = бактериофеофитин а (ВСhl, в котором центральный магний замещен двумя атомами Н).
BPheid = бактериофеофорбид а (свободная от С-172 карбоновая кислота, полученная из BPhe).
Chl (b) = хлорофилл а (b) (Мg-содержащий 17,18-дигидропорфирин формулы (b) в приводимой ниже схеме А, в которой М означает Мg, и имеющий фитилгруппу в положении 173, СOOСН3 группу в положении 132, атом Н в положении 132, виниловую группу в положении 3, двойную связь в положениях 7-8, и либо метил в положении 7 и этил в положении 8 (Chl a), либо формилгруппу в положении 7 и этил в положении 8 (Chl b)).
Chlide = хлорофиллид а (свободная от С-172 карбоновая кислота, полученная из Chl).
DMF = диметилформамид; ESI = ионизация электроспреем;
et = этил; gg = геранилгеранил; glс = глюкоза;
HPLC = жидкостная хроматография высокого давления (ЖХВД);
FITC = флюоресцеинизотиоцианат.
[М]-BChl = производное BChl, в котором центральный атом Мg замещен металлом М согласно приводимому ниже описанию.
mе = метил; MS = масс-спектроскопия; NMR = ядерный магнитный резонанс; NtBoc-ser=N-трет-бутоксикарбонилсерил; PDT=фотодинамическое лечение.
Phe = феофитин а (Chl, в котором центральный Мg замещен двумя атомами Н).
Pheid = феофорбид а (свободная от С-172 карбоновая кислота, полученная из Phe); рr = пропил; SDP = сайт-направленное фотодинамическое лечение; ser = серил, серин;
tbb = пара-трет-бутилбензил; THF = тетрагидрофуран;
Ti(OEt)4=тетраэтил-орто-титанат.
На протяжении всего описания используется номенклатура и нумерация (бактерио)хлорофилловых структур в соответствии с IUPAC (Международный союз теоретической и прикладной химии) (см. приводимую ниже Схему А). Согласно данной номенклатуре нативные (бактерио)хлорофиллы имеют две группы сложного эфира карбоновой кислоты в положениях С-132 и С-172, этерифицированные в положениях С-133 и С-173. В номенклатуре и сокращениях, используемых в примерах, вначале появляется этерифицирующий остаток в С-133, затем центральный атом металла, если не Мg, а затем тетрапиррол (существительное), за которым следует остаток сложного эфира С-173. Например, соединение в приводимом ниже примере 1 обозначено как а-173-метиловый эфир 133-трет-бутилбензил-Рd-бактериофеофорбида (сокращенно tbb-Pd-BPheid-me).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Хлорофиллы и бактериохлорофиллы, убиквотные пигменты фотосинтеза, интенсивно изучались с целью понимания их фотофизики и фотохимии (Scheer, 1991). Вместе с более доступными, но спектроскопически менее информативными порфиринами их также применяли для более общего проникновения в явления переноса энергии и электронов, взаимодействия больших ароматических молекул с центральными металлами, а также центральных металлов с лишними лигандами.
Интерес представляет применение фотосенсибилизаторов для фотодинамического лечения (PDT) опухолей. В соответствии с данным способом применяют сочетание нетоксичного лекарственного препарата, поглощающего свет при подходящей длине волны, с неопасным фотосенсибилизирующим облучением пациента после введения лекарственного препарата.
Было установлено, что порфирины аккумулируются в опухолевой ткани и после ее облучения, поглощают свет in situ, обеспечивая возможность определения опухолей по расположению флюоресценции. Как для обнаружения, так и для фотодинамического лечения опухолей было предложено применение сырого производного гематопорфирина, известного как HPD. Форма HPD, которая считается более эффективной, включает порцию HPD, имеющего агрегатную массу свыше 10 кДа и являющегося предметом патента США №4649151. HPD или его активные компоненты были описаны в патенте США №4753958 для местного лечения кожных заболеваний, а также Matthews et al., 1988, для стерилизации биологических образцов, содержащих инфекционные организмы, такие как бактерии и вирусы. Смесь, известная как производное гематопорфирина (HPD), содержащая большое количество связанных сложным эфиром олигомеров гематопорфирина (HP), доступна коммерчески (Photofrin II, Quadra Logic Technologies Inc., Vancouver, ВС, Canada).
С целью оптимизации свойств порфириновых лекарственных препаратов при лечении и диагностике было предложено несколько производных порфирина, в которых, например, присутствует центральный атом металла в комплексе с четырьмя кольцами пиррола, и/или периферические заместители колец пиррола модифицированы, и/или макроцикл дигидрирован до производных Chl (хлорины) либо тетрагидрированы до производных BChl (бактериохлорины).
Производные хлорофилла и бактериохлорофилла имеют лучшие свойства по сравнению с порфиринами, однако они не так легко доступны и более трудны в обращении. Была исследована возможность применения производных хлорофилла (Spikes and Bommer, 1991) и производных бактериохлорофилла (Beems et al., 1987; Dougherty, 1992; Fiedor et al., 1993; Kessel et al., 1993; Moser, 1998; Pandey et al., 1994; Tregub et al., 1993) для диагностики и лечения рака. Благодаря их интенсивному поглощению в благоприятных спектральных диапазонах (650-850 нм) и их легкому распаду после лечения производные хлорофилла и бактериохлорофилла считаются прекрасными сенсибилизаторами для опухолей PDT.
Были исследованы комплексы тетрапирролов с металлами, отличными от Мg, в сериях порфирина и 17,18-дигидропорфирина для понимания их спектроскопических и восстановительно-окислительных свойств (Hynninen, 1991). Бактериохлорофиллы имеют потенциальное преимущество по сравнению с хлорофиллами, поскольку они демонстрируют интенсивные, почти инфракрасные полосы, т.е. при существенно большей длине волны, чем производные хлорофилла.
Публикация Международной заявки РСТ № WO 90/12573 на имя Dougherty описывает производные бактериохлорофилла-а или -b соответствующих бактериохлоринов, которые не имеют центрального атома металла либо в которых центральный атом металла может представлять непарамагнитный металл, выбранный из Mg2+, Sn2+ и Zn2+, а С-172-карбоксильная группа этерифицирована насыщенным или ненасыщенным гидрокарбильным остатком 8-25С, для получения композиции, применимой в способе разрушения или ухудшения нежелательных целевых биологических субстратов, включающего фотосенсибилизацию указанного субстрата эффективным количеством указанного производного с последующим облучением целевого субстрата излучением в диапазоне длины волны, поглощаемой указанным производным в течение периода времени, достаточного для ухудшения или разрушения субстрата. Кроме того, применение данных соединений считается целесообразным для фотодинамического лечения и диагностики. Следует отметить, что несмотря на заявленные комплексы Sn2+ и Zn2+ бактериохлорофилла-а или -b, данные производные металла не были проиллюстрированы примерами, равно как и ни один способ их получения не был раскрыт в описании указанной заявки на патент WO 90/12573.
При нормальных условиях доставки, т.е. в присутствии кислорода, при комнатной температуре и в нормальных световых условиях остатки BChl лабильны и имеют несколько более низкий квантовый выход для получения триплетного состояния по сравнению, например, с производным гематопорфирина (HPD). Однако их возможная инициация биологических окислительно-восстановительных реакций, благоприятные спектральные характеристики и их легкий распад in vivo приводят к потенциальному превосходству бактериохлорофиллов над другими соединениями, например порфиринами и хлорофиллами, при лечении PDT и диагностике, а также для уничтожения клеток, вирусов и бактерий в образцах и живой ткани. Ожидается, что химическая модификация бактериохлорофиллов приведет к дальнейшему улучшению их свойств, однако она весьма ограничена из-за отсутствия подходящих способов получения таких модифицированных бактериохлофиллов (Hynninen, 1991).
Заявка на Европейский патент, опубликованная под №0584552, того же заявителя, что и заявитель настоящей заявки, описывает новые конъюгаты хлорофиллов и бактериохлорофиллов в положении С-173 с аминокислотами, пептидами и белками, применимые для лечения PDT и для диагностики. Аминокислотный, пептидный или белковый остаток связан непосредственно или через спейсер с С-172-карбоксильной группой молекулы хлорофилла или бактериохлорофилла. Данные конъюгаты получают способами, достаточно мягкими для того, чтобы удержать кислотолабильный центральный атом Мg.
С-132-карбометоксигруппу хлорофиллов и бактериохлорофиллов биосинтетически получают из боковой цепи С-13 пропионовой кислоты и части реакционноспособной β-кетоэфирной системы, присутствующей в изоциклическом кольце большинства хлорофиллов. Однако в отличие от боковой цепи сложного С-17 пропионового эфира не имеется никаких способов ни для химической, ни для ферментной трансэтерификации в положении С-133. Единственной ранее известной реакцией для данной группы является расщепление, приводящее к получению 132-деметоксикарбонил- или пирохлорофиллов. В заявке на патент Германии № DE 4121876 и публикации РСТ № WO 97/19081, принадлежащих данному заявителю, предложены производные бактериохлорофиллов с модифицированными остатками сложных эфиров в положении 133 и 173. Однако в указанных заявках описаны только производные бактериохлорофилла с нативными остатками метилового эфира в положении 133 и не описаны способы получения других сложных эфиров в положении 133.
Существует необходимость получения новых производных хлорофилла и бактериохлорофилла, применимых для PDT, с целью поддержания или даже улучшения благоприятных оптических и физиологических свойств Chl и BChl, при этом оптимизируя их фотосенсибилизирующий потенциал, а также улучшая их химическую стабильность и оптимизируя их физиологический срок действия.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с настоящим изобретением было установлено, что новые диэфиры С-133/С-173 хлорофиллов и бактериохлорофиллов могут быть получены путем селективной трансэтерификации С-132-карбометоксигруппы производных хлорофилла и бактериохлорофилла как таковых либо вместе с боковой цепью С-17 пропионовой кислоты в безводных и анаэробных условиях в присутствии избытка спирта и с применением тетраэтил-о-титаната в качестве катализатора. Данная процедура достаточна мягка для того, чтобы обеспечить модификацию, т.е. трансэтерификацию, кислотнолабильных пигментов, таких как нативные, Мg-содержащие хлорофиллы.
В настоящем изобретении раскрыты новые производные хлорофилла и бактериохлорофилла общей формулы I:
в которой
М означает центральный атом металла или представляет два атома Н;
каждый из R3 и R5 независимо представляет ацетил, винил, этил, 1-гидроксиэтил либо простой или сложный эфир указанного 1-гидроксиэтилрадикала;
R4 представляет метил или формил;
пунктирная линия в положениях 7-8 представляет необязательную двойную связь; а
R1 и R2, одинаковые или различные, выбраны из группы, включающей:
(i) C1-C25 гидрокарбилрадикал, который может быть прямолинейным или разветвленным, насыщенным или ненасыщенным, необязательно замещенным одним или несколькими радикалами, выбранными из галогена, оксо (=O), OН, СНO, СOOН или NH2, либо прерван одним или несколькими гетероатомами, выбранными из O, S и NH, либо карбоциклическими или гетероциклическими остатками;
(ii) остаток аминокислоты, олигопептида или полипептида, содержащего гидроксигруппу, либо их производное, выбранное из группы, включающей сложные эфиры и N-защищенные производные, где указанная гидроксилированная аминокислота или ее производное связано с СOO- остатком производного Chl или BChl через указанную гидроксигруппу;
(iii) остаток пептида, описанный в (ii), связанный с СOO- остатком через C1-C25 гидрокарбил, описанный в (i), где указанный C1-C25 насыщенный или ненасыщенный гидрокарбильный остаток, необязательно замещенный одним или несколькими радикалами, выбранными из галогена, оксо (=O), ОН, СНО, СООН или NH2, либо такой остаток, прерванный одним или несколькими гетероатомами, выбранными из O, S и NH, либо фенильным кольцом, далее замещен концевой функциональной группой, выбранной из ОН, СООН или NH2;
(iv) остаток клеточно- или тканево-специфического лиганда, выбранного из олигопептида и белка, непосредственно связанного с СOO- остатком или через C1-C25 гидрокарбил, описанный в (i), в котором указанный C1-C25 насыщенный или ненасыщенный гидрокарбильный остаток, необязательно замещенный одним или несколькими радикалами, выбранными из галогена, оксо (=O), OН, СНO, СOOН или NH2, либо такой остаток, прерванный одним или несколькими гетероатомами, выбранными из O, S и NH, либо фенильным кольцом, далее замещен концевой функциональной группой, выбранной из OН, СOOН или NH2; и
(v) остаток моно-, олиго- или полисахарида или полиоксиэтилена, непосредственно связанный с СOO- остатком или через C1-C25 гидрокарбил, описанный в (i), где указанный C1-C25 насыщенный или ненасыщенный гидрокарбильный остаток, необязательно замещенный одним или несколькими радикалами, выбранными из галогена, оксо (=O), ОН, СНО, СOOН или NH2, либо такой остаток, прерванный одним или несколькими гетероатомами, выбранными из О, S и NH, либо фенильным кольцом, далее замещен концевой функциональной группой, выбранной из ОН, СOOН или NH2.
Соединения формулы I, в которых R3 представляет винил, R4 представляет метил или формил, R5 представляет этил, а пунктирная линия в положениях 7-8 представляет двойную связь, являются производными хлорофилла а и b соответственно. Соединения формулы I, в которых R3 представляет ацетил, R4 представляет метил, R5 представляет этил, а положения 7-8 гидрированы, являются производными бактериохлорофилла а.
Центральный атом металла М в соединении формулы I может отсутствовать, может быть нативным атомом Мg натуральных пигментов хлорофилла и бактериохлорофилла, либо он может быть двухвалентным металлом, выбранным из группы, включающей Pd, Со, Ni, Cu, Zn, Hg, Er, It, Еu, Sn и Мn.
Настоящее изобретение относится к новому способу трансэтерификации для получения синтетических производных хлорофилла и бактериохлорофилла вышеприведенной общей формулы I, включающему следующие стадии:
(a) взаимодействие в анаэробных условиях соответствующего производного (бактерио)хлорофилла, металл(бактерио)хлорофилла или (бактерио)феофитина, имеющего в положении С-132 группу СOOСН3, а в положении С-172 - группу COOR2, со спиртом R1OH, где R1 и R2 имеют вышеуказанные значения, при условии, что R1 не представляет метил, в присутствии тетраэтил-орто-титаната, при этом взаимодействие осуществляют либо в растворителе, таком как свободный от пероксида тетрагидрофуран (ТГФ) или диметилформамид (ДМФ); в этом случае предпочтительно получают диэфир C-132-COOR1, С-172-СОOR2, либо спирт R1OH, применяемый в большом избытке, служит в качестве растворителя; в таком случае получают диэфир C-132-COOR1, C-l72-COOR1; и
(b) отделение желаемого продукта от реакционной смеси.
Методы в соответствии с данным изобретением могут быть осуществлены в сочетании с другими известными методами модификации молекулы, например, конъюгирования в положении С-173, описанного в ЕР 0584552, модификациями на периферии молекулы и/или переметаллирования, например, описанного в WO 97/19081. Предпочтительно деметаллирование или замену центрального атома металла осуществляют перед трансэтерификацией.
Новые соединения хлорофилла и бактериохлорофилла, полученные способом трансэтерификации данного изобретения, применимы в качестве фотосенсибилизаторов как терапевтические и диагностические агенты, например, против рака и возрастной дегенерации желтого пятна, для уничтожения клеток, вирусов и бактерий в образцах и живых тканях, также известных в области применения PDT и других фотосенсибилизаторов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
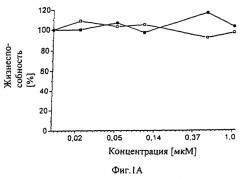
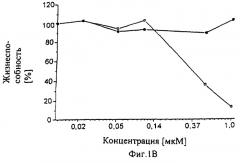
Фиг.1А-1D показывают токсичность в темноте (черные квадраты) и фототоксичность (белые квадраты) относительно клеток меланомы M2R после инкубирования с применением tbb-Pd-BPheid-tbb (1A), tbb-Pd-BPheid-me (1В), Pd-BPheid-et (1C), контроль (1D). Сенсибилизаторы добавляют в липосомы. Жизнеспособность клеток определяли, вводя в ДНК [3Н]-тимидин.
Фиг.2 показывает токсичность в темноте (--+--) и фототоксичность Pd-BPheid-Nglc (черные квадраты) и Pd-BPheid-ser светлые (черные треугольники), темные (белые треугольники) клетки меланомы M2R у мышей. Жизнеспособность клеток определяли, вводя [3H] -тимидин.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому способу трансэтерификации для получения новых производных С-132-COOR1, С-172-СOOR2 и C-132-COOR1, C-172-COOR1 соединений хлорофилла и бактериохлорофилла.
В соответствии с одним из вариантов осуществления данного изобретения R1 и R2 идентичны; в соответствии с другим вариантом они различны.
В соответствии с одним из вариантов осуществления настоящего изобретения R1 и R2 могут представлять гидрокарбильный радикал. В данном описании термин "гидрокарбил" означает любые прямолинейные или разветвленные, насыщенные или ненасыщенные, включая ароматические, гидрокарбильные радикалы, предпочтительно имеющие 1-25 атомов углерода, такие как алкил, предпочтительно имеющий 1-4 атомов углерода, например, метил, этил, пропил, бутил или алкенил, алкинил, циклоалкил, арил, такой как фенил, или аралкильная группа, такая как бензил или замещенный бензил, например, трет-бутилбензил. Если R1 и R2 различны, то R1 предпочтительно представляет метил, радикал, присутствующий в натуральных соединениях Chl и BChl, a R2 предпочтительно представляет этил или радикал, полученный из натуральных соединений Chl и BChl, например, геранилгеранил(2,6-диметил-2,6-октадиенил) или фитил(2,6,10,14-тетраметилгексадец-14-ен-16-ил). Если R1 и R2 различны, то R1 и R2 также могут представлять углеводородную цепь, замещенную одним или несколькими радикалами, выбранными из галогена, такого как F, Br, Cl и I, или ОН, оксо (=O), СНO, СOOН или NH2, либо такая необязательно замещенная гидрокарбильная цепь, прерванная O, S или NH, предпочтительно O, например, R1 или R2, представляет остаток олигооксиэтиленгликоля, имеющий от 4 до 10 атомов углерода, предпочтительно пентаоксиэтиленгликоль, либо карбоциклическими, например, фенил, или гетероциклическими, например, пиридил, остатками.
В соответствии с другим вариантом R1 и R2 могут представлять остаток аминокислоты или пептида (олиго- или полипептид), содержащего гидроксигруппу, такую как серин, треонин и тирозин, или содержащие их пептиды, либо производное указанной аминокислоты или пептида, выбранное из сложных эфиров, например, сложных эфиров алкила, и N-защищенные производные, в которых N-защитная группа представляет, например, трет-бутилокси, карбобензокси или тритил, а указанная гидроксилированная аминокислота или пептид, или их производное связано с группой СОО- производного Chl или BChl через свою гидроксигруппу. Примерами таких производных аминокислот являются метиловый эфир серина, N-трет-бутилоксикарбонилсерин, метиловый эфир N-тритилсерина, метиловый эфир тирозина и метиловый эфир N-трет-бутокситирозина, а примером такого пептида является метиловый эфир N-карбобензоксисерилсерина, при этом все вышеуказанные соединения получены в соответствии с описанием, приведенным в ЕР 0584552. Согласно предпочтительному варианту производное Chl или BChl этерифицируют L-серином или N-трет-бутилоксикарбонилсерином.
В соответствии с дальнейшим вариантом R1 и R2 могут представлять остаток пептида (олиго- или полипептида), связанного с Chl или BChl через радикал C1-C25 гидрокарбила согласно вышеприведенному описанию; в таком случае радикал гидрокарбила служит в качестве спейсера для указанного пептида или полипептида/белка и имеет концевую функциональную группу, выбранную из ОН, СOOН и NH2, через которую пептид или белок связан сложноэфирной или амидной связью.
В соответствии со следующим вариантом R1 и R2 могут представлять остаток клеточно- или тканево-специфического лиганда, выбранного из пептидов и белков, примерами которых являются, но не ограничиваются ими, пептиды гормонов, например, меланоцитстимулирующие гормоны (меланотропины), и антитела, например, иммуноглобулины и опухолево-специфические антитела. В таком случае пептид или белок также могут быть соединены с Chl или BChl через радикал C1-C25 гидрокарбила, как указано выше, при этом радикал гидрокарбила служит в качестве спейсера для указанного пептида или полипептида/белка и имеет концевую функциональную группу, выбранную из ОН, СOOН и NH2, через которую пептид или белок связан сложноэфирной или амидной связью.
В соответствии с очередным вариантом R1 и R2 могут представлять остаток моно-, олиго- или полисахарида, непосредственно связанного с СOO- молекулы Chl или BChl либо через радикал C1-C25 гидрокарбила, как указано выше. В соответствии с предпочтительным вариантом моносахаридом является глюкозамин.
Для получения сложных эфиров в соответствии с данным изобретением трансэтерификацию только в положении С-133 предпочтительно осуществляют взаимодействием С-173, С-133 производного диэфира Chl или BChl, имеющего нативную карбометоксигруппу в положении С-133, с желаемым спиртом R1OH, в котором R1 не представляет метил, в присутствии тетраэтил-орто-титаната, при этом реакцию осуществляют в апротонном растворителе, таком как свободный от пероксида тетрагидрофуран (ТГФ) или диметилформамид (ДМФ). Некоторые сложные эфиры получают данным способом в соответствии с приведенным ниже описанием с этанолом, трет-бутилбензиловым спиртом, пропанолом, трет-бутилоксикарбонилсерином и серином.
В соответствии с другим вариантом трансэтерификацию как в положении С-133, так и в положении С-173 осуществляют одновременно спиртом R1OH. После синтеза следует вышеописанная процедура, однако в качестве растворителя применяют спирт (Неприменимо для NtBoc-ser, представляющего собой твердое вещество). Данным способом в соответствии с нижеприведенным описанием получают некоторые сложные эфиры, включая сложные эфиры tbb, Pr, NtBoc-Ser и ser. Время реакции для пара-трет-бутилбензилового спирта и для н-пропанола составляет 48 и 12 часов соответственно.
Вид спирта и температура определяют, произойдет ли этерификация сильнее в положении С-133 или как в положении С-173, так и С-133. Большие спирты R1OH предпочтительно этерифицируют положение С-133, в то время как небольшие спирты этерифицируют как положение С-173, так и положение С-133.
Предпочтительным растворителем в соответствии с данным изобретением является ТГФ. ДМФ применяют в том случае, если спирт нерастворим в ТГФ. Температура реакционной смеси может составлять 75°С в течение нескольких дней, например, при использовании 1-пропанола, пара-трет-бутилбензилового спирта и N-tBoc-серина.
Отделение продуктов от реакционной смеси осуществляют обычными способами, например, путем добавления диэтилового эфира и воды до разделения фаз, трехкратной экстракции водной фазы простым эфиром, сушки объединенных органических фаз с применением NaCl, выпаривания растворителя в вакууме, удаления избытка спирта в глубоком вакууме (<10-3 Ра) и выделения желаемого трансэтерифицированного производного Chl или BChl в результате применения ЖХВД или колоночной хроматографии.
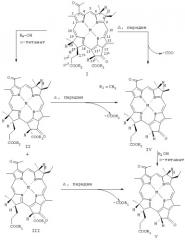
Трансэтерифицированные сложные эфиры Chl и BChl в соответствии с данным изобретением могут быть затем обработаны пиридином при повышенной температуре с целью отщепления С-132-карбометоксиостатка и получения пиропроизводных формул IV и V, приведенных ниже на Схеме В. Пигменты формулы IV могут быть затем трансэтерифицированы, тиолированы или амидированы в положении 173.
Производные Chl и BChl, полученные обоими способами, сами могут быть использованы как сенсибилизаторы в соответствии с данным изобретением, либо они могут служить в качестве мостика/спейсера для связывания других подходящих молекул с макроциклом Chl/BChl.
При получении сложного эфира, когда желаемый пептид или белок, присоединяемый к одному из положений, лишен гидроксилсодержащего аминокислотного остатка, то макроцикл Chl или BChl может быть вначале соединен с серином или любым другим гидроксилсодержащим остатком либо его производным путем трансэтерификации нативных соединений или этерификации соответствующих свободных кислот (Chlide или BChlide), а затем пептид или белок связывают с макроциклом через такой аминокислотный остаток.
Для получения замещенных металлом производных Chl и BChl нативный центральный атом Мg замещают желаемым металлом М перед конъюгированием пигмента с аминокислотным или клеточно-специфическим лигандом. Замещение центрального атома Мg в хлорофилле и его производных на Pd, Еr, Сu, Ni, Zn, V, Co, Sn, Hg и другие двухвалентные металлы осуществляют обычными способами, например, обработкой соответствующего феофитина солью желаемого металла, например, ацетатом Zn или Сu, в абсолютном этаноле при комнатной температуре (Hambright, 1975; Hynninen, 1991). В случае бактериохлорофилла и его производных центральный атом Мg может быть замещен Zn, Сu или Pd в результате похожей процедуры, включающей обработку ацетатом Zn, Сu или Pd в аргоне при повышенных температурах, как описано в WO 97/19081.
Если R1 представляет замещенный гидрокарбил, то он может содержать концевую функциональную группу, через которую он может быть прикреплен к другим желательным остаткам, например, сложноэфирную группу получают взаимодействием либо концевой карбоксильной группы R1 с карбоксильной группой другого соединения, такого как аминокислота или сахарид, либо концевой гидроксильной группы R1 с карбоксильной группой другого указанного соединения; амидную группу получают взаимодействием концевой карбоксильной группы R1 с аминогруппой другого соединения, такого как аминокислота, либо концевой аминогруппы R1 с карбоксильной группой другого соединения, такого как аминокислота.
Новые сложные эфиры, полученные способом трансэтерификации данного изобретения, имеют такие же характеристики оптического поглощения и фотофизические характеристики, как и соответствующие Chl и BChl. Поэтому ожидается, что после внедрения в обработанную ткань новые сложные эфиры Chl и BChl станут эффективными фотодинамическими агентами. Таким образом, они могут быть использованы в качестве фотосенсибилизаторов как терапевтические и диагностические агенты, для уничтожения клеток, вирусов и бактерий в образцах и живых тканях, хорошо известных в области HPD и других фотосенсибилизаторов. Данные соединения применимы, например, для сенсибилизации неопластических клеток или других аномальных тканей к разрушению облучением in vivo или ex vivo с применением света с соответствующей длиной волны. Полагают, что энергия фотоактивации передается эндогенному кислороду, превращая его в синглетный кислород, который, как считается, отвечает за цитотоксическое действие. Кроме того, фотоактивированные формы (бактерио)хлорофиллов флюоресцируют, что может помочь при локализации опухолей или других мест, в которые вводят (бактерио)хлорофиллы.
Примеры известных в данной области показаний, при которых могут быть назначены новые производные (бактерио)хлорофиллов, полученные способом трансэтерификации данного изобретения, включают разрушение опухолевой ткани в твердых опухолях, растворение бляшек в кровеносных сосудах (см. например, патент США №4512762); лечение местных состояний, таких как акне, стопа атлета, бородавки, папилломы и псориаз, а также обработку биологических продуктов (таких как кровь для переливания) с целью уничтожения инфекционных агентов.
Производные (бактерио)хлорофилла, полученные способом трансэтерификации настоящего изобретения, приготавливают в виде готовых фармацевтических композиций, вводимых пациенту или применяемых для объекта in vitro, используя способы, хорошо известные в данной области, например, описанные в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton Penna., последнее издание. Композиции могут быть введены системно, в частности, путем инъекций, либо могут иметь местное применение.
Для диагностики производные (бактерио)хлорофилла могут быть использованы как таковые либо могут быть помечены радиоизотопом или другим средством для обнаружения, известным в данной области.
Согласно практике, количество вводимого производного (бактерио)хлорофилла соответствует другим порфиринам, применяемым для PDT, и варьируется в зависимости от выбора производного, используемого в качестве активного ингредиента, подвергаемого лечению состояния, способа введения, возраста и состояния пациента, а также заключения врача.
Длину волны облучающего света предпочтительно выбирают таким образом, чтобы она соответствовала максимальному поглощению фотосенсибилизатора (бактерио)хлорофилла. Подходящая длина волны для любого соединения может быть легко установлена по его спектру поглощения.
Помимо применения in vivo, производные (бактерио) хлорофилла, полученные способом трансэтерификации данного изобретения, могут быть использованы для обработки материалов in vitro для уничтожения опасных вирусов или инфекционных агентов, таких как опасные бактерии. Например, кровь и плазма крови, предназначенные для переливания, могут быть обработаны соединением в соответствии с данным изобретением и подвергнуты облучению с целью стерилизации.
Конъюгирование белков, например, гормонов, факторов роста или их производных и антител, а также питательных веществ для клеток, например, тирозина, с остатками Chl и BChl, как подразумевается, способствует их лучшему удержанию в опухолях и на обрабатываемых участках. Усиление сдвига в красную область обеспечивает более глубокое проникновение, сохраняя убиквотность натуральной системы. Замена Мg другими металлами, как подразумевается, способствует оптимизации собственной и метаболической стабильности остатка Chl или BChl и его внутрисистемному пересечению с возбужденным триплетным состоянием, а также открывает возможность для новых диагностических процедур.
Опухолево-специфические антитела предпочтительно нацеливают остатки Chl и BChl в опухоли или на обрабатываемый участок, в то время как гормоны и питательные вещества для клеток также могут быть захвачены нормальными, нетрансформированными двойниками. Однако клетки, выбранные в качестве мишеней для гормонов и питательных веществ для клеток, таких как меланоциты, рассеяны среди других клеток в нормальных условиях и при трансформации в злокачественные клетки собираются вместе, образуя твердые опухоли. В результате ожидается, что концентрация фотосенсибилизатора в злокачественной ткани резко возрастет относительно его концентрации в нормальной ткани, где клетки более диспергированы, обеспечивая усиление действия PDT на опухолевом участке. Это позволяет эффективно применять невысокие дозы, ниже порога разрушения нормальной ткани, таким образом снижая необходимость применения четко направленного в пространстве облучения. Кроме того, обладая очень сильной флюоресценцией, сайт-направленный Chl или BChl может быть использован для флюоресцентного мечения опухолевого участка (участков) или других мишеней.
Новые фотосенсибилизаторы Chl и BChl, полученные способом трансэтерификации данного изобретения, подходят для лечения опухолей-меланом по нескольким причинам: (а) на ранних стадиях (неметастатических) злокачественная меланома и другие опухоли кожи легко доступны для PDT; (b) фотодинамическое лечение с применением зеленого света, а также обычная химиотерапия и радиотерапия до сих пор не достигли успеха в лечении меланом; (с) однако существует несколько специфических для меланомы лигандов, которые могут нацелить фотосенсибилизирующий остаток на опухолевой участок, и (d) ожидается, что применение возбуждаемых длинными волнами остатков Chl и BChl устранит недостатки обычно применяемых фотосенсибилизаторов, которые экранируются из-за поглощения меланина.
Опухоли-меланомы возникают в результате канцерогенной трансформации (включая УФ-индуцированный мутагенез) меланоцитов. Нормальные меланоциты включают небольшое количество нормальной популяции клеток кожи человека и обычно располагаются в базальном клеточном слое между эпидермисом и дермисом, где каждая из них окружена 30-40 кератиноцитами и одной клеткой Лангерханса. Лечение опухолей-меланом особенно затруднительно при использовании PDT, поскольку клетки опухоли-меланомы могут содержать черные нерастворимые эумеланины (поли-5,6-индолхиноны), имеющие широкую полосу поглощения вокруг 540 нм и поэтому соревнующиеся с любым фотосенсибилизатором за излучение на длине волн менее 650 нм. Кроме того, молекулы меланина могут гасить образовавшиеся радикалы кислорода, тем самым предотвращая интоксикацию органелл жизнеспособных клеток. Следовательно, PDT меланотических меланом обычно применяемыми HPD не очень обнадеживает. Однако имея максимальное оптическое поглощение при длине волны свыше 650 нм, возбужденные Chl и BChl и их синтетические производные не должны заслоняться меланином. Более того, опухолевые клетки меланомы (т.е. трансформированные меланоциты) потребляют значительное количество тирозина во время синтеза меланина, проявляют высокую аффинность по отношению к меланотропинам (α-, β- и γ-меланоцитстимулирующие гормоны (MSH) гипофиза) и к нескольким известным антителам. Поэтому они могут служить хорошей мишенью для тирозин-, меланокортин- или антител-конъюгатов Chl и BChl, при условии, что конъюгирование не сильно влияет на распознавание лигандов клеточными рецепторами. Поскольку концентрация меланоцитов увеличивается почти в 40 раз на участках меланомы (относительно нормальной ткани кожи), то ожидается резкое усиление фотодинамического действия.
Новые производные Chl и BChl, полученные способом трансэтерификации настоящего изобретения, могут быть использованы в качестве активных агентов в фармацевтических композициях для фотодинамического лечения некоторых видов рака, включая рак мозга, яичников, молочной железы, опухоли, рак кожи, легких, пищевода и мочевого пузыря, а также другие гормоночувствительные опухоли.
Например, соединения могут быть использованы в фотодинамических лечениях злокачественных меланом. Фотодинамическое действие соединений наблюдают на клетках меланомы в опухолевых и клеточных культурах. Примеры производных, которые могут быть использованы для данной цели, включают конъюгаты производных Chl и BChl с α-меланотропином, связанным с остатком пигмента либо через свои остатки серина, тирозина или лизина, либо через концевую аминогруппу.
Фармацевтические композиции могут быть введены пациенту обычными способами, применяемыми при PDT. Количество вводимого соединения и способ введения определяют в соответствии с родом опухоли, стадией заболевания, возрастом и состоянием здоровья пациента, однако указанное количество намного ниже применяемой в настоящее время дозировки фотофрина II, составляющего около 20-40 мг HPD/кг массы тела. Предпочтительным способом введения является внутривенный способ или прямая инъекция в твердую опухоль водного раствора активного сое