Набор для радиоактивного мечения и анализ связывания
Иллюстрации
Показать всеИзобретение относится к области радиационной биохимии. Сущность изобретения состоит в наборах для анализа связывания антител и радиоактивного мечения, предназначенных для тестирования антител при опухолях. В частности, разработаны наборы для приготовления и оценки радиомеченых анти-CD20-конъюгатов, которые используют для лечения и диагностики В-клеточных лимфомных опухолей. Все реагенты стерильны и дают при использовании высоковоспроизводимые результаты. Технический результат - расширение арсенала диагностических средств для выявления опухолей. 9 н. и 95 з.п. ф-лы, 46 табл., 45 ил.
Реферат
ПРЕДПОСЫЛКА ИЗОБРЕТЕНИЯ
1. Область изобретения
Данное изобретение имеет отношение к анализам связывания антител и наборам для радиоактивного мечения, препаратам лиофилизированных клеток, реактивам и протоколам тестирования клинической эффективности используемых в терапии антител при лечении/визуализации опухолей и опухолевых клеток. В частности, наборы данного изобретения используют для изготовления и оценки радиоактивно меченных конъюгатов антител, которые будут использованы для лечения и визуализации В-клеточных лимфомных опухолей посредством направленной доставки к мишени - поверхностному антигену В-клеток ВР35 ("CD20").
2. Технологическая предпосылка
Все публикации и заявки на патенты включены здесь при ссылке на них в таком же объеме, как в случае, если бы для каждой отдельной публикации или заявки на патент было конкретно и отдельно указано, что она включена в виде ссылки.
Иммунная система позвоночных (например, приматов, которые включают в себя людей, человекообразных обезьян, обезьян и т.д.) состоит из ряда органов и типов клеток, которые образовались в ходе эволюции для того, чтобы: точно и специфично узнавать чужеродные микроорганизмы (“антиген”), которые вторглись в организм хозяина-позвоночного; специфично связываться с такими чужеродными микроорганизмами; и удалять/уничтожать такие чужеродные микроорганизмы. Лимфоциты так же, как и другие типы клеток, имеют решающее значение для иммунной системы. Лимфоциты образуются в тимусе, селезенке и костном мозге (взрослый организм) и составляют примерно 30% от общего количества белых кровяных телец, присутствующих в системе циркуляции человека (взрослый организм).
Существуют две основных субпопуляции лимфоцитов: Т-клетки и В-клетки. Т-клетки ответственны за опосредуемый клетками иммунитет в то время, как В-клетки ответственны за продукцию антител (гуморальный иммунитет). Однако Т-клетки и В-клетки можно считать взаимозависимыми - при обычном иммунном ответе Т-клетки активируются в том случае, когда рецептор Т-клетки связывается с фрагментами антигена, который связан с гликопротеидами главного комплекса гистосовместимости ("МНС") на поверхности антигенпредставляющей клетки; такая активация вызывает высвобождение биологических медиаторов (“интерлейкинов”), которые по существу стимулируют В-клетки к дифференцировке и продукции антитела (“иммуноглобулинов”) против антигена.
Каждая В-клетка в организме хозяина экспрессирует особое антитело на своей поверхности - поэтому одна В-клетка будет экспрессировать антитело, специфичное для одного антигена, в то время как другая В-клетка будет экспрессировать антитело, специфичное для другого антигена. Следовательно, В-клетки довольно разнообразны, и это разнообразие имеет решающее значение для иммунной системы. У человека каждая В-клетка может продуцировать огромное количество молекул антитела (а именно, примерно от 107 до 108). Такая продукция антител в наиболее типичных случаях прекращается (или в значительной степени снижается), когда чужеродный антиген нейтрализован. Однако иногда пролиферация особой В-клетки будет продолжаться, не снижаясь; результатом такой пролиферации может быть рак, называемый “В-клеточной лимфомой”.
Как Т-клетки, так и В-клетки содержат белки клеточной поверхности, которые могут быть использованы как “маркеры” дифференцировки и для идентификации. Одним из таких маркеров В-клеток человека является антиген дифференцировки Вр35, ограниченный В-лимфоцитами человека, называемый "CD20". CD20 экспрессируется во время раннего периода развития предшественников В-клеток и сохраняется до дифференцировки плазматических клеток. В частности, молекула CD20 может регулировать этап процесса активации, который необходим для инициации клеточного цикла и дифференцировки, и обычно на очень высоких уровнях экспрессируется на неопластических (“опухолевых”) В-клетках. CD20, по определению, присутствует как на “нормальных” В-клетках, так и на “малигнизированных” В-клетках, т.е. таких В-клетках, не снижающаяся пролиферация которых может приводить к В-клеточной лимфоме. Таким образом, поверхностный антиген CD20 потенциально может служить кандидатом для “обеспечения направленной доставки” к В-клеточным лимфомам.
По существу такую направленную доставку к мишени в общем виде можно представить следующим образом: антитела, специфичные в отношении поверхностного антигена CD20 В-клеток, например, инъецируют пациенту. Указанные анти-СD20-антитела специфично связываются с антигеном клеточной поверхности CD20 (очевидно) как нормальных, так и малигнизированных В-клеток; анти-СD20-антитело, связанное с поверхностным антигеном CD20, может приводить к гибели и ослаблению опухолевых В-клеток. Кроме того, с aнти-CD20-антителом могут быть конъюгированы химические агенты или радиоактивные метки, обладающие потенциальной способностью разрушать опухоль, так что агент специфично “доставляется”, например, к опухолевым В-клеткам. Независимо от подхода основной целью является уничтожение опухоли: конкретный подход может определяться конкретным анти-СD20-антителом, которое используется, и, таким образом, отвечающие требованиям подходы к направленной доставке к мишени - CD20-антигену - могут значительно варьироваться.
Например, сообщалось о попытках такой направленной доставки к мишени - поверхностному антигену CD20. По имеющимся сообщениям, мышиное (мышь) моноклональное антитело 1F5 (анти-СD20-антитело) вводили посредством непрерывной внутривенной инфузии пациентам с В-клеточной лимфомой. Как сообщают, требовались экстремально высокие уровни (>2 грамм) 1F5, чтобы уменьшить количество циркулирующих опухолевых клеток, и результаты были описаны как “временные”. Press et al., "Monoclonal Antibody 1F5 (Anti-CD20) Serotherapy of Human B-Cell Lymphomas," Blood 69/2: 584-591 (1987).
Возможной проблемой при таком подходе является то, что моноклональные антитела не человека, а другого организма (например, мышиные моноклональные антитела) обычно не обладают эффекторными функциями у человека, т.е. они, в том числе, не способны опосредовать комплемент-зависимый лизис или лизировать клетки-мишени человека благодаря зависимой от антител цитотоксичности или опосредованного Fc-рецепторами фагоцитоза. Кроме того, моноклональные антитела не человека, а другого организма, могут распознаваться хозяином-человеком как чужеродный белок; поэтому многократные инъекции таких чужеродных антител могут приводить к индукции иммунных ответов, приводящих к вредным реакциям гиперчувствительности. Для моноклональных антител на основе мышиных антител это часто называют ответом, направленным против мышиных антител, у человека (Human Anti-Mouse Antibody response), или "НАМА"-ответом. Кроме того, указанные “чужеродные” антитела могут быть атакованы иммунной системой хозяина так, что они в действительности нейтрализуются до того, как они достигают местонахождения мишени.
Лимфоцитам и клеткам лимфомы присуща чувствительность к радиотерапии. Поэтому В-клеточные неоплазии являются привлекательными мишенями для радиоиммунотерапии (РИТ) по нескольким причинам: местное испускание ионизирующего излучения радиоактивно меченными антителами может убивать клетки, имеющие или не имеющие антигена-мишени (например, CD20), находящиеся в близком соседстве с антителом, связанным с антигеном; проникающая радиация, например источники бета-излучения, могут избавить от проблемы ограниченного доступа антитела в объемные или сильно васкуляризованные опухоли; и общее количество необходимых антител может быть снижено. Радионуклид испускает радиоактивные частицы, которые могут повреждать клеточную ДНК до того момента, когда механизмы клеточной репарации не способны дать клеткам возможность продолжать жить; поэтому если клетками-мишенями являются опухоли, радиоактивная метка целительным образом убивает опухолевые клетки. Радиоактивно меченные антитела по определению включают применение радиоактивного вещества, которое может требовать необходимости в предосторожности как для пациентов (а именно, возможная трансплантация костного мозга), так и для медицинского персонала (а именно, необходимость проявлять высокую степень осторожности при работе с радиоактивностью).
Поэтому подходом к повышению способности мышиных моноклональных антител осуществлять лечение В-клеточных нарушений являлось конъюгирование радиоактивной метки с антителом так, что метка или токсин локализуются в месте опухоли. Токсины (т.е. химиотерапевтические средства, такие как доксорубицин или митомицин С) также конъюгировали с антителами. Смотри, например, опубликованную заявку РСТ WO 92/07466 (опубликована 14 мая 1992 г.).
“Химерные” антитела, т.е. антитела, которые содержат части от двух или более различных видов (например, мышь и человек), были разработаны в качестве альтернативы “конъюгированным антителам”. Были созданы химерные антитела мыши/человека, и показано, что они проявляют параметры связывания родительского мышиного антитела и эффекторные функции, связанные с константным районом антитела человека". Смотри, например, Cabilly et al., патент США 4816567; Shoemaker et al., патент США 4978745; Beavers et al., патент США 4975369; и Boss et al., патент США 4816397, все они включены в данное описание в виде ссылок. Как правило, указанные химерные антитела конструируют посредством получения геномной библиотеки генов из ДНК, экстрагированной из ранее существовавших мышиных гибридом. Nishimura et al. (1987) Cancer Research 47: 999. Затем проводят скрининг библиотеки по генам вариабельных районов как тяжелых, так и легких цепей, демонстрирующих правильную картину перестройки фрагментов антител. Затем клонированные гены вариабельных районов лигируют в экспрессирующий вектор, содержащий клонированные кассеты гена соответствующего константного района тяжелой или легкой цепи человека. Затем химерные гены экспрессируют в предпочтительной клеточной линии, обычно линии миеломы мыши.
Например, Liu, A.Y. et al., "Production of Mouse-Human Chimeric Monoclonal Antibody to CD20 with Potent Fc-Dependent Biologic Activity", J. Immun. 139/10: 3521-3526 (1987) описывают химерное антитело мыши/человека, направленное против СD20-антигена. Смотри также заявку РСТ №WO 88/04936. Однако в ссылке не представлено информации относительно способности, эффективности или практического применения использования химерных антител Liu для лечения В-клеточных нарушений.
Отмечают, что функциональные анализы in vitro (например, комплемент-зависимый лизис ("CDC"); антителозависимая клеточная цитотоксичность ("ADCC") и т.д.), в сущности, не могут предсказать способность какого-либо антитела уничтожать или уменьшать количество клеток-мишеней, экспрессирующих специфичный антиген, in vivo. Смотри, например, Robinson R.D., et al., "Chimeric mouse-human anti-carcinoma antibodies that mediate different anti-tumor cell biological activities," Hum. Antibod. Hybridomas, 2: 84-93 (1991) (химерные антитела мыши-человека, не обладающие обнаруживаемой активностью ADCC). Поэтому потенциальная терапевтическая эффективность антител точно может быть определена только путем экспериментирования in vivo.
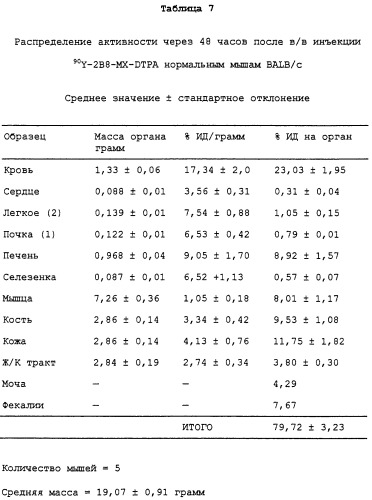
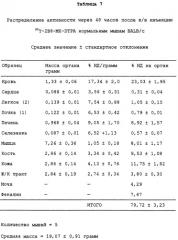
С этой целью в заявках, которые рассматриваются совместно, 08/475813, 08/475815 и 08/478967, включенных здесь в виде ссылки в полном объеме, приведена информация о радиоактивно меченных анти-СD20-конъюгатах для диагностической “визуализации” В-клеточных лимфомных опухолей перед введением используемого для терапии антитела. Конъюгат “In2В8” содержит мышиное моноклональное антитело 2В8, специфичное в отношении антигена CD20 человека, которое связано с индием [111] (111In) бифункциональным хелатирующим агентом, а именно MX-DTPA (диэтилентриаминопентауксусной кислотой), который содержит смесь 1-изотиоцианатбензил-3-метил-DTPA и 1-метил-3-изотиоцианатбензил-DТРА в соотношении 1:1. Индий-[111] выбран в качестве диагностического радионуклида потому, что он испускает гамма-излучение, и прежде использовался в качестве средства для визуализации.
Патенты, имеющие отношение к хелатирующим агентам и конъюгатам хелатирущих агентов, известны в данной области. Например, патент США №4831175 Gansow направлен на хелаты полизамещенной диэтилентриаминопентауксусной кислоты и белковые конъюгаты, которые их содержат, и способы их получения. Патенты США №№5099069, 5246692, 5286850 и 5124471 Gansow также имеют отношение к полизамещенным DTPA-хелатам. Указанные патенты включены здесь в полном объеме.
В заявках 08/475813, 08/475815 и 08/478967 был выбран специфичный бифункциональный хелатирующий агент, используемый для обеспечения хелатирования, так как он обладает высоким сродством к трехвалентным металлам и предусматривает повышенные содержание в опухоли по отношению к неопухолевой ткани, меньшее поглощение костной тканью и большее удерживание радионуклида в местах мишеней in vivo, т.е. в местах В-клеточных лимфомных опухолей. Однако в данной области известны другие бифункциональные хелатирующие агенты, и они также могут быть полезны в терапии опухолей.
Также в заявках 08/475813, 08/475815 и 08/478967 показаны радиоактивно меченные терапевтические антитела для целенаправленной доставки к В-клеточным лимфомам и опухолевым клеткам и их разрушения. В частности, конъюгат Y2B8 содержит такое же мышиное моноклональное антитело против CD20 человека, 2В8, связанное с иттрием-[90] (90Y) с помощью такого же бифункционального хелатирующего агента. Указанный радионуклид был выбран для терапии по нескольким причинам. Период полураспада 90Y, равный 64 часам, достаточен для того, чтобы обеспечить возможность накопления опухолью, в отличие, например, от 131I, он представляет собой источник чистого бета-излучения высокой энергии, не сопровождающегося при его распаде гамма-излучением, с радиусом действия от 100 до 1000 диаметров клетки. Минимальное количество проникающей радиации позволяет вводить 90Y-меченые антитела в амбулаторных условиях. Кроме того, для гибели клеток не требуется интернализации меченых антител, и локальное испускание ионизирующего излучения должно быть летальным для близлежащих опухолевых клеток, у которых отсутствует антиген-мишень.
Так как радионуклид 90Y связывали с антителом 2В8, используя ту же самую бифункциональную хелатирующую молекулу MX-DTPA, конъюгат Y2B8 обладает теми же преимуществами, которые обсуждались выше, например, повышенным удерживанием радионуклида в сайте-мишени (опухоль). Однако в отличие от 111In его нельзя использовать в целях визуализации из-за отсутствия ассоциированного с ним гамма-излучения. Таким образом, радионуклид для диагностической “визуализации”, такой как 111In, можно использовать для определения локализации и относительного размера опухоли перед и/или после введения терапевтических химерных или 90Y-меченых антител с целью уменьшения опухоли. Кроме того, меченное индием антитело делает возможным производить дозиметрическое определение.
В зависимости от предполагаемого применения антитела, а именно как диагностического или терапевтического реагента, в данной области известны другие радиоактивные метки, и они были использованы для подобных целей. Например, радионуклиды, которые использовались для клинической диагностики, включают в себя 131I, 125I, 123I, 90Тc, 67Ga, а также 111In. Для потенциального применения в целенаправленной терапии антитела также метили разнообразными радионуклидами (Peirersz et al. (1987) The use of monoclonal antibody conjugates for the diagnosis and treatment of cancer. Immunol. Cell Biol. 65: 111-125). Указанные радионуклиды включают в себя 188Re и 186Re, а также 90Y, и в меньшей степени - 199Аu и 67Сu. I-[131] также был использован в терапевтических целях. В патенте США №5460785 представлен список таких радиоизотопов, и патент включен в данное описание в виде ссылки.
Как сообщалось в совместно рассматриваемых заявках 08/475813, 08/475815 и 08/478967, введение радиоактивно меченного конъюгата Y2B8, а также немеченого химерного анти-CD20-антитела, в результате приводило к значительному уменьшению опухоли у мышей, несущих В-клеточную лимфобластную опухоль. Кроме того, клинические испытания на человеке, о которых сообщалось в этих заявках, показали значительное уменьшение количества В-клеток у пациентов с лимфомой, которым инфузировали химерное анти-СD20-антитело. Действительно, недавно химерное 2В8 было объявлено первым в США утвержденным FDA противоопухолевым моноклональным антителом под названием Rituxan®. Таким образом, было показано, что по меньшей мере одно химерное анти-СD20-антитело проявляет терапевтическую эффективность при лечении В-клеточной лимфомы.
Кроме того, в заявке на патент США с регистрационным №08/475813, включенной здесь в виде ссылки, сообщается о последовательном введении Rituxan®, химерного анти-СD20-антитела, либо с меченым индием, либо с меченым иттрием моноклональным антителом или с обоими. Хотя радиоактивно меченные антитела, используемые в указанных случаях комбинированной терапии, являются мышиными антителами, начальная обработка химерным анти-СD20 в достаточной степени истощает популяцию В-клеток, так что НАМА-ответ снижается, тем самым, способствуя осуществлению программ комбинированной терапии и диагностики.
Таким образом, в таком контексте комбинированной иммунотерапии мышиные антитела могут найти особое применение в качестве диагностических реагентов. Более того, в заявке на патент США 08/475813 было показано, что терапевтически эффективная доза меченного иттрием анти-СD20-антитела после введения Rituxan® достаточна для того, чтобы (а) очистить от любых оставшихся В-клеток периферической крови, от которых не очистило химерное анти-СD20-антитело; (b) начать истощение В-клеток в лимфатических узлах; или (с) начать истощение В-клеток в других тканях.
Таким образом, конъюгация радиоактивных меток с антителами, используемыми для терапии рака, предоставляет полезное для клиники средство, которое можно использовать для оценки потенциальной терапевтической эффективности таких антител, создания диагностических реагентов для того, чтобы контролировать ход лечения, и разрабатывать дополнительные терапевтические реагенты, которые можно использовать для повышения первоначальной потенциальной способности химерного антитела убивать опухоли. При наличии испытанной эффективности анти-СD20-антитела в лечении неходжкинских лимфом и известной чувствительности лимфоцитов к радиоактивности, было бы очень полезно, чтобы такие терапевтические антитела стали бы доступными для приобретения в форме наборов, посредством которых их можно было бы модифицировать радиоактивной меткой и вводить непосредственно пациенту в условиях клиники.
Хотя существует много способов и реагентов для осуществления радиоактивного мечения антител, что отсутствует в данной области, так это подходящий наполнитель для размещения указанных реагентов в условиях клиники, посредством которого их можно было легко приготовить и ввести пациенту прежде, чем произойдет значительный распад радиоактивной метки или значительное разрушение антитела из-за радиоактивной метки. Отсутствие таких подходящих средств для того, чтобы перевести указанную полезную технологию на коммерческую основу, может быть следствием низкой эффективности включения, демонстрируемой некоторыми известными протоколами мечения, и последующей необходимостью очищать реагент на колонке после процедуры радиоактивного мечения. Задержка в разработке таких наборов отчасти также может быть следствием того, что ранее были недоступны для коммерческого приобретения чистые радиоизотопы, которые можно использовать для создания эффективно меченных продуктов без последующей очистки. Альтернативно, возможно причиной повсеместного отсутствия таких наборов является фактическое отсутствие антител, для которых удалось достичь либо утверждения, либо эффективности, которые были достигнуты для Rituxan® при лечении лимфомы у больных людей.
Например, как обсуждалось в патенте США 4636380, включенном здесь в виде ссылки, как правило, среди научной общественности полагают, что для того, чтобы радиоактивный фармацевтический препарат нашел клиническое применение, он должен подвергаться длительной и трудоемкой процедуре выделения и очистки. Действительно, инъекции несвязанной радиоактивной метки пациенту были бы нежелательны. Необходимость дополнительных этапов очистки делает способ радиоактивного мечения антител невозможным в условиях клиники, особенно для врачей, у которых нет ни оборудования, ни времени для очистки своих собственных терапевтических средств.
Кроме того, радиоактивно меченные белки могут быть исходно нестабильными, особенно белки, меченные радиолитическими изотопами, такими как 90Y, которые имеют тенденцию вызывать повреждения антитела тем больше, чем дольше они связаны с ним в близком соседстве. В свою очередь, такой радиолиз приводит к ненадежной эффективности терапевтического средства вследствие отсутствия радиоактивной метки и/или сниженного связывания с антигеном-мишенью и может приводить к нежелательным иммунным ответам, направленным на денатурированный белок. Помимо этого, не имея возможностей для мечения и очистки антител на месте, клиницисты не имели выбора кроме назначения уже меченных терапевтических антител, или метили их вне клиники в другом относительно доступном месте и после мечения транспортировали в клинику для введения пациенту. Все такие манипуляции добавляют драгоценное время к периоду между мечением и введением, внося тем самым вклад в нестабильность терапевтического средства, в то же время, в сущности, сокращая применение наборов для радиоактивного мечения в условиях клиники.
Другие исследователи безуспешно пытались разработать наборы для радиоактивного мечения антител, которых было бы специалисту достаточно, чтобы отказаться от отдельного этапа очистки антитела. Например, Cytogen недавно выпустили коммерческий набор для радиоактивного мечения мышиного моноклонального антитела, направленного на ассоциированный с опухолью гликопротеид TAG-72. Однако антитело, выпущенное Cytogen, очень плохо поддается приготовлению композиции набора из-за тенденции образовывать частицы при хранении, которые потом надо удалять посредством дополнительного этапа фильтрации. Кроме того, антитело, выпущенное Cytogen, вызывало побочные реакции у пациентов вследствие НАМА-ответов.
Другими авторами было заявлено о том, что они имеют разработанные протоколы радиоактивного мечения, которое поддавалось бы компоновке набора, в котором отдельный этап очистки не требовался бы (Richardson et al. (1987) Optimization and batch production of DTPA-labeled antibody kits for routine use in 111In immunoscintography. Nuc. Med. Commun. 8: 347-356; Chinol and Hnatowich (1987) Generator-produced yttrium-[90] for radioimmunotherapy. J. Nucl. Med. 28(9): 1465-1470). Однако при таких протоколах было невозможно достичь уровня включения, которого достигли авторы данного изобретения, используя заявленные здесь протоколы, результатом которых была эффективность включения по меньшей мере 95%. Такой уровень включения предоставляет дополнительное преимущество повышенной безопасности тем, что фактически несвязанная метка не будет инъецирована пациенту в результате низкого радиоактивного включения.
Протоколы, включенные в наборы данного изобретения, позволяют проводить быстрое мечение, которому подвергают примерно полчаса или только пять минут, в зависимости от метки. Кроме того, протоколы наборов данного изобретения имеют эффективность мечения более 95%, позволяя таким образом отказаться от необходимости дальнейшей очистки. При отказе от необходимости в дальнейшей очистке сберегается время полураспада радиоактивной метки и сохраняется целостность антитела для терапевтической цели, для которой его метят.
В данной заявке раскрыта информация об удобных наборах и способах, посредством которых диагностические и терапевтические антитела можно радиоактивно метить и вводить пациенту воспроизводимым, надежным и удобным способом. Наборы согласно данному изобретению превращают способ радиоактивного мечения антител в нетрудный, не мучительный стандартизованный способ, который чрезвычайно облегчает протоколы лечения пациентов. Данные наборы дают преимущества перед предшествующим уровнем техники в том, что определены оптимальные параметры мечения и введения терапевтического или диагностического средства, что снижает стоимость продукции. Так как описанные здесь наборы предоставляют оптимальные параметры в соответствии с конкретной меткой, применение набора, предназначенного для конкретной метки, также будет минимизировать изъятие компонентов для использования в других целях, т.е. то, что происходит в случае использования неподходящего набора для конкретной метки. Устранение растаскивания набора по частям, в свою очередь, также обеспечивает оптимальную эффективность мечения. Кроме того, протоколы и стерильные, апирогенные компоненты, включенные в каждый набор, способствуют осуществлению более удобной для пользователя процедуры, так как тестирование стерильности, пирогенности и очистка реагентов после мечения устраняются.
3. Краткое изложение сути изобретения
Данное изобретение включает в себя набор для радиоактивного мечения диагностического или терапевтического антитела перед введением пациенту, содержащий по меньшей мере (i) флакон, содержащий антитело, конъюгированное с хелатирующим агентом, (ii) флакон, содержащий буфер композиции для стабилизации и введения радиоактивно меченного антитела, и (iii) инструкции по радиоактивному мечению антитела, где указанные компоненты флаконов поставляются в таком количестве и в такой концентрации, что при их объединении с радиоактивной меткой достаточной чистоты и активности согласно инструкциям набора не требуется дополнительная очистка радиоактивно меченного антитела перед введением указанному пациенту. Кроме того, в случае мечения согласно инструкциям набора и радиоизотопом достаточной чистоты и активности включение такого изотопа может достигать уровней выше 95%, и даже вплоть до 98% или выше.
Наиболее предпочтительно антителом, включенным в набор, является анти-СD20-антитело. Антитело поставляется в форме, в которой оно связано с бифункциональным хелатирующим агентом. Предпочтительно антитело конъюгируют с MX-DTPA, но также можно использовать другие хелатирующие агенты, такие как DTPA, конъюгированный фенил- или бензил-DTPA, циклогексил-DTPA, производные EDTA и DOTA. Хелатирующим агентом согласно данному изобретению может быть любой хелатирующий агент, который по меньшей мере бифункционален, т.е. который обладает по меньшей мере двумя сайтами связывания (по меньшей мере один сайт для хелатирования иона металла и по меньшей мере один сайт для связывания с белковым лигандом).
В зависимости от используемого антитела конъюгированное антитело обычно поставляется в концентрации от 0,5 до 30 мг/мл, более предпочтительно 2 мг/мл. Объем конъюгированного антитела будет зависеть от концентрации и количества, необходимого для оптимального мечения в зависимости от радиоактивной метки. Однако конъюгированное антитело поставляют в таком объеме и концентрации, чтобы весь объем был добавлен в реакционный флакон с использованием стерильного шприца и асептическим способом. Это сделает возможным повышенную воспроизводимость и легкость применения. Все реагенты заявленных здесь наборов стерильны и апирогенны, и специально разработаны для простоты и скорости перехода непосредственно от тестирования антитела к введению. С некоторыми метками необходимость в тестировании эффективности мечения может не требоваться.
Компонентом набора, обладающим особыми преимуществами, является буфер композиции для стабилизации от воздействия радиолиза и для введения радиоактивно меченного конъюгированного антитела пациенту. Буфер для приготовления композиции представляет собой фармацевтически приемлемый носитель, который служит и разбавителем для меченого антитела, и буфером для введения. Несмотря на то что любой фармацевтически приемлемый разбавитель может быть использован для введения терапевтического или диагностического антитела пациенту, буфер для приготовления композиции данного изобретения особенно подходит для введения радиоактивно меченных антител.
Например, буфер композиции согласно данному изобретению содержит радиопротектор, такой как сывороточный альбумин человека (ЧСА) или аскорбат, которые минимизируют радиолиз из-за иттрия и, в меньшей степени, индия. В данной области известны другие радиопротекторы, и их также можно использовать в буфере композиции согласно данному изобретению, а именно акцепторы свободных радикалов (фенол, сульфиты, глютатион, цистеин, гентизиновая кислота, никотиновая кислота, аскорбилпальмитат, НОР(:О)H2, глицерин, формальдегид-сульфоксилат натрия, Na2S2O5, Nа2S2О3 и SO2 и т.д.).
Следует отметить, что хотя радиопротекторы обычно применяют в буферах для приготовления композиции, чтобы защитить антитело от радиолиза, можно оказать дополнительную защиту включением радиопротектора также и в реакционный буфер. Прежде этого обычно не делали, а именно не добавляли ЧСА, из-за наличия металлов, которые помешали бы процессу мечения. Однако можно “очистить” ЧСА, используя хелатирующую смолу, такую, чтобы ее также можно было включить в буфер реакции. Также может потребоваться обработка аскорбата или других радиопротекторов, чтобы удалить загрязняющие металлы.
Буфер для приготовления композиции согласно данному изобретению также содержит избыток неконъюгированного хелатирующего агента. Целью включения неконъюгированного хелатирующего агента является то, чтобы указанный хелатирующий агент служил акцептором любой несвязанной с белком радиоактивной метки у пациента, и осуществлял выделение радиоактивной метки, тем самым снижая поглощение изотопов, “ищущих кость”, т.е. 90Y, костной тканью пациента. Например, в случае, когда антитело набора конъюгировано с хелатирующим агентом DTPA, избыток DTPA или любого другого хелатирующего агента может быть включен в буфер для приготовления композиции. Буфер композиции также предпочтительно поставляется в таком объеме, что содержимое полностью переносят в реакционный флакон. Как обсуждалось выше, в результате это приводит к повышению простоты применения и воспроизводимости, поскольку не приходится измерять и переносить точные объемы.
Предпочтительный буфер композиции содержит забуференный фосфатами или физиологический раствор соли, сывороточный альбумин человека и DTPA. Сывороточный альбумин человека предпочтительно присутствует в концентрации примерно от 1 до 25% (маc./об.) и более предпочтительно в концентрации примерно равной 7,5% (маc./об.). Концентрация DTPA предпочтительно составляет примерно 1 мМ. Аскорбат может быть использован в качестве альтернативы сывороточному альбумину человека, и обычно используется в концентрации примерно от 1 до 100 мг/мл. Хотя можно использовать широкие пределы концентраций, не подвергая риску безопасность пациента.
Антитело набора для радиоактивного мечения без труда метят предпочтительным радиоизотопом посредством бифункционального хелатирующего агента согласно способам данного изобретения. В этом отношении для дополнительного упрощения набор согласно данному изобретению также может включать в себя флакон, содержащий буфер для доведения рН раствора радиоизотопа, и стерильный стеклянный реакционный флакон для выполнения мечения и затем для ресуспендирования конечного радиоактивно меченного антитела в буфере для приготовления композиции. Обычно достаточно реакционного флакона объемом 10 мл, но также можно использовать флаконы, способные вмещать от 5 до 20 мл. Буфер предпочтительно представляет собой раствор ацетата натрия с низким содержанием металлов в концентрации от 10 до 1000 мМ, наиболее предпочтительно 50 мМ.
Специальный набор согласно данному изобретению содержит антитело, конъюгированное с MX-DTPA, 2B8-MX-DTPA. 2В8 представляет собой анти-СD20-антитело, которое, как показано, оказывает влияние на истощение популяции В-клеток при введении пациентам с лимфомой. Однако специалистам в данной области должно быть ясно, что набор для радиоактивного мечения согласно данному изобретению можно оптимизировать для радиоактивного мечения других анти-СD20-антител или любого другого антитела, которое было конъюгировано с DTPA или другими поливалентными хелатирующими агентами. Предпочтительный набор согласно данному изобретению может включать в себя по меньшей мере (i) флакон, содержащий антитело 2В8, конъюгированное с MX-DTPA, либо в растворе, либо лиофилизированное (требующее восстановления исходного состояния); и (ii) флакон, содержащий буфер композиции для введения радиоактивно меченного антитела пациенту. Предпочтительный набор будет также содержать (iii) буфер для доведения рН изотопа и (iv) реакционный флакон. Альтернативно, и более предпочтительно буфер поставляется в реакционном флаконе, тем самым, устраняя этапы измерения и перенесения буфера и повышая простоту, устойчивость и стерильность компонентов набора. Однако также предвидятся другие варианты, а именно в которых буфер добавляют сначала к флакону с изотопом, и затем забуференный изотоп переносят в реакционный флакон. В этом случае реакционный флакон может поставляться с требуемым объемом антитела. В альтернативном случае флакон с изотопом/буфером можно сделать большим, достаточным для того, чтобы вместить добавку конъюгата антитела, т.е. непосредственно во флакон поставщика. Это устранит необходимость в реакционном флаконе.
Как описано выше, осуществляют другую предпочтительную форму набора, в которой сам реакционный флакон содержит требуемый объем конъюгированного антитела (т.е. 1 или 1,5 мл для 111In и 90Y соответственно). Антитело может поставляться в буфере, который обеспечивает значение рН, подходящее для радиоактивного мечения, в соответствии с конкретным необходимым изотопом (т.е. рН 3-6 для 111In, рН 3-5 для 90Y). Можно использовать различные буферы в зависимости от изотопа (т.е. ацетат натрия для 90Y, цитрат натрия для 111In). рН и состав буфера могут также варьироваться в зависимости от природы связываемого лиганда, который нужно метить (а именно, при мечении пептидов можно позволить использовать рН<3). По существу далее изотоп должен быть перенесен непосредственно в реакционный флакон так же, как буфер композиции. Ограничение до двух этапов переноса при применении набора дополнительно увеличило бы воспроизводимость и простоту, и дополнительно уменьшило бы возможность загрязнения стерильности во время манипуляции с компонентами набора.
Наборы для радиоактивного мечения согласно данному изобретению могут дополнительно содержать флакон радиоизотопа, или радиоизотоп можно заказать отдельно у подходящего поставщика. Предпочтительными радиоизотопами согласно данному изобретению являются хлорид 111In и хлорид 90Y в НСl, хотя заявленные способы не ограничены данными изотопами. В данной области известны другие радионуклиды, которые использовались для применений с целью визуализации, а именно как описано в патентах США №4634586, 5460785 и 5766571, которые включены здесь в виде ссылки. Индий-111 обладает особыми преимуществами при визуализации В-клеточных опухолей, а источники бета-излучения, такие как 90Y особенно пригодны в качестве радиотерапевтических средств. Хотя для конъюгации с антителами, в зависимости от используемого хелатирующего агента, можно использовать и другие радиоизотопы, пригодные для этих и других целей, а именно источники альфа-излучения.
При условии доказанной эффективности комбинированных терапевтических схем, раскрытых в заявке на патент США, имеющей номер регистрации 08/475813, следующий вариант набора будет также включать в себя отдельный флакон химерного антитела, т.е. Rituxan®, чтобы вводить перед или после радиоактивно меченного анти-СD20-антитела. В том случае, когда химерное антитело вводят до радиоактивно меченного антитела, НАМА-ответ, который может, как правило, иметь место в ответ на введение мышиного анти-СD20-антитела, может быть значительно снижен, тем самым, увеличивая терапевтическую эффективность радиоактивно меченных мышиных антител. Кроме того, в том случае, когда для того, чтобы очистить циркулирующие В-клетки применяют химерное анти-СD20, последующие диагностические изображения, достигну