Способ моделирования гипоксии с гиперкапнией у животного
Иллюстрации
Показать всеИзобретение относится к медицине и может быть использовано в экспериментальной физиологии. Гипоксию с гиперкапнией моделируют путем создания замкнутой системы циркуляции вдыхаемого воздуха. Воздух поступает в легкие из герметичной емкости и при выдохе возвращается обратно. Процесс рециркуляции обеспечивается аппаратом искусственной вентиляции легких. Изобретение обеспечивает постепенность развития гипоксии с гиперкапнией, исключающей развитие стрессорной реакции. Создаются условия для проведения любых манипуляций с животным в процессе эксперимента. 5 ил.
Реферат
Изобретение относится к области экспериментальной физиологии. Модель может быть применена для изучения динамики показателей, характеризующих статус экспериментального животного в условиях развития острой и подострой гипоксии с гиперкапнией.
Известен способ моделирования состояния гипоксии с гиперкапнией на мышах, использующийся для скрининга химических веществ с целью поиска новых антигипоксантов. Экспериментальное животное помещают в герметичный стеклянный сосуд стандартной емкости (250 мл). Мышь в процессе эксперимента потребляет некоторую часть кислорода, заменяя его равноценным количеством углекислого газа. Метод позволяет следить за поведением животного, регистрировать частоту дыхательных движений, а также фиксировать основной параметр - продолжительность жизни (критерием гибели служит момент полной остановки дыхания). (Новиков В.Е., Катунина Н.П. Изучение антигипоксических свойств новых производных 3-оксипиридина // Вест. Смоленской мед. академии. - 2002. - №3. - С.9-10).
Главным недостатком описанной модели является невозможность регистрации многих параметров жизнедеятельности и ограничение возможности воздействия на организм во время опыта (применение раздражителей, введение лекарственных веществ) без нарушения герметичности системы.
Для преодоления этих недостатков некоторые исследователи используют метод циклического чередования периодов асфиксии с периодами восстановления. Дыхание животного (обычно, кошки) переводят в режим искусственной вентиляции (дыхательную мускулатуру выключают миорелаксантом). Асфиксия достигается путем кратковременной остановки аппарата искусственной вентиляции легких (ИВЛ). Период асфиксии сменяют периодом восстановления, т.е. включая аппарат ИВЛ. Затем цикл повторяется. (Виноградов В.М., Криворучко Б.И. Фармакологическая защита мозга от гипоксии //Психофармакология, биологическая наркология. 2001. - T.1. - C.27-37).
Недостатком модели является невозможность создания условий для плавного, постепенного ухудшения газовой среды, без резких колебаний. Проведенные нами исследования показали, что устойчивость к гипоксии у животных при использовании этой модели во многом зависит от степени активации симпато-адреналовой системы и ее ответа на стресс. Часто непосредственной причиной смерти в эксперименте с асфиксией является не газовый дисбаланс в организме, а внезапное развитие сердечной недостаточности в ответ на стресс.
Сущность предложенного способа моделирования гипоксии с гиперкапнией состоит в том, что подключив животное к аппарату искусственной вентиляции легких (ИВЛ), создают замкнутый объем циркулирующего воздуха, включая в систему ИВЛ герметичную емкость заданного объема с помощью двух трубок, через одну из которых воздух из емкости посредством аппарата ИВЛ нагнетается в легкие животного, а через вторую возвращается в емкость при выдохе.
Данный способ моделирования гипоксии с гиперкапнией обеспечивает стандартизацию стартовых условий и постепенное ухудшение качества вдыхаемого воздуха, а также позволяет экспериментатору осуществлять аппаратный контроль за процессом развития гипоксии и производить фармакокоррекцию на любой стадии гипоксии.
Способ моделирования гипоксии с гиперкапнией осуществляют следующим образом. Проводят стереотипные оперативные действия: наркотизацию животного (5% раствор калипсола внутрибрюшинно); трахеостомию и интубацию Т-образной стеклянной трубкой (трубку герметично фиксируют в трахее лигатурой); выключают дыхательную мускулатуру путем введения миорелаксантов (1% раствор d-тубокурарина) с переводом животного на ИВЛ.
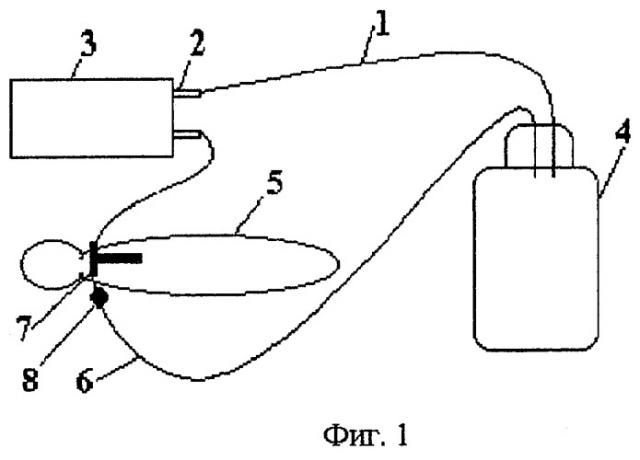
К аппарату ИВЛ подключают герметичную емкость необходимого объема (фиг.1). В нее вводят концы двух полихлорвиниловых трубок. Трубку 1 присоединяют к входному 2 (забирающему воздух) штуцеру аппарата ИВЛ 3. Воздух из емкости 4 поступает в легкие животного 5.
Другую трубку 6 присоединяют к выходному концу интубационной Т-образной трубки 7. Выдыхаемый воздух поступает в емкость 4, что обеспечивает процесс рециркуляции воздушной смеси. Глубину вдоха (дыхательный объем) регулируют с помощью специального скользящего зажима 8, который располагают на трубке 6 рядом с выходным концом интубационной трубки 7.
Способ позволяет проводить определение газовых объемов в емкости с помощью любого газового анализатора, путем подключения его к трубке 1 (или через дополнительную трубку, предварительно введенную в емкость 4). В наших экспериментах мы использовали анализатор углекислотный химический (АУХ-2).
Пример:
Кошку (самца) массой 4,2 кг наркотизировали 5% раствором калипсола (2,5 мл внутрибрюшинно). После трахеостомии, интубации Т-образной трубкой и введения миорелаксанта (1% раствор d-тубакурарина 3 мл внутримышечно) заменяли самостоятельное дыхание животного искусственной вентиляцией легких (ИВЛ).
Регистрировали электрокардиограмму (ЭКГ) с подсчетом числа сердечных сокращений (ЧСС); электроэнцефалограмму (ЭЭГ); измеряли ректальную температуру электрическим термометром.
Для регистрации вызванных потенциалов (ВП) раздражающие электроды накладывали на седалищный нерв правой задней лапы. Стимуляцию осуществляли отдельными прямоугольными импульсами постоянного тока: амплитуда - 40×103 мВ; длительность - 20 мс. Отводящие электроды располагали на поверхности черепа: активный - в области корковой проекции соматосенсорной зоны правой задней лапы (левое полушарие головного мозга); нулевой электрод - между лобными пазухами.
Оценку активности КГМ животного осуществляли методом регистрации ВП. Сравнивали амплитуду волн первичного и вторичного ответов и длительность интервальных показателей (латентный период, продолжительность первой позитивной, первой негативной и второй позитивной волн).
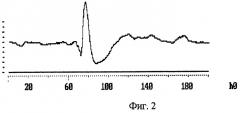
На фиг.2 изображен фоновый (контрольный) ВП, зарегистрированный у кошки через 5 часов после наркотизации калипсолом (т.е. после прекращения действия наркоза) непосредственно перед подключением к системе рециркуляции.
После подключения животного к системе рециркуляции спустя 30 минут форма ВП начинает изменяться (фиг.3-5).
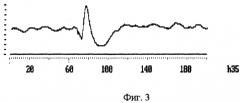
На фиг.3 показан ВП через 35 минут после подключения. Амплитуда негативной волны первичного ответа уменьшается почти в 2 раза.
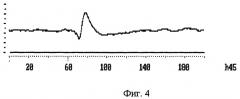
Фиг.4 демонстрирует, что через 45 минут вторичный ответ исчезает. Происходит расширение первичного ответа за счет удлинения негативной волны.
Через 50 минут ВП не регистрируется (фиг.5).
ЧСС на протяжении эксперимента постепенно увеличивалась со 180 сокращений в минуту до 228.
Ректальная температура снизилась с 37.5°С до 37.0°С.
Предлагаемый способ моделирования гипоксии с гинеркапнией применили в экспериментах на 12 кошках с изучением динамики вызванных потенциалов и активности одиночных нейронов коры головного мозга.
Таким образом, новая модель позволяет исследовать большое количество параметров организма и избежать резких проявлений стрессорной реакции в связи с постепенным развитием гипоксии, что обеспечивает стабильность ответных реакций и предупреждает внезапную гибель животных, связанную с развитием сердечной недостаточности.
Способ моделирования гипоксии с гиперкапнией у животного путем его подключения к аппарату искусственной вентиляции легких (ИВЛ), отличающийся тем, что создают замкнутый объем циркулирующего воздуха, подключая перед входным штуцером аппарата ИВЛ герметичную емкость с помощью двух трубок, через одну из которых воздух из емкости посредством аппарата ИВЛ нагнетается в легкие животного, а через вторую возвращается в емкость при выдохе.