Трансдермальная терапевтическая система (ттс), содержащая толтеродин
Иллюстрации
Показать всеИзобретение относится к медицине. Описана трансдермальная терапевтическая система (ТТС), предназначенная для чрескожного введения толтеродина в течение нескольких дней, а также способ ее изготовления. ТТС представляет собой самоклеящуюся слоистую матричную структуру, содержащую включающий аммонийные группы сополимер (мет)акрилата, по меньшей мере один пластификатор и до 25 мас.% толтеродина. ТТС обладает хорошей переносимостью кожей и обладает физической и химической стабильностью при длительном хранении и применении, а также имеет хорошие адгезивные свойства и на единицу своей площади высвобождать на кожу и обеспечивать проникновение через нее максимально возможного количества действующего вещества. 2 с. и 6 з.п. ф-лы, 2 ил., 3 табл.
Реферат
Настоящее изобретение относится к трансдермальной терапевтической системе (ТТС), предназначенной для чрескожного введения толтеродина в течение нескольких дней, а также к способу ее изготовления.
Биологическая доступность вводимых перорально действующих веществ часто является неудовлетворительной. Внутривенное введение действующих веществ часто не дает требуемого эффекта и является неприятной для пациентов процедурой. В результате метаболизма, происходящего в печени, для многих действующих веществ при первом прохождении через печень возникают нежелательные соотношения концентраций, образуются токсические побочные продукты, что приводит к снижению эффективности или даже к потере эффективности. По сравнению с пероральным введением трансдермальное введение действующих веществ обладает различными преимуществами. Доставку действующего вещества можно регулировать оптимальным образом в течение более продолжительного периода времени, благодаря чему создается возможность избегать больших колебаний его уровня в крови. Кроме того, можно значительно снизить необходимые терапевтически эффективные дозы. Помимо этого, для пациентов пластырь часто является более предпочтительным и удобным по сравнению с принимаемыми однократно или несколько раз в день таблетками.
В прошлые годы для преодоления вышеуказанных недостатков, присущих отличному от трансдермального пути введения действующих веществ, для терапевтического лечения различных заболеваний использовали многочисленные трансдермальные терапевтические системы (ТТС), имеющие различную структуру для различных действующих веществ.
Так, в частности, в указанных ниже публикациях описаны различные действующие вещества системного или местного действия, парентеральное введение которых осуществляется с помощью обеспечивающих контролирование дозы систем или обычных систем со свободным высвобождением. Примерами таких публикаций являются патенты US 3598122, US 3598123, US 3731683, US 3797494, US 4031894, US 4201211, US 4286592. US 4314557, US 4379454, US 4435180, US 4559222, US 4568343, US 4573995, US 4588580, US 4645502, US 4702282, US 4788062, US 4816258, US 4849226, US 4908027, US 4943435 и US 5004610.
В конце шестидесятых годов прошлого столетия сначала теоретически предполагалось, что для эффективного введения с помощью ТТС может использоваться любое действующее вещество, имеющее короткое время полужизни, но обладающее высокой активностью и хорошей способностью проникать через кожу. Однако эти первоначальные ожидания, касающиеся возможностей трансдермального введения действующих веществ с помощью ТТС, не оправдались. Связано это в основном с тем фактором, что кожа по своей природе обладает чрезвычайно разнообразными свойствами, обусловливающими ее функционирование в качестве интактного барьера, препятствующего проникновению в организм чужеродных по отношению к организму субстанций (см. Transdermal Drug Delivery: Problems and Possibilities, B.M. Knepp и др., CRC Critical Review and Therapeutic Drug Carrier Systems, том 4, 1-е изд. (1987)).
Поэтому трансдермальное введение может применяться только для ограниченного количества действующих веществ, которые обладают необходимой комбинацией многочисленных соответствующих характеристик. Однако для конкретного действующего вещества нельзя предсказать заранее эти необходимые характеристики, которые должны обеспечивать безопасное и эффективное трансдермальное введение.
Предназначенное для трансдермального введения действующее вещество должно удовлетворять следующим требованиям:
- обладать способностью проникать через кожу,
- не ухудшать характеристики прилипания пластыря в результате присутствия действующего вещества,
- не вызывать раздражения кожи,
- не вызывать аллергических реакций,
- обладать благоприятными фармакокинетическими характеристиками,
- обладать благоприятными фармакодинамическими характеристиками,
- обладать относительно широким спектром терапевтического действия,
- обладать характеристиками метаболизма, которые согласуются с терапевтическим действием при непрерывном введении.
Несомненно приведенный перечень требований не является исчерпывающим. Действующее вещество, чтобы его можно было применять для трансдермального введения, преимущественно должно удовлетворять “правильной” комбинации всех этих требований.
Все вышеуказанные требования для действующего вещества равным образом относятся к ТТС-композиции, содержащей любое действующее вещество, и к ее конструктивной структуре.
Обычно трансдермальные терапевтические системы (ТТС) представляют собой пластырь, имеющий непроницаемый покровный слой, отделяемый защитный слой и содержащую действующее вещество матрицу или содержащий действующее вещество резурвуар, снабженный полупроницаемой мембраной. В первом случае системы называют матричными пластырями, а во втором случае - мембранными системами.
Для покровного слоя обычно используют сложный полиэфир, полипропилен, полиэтилен, полиуретан и т.д., которые также могут быть подвергнуты металлизации или пигментации. Для отделяемого защитного слоя могут применяться, например, сложный полиэфир, полипропилен, а также бумага с силиконовым и/или полиэтиленовым покрытием. Возможно также применение фторполимеров.
Для приемлемых с фармацевтической или медицинской точки зрения матриц, содержащих действующее вещество, могут применяться многочисленные соединения на основе полиакрилата, силикона, полиизобутилена, бутилкаучука, сополимера стирола и бутадиена или сополимера стирола и изопрена.
Мембраны, применяемые в мембранных системах, могут иметь микропоры или быть полупроницаемыми и могут быть созданы обычным методом на основе инертных полимеров, в частности, на основе полипропилена, поливинилацетата или силикона.
В то время как содержащие действующее вещество матричные композиции могут быть самоприклеивающимися, однако в зависимости от используемого действующего вещества могут применяться матрицы, которые не обладают самоприклеивающими свойствами, вследствие чего пластырь или ТТС должны быть снабжены верхней липкой лентой.
Для обеспечения требуемой скорости проникновения действующего вещества в качестве добавок часто применяют агенты, усиливающие проникновение через кожу, такие как алифатические, циклоалифатические и/или ароматические-алифатические одно- или многоатомные спирты, содержащие до 8 атомов углерода, смесь спирт/вода, насыщенный и/или ненасыщенный жирный спирт, содержащий 8-18 атомов углерода, насыщенная и/или ненасыщенная жирная кислота, содержащая 8-18 атомов углерода, и/или ее эфиры, а также витамины.
Кроме того, в содержащую действующее вещество матрицу часто добавляют стабилизаторы, такие как поливинилпирролидон, α-токоферолсукцинат, пропилгаллат, метионин, цистеин и/или гидрохлорид цистеина.
Как видно из представленного выше описания, в настоящее время применяются многочисленные ТТС-структуры и для них используются различные материалы. Однако, если лекарственное средство в форме ТТС используется в медицинских целях, следует учитывать многие дополнительные требования.
При разработке ТТС, содержащих действующее вещество, необходимо учитывать следующие проблемы:
1. Проницаемость кожи для действующего вещества является слишком низкой для обеспечения необходимой с терапевтической точки зрения скорости проникновения и/или время запаздывания (“lag-time”) до достижения требуемого с терапевтической точки зрения уровня в плазме является слишком большим, вследствие чего необходимо применять добавки, ускоряющие проникновение через кожу.
2. Полимерная матрица, содержащая действующее вещество и при необходимости агенты, способствующие увеличению скорости проникновения через кожу, при длительном хранении не является стабильной с физической точки зрения. Так, в частности, может происходить кристаллизация действующего вещества, что приводит к неконтролируемому снижению эффективности высвобождения действующего вещества из ТТС.
3. Высокое содержание действующего вещества и/или агентов, способствующих проникновению через кожу, в полимерном носителе в случае использования самоклеящихся полимерных пленок затрудняет регулирование оптимальных адгезионных свойств трансдермальной системы.
4. Скорость поглощения действующего вещества через несколько дней снижается до неприемлемого уровня, вследствие чего требуется применять дополнительные регулирующие слои и/или компоненты.
5. Кроме того, из литературных источников известно, что часто используемые для усиления проникновения через кожу эфиры жирных кислот и многоатомных спиртов обладают неодинаковым качеством и содержат неочищенные разбавители, в результате чего усиление проникающей способности не обладает удовлетворительными показателями воспроизводимости (Burkoth и др., 1996, DE 19622902 A1).
Перечисленными выше проблемами обусловлено наличие большого количества различных вариантов трансдермальных терапевтических систем, что отражает существующий уровень техники в данной области.
В DE 19653606 А1 описано адгезивное и связующее средство для ТТС, включающее в определенных массовых соотношениях такие компоненты, как а) (мет)акрилатный полимер, который может содержать группы четвертичного аммония, б) органическая ди- или трикарбоновая кислота и в) пластификатор, который может представлять собой триэфир лимонной кислоты.
Как следует из вышеизложенного, в настоящее время известны многочисленные структуры пластырей, в которых применяются различные материалы. Тем не менее, в настоящее время для многих действующих веществ, предназначенных для применения в трансдермальных терапевтических системах, существует необходимость в разработке ТТС, которые имели бы простую структуру с оптимальным набором составляющих их элементов и позволяли бы вводить необходимое с терапевтической точки зрения действующее вещество. Это относится также к действующему веществу толтеродину в том случае, когда он должен вводиться чрескожным путем.
Название толтеродин представляет собой общепринятое наименование (INN) R-изомера N,N-диизопропил-3-(2-гидрокси-5-метилфенил)-3-фенилпропиламина (название в соответствии с классификацией ИЮПАК: (+)-(R)-2-{α-[2-(диизопропиламино)этил] бензил}-4-метилфенол). В дальнейшем название толтеродин употребляется по отношению к N,N-диизопропил-3-(2-гидрокси-5-этилфенил)-3-фенилпропиламину. Если указывается отдельный изомер, например его R- или S-изомер или рацемическая смесь R- и S-изомеров, то их обозначают как R-, S-, соответственно R,S-толтеродин.
Толтеродин применяется в терапии для лечения нарушений функций мочевого пузыря, сопровождающихся симптомами непроизвольного позыва на мочеиспускание, поллакиурией и недержанием мочи. Предписываемая доза составляет 2 мг толтеродина, вводимого перорально дважды в день.
После перорального введения при первом прохождении через печень уровень метаболизма толтеродина может существенно колебаться. Так, например, при медленном процессе метаболизма абсолютная биологическая доступность толтеродина составляет 65%, тогда как при быстром процессе метаболизма - только 17%. Поскольку образующийся 5-гидроксиметиловый метаболит также обладает фармакологической активностью, при быстром процессе метаболизма низкие уровни толтеродина в крови не теряют эффективности. Тем не менее следует избегать таких колебаний между индивидуумами и обусловленных ими вариаций эффективности. Кроме того, различные уровни в плазме возникают в зависимости от того, вводится ли толтеродин одновременно с приемом пищи или независимо от него. Этих проблем можно практически полностью избежать при трансдермальном введении толтеродина, поскольку в этом случае действующее вещество, минуя желудочно-кишечный тракт и первое прохождение через печень, поступает непосредственно в кровеносную систему. При трансдермальном введении можно избежать возникающих при пероральном введении колебаний уровня действующего вещества в плазме, характеризующихся высокими пиками концентраций, которые могут приводить к нежелательным побочным действиям, таким как сухость во рту, диспепсия, рвота, нарушения аккомодации и спутанность сознания. Кроме того, при этом можно избежать падения концентрации действующего вещества ниже допустимого уровня, а также непроизвольного круглосуточного мочеиспускания. Более того, из-за отсутствия первого прохождения через печень существенно снижается нагрузка на печень, обусловленная действующим веществом, что особенно важно для пациентов с заболеваниями печени, например страдающих циррозом печени.
В WO 98/03067 описано применение S-толтеродина для лечения нарушений функции мочеиспускательной системы, включая недержание мочи. Для введения действующего вещества предложено среди прочего также использовать трансдермальный путь введения. Однако в этом документе не приведены технические сведения, касающиеся метода трансдермального введения, или примеры, подтверждающие возможность такого введения.
В настоящее время в литературе отсутствуют сведения о трансдермальных терапевтических системах, предназначенных для введения толтеродина.
Исходя из вышеизложенного, в основу настоящего изобретения была положена задача разработать ТТС для введения толтеродина. Такая ТТС должна иметь простую структуру, обладать хорошей переносимостью кожей и обладать физической и химической стабильностью при длительном хранении и применении, а также иметь хорошие адгезивные свойства и на единицу своей площади высвобождать на кожу и обеспечивать проникновение через нее максимально возможного количества действующего вещества.
Указанная задача решается с помощью трансдермальной терапевтической системы (ТТС), которая предназначена для чрескожного введения толтеродина и которая представляет собой самоклеящуюся слоистую матричную структуру, содержащую сополимер (мет)акрилата, включающий группы аммония, по меньшей мере один пластификатор и до 25 мас. % толтеродина. При создании изобретения неожиданно было установлено, что толтеродин высвобождается и проникает через кожу со столь высокой скоростью, которая для других действующих веществ, как известно, может достигаться только с помощью агентов, усиливающих проникновение через кожу. Благодаря этому необходимые с терапевтической точки зрения дозы могут вводиться с помощью ТТС, имеющей меньшую площадь для высвобождения, без повышения риска раздражения кожи, обусловленного применением агентов, усиливающих проникновение через кожу.
В контексте изобретения понятия “несколько дней” и “твердый раствор” имеют следующие значения:
а) “несколько дней” означает, что ТТС для терапевтического применения может быть закреплена на коже на срок от 1 до 7 дней, предпочтительно от 1 до 4 дней;
б) “твердый раствор” обозначает фармацевтическое действующее вещество, которое диспергировано на молекулярном уровне в ТТС-матрице.
Согласно следующему варианту осуществления изобретения указанная выше ТТС может быть дополнительно снабжена не содержащим действующего вещества кожным пластырем, который предназначен для ее фиксации в области введения (верхняя липкая лента) и который окружает ее за исключением области, через которую происходит высвобождение толтеродина из содержащей его матрицы на кожу.
Преимущество подобной структуры состоит в том, что она может применяться для различных типов кожи и в различных климатических зонах. Кроме того, при этом имеется возможность по отдельности оптимизировать, с одной стороны, (ко-)адгезивные свойства ТТС, а с другой стороны, растворимость действующего вещества, скорость растворения действующего вещества и характеристики высвобождения.
Включающая действующее вещество матрица предпочтительно содержит R-толтеродин или R,S-толтеродин.
Согласно еще одному варианту осуществления изобретения матричная структура содержит в качестве действующего вещества дейтерированный толтеродин. Дейтерированный толтеродин образуется в том случае, если в толтеродине один или несколько атомов водорода заменяются на его изотоп - дейтерий. В принципе на дейтерий может быть заменен каждый из содержащихся в толтеродине атомов водорода. Предпочтительно метальный заместитель ароматического соединения и/или само ароматическое соединение содержит по крайней мере один атом дейтерия.
В качестве примера следует отметить 2-(3-диизопропиламино-1-фенилпропил)-4-[2H3]метилфенол.
При создании изобретения неожиданно было установлено, что скорость проникновения дейтерированного толтеродина через кожу является еще более высокой по сравнению с недейтерированным толтеродином, который сам по себе уже обладает очень высокой скоростью проникновения через кожу.
В другом варианте осуществления матричная структура предпочтительно содержит 10-20 мас. % толтеродина.
Помимо этого содержащая толтеродин матричная структура может представлять собой твердый раствор.
Тот факт, что толтеродин образует твердый раствор в содержащих аммонийные группы (мет)акрилатных полимерах, был непредсказуемым и даже неожиданным, поскольку известно, что многие действующие вещества не образуют твердых растворов в полимерах (в которых вещество диспергировано на молекулярном уровне), а находятся в соответствующем полимере в форме твердых частиц, которые могут быть различимы с помощью электронного микроскопа. В отличие от твердых растворов для кристаллических действующих веществ может быть получена также дебаеграмма.
Согласно следующему варианту осуществления изобретения содержащая толтеродин матричная структура содержит по крайней мере один триэфир лимонной кислоты. Предпочтительно триэфир лимонной кислоты содержит алкановые кислоты с короткой цепью. Примерами таких кислот могут служить, в частности, метановая кислота, этановая кислота, н-пропановая кислота, изопропановая кислота, н-бутановая кислота, втор-бутановая кислота и трет-бутановая кислота.
Согласно предпочтительному варианту осуществления содержащая толтеродин матричная структура включает бутиловый эфир лимонной кислоты, этиловый эфир лимонной кислоты или их смесь.
Неожиданно было установлено, что благодаря используемому составу и используемой структуре, предлагаемой в изобретении, ТТС, несмотря на высокие концентрации действующего вещества, представляющего собой толтеродин, в полимерной матрице, обеспечивается достаточная физическая стабильность системы при продолжительном хранении.
Неожиданно было установлено, что при использовании полимера в качестве содержащей действующее вещество полимерной матрицы непосредственно после приклеивания ТТС возникает плотный контакт между матрицей, содержащей действующее вещество, и кожей, что позволяет создать самоклеящуюся ТТС, которая сохраняет свои свойства в течение нескольких дней и которая удовлетворяет как терапевтическим, так и промышленным, в частности экономическим, требованиям.
Тем самым достигается хорошее решение проблемы соблюдения больными режима и схемы лечения.
Если выбирают вариант с использованием не содержащего действующего вещества кожного пластыря/верхней липкой ленты, то в этом случае требуется кожный пластырь с очень небольшой площадью поверхности, имеющий клеящий край шириной лишь в несколько миллиметров.
В результате достигается преимущество как с экономической точки зрения, так и с точки зрения соблюдения больными режима и схемы лечения.
Согласно еще одному варианту осуществления изобретения пленочная подложка ТТС имеет со стороны, обращенной к матрице, покрытие из напыленного металла или оксидное покрытие.
Ниже структура предлагаемой в изобретении ТТС поясняется со ссылкой на прилагаемые чертежи, на которых показано:
на фиг.1 - вариант выполнения ТТС, в которой не используется верхняя липкая лента и которая имеет содержащую действующее вещество полимерную матрицу (1), отделяемую защитную пленку (5) и покровную пленку (2) и
на фиг.2 - вариант выполнения ТТС, в которой используется внешняя липкая лента и которая в дополнение к слоям, указанным для показанного на фиг.1 варианта, имеет верхнюю липкую ленту, состоящую из пленочной подложки (4) и адгезивной пленки (3).
ТТС по изобретению может быть изготовлена согласно так называемому “методу, основанному на применении растворителя”. Для этого полимер, действующее вещество и другие компоненты растворяют в одном растворителе и образовавшийся раствор тонким слоем наносят на подложку. Подложку с нанесенным слоем сушат для того, чтобы удалить содержащийся в полимерной матрице растворитель, накрывают другой пленкой и затем нарезают на куски требуемого размера.
В альтернативном варианте ТТС можно также изготавливать согласно так называемому “методу на основе горячего расплава”. Для этого полимер расплавляют, смешивают с действующим веществом, а также с другими вспомогательными веществами, полученную смесь наносят тонким слоем на подложку (пленку) (т.е. отделяемую защитную пленку) и охлаждают. Затем накрывают другой пленкой (покровной пленкой) и нарезают на куски требуемого размера.
Предпочтительным является приготовление содержащей толтеродин матрицы путем экструзии расплава, когда компонент, представляющий собой действующее вещество, непрерывно добавляют в виде твердого вещества в расплав полимера и пластификатора и сразу после добавления действующего вещества полимерный расплав, содержащий действующее вещество, непрерывно наносят толщиной от 0,02 до 0,5 мм на отделяемый защитный слой и на образовавшуюся двухслойную структуру со стороны матрицы наносят покровный слой. Приготовление содержащей действующее вещество матрицы и ее дальнейшую переработку предпочтительно осуществлять с помощью непрерывного и экономичного технологического процесса с коротким циклом. Благодаря минимальной тепловой нагрузке на содержащую действующее вещество полимерную массу удается исключить реакции разложения.
Ниже изобретение поясняется на примерах.
Пример 1
В стеклянном стакане при перемешивании растворяют 2,52 г Eudragit RS 100 (т.е. полимер на основе этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата в молярном соотношении мономерных звеньев 1:2:0,1), 1,16 г трибутилцитрата и 0,65 г R-толтеродина с добавлением 8,00 г этилового эфира уксусной кислоты.
Полученный полимерный раствор наносят с помощью ракли на покрытую напыленным алюминием и имеющую двустороннее силиконовое покрытие отделяемую полиэфирную пленку (т.е. пленку-подложку) толщиной приблизительно 100 мкм и сушат в течение 30 мин при 45°С в камерной сушилке с циркуляцией воздуха, в результате чего образуется содержащая толтеродин полимерная пленка с удельной массой поверхности 110 г/м2. После этого ее накрывают полиэфирной пленкой толщиной приблизительно 19 мкм (покровная пленка). Из полученного таким образом 3-слойного ламината, состоящего из отделяемой защитной пленки, содержащей действующее вещество полимерной пленки и покровной пленки, вырезают с помощью штампа трансдермальную систему (ТТС) площадью 5 см2.
Оценка in vitro скорости проникновения толтеродина
Оценка скорости проникновения через мышиную кожу
Вырезанную с помощью штампа ТТС площадью 2,55 см2 закрепляют в горизонтальной диффузионной ячейке на роговом слое кожи с брюшной и спинной области лишенных волосяного покрова (бестимусных) мышей. Сразу после этого акцепторную камеру ячейки заполняют не содержащим воздушных пузырьков раствором фосфатного буфера (0,066-молярного) с рН 6,2, температуру которого предварительно доводят до 32°С, и температуру высвобождаемой среды поддерживают на уровне 32±0,5°С.
В моменты отбора проб (через 3, 6, 24, 30, 48, 54 и 72 ч) высвобождаемую среду заменяют свежей средой, температуру которой поддерживают на уровне 32±0,5°С.
Измерения скорости проникновения через человеческую кожу
Тестирование проводят в проточной ячейке согласно методу, описанному у Tiemessen (Harry L.G.M. Tiemessen и др. Acta Pharm. Technol. 34, 99-101 (1988)) с использованием свежепрепарированного кусочка человеческой кожи толщиной приблизительно 200 мкм, который акцепторной стороной помещают на силиконовую мембрану (акцепторная среда: раствор фосфатного буфера (0,066-молярный) с рН 6,2, температуру которого поддерживают на уровне 32±0,5°С).
Отбор проб проводят через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69 и 72 ч.
Содержание R-толтеродинового основания в высвобождаемой, соответственно в акцепторной среде, при исследовании проницаемости человеческой кожи определяют с помощью жидкостной хроматографии высокого разрешения в указанных ниже условиях:
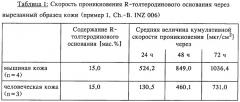
Результаты исследований, описанных в примере 1, представлены в таблице 1.
Пример 2
В стеклянном стакане при перемешивании растворяют 9,71 г Eudragit RS 100 (т.е. полимера на основе этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата в молярном соотношении мономерных звеньев 1:2:0,1), 4,76 г трибутилцитрата и 2,50 г (R,S)-толтеродина с добавлением 32,00 г этилового эфира уксусной кислоты.
Полученный полимерный раствор наносят с помощью ракли на покрытую напыленным алюминием и имеющую двустороннее силиконовое покрытие отделяемую полиэфирную пленку (т.е. пленку-подложку) толщиной приблизительно 100 мкм и сушат в течение 30 мин при 45°С в камерной сушилке с циркуляцией воздуха, в результате чего образуется содержащая толтеродин полимерная пленка с удельной массой поверхности 125 г/м2. После этого ее накрывают полиэфирной пленкой толщиной приблизительно 19 мкм (покровная пленка). Из полученного таким образом 3-слойного ламината, состоящего из отделяемой защитной пленки, содержащей действующее вещество полимерной пленки и покровной пленки, вырезают с помощью штампа трансдермальную систему (ТТС) площадью 5 см2.
Оценка in vitro скорости проникновения толтеродина
Оценка скорости проникновения через мышиную кожу
Вырезанную с помощью штампа ТТС площадью 2,55 см2 закрепляют в горизонтальной диффузионной ячейке на роговом слое кожи с брюшной и спинной области лишенных волосяного покрова (бестимусных) мышей. Сразу после этого акцепторную камеру ячейки заполняют не содержащим воздушных пузырьков раствором фосфатного буфера (0,066-молярного) с рН 6,2, температуру которого предварительно доводят до 32°С, и температуру высвобождаемой среды поддерживают на уровне 32±0,5°С.
В моменты отбора проб (через 3, 6, 24, 30, 48, 54 и 72 ч) высвобождаемую среду заменяют свежей средой, температуру которой поддерживают на уровне 32±0,5°С.
Измерения потока через человеческую кожу
Тестирование проводят в проточной ячейке согласно методу, описанному у Tiemessen (Harry L.G.M. Tiemessen и др., Acta Pharm. Technol. 34, 99-101 (1988)) с использованием свежепрепарированного кусочка человеческой кожи толщиной приблизительно 200 мкм, который акцепторной стороной помещают на силиконовую мембрану (акцепторная среда: раствор фосфатного буфера (0,066-молярный) с рН 6,2, температуру которого поддерживают на уровне 32±0,5°С).
Отбор проб проводят через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69 и 72 ч.
Содержание R,S-толтеродинового основания в высвобождаемой, соответственно в акцепторной среде, при исследовании проницаемости человеческой кожи определяют с помощью жидкостной хроматографии высокого разрешения в указанных ниже условиях:
Результаты исследований, описанных в примере 2, представлены в таблице 2.
Пример 3
В стеклянном стакане при перемешивании растворяют 9,71 г Eudragit RS 100 (т.е. полимера на основе этилакрилата, метилметакрилата и хлорида триметиламмонийэтилметакрилата в молярном соотношении мономерных звеньев 1:2:0,1), 4,76 г трибутилцитрата и 2,50 г R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-[2Н3]метилфенола (R-(D3)толтеродина) с добавлением 32,00 г этилового эфира уксусной кислоты.
Полученный полимерный раствор наносят с помощью ракли на покрытую напыленным алюминием и имеющую двустороннее силиконовое покрытие отделяемую полиэфирную пленку (т.е. пленку-подложку) толщиной приблизительно 100 мкм и сушат в течение 30 мин при 45°С в камерной сушилке с циркуляцией воздуха, в результате чего образуется содержащая толтеродин полимерная пленка с удельной массой поверхности 125 г/м2. После этого ее накрывают полиэфирной пленкой толщиной приблизительно 19 мкм (покровная пленка). Из полученного таким образом 3-слойного ламината, состоящего из отделяемой защитной пленки, содержащей действующее вещество полимерной пленки и покровной пленки, вырезают с помощью штампа трансдермальную систему (ТТС) площадью 5 см2.
Измерения in vitro скорости проникновения толтеродина
Измерения скорости проникновения через мышиную кожу
Вырезанную с помощью штампа ТТС площадью 2,55 см2 закрепляют в горизонтальной диффузионной ячейке на роговом слое кожи с брюшной и спинной области лишенных волосяного покрова (бестимусных) мышей. Сразу после этого акцепторную камеру ячейки заполняют не содержащим воздушных пузырьков раствором фосфатного буфера (0,066-молярным), рН 6,2, температуру которого предварительно доводят до 32°С, и температуру высвобождаемой среды поддерживают на уровне 32±0,5°С.
В моменты отбора проб (через 3, 6, 24, 30, 48, 54 и 72 ч) высвобождаемую среду заменяют свежей средой, температуру которой поддерживают на уровне 32±0,5°С.
Содержание R-(D3)-толтеродинового основания в высвобождаемой, соответственно в акцепторной среде, при исследовании проницаемости мышиной кожи определяют с помощью жидкостной хроматографии высокого разрешения в указанных ниже условиях:
| стационарная фаза:температура колонки:элюент: | обращенная фаза C8, 3,9×150 мм, 5 мкм;комнатная температура;700 об./част. натрийдигидрофосфатного буфера (0,05-молярный), рН 3,0, 300 об./част. ацетонитрила; |
| обнаружение:скорость потока:инжектируемый объем: | УФ при 220 нм;1,2 мл/мин;50 мкл при 15°С. |
Измерения скорости проникновения через человеческую кожу
Тестирование проводят в проточной ячейке согласно методу, описанному у Tiemessen (Harry L.G.M. Tiemessen и др., Acta Pharm. Technol. 34, 99-101 (1988)) с использованием свежепрепарированного кусочка человеческой кожи толщиной приблизительно 200 мкм, который акцепторной стороной помещают на силиконовую мембрану (акцепторная среда: раствор фосфатного буфера (0,066-молярный) с рН 6,2, температуру которого поддерживают на уровне 32±0,5°С).
Отбор проб проводят через 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69 и 72 ч.
Содержание R-(D3)-толтеродинового основания в высвобождаемой, соответственно в акцепторной среде, при исследовании проницаемости человеческой кожи определяют с помощью жидкостной хроматографии высокого разрешения в указанных ниже условиях:
| стационарная фаза:температура колонки:элюент: | обращенная фаза C8, 3,9×150 мм, 5 мкм;комнатная температура;700 об./част. натрийдигидрофосфатного буфера (0,05-молярный), рН 3,0, 300 об./част. ацетонитрила; |
| обнаружение:скорость потока:инжектируемый объем: | УФ при 220 нм;1,2 мл/мин;50 мкл при 15°С. |
Результаты исследований, описанных в примере 3, представлены в таблице 3.
1. Трансдермальная терапевтическая система (ТТС), предназначенная для чрескожного введения толтеродина в течение нескольких дней, отличающаяся тем, что она представляет собой самоклеящуюся слоистую матричную структуру, содержащую включающий аммонийные группы сополимер (мет)акрилата, по меньшей мере один пластификатор и до 25 мас.% толтеродина.
2. Трансдермальная терапевтическая система (ТТС), предназначенная для чрескожного введения толтеродина в течение нескольких дней и снабженная приспособлением для ее фиксации на коже, отличающаяся тем, что она представляет собой содержащую толтеродин самоклеящуюся слоистую матричную структуру, которая включает содержащий аммонийные группы сополимер (мет)акрилата, по меньшей мере один пластификатор и до 25 мас.% толтеродина, и окружена, за исключением поверхности, через которую происходит высвобождение, пластырем большего по сравнению с самой ТТС размера, который не содержит действующее вещество и предназначен для закрепления на коже в месте введения.
3. ТТС по п.1 или 2, отличающаяся тем, что содержащая действующее вещество матричная структура содержит (R, S)- толтеродин или R-толтеродин.
4. ТТС по любому из пп.1-3, отличающаяся тем, что содержащая действующее вещество матричная структура содержит дейтерированный толтеродин.
5. ТТС по любому из пп.1-4, отличающаяся тем, что содержащая толтеродин матричная структура представляет собой твердый раствор.
6. ТТС по любому из пп.1-5, отличающаяся тем, что содержащая толтеродин матричная структура содержит в качестве пластификатора по крайней мере один триэфир лимонной кислоты.
7. ТТС по п.6, отличающаяся тем, что она в качестве пластификатора содержит трибутиловый эфир лимонной кислоты либо индивидуально, либо в смеси с триэтиловым эфиром лимонной кислоты.
8. ТТС по любому из пп.1-7, отличающаяся тем, что пленочная подложка со стороны, обращенной к матрице, имеет нанесенное напылением металлическое покрытие или оксидное покрытие.