Фармацевтическая композиция для лечения ишемического инсульта и способ лечения
Иллюстрации
Показать всеИзобретение относится к фармацевтической химии, медицине. Гептапептид последовательности Met-Glu-His-Phe-Pro-Gly-Pro (гептапептид А) в составе композиции используют для лечения ишемического инсульта путем введения по 2 капли композиции в каждый носовой ход 5-6 раз в сутки в течение 10 дней при заболевании средней тяжести, а при тяжелой - по 3 капли композиции в каждый носовой ход 7 раз в сутки в течение 10 дней. Изобретение обеспечивает повышение эффективности при снижении концентрации гептапептида, без побочных эффектов. 2 н.п. ф-лы, 5 табл., 6 ил.
Реферат
Изобретение относится к области медицины, а именно к исследованию и применению пептидной последовательности Met-Glu-His-Phe-Pro-Gly-Pro (гептапептид А) на нейропротекторную активность и созданию фармацевтической композиции с нейропротективным действием. Лекарственное средство на этой основе может быть использовано при различных неврологических заболеваниях, связанных с поражением мозга, при сосудистых поражениях мозга, при прогрессирующих заболеваниях центральной нервной системы в том числе и наследственных.
Актуальность разработки различных нейропротекторных средств, средств защиты центральной нервной системы за счет активизации различных метаболических процессов мозга, определяется потребностями современного здравоохранения. Достаточно, например, сказать, что смертность от инсульта в нашей стране вышла на второе место после сердечно-сосудистых заболеваний. Одним из перспективных направлений нейропротекторной терапии в условиях ишемии является усиление нейротрофического обеспечения мозга, что препятствует развитию как апоптозных, так и некротических изменений нейронов.
Современные представления о пластичности центральной нервной системы позволяют предполагать значительные возможности для восстановления ее функций, нарушаемых в результате патологических воздействий, таких как травма, инсульт, ишемия и др. Считается, что при данных воздействиях клетки нервной системы претерпевают гибель по механизмам некроза и программированной клеточной смерти (апоптоза). Вокруг некротического очага развивается область, клетки которой входят в состояние апоптоза. Отличительной особенностью апоптоза является его обратимость, что означает возможность восстановления нормального состояния нервных клеток при действии на них так называемых нейропротективных факторов. В настоящее время выделен и изучен ряд таких факторов, защищающих нейроны от повреждающих воздействий, в частности Фактор роста нервов (NGF) и Нейротрофический фактор мозга (BDNF) и другие. Более того, показано увеличение уровня синтеза нейротрофического Фактора мозга вслед за ишемическим повреждением мозга. В связи с этим существует возможность предотвращения последствий патологических воздействий на центральную нервную систему с помощью подобных нейропротективных факторов. Существует, однако, принципиальная сложность их использования в клинической практике, связанная со способом введения данных веществ в мозг, вследствие непроницаемости для них гематоэнцефалического барьера. В связи с этим представляется важным синтез коротких пептидных соединений, которые были бы способны стимулировать синтез нейротрофических факторов в мозге in vivo, особенно после интраназального введения таких пептидных соединений.
Известен гептапептид Met-Glu-His-Phe-Pro-Gly-Pro в качестве стимулятора памяти пролонгированного действия (Патент СССР № 939440, С 07 С 103/52, А 61 К 37/02, приоритет от 6 января 1981) [1], который является основой ноотропного средства и фармацевтической композицией ноотропного действия (Патент РФ № 2045958, С 16 А 61 К 38/08, 1994) [2].
Известен способ лечения инсульта с использованием гептапептида А для больных средней тяжести и при тяжелых инсультах в суточной дозе соответственно 9-13 и 15-24 мг (Патент РФ № 2124365, С1 А 61 К 38/08) [3]. Гептапептид А в случае лечения инсульта средней тяжести и при тяжелых инсультах используется в виде 4-5% раствора (Патент РФ № 2124365, С1 А 61 К 38/08). Этот патент является прототипом.
Однако использование 4-5% раствора при вышеуказанных дозах предполагает введение по 1 капле в каждый носовой ход 2 раза в сутки в случае инсульта средней тяжести и по 1 капле 4 раза (или по 2 капли 2 раза) в сутки в случае тяжелого инсульта. Введение в носовой ход одной капли препарата резко снижает эффективность его использования, так как лишь малая часть лекарства смачивает слизистую оболочку носа. Это является главным недостатком прототипа, так как в случае лечения неврологических заболеваний препарат целесообразно вводить по 2-3 капли в каждый носовой ход для лучшего смачивания слизистой оболочки носовой полости через 2-4 часа. Кроме того, предложенный в прототипе состав не определяет фармакологической композиции лекарственного средства, от которой зависит гарантированный срок сохранности препарата.
Техническим результатом, достигаемым при реализации данного изобретения, является возможность создания нового лекарственного препарата для лечения различных патологий мозга (инсульт, ишемии, травмы и т.д.).
Достигается это тем, что известный гептапептид, общей формулы Met-Glu-His-Phe-Pro-Gly-Pro применяется в качестве нейропротекторного средства в следующей фармацевтической композиции:
Гептапептид А, вода дистиллированная и в качестве консервирующего вещества нипагин при следующем соотношении компонентов, г/л:
гептапептид указанной формулы 9,5-10,6
нипагин 0,90-1,10
дистиллированная вода до 1 л
Следующие примеры подтверждают нейропротекторные свойства гептапептида А, нейропротективные свойства лекарственного средства и фармацевтическую композицию.
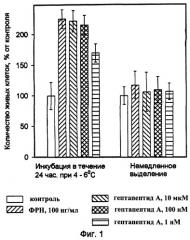
Пример 1:
Проводили исследование способности вышеприведенной пептидной последовательности Met-Glu-His-Phe-Pro-Gly-Pro (гептапептид А) увеличивать выживаемость культивируемых нервных клеток после гибернации эмбрионального мозга. Нелинейных белых крыс со сроком беременности 16-18 дней забивали путем углекислотной асфиксии. Из мозга эмбрионов выделяли базальные ядра переднего мозга, которые диссоциировали на отдельные клетки. Полученную клеточную суспензию переносили в культуральную среду MEM/F-12 (1:1), содержащюю 6 г/л D-глюкозы, 25 мг/л инсулина, 100 мг/л трансферрина, 20 нМ прогестерона, 100 нМ путресцина и 30 нМ селенита натрия и высевали на 96-луночные планшеты, предварительно обработанные D-полилизином. Плотность клеток составляла 30-50 тысяч клеток на лунку. После прикрепления клеток к подложке добавляли растворы гептапептида А и Фактора роста нервов (положительный контроль) в культуральной среде указанного состава до конечной концентрации 10 мкМ и 100 нг/мл соответственно. В качестве контроля использовалась среда, не содержащая гептапептид А и Фактор роста нервов. Клетки культивировали в СО2-инкубаторе (5% СO2) при 37° С, затем оценивали количество живых клеток с помощью окрашивания МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолий-бромид). Гептапептид А и Фактор роста нервов не влияли на выживаемость клеток через 24 часа после начала культивирования при немедленном выделении базальных ядер переднего мозга из эмбрионального мозга. Однако достоверно увеличивали выживаемость при предварительной инкубации выделенного целого мозга в растворе Хэнкса при 4-6° С в течение 24 часов (фиг.1). Таким образом, гептапептид А замедляет гибель части культивируемых клеток базальных ядер переднего мозга, вызванную гибернацией эмбрионального мозга, и проявляет нейропротективный эффект, сравнимый с действием Фактора роста нервов.
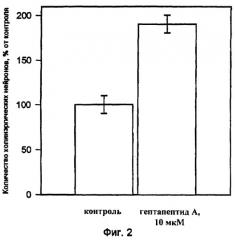
Пример 2:
Проводили исследование способности гептапептида А увеличивать выживаемость культивируемых в течение длительного времени нервных клеток. Культуры получали и культивировали, как описано в примере 1. После прикрепления клеток к подложке добавляли раствор гептапептида А в культуральной среде указанного состава до конечной концентрации 10 мкМ. В качестве контроля использовалась среда, не содержащая гептапептид А. Через 7 дней после начала культивирования клетки фиксировали 4% раствором параформальдегида в фосфатно-солевом буфере и проводили визуализацию холинэргических нейронов с помощью цитохимического окрашивания клеток на ацетилхолинэстеразу согласно методике, приведенной в (Hefti F., Hartikka J., et. Al.Sanchez-Ramos J.//A Dissection and Tissue Culture Manual of the Nervous System./eds.: Shahar A., de Vellis J./Wiley-Liss, New-York. 1989. P.172-182.) [4]. Результаты данных экспериментов приведены на фиг.2. Гептапептид А достоверно увеличивал количество холинэргичесских нейронов.
Пример 3:
Проводили исследование способности гептапептида А влиять на пролиферацию глиальных клеток. Культуру глиальных клеток базальных ядер переднего мозга крысы получали из новорожденных крыс по стандартной методике. Клетки культивировали в среде MEM с 15% эмбриональной сыворотки (ЭС) в СО2-инкубаторе (5% CO2) при 37° С. Включение [3H]тимидина в ДНК глиальных клеток определяли согласно общепринятой методике. Глиальные клетки высевали на 24-луночные планшеты с плотностью 70 тыс. клеток на лунку, выдерживали 1 день в бессывороточной среде MEM в СО2-инкубаторе (5% СО2) при 37° С, затем добавляли указанные на фиг.2 соединения и [3H]тимидин (1мкКюри/мл) или только [3H]тимидин (контроль). Инкубацию с добавленными соединениями и [3H]тимидином проводили в течение 24 часов при аналогичных условиях. Не было обнаружено достоверного уменьшения или увеличения включения [3H]тимидина в ДНК глиальных клеток (фиг.3), что указывает на отсутствие у гептапептида А способности подавлять или стимулировать пролиферацию глиальных клеток.
Пример 4:
Изучалась способность пептидной последовательности Met-Glu-His-Phe-Pro-Gly-Pro (гептапептид А) стимулировать синтез нейротрофического фактора выделенного из мозга (BDNF) в гиппокампе мозга крыс in vivo. В работе были использованы самцы крыс линии Вистар, массой 300-350 г. Животных содержали в стандартных условиях вивария со свободным доступом к воде и пище и 12-ти часовым циклом освещения. Пептид вводили животным интраназально в объеме 100 мкл/кг массы тела животного однократно. Контрольным животным вводили эквивалентный объем дистиллированной воды. Использованные дозы соответствуют тем, которые были эффективны в поведенческих тестах. В каждой группе было по 3 животных. Для определения уровня экспрессии BDNF в отделах мозга гептапептид вводили интраназально в дозах 50 и 250 мкг/кг. Экспериментальных животных декапитировали через 3 и 24 час после введения пептида. Соответствующие отделы мозга (гиппокамп) отделяли и замораживали в жидком азоте. Приготовление экстрактов из выделенных отделов и дальнейшее количественное определение уровня BDNF с помощью иммуноферментного анализа осуществляли согласно протоколу фирмы "Promega" США. Для каждой экспериментальной точки использовали 4 параллели. Достоверность полученных результатов оценивали по критерию Стьюдента с помощью программы Sigma Plot 2.01.
Из результатов, представленных на фиг.4, видно, что гептапептид увеличивает уровень BDNF в гиппокампе мозга экспериментальных животных. Следует отметить, что уровень BDNF увеличивался уже через 3 час после введения гептапептида. Эффект гептапептида выявлялся в гиппокампе и через 24 час после его введения. Повышенный по отношению к контролю уровень BDNF наблюдался как при введении гептапептида в дозе 50, так и 250 мкг/кг веса животного.
Пример 5:
Изучалась эффективность пептидной последовательности Met-Glu-His-Phe-Pro-Gly-Pro (гептапептид A) in vivo на модели глобальной ишемии мозга у животных с необратимой двусторонней окклюзией общих сонных артерий. Под влиянием гептапептида А достоверно уменьшалась выраженность неврологического дефицита и отмечалась тенденция увеличения выживаемости животных, что связано с нейропротекторным действием препарата (фиг.5).
Рандомизированное слепое исследование было проведено на 40 самцах крыс линии Вистар, весом от 80 до 110 г. Необратимая двусторонняя окклюзия общих сонных артерий осуществлялась под эфирным наркозом с использованием хирургического доступа и одномоментной перевязки артерий шелковой лигатурой. Операция на каждом животном проводилась стандартно и занимала не более 7-10 минут, затем крысы быстро восстанавливались после эфирного наркоза.
Все исследованные субстанции, приведенные ниже, вводились в виде внутрибрюшинных инъекций (суточная доза в 1 мл раствора). В эксперимент были включены группы животных, получавших гептапептид последовательности Met-Glu-His-Phe-Pro-Gly-Pro (гептапептид А), церебролизин, физиологический раствор (контроль), а также ложнооперированные животные. В основную группу входили 10 животных, получавших гептапептид А из расчета 300 мкг/кг/сут, дробно через 15, 60, 120 минут и 5 часов после момента окклюзии. Доза и дробное назначение препарата были выбраны на основании клинических и экспериментальных данных, продемонстрировавших ноотропный эффект малых доз гептапептида А (3-30 мкг/кг) и антигипоксическое и нейротрофическое действие высоких доз препарата (150-300 мкг/кг) [5,6,7]. Группу сравнения составили 10 животных, получавших церебролизин. Активным действующим началом препарата являются низкомолекулярные пептиды, обладающие ярко выраженным нейротрофическим эффектом [8]. Церебролизин вводился в дозе 2,5 мл/кг/сут через 15 и 60 минут от момента окклюзии. 10 животных контрольной группы после окклюзии получали физиологический раствор по 0,5 мл через 15 и 60 минут после ишемии. В группе ложнооперированных животных под тем же наркозом был осуществлен хирургический доступ к общим сонным артериям без их перевязки, и внутрибрюшинно вводился физиологический раствор. Оценка неврологического дефицита осуществлялась слепо (без информации о распределении крыс по группам) через каждые 30 минут в течение суток по шкалам балльной оценки: определение Stroke-Index no C.P.McGrow [9] и неврологической шкале Rudolphi et al. [10]. По шкале C.P.McGrow [9] Stroke-Index возрастает с появлением отдельных признаков неврологического дефицита, по шкале Rudolphi et al. [10] неврологический балл изменяется от 9 (норма) до 0 (смерть). Основные признаки неврологического дефицита включали ограничение подвижности животного, птоз (дву- или односторонний), кружение, гиперактивное поведение, вращательные судороги, тонические и клонические судороги, кому со слабым болевым ответом или его отсутствием.
Для статистического анализа полученных данных по динамике неврологического дефицита использовался дисперсионный факторный анализ ANOVA. Для оценки летальности и отдельных неврологических проявлений применялся тест Fisher.
В контрольной группе животных в первые 3 часа после окклюзии общих сонных артерий вращательные и клонические судороги были зарегистрированы у 80% животных. В группах животных, получавших гептапептид А и церебролизин, у 40% (р=0,08) и 50% (р=0,17), соответственно.
При оценке неврологического дефицита в течение суток выявлено, что введение церебролизина не оказывало заметного влияния на динамику изменения балла по шкалам оценки Mc Grow [9] и Rudolphi et al. [10] при сравнении с контрольной группой (фиг.5). В группе животных, получавших гептапептид А, на протяжении суток сохранялись более низкие значения среднего балла по шкале Mc Grow [8] и более высокие значения по Rudolphi et al. [7] по сравнению с контрольной группой животных и группой животных, получавших церебролизин. Достоверные отличия были найдены в период от 1,5 до 6,5 часов (р=0,03, ANOVA) между контрольной группой и группой животных, получавших гептапептид А.
При оценке досуточной летальности необходимо отметить, что 50% летальных случаев в контрольной группе и в группе животных, получавших церебролизин, наблюдались в течение первых 7 часов от момента окклюзии, тогда как в группе животных, получавших гептапептид А, до 7 часов не было зарегистрировано ни одного смертельного исхода. 50% летальных случаев в группе животных, получавших гептапептид А, наблюдались в интервале от 8 до 10 часов от момента ишемии. При оценке летальности к концу первых суток после глобальной ишемии мозга получены следующие показатели: 100% животных в контрольной группе, 90% - в группе животных, получавших церебролизин, и 70% - в группе животных, получавших гептапептид А (р>0,05). Средняя продолжительность жизни в контрольной группе составила 9,1±1,7 часа, в группе животных, получавших церебролизин, - 11,5±2,3 часа и в группе животных, получавших гептапептид А, - 14,2±2,5 часа. Значения среднего балла на момент смерти по шкале С.Р. McGrow [7] во всех группах были сопоставимы: 19,4±0,9 в контрольной группе, 19,9±0,5 в группе животных, получавших церебролизин, и 20±1,1 в группе животных, получавших гептапептид А. Необходимо отметить, что к концу суток в группе животных, получавших гептапептид А, средний балл по шкале Mc Grow [7] был на 10 пунктов выше, чем в группе животных, получавших церебролизин, что свидетельствовало о выживании на фоне гептапептида А даже животных с выраженным неврологическим дефицитом.
Проведенные экспериментальные исследования показали, что применение гептапептида А при глобальной ишемии мозга у животных оказывает определенный положительный эффект, уменьшая выраженность неврологического дефицита в течение первых 6,5 часов, при сравнении с контрольной группой и группой животных, получавших церебролизин. Наблюдаемая тенденция увеличения выживаемости животных, удлинения периода до первого смертельного исхода также могут быть обусловлены нейропротекторными свойствами гептапептида А.
Пример 6:
Срок хранения препарата “Семакс - 1,0% раствор” определяли методом ускоренного старения. Раствор лекарственной формы препарата, представляющий собой водный раствор гептапептида А (1,0%) с добавлением 0,1% консерванта нипагина, был в стерильных условиях разлит во флаконы с пластмассовой пробкой-пипеткой по 3 мл во флакон. Произведено 3 серии препарата по 75 флаконов в каждой.
Был осуществлен входной контроль препарата по следующим критериям: описание раствора, его цветность, прозрачность, рН, стерильность, определение количественного содержания основного вещества и нипагина. Количественное содержание проводили методом высокоэффективной жидкостной хроматографии.
2 мкл препарата “Семакс-1,0% раствор” анализировали на любом жидкостном хроматографе высокого давления, оснащенном ультрафиолетовым спектрофотометрическим детектором на 210-230 нм и термостатом колонок.
Для анализа использовали аналитическую колонку (например, размером 4· 150 мм), заполненную обращенно-фазным (С8, С 16 или C18) сорбентом (типа Nucleosil C8, Диасорб С8Т, Диасорб C16T, Zorbax ODS и др.), с размером зерна 5-7 мкм. Для увеличения срока службы колонки использовали предколонку, заполненную тем же сорбентом. Подвижная фаза - элюент А. Элюент А получали следующим образом: К 670 мл буфера А прибавляли 330 мл метанола для жидкостной хроматографии. Элюент фильтровали через фильтр с размером пор 0.45 мкм. Перед употреблением элюент дегазировали фильтрацией под вакуумом, пропусканием гелия или другим подходящим методом. Срок годности элюента - 1 месяц при комнатной температуре в плотно закрытой таре. Скорость подачи элюента 800 мкл/мин. Хроматографию проводили в следующих условиях: Объем вводимой пробы - 2 мкл.
Детектирование на длине волны 210 нм. Температура колонки 35°С. Масштаб регистрации - 2 е.о.п.
Для определения гептапептида А и нипагина в растворе проводили трехкратный анализ соответствующего раствора. Ориентировочное время удерживания гептапептида А и нипагина в указанных условиях анализа составляет 9,1 мин и 18 мин соответственно. Искомая концентрация гептапептида А и нипагина в растворе (Сi,гепт и Сi,нип) определяется по формулам:
Ci,гепт=Ai,гепт ·Кгепт/Vi [мг/мл],
Ci,нип=Ai,нип ·Книп/Vi [мг/мл],
где Аi, гепт и Аi, нип - площади пиков гептапептида А и нипагина на i-й хроматограмме;
К гепт и Книп - средние значения градуировочного коэффициента для гептапептида
А и нипагина, полученные в результате калибровки.
Vi - объем введенной пробы, мкл (Vi = 5 мкл).
Средние значения концентраций гептапептида А и нипагина в препарате
“Семакс-1,0% раствор”
(Ср,гепт и Сср,нип):
Ci,гепт=Σ (Сi,гепт)/3; Ci,нип=Σ (Сi,нип_/3 [мг/мл].
Содержание нипагина в препарате должно быть не менее 0,90 и не более 1,10 г/л. Содержание гептапептида А в препарате должно быть не менее 9,5 и не более 10,6 г/л. Значения среднего квадратичного отклонения для гептапептида А и нипагина в серии из трех анализов не должны быть больше чем 0,02 (2%).
Образцы препарата “Семакс- 1,0% раствор” (3 серии по 75 флаконов) подвергали ускоренному старению, что достигалось выдерживанием их в термостате при постоянной температуре 60°С в течение определенного срока.
Метод ускоренного старения для определения срока хранения препарата основан на том, что сохранность веществ при ускоренном старении (хранение в термостате при Т=60° С). Эти сроки составляли 5; 11; 23; 34 и 46 дней, что соответствует 1 мес; 6 мес; 1 год; 1,5 года; 2 года хранения препарата в холодильной камере при Т=8-10° С. По истечении каждого срока ускоренного старения проводилась серия исследований по тем же критериям, что и входной контроль. Количественное содержание гептапептида А и нипагина определяли методом ВЭЖХ в тех же хроматографических условиях, что и при входном контроле препарата.
Использовался метод абсолютной градуировки по стандарту (в данном случае - метод расчета количества вещества по калибровочной таблице, соответствующей хроматограмме образца препарата, который не подвергался ускоренному старению). На основании результатов, полученных при количественном определении гептапептида А и нипагина в установленные сроки ускоренного старения с учетом качественной оценки сохранности препарата по всем необходимым критериям, установлен срок годности для лекарственного препарата “Семакс - 1,0% раствор” - 2 года.
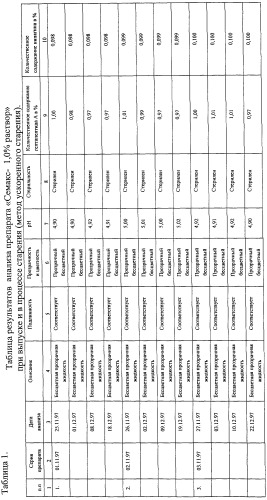
Экспериментальные результаты анализов сохранности лекарственного препарата “Семакс- 1,0% раствор” методом ускоренного старения приведены в таблице 1.
Пример 7:
В данном примере приведены обобщенные результаты клинического использования лекарственного препарата “Семакс- 1,0% раствор” в одной из клиник.
Было обследовано 80 больных (38 мужчин, 42 женщин, средний возраст 68,3±1,98 лет) с острым ишемическим полушарным инсультом. Все пациенты были госпитализированы в клинику в течение первых 12 часов с момента развития инсульта. У 42 пациента было диагностировано острое нарушение мозгового кровообращения в системе левой внутренней сонной артерии, у 38 - в системе правой внутренней сонной артерии.
Основным этиологическим фактором развития инсульта у 56 (70 %) пациентов явилось сочетание атеросклероза с артериальной гипертонией. У 14 (17,5%) больных инсульт развился на фоне артериальной гипертензии, на высоте гипертонического криза. Сочетание сахарного диабета, атеросклероза и гипертензии наблюдалось в 2 случаях (2,5%), 72 (90%) больных имели признаки ишемической болезни сердца, 16 в прошлом перенесли инфаркт миокарда. У 1 больной острое нарушение мозгового кровообращения развилось на фоне острого инфаркта миокарда (кардиоцеребральный синдром), 22 (27,5%) пациентов имели постоянную форму мерцательной аритмии неревматической природы, у 4 больных инсульт развился на фоне пароксизма мерцания предсердий (5%).
У всех больных клиническая картина соответствовала локализации очага поражения головного мозга разной степени тяжести. На момент поступления состояние у 44 больных (55%) было средней тяжести, так как в клинической картине превалировали очаговые неврологические нарушения умеренной выраженности. У 36 больных (45%) состояние оценивалось как тяжелое (таблица 2). У этих больных имелись расстройства сознания и другие общемозговые проявления, вегетативно-трофические нарушения, а также признаки грубого неврологического дефекта. Оценка состояния больных осуществлялась по трем взаимообогащающим по информативности клиническим шкалам балльной оценки неврологического дефицита (шкалы - оригинальная (Е.И.Гусев, В.И.Скворцова, 1992), Оргогозо (1986), Скандинавская (1985)) на момент поступления больных, 3-и, 5-е и 21-е сутки инсульта. Это позволило унифицировать критерии тяжести состояния, выраженности общемозговой симптоматики и неврологического дефицита для проведения сравнительного анализа, статистической и корреляционной обработки полученного материала. Сравнительный анализ эффективности терапии проводили на 5-е (в конце острейшего периода) и 21-е (в конце острого периода) сутки инсульта.
Контрольную группу составили 40 больных, которым в остром периоде инсульта проводилась комплексная, максимально унифицированная терапия, направленная на коррекцию нарушений центральной и церебральной гемодинамики, гемореологических показателей, борьбу с отеком мозга. Нейропротективные препараты не применялись. 40 пациентам с первых часов заболевания на фоне комплексной базисной терапии вводили “Семакс-1,0% раствор” по 2 капле каждый носовой ход 5-6 раз в сутки в случае инсульта средней тяжести и по 3 капли в каждый носовой ход 7 раз в сутки при тяжелом инсульте. Это позволило провести оценку эффективности включения лекарственного препарата “Семакс-1,0% раствор” в лечение острого периода полушарного ишемического инсульта, а также уточнить метаболические аспекты патогенеза ишемического инсульта и механизм действия лекарственного препарата. Препарат “Семакс-1,0% раствор” вводили эндоназально в течение 10 первых дней заболевания.
По этиологическим факторам, особенностям дебюта заболевания, срокам заболевания, возрастному и половому составу все анализируемые группы были сопоставимы.
При сопоставлении клинической динамики в группе с применением препарата “Семакс-1,0% раствор” и в контроле было обнаружено достоверное улучшение восстановительных процессов на фоне лечения препаратом “Семакс-1,0% раствор”. У больных со среднетяжелым (р<0,01-0,05) и тяжелым инсультом (р<0,001-0,05). Данные приведены в таблице 3.
У 87,5 % больных, получавших препарат “Семакс-1,0% раствор”, течение инсульта было регредиентным, со стабильным регрессом неврологических нарушений, ни в одном случае не отмечалось прогрессирования инсульта. К концу острого периода инсульта у 84% больных наблюдалось хорошее восстановление нарушенных функций с регрессом двигательных нарушений до минимального монопареза, сохранением минимальных элементов моторной афазии и полным регрессом расстройств чувствительности.
При тяжелом инсульте применение в первые часы и дни препарата “Семакс-1,0% раствор” позволило достоверно ускорить регресс не только очаговых, но и общемозговых и вегетативных симптомов. У всех больных, поступивших в состоянии оглушения, к концу 2-х суток вернулось ясное сознание, сознание 4 больных, находившихся в сопоре, ко 2-м суткам вышло на стадию оглушения, только в одном случае сопор сохранялся до конца 3-х суток заболевания. К 5-м суткам инсульта у 78% больных расстройства сознания и менингеальные симптомы регрессировали полностью. Количественная оценка динамики средних значений суммарного клинического балла показала статистически значимое опережение темпов восстановления нарушенных функций на фоне применения препарата “Семакс-1,0% раствор” по всем трем использованным шкалам, при этом различия с контролем были более выраженными, чем в группе больных со средней тяжестью заболевания. Как и в группе инсультов средней тяжести наиболее выраженным и достоверным (р<0,05) было ускорение регресса двигательных нарушений. В группе пролеченных препаратом “Семакс-1,0% раствор” тяжелых больных в 78% случаев определялось регредиентное течение заболевания (в контрольной группе - у 32,0%), у остальных больных течение острого периода инсульта было реммитирующим. В группе с применением препарата “Семакс-1,0% раствор” летальность при тяжелом инсульте составила 8,7%, тогда как в контрольной группе - 22,3% (р=0,07 по критерию Фишера). К концу острого периода у 5% обследованных регистрировалось хорошее восстановление нарушенных функций (в контроле - у 1,3%), у 64% - умеренное ограничение функций (в контроле - у 17,4%), тяжелый очаговый дефект сохранялся у 31% больных (в контроле у 81,3%).
Сопоставление эффективности разных доз препарата “Семакс-1,0% раствор” (фиг.6) выявило в группе больных со средней тяжестью инсульта большую эффективность суточной дозы 12 мг (в среднем 150 мкг/кг) по сравнению с более низкими дозами. В то же время в группе тяжелобольных большая выраженность положительной клинической динамики заболевания имела место при лечении суточной дозой 20 мг (270 мкг/кг).
Пример 8:
В данном примере приведены обобщенные результаты клинического использования лекарственного препарата “Семакс-1,0% раствор” в другой клинике. Для исследования были отобраны 80 больных (44 мужчин, 36 женщин, средний возраст 69,8±2,04 лет) с острым ишемическим полушарным инсультом, поступивших в клинику в течение первых 12 часов с момента развития инсульта (таблица 4). У 46 больных было диагностировано острое нарушение мозгового кровообращения в системе левой внутренней сонной артерии, у 34 - в системе правой внутренней сонной артерии. Основным этиологическим фактором развития инсульта у 64 (80%) пациентов явилось сочетание атеросклероза с артериальной гипертензией, сочетание сахарного диабета, атеросклероза и гипертензии наблюдалось в 4 случаях (5%), у 8 больных инсульт имел кардиоэмболический характер, пациенты страдали постоянной формой мерцательной аритмии (10%), у 4 больных инсульт развился на фоне пароксизма мерцания предсердий (5%). У всех больных клиническая картина соответствовала корково-подкорковой локализации очага поражения головного мозга разной степени тяжести. На момент поступления состояние у 48 больных (60%) было средней тяжести, в клинической картине превалировали очаговые неврологические нарушения умеренной выраженности, у 32 больных (40%) состояние оценивалось как тяжелое, у этих больных имелись расстройства сознания и другие общемозговые проявления, вегетативно-трофические нарушения, а также признаки грубого неврологического дефекта. Оценка состояния больных осуществлялась по трем взаимообогащающим по информативности клиническим шкалам балльной оценки неврологического дефицита (шкалы - оригинальная (Е.И.Гусев, В.И.Скворцова, 1992), Оргогозо (1986), Скандинавская (1985) на момент поступления больных, 3-и, 5-е и 21-е сутки инсульта. Это позволило унифицировать критерии тяжести состояния, выраженности общемозговой симптоматики и неврологического дефицита для проведения сравнительного анализа, статистической и корреляционной обработки полученного материала. Сравнительный анализ эффективности терапии проводили на 5-е (в конце острейшего периода) и 21-е (в конце острого периода) сутки инсульта.
Контрольную группу составили 40 больных, которым в остром периоде инсульта проводилась комплексная, максимально унифицированная терапия, направленная на коррекцию нарушений центральной и церебральной гемодинамики, гемореологических показателей, борьбу с отеком мозга, без включения нейропротективных препаратов. 40 пациентам с первых часов заболевания на фоне комплексной базисной терапии вводили препарат “Семакс-1,0% раствор” в дозах и по схеме предыдущего примера. Это позволило провести оценку эффективности включения препарата “Семакс-1,0% раствор” в лечение острого периода полушарного ишемического инсульта, а также уточнить метаболические аспекты патогенеза ишемического инсульта и механизм действия препарата. Препарат “Семакс-1,0% раствор” вводили эндоназально в течение 10 первых дней заболевания.
По этиологическим факторам, особенностям дебюта заболевания, срокам заболевания, возрастному и половому составу все анализируемые группы были сопоставимы.
Сопоставление клинической динамики в группе с применением препарата “Семакс-1,0% раствор” и в контроле обнаружило достоверное улучшение восстановительных процессов на фоне лечения препаратом “Семакс-1,0% раствор” у больных со среднетяжелым (р<0,01-0,05) и тяжелым инсультом (р<0,001-0,05) (таблица 5).
При ишемическом инсульте средней тяжести с преобладанием в клинической картине очаговых неврологических симптомов эффективность препарата “Семакс-1,0% раствор” проявлялась с первых суток заболевания и выражалась в общей активизации больных, статистически достоверном ускорении регресса очаговой симптоматики к 5-м и 21 суткам заболевания. У 88% больных, получавших препарат “Семакс-1,0% раствор”, течение инсульта было регредиентным со стабильным регрессом неврологических нарушений, что значительно превышало аналогичный показатель в контрольной группе (55,2%). К концу острого периода инсульта у 80% больных констатировано хорошее восстановление нарушенных функций (до минимального монопареза или рефлекторной асимметрии), причем у 36% пациентов регресс очаговых симптомов был полным (варианты “малого” инсульта). При тяжелом инсульте применение в первые часы и дни препарата “Семакс-1,0% раствор” позволило достоверно ускорить регресс не только очаговых, но и общемозговых и вегетативных симптомов. У всех больных, поступивших в состоянии оглушения, к концу 2-х суток вернулось ясное сознание. К 5-м суткам инсульта у 80% больных расстройства сознания и менингеальные симптомы регрессировали полностью. У 82% больных, леченных препаратом “Семакс-1,0% раствор”, определялось регредиентное течение заболевания (в контрольной группе - у 58%). В группе с применением препарата “Семакс-1,0% раствор” летальность при тяжелом инсульте составила 10%, тогда как в контрольной группе - 28,9% (р=0,07 по критерию Фишера). К концу острого периода у 21% обследованных регистрировалось хорошее восстановление нарушенных функций (в контроле - у 5,1%), у 40% - умеренное ограничение функций (в контроле - у 14,4%), тяжелый очаговый дефект сохранялся у 39% больных (в контроле - у 57,1%).
Сопоставление эффективности разных доз препарата “Семакс-1,0% раствор” выявило в группе больных со средней тяжестью инсульта большую эффективность суточной дозы 12 мг (в среднем 150 мкг/кг) по сравнению с более низкими дозами. В то же время в группе тяжелобольных большая выраженность положительной клинической динамики заболевания имела место при лечении суточной дозой 20 мг (270 мкг/кг).
Вышеприведенные примеры подтверждают нейропротективные свойства пептидной последовательности Met-Glu-His-Phe-Pro-Gly-Pro) и эффективность предложенной фармацевтической композиции.
Литература
1. Пономарева-Степная М.А., Незавибатько В.Н., Ашмарин И.П., Каменский А.А., Антонова Л.В. (1982). Патент СССР № 939440, С 07 С 103/52, А 61 К 37/02, приоритет от 6 января 1981.
2. Л.А.Андреева, И.П.Ашмарин, А.А.Каменский, Н.Ф.Мясоедов, В.Н.Незавибатько, Т.В.Рясина (1994). Патент РФ № 2045958, С 16 А 61 К 38/08. Приоритет изобретения от 28 марта 1994 г.
3. Гусев Е.И., Скворцова В.И., Журавлева Е.Ю., Андреева Л.А., Незавибатько В.Н., Гривенников И.А., Мясоедов Н.Ф. (1999). Патент РФ № 2124365 С1 А 61 К 38/08. Приоритет изобретения от 13 мая 1997 г.
4. Hefti F., Hartikka J., Sanchez-Ramos J.//A Dissection and Tissue Culture Manual of the Nervous System./eds.: Shahar A., de Vellis J./Wiley-Liss, New-York. 1989. P.172-182.
5. Ашмарин И.П., Незавибатько В.Н., Мясоедов Н.Ф., Каменский А.А., Гривенников И.А., Пономарева-Степная М.А., Андреева Л.А., Каплан А.Я., Кошелев В.Б., Рясина Т.В. (1997). Журнал высшей нервной деятельности. Т. 47, Вып. 2, С.420-430.
6. Волков А.В., Заржецкий Ю.В., Постнов А.Ю., Болякина Г.Н., Каменский А.А., Муравьев О.Б., Мишарина Г.В., Геренко А.Н. (1992). Результаты применения регуляторных пептидов при реанимации после остановки сердца в эксперименте. Терминальные состояния и постреанимационная патология организма: патофизиология, клиника, профилактика и лечение. М., Институт общей реаниматологии РАМН. С.69-76.
7. Kaplan A.Ya., Kochetova A.G., Nezavibathko V.N., Rjasina T.V., Ashmarin I.P. Neuroscience Research Communications. (1996). Vol. 19, № 2, P.115-123.
8. Windrisch M. et al. Advances in the Biosciences.(1993). Vol. 87.- P. 355-357.
9. Dag K.J.E. Von Lubitz, R.C.-S. Lin et al. Eur J Pharm.(1992). Vol. 219, P.153-158.
10. Mc Grow P. Arch Neurol. (1977). Vol. 34.- P. 334-336.
| Таблица 2 | |||||||
| Распределение больных по полу, тяжести состояния и локализации поражения | |||||||
| Группы больных | Локализация сосудистого поражения | Итого | |||||
| Система внутренней сонной артерии | |||||||
| Левой | Правой | ||||||
| мужчины | женщины | всего | мужчины | женщины | всего | ||
| Состояние средней тяжести >36;>25;>50 (55%) баллов* | 10 | 16 | 26 | 12 | 6 | 18 | 44 |
| Тяжелое состояние ≤ 36; ≤ 25; ≤ 50 (45%) баллов* | 4 | 12 | 16 | 12 | 8 | 20 | 36 |
| Итого | 14 (33,3%) | 28 (66,6%) | 42 (100%) | 24 (63,12%) | 14 (36,88%) | 38 (100%) | 80 (100%) |
| * баллы даны по оригинальной. Скандинавской и шкале Оргогозо, соответственно |
| Таблица 3 | |||
| Распределение обследованных больных разных групп по тяжести состояния | |||
| Группы больных | Состояние средней тяжести (>36;>25;>50) | Тяжелое состояние (≤ 36; ≤ 25; ≤ 50) | Всего |
| Контрольная групп |