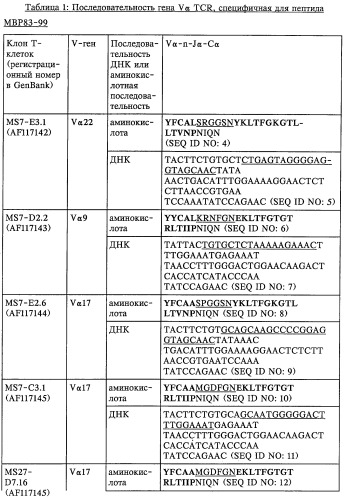
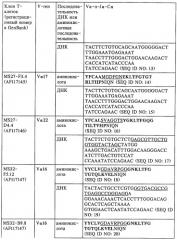
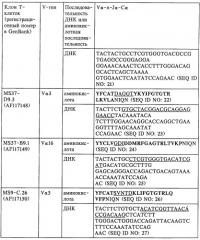
V-d-j олигонуклеотид т-клеточного рецептора, пара праймеров, олигонуклеотидный зонд, способ обнаружения клона mbp83-99v13.1 т-клеток, экспрессирующих мотив lgraglty т-клеточного рецептора, набор, способ лечения аутоиммунного заболевания и способ его мониторинга
Иллюстрации
Показать всеИзобретение относится к генной инженерии, конкретно к последовательности Т-клеточного рецептора, обнаруженного у страдающих расширенным склерозом пациентов, и может быть использовано в диагностических и лечебных целях. Получают олигонуклеотид, включающий последовательность, которая представляет собой или выведена из 5'-CTAGGGCGGGCGGGACTCACCTAC-3' или нуклеотидной последовательности, полностью комплементарной ей. Олигонуклеотид совместно с нуклеиновой кислотой, включающей примерно 15-30 нуклеотидов, которая не содержит последовательность олигонуклеотида и присутствует в области от Vβ до Jβ гена Vβ13.1 в Vβ13.1-подгруппе Т-клеток, причем последовательности олигонуклеотида и нуклеиновой кислоты не присутствуют на одной и той же цепи пары последовательностей гена Vβ13.1 применяют для амплификации части гена Vβ13.1. В способе обнаружения мотива LGRAGLTY, присутствующего в Т-клеточных рецепторах Vβ13.1-подгруппы Т-клеток, используют олигонуклеотид в сочетании с частицей для мечения. При обнаружении мотива LGRAGLTY осуществляют наблюдение за развитием и проводят лечение путем введения пептида, включающего мотив LGRAGLTY. Изобретение позволяет упрощенным методом обнаружить мотив LGRAGLTY в Т-клеточных рецепторах у пациента, страдающего рассеянным склерозом, и облегчить лечение пациента. 7 с. и 14 з.п. ф-лы, 7 ил., 3 табл.
Реферат
Предпосылки создания изобретения
Согласно гранту номер NS36140, полученному от Национальных институтов здоровья (National Institutes of Health) правительство Соединенных Штатов может иметь право на настоящее изобретение.
1. Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к области лечения аутоиммунного заболевания, такого как рассеянный склероз (MS). Более конкретно оно относится к последовательности Т-клеточного рецептора, обнаруженной у некоторых страдающих MS пациентов, и к способу ее обнаружения.
2. Описание известного уровня техники
У людей и других млекопитающих на поверхности Т-клеток обнаружены Т-клеточные рецепторы. Т-клеточные рецепторы содержат α- и β-цепи, причем β-цепи состоят из следующих областей (перечисленных от N-конца к С-концу): Vβ-Dβ-Jβ-Cβ. В естественных условиях Т-клеточные рецепторы имеют различные Vβ-Dβ-Jβ-области.
Когда антиген представляется Т-клеткам антигенпрезентирующими клетками (АРС), Т-клеточный рецептор с вариабельными областями (включая Vβ-Dβ-Jβ), который обладает способностью распознавать антиген, связывается с антигеном на АРС. После этого Т-клетка, несущая Т-клеточный рецептор, подвергается активации (клональная экспансия).
Патогенез целого ряда аутоиммунных болезней, по-видимому, связан с аутоиммунными Т-клеточными ответами на антигены, которые в норме присутствуют в организме. Примером такого заболевания является рассеянный склероз (MS), при котором обычно возникают Т-клеточные ответы на антигены миелина, в частности на основной протеин миелина (МВР). Установлено, что МВР-реактивные Т-клетки подвергаются активации in vivo, и это происходит при более высокой по сравнению с контролем частоте встречаемости предшественников в крови и спинномозговой жидкости у страдающих MS пациентов. Эти МВР-реактивные Т-клетки продуцируют Th1-цитокины, например IL-2, TNF и γ-интерферон. Эти Th1-цитокины облегчают миграцию воспалительных клеток в центральную нервную систему и обостряют разрушающие миелин воспалительные реакции при MS.
При лечении MS могут использоваться различные регуляторные механизмы. Одним из них является вакцинация с использованием одного или нескольких связанных с мембранами пептидов с внеклеточными доменами, которые снижают количество Т-клеток. Vandenbark в патенте US 5614192 предлагает лечение аутоиммунных болезней с помощью иммуногенных пептидов Т-клеточного рецептора, состоящих из 15-30 аминокислот, которые включают по крайней мере часть вторичного гипервариабельного участка (CDR2) Т-клеточного рецептора. В находящейся в процессе одновременного рассмотрения заявке на патент US на имя Zhang (60/099102) предложено лечение аутоиммунных болезней с помощью иммуногенных пептидов Т-клеточного рецептора в сочетании с иммуногенными маркерными пептидами Т-клеточной активации.
Одним из возможных путей повышения эффективности вакцинации с помощью пептидов Т-клеточного рецептора является выявление того, какие общие мотивы (если таковые вообще имеются) присутствуют в Т-клеточных рецепторах пациентов, страдающих аутоиммунным заболеванием, таким как MS. Если такие мотивы обнаружены, то пациент может быть вакцинирован пептидами, идентичными этим мотивам, с целью облегчения лечения.
Таким образом, существует потребность в выявлении аминокислотных последовательностей общих мотивов, присутствующих в Т-клеточных рецепторах пациентов, страдающих аутоиммунным заболеванием. Также важно иметь возможность простого обнаружения таких мотивов у пациента с помощью обычного метода, такого как ПЦР. Кроме того, желательно применять пептиды, идентичные выявленным мотивам, для лечения пациента, страдающего аутоиммунным заболеванием.
В настоящем изобретении описан такой общий мотив, обнаруженный в Т-клеточных рецепторах Vβ13.1-подгруппы Т-клеток, т.е. "LGRAGLTY-мотив", который имеет аминокислотную последовательность Lue Gly Arg Ala Gly Leu Thr Tyr (SEQ ID NO: 3), а также способ его простого обнаружения с помощью ПЦР. Этот мотив обнаружен в некоторых Т-клеточных рецепторах тех Т-клеток, которые распознают аминокислоты 83-99 МВР (далее обозначены как "МВР83-99"). Мотив в контексте указанной Vβ13.1-подгруппы Т-клеток может быть далее обозначен как "Vβ13.1-LGRAGLTY". Идентичные мотиву пептиды могут применяться для вакцинации пациентов с целью лечения или предупреждения аутоиммунных заболеваний, с которыми связан мотив Vβ13.1-LGRAGLT. Одним из таких аутоиммунных заболеваний является MS.
Краткое изложение сущности изобретения
Одним из вариантов осуществления настоящего изобретения является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или последовательности, комплементарной ей или выведенной из нее. Еще более предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей.
В ряде дополнительных вариантов осуществления олигонуклеотид может применяться для амплификации или обнаружения нуклеотидной последовательности, выявленной в Т-клеточном мотиве Vβ13.1-LGRA GLTY. В одной из подгрупп вариантов осуществления олигонуклеотид применяют в паре праймеров, причем пара праймеров состоит или выведена из:
(а) первого праймера, который представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или последовательности, комплементарной ей; и
(б) второго праймера, который представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который не включает последовательность, указанную в (а), и эта вторая праймерная последовательность может быть обнаружена в области, простирающейся от Vβ до Jβ гена Vβ13.1 (SEQ ID NО:2) в Т-клеточном рецепторе Т-клеток, причем последовательности, указанные в (а) и (б), не присутствуют на одной и той же цепи гена Т-клеточного рецептора.
Предпочтительно первый праймер представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей.
В другой подгруппе вариантов осуществления олигонуклеотид применяют в качестве олигонуклеотидного зонда, причем олигонуклеотидный зонд включает:
(а) олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или последовательности, комплементарной ей; и
(б) частица для мечения.
Предпочтительно олигонуклеотид состоит примерно из 15-30 нуклеотидов и включает 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей. Частицу для мечения предпочтительно выбирают из 32Р или дигоксингенина.
Согласно другому варианту осуществления настоящее изобретение относится к способу обнаружения клона МВР83-99 Vβ13.1-подгруппы Т-клеток, экспрессирующего мотив LGRAGLTY, который предусматривает:
(I) получение образца нуклеиновой кислоты из клона МВР83-99 Vβ13.1-подгруппы Т-клеток;
(II) приведение образца нуклеиновой кислоты в контакт с парой праймеров, которые выбраны или выведены из:
(а) первого праймера, который представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или последовательности, комплементарной ей или выведенной из нее; и
(б) второго праймера, который представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который не включает последовательность, указанную в (а), и присутствует в области, простирающейся от Vβ до Jβ Т-клеточного гена Vβ13.1 (SEQ ID NО:2),
причем последовательности, указанные в (а) и (б), не присутствуют на одной и той же цепи гена Vβ13.1; и
(III) выявление присутствия нуклеиновой кислоты, кодирующей мотив LGRAGLTY.
Предпочтительно первый праймер представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит
нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей.
Согласно еще одному варианту осуществления настоящее изобретение относится к способу лечения аутоиммунного заболевания, предусматривающему:
(а) выделение клона МВР83-99 Vβ13.1-подгруппы Т-клеток из организма человека;
(б) выявление присутствия нуклеиновой кислоты, кодирующей мотив LGRAGLTY, с помощью описанного выше способа; и если нуклеиновая кислота обнаружена, то
(в) введение человеку пептида Lue Gly Arg Ala Gly Leu Thr Tyr (SEQ ID NO: 3).
Согласно еще одному варианту осуществления настоящее изобретение относится к способу мониторинга аутоиммунного заболевания, предусматривающему:
(а) выделение клона МВР83-99 Vβ13.1-подгруппы Т-клеток из организма человека;
(б) выявление присутствия нуклеиновой кислоты, кодирующей мотив LGRAGLTY, с помощью описанного выше способа; и если нуклеиновая кислота обнаружена, то
(в) количественную оценку нуклеиновой кислоты.
Краткое описание чертежей
Приведенные ниже чертежи составляют часть настоящего описания и включены с целью дополнительного пояснения некоторых объектов настоящего изобретения. Изобретение станет более понятным при ссылке на один или несколько из указанных чертежей в сочетании с подробным описанием конкретных вариантов осуществления.
На фиг.1 представлена экспериментальная процедура клонирования и секвенирования ПЦР-продуктов, выделенных из мононуклеарных клеток периферической крови (РВМС). кДНК, полученные из образцов РВМС, подвергали амплификации с помощью праймера 5'Vβ13.1 и праймера 3'Jβ из 4 образцов РВМС, позитивных в отношении экспрессии мотива LGRAGLTY, и встраивали путем лигирования в ТА-клонирующий вектор pCR2.1 и трансформировали им Е.coli. Плазмидную ДНК подвергали скринингу с помощью ПЦР с использованием праймера М13 и LGRAGLTY-специфичного праймера. Позитивные плазмиды, для которых выявлена заметная ПЦР-амплификация, секвенировали в отношении наличия последовательностей VβDβJβ с помощью Vβ13.1-праймера.
На фиг.2 представлены схемы реактивности двух Т-клеточных клонов МВР83-99 в отношении пептидных аналогов с одной заменой аланина. Две пары Т-клеточных клонов МВР83-99, для которых характерны одинаковые реаранжировки гена Vβ13.1 (MS7-E2.6 и MS27-C3.1) и одинаковая последовательность Vα-Jα-стыка (MS7-E2.6 и MS27-C3.1), оценивали с точки зрения реактивности в отношении панели замещенных аланином пептидов в опытах по включению [3Н]-тимидина. В качестве источника антигенпрезентирующих клеток использовали линию фибробластов мыши, экспрессирующую DRB1*1501. Пролиферативные ответы клонов на каждый из пептидных аналогов оценивали через 72 ч и результат представлен в виде количества срм (импульсов/мин). Заключенные в прямоугольник (заштрихованные) данные соответствуют снижению пролиферации Т-клеточных клонов более чем на 50% в ответ на воздействие пептидных аналогов.
На фиг.3 представлены данные по перекрестной специфичности CDR3-олигонуклеотидов в отношении исходных и неродственных Т-клеточных клонов. Набор олигонуклеотидов, специфичных в отношении VDJ-области Т-клеточного рецептора (TCR), оценивали с точки зрения их специфичности в отношении обнаружения известных последовательностей ДНК-мишеней, присутствующих в исходных Т-клеточных клонах МВР83-99, а также неродственных Т-клеточных клонов МВР83-99, полученных из одного и того же или различных индивидуумов. Осуществляли ПЦР-реакции с использованием СDR3-специфических олигонуклеотидов в качестве праймеров, обеспечивающих синтез по ходу транскрипции (прямых праймеров), и 3'-Сβ-праймера в качестве праймера, обеспечивающего синтез против хода транскрипции (обратного праймера). Сплошными прямоугольниками обозначены положительные результаты определения последовательностей ДНК, присутствующих в исходных Т-клеточных клонах или в Т- клеточном (ых) клоне(ах), несущем(их) такие же CDR3-последовательности. Все праймеры также оценивали в отношении их способности связываться с ДНК-продуктами случайным образом отобранных Т-клеточных клонов, которые несли неродственные CDR3-последовательности (заштрихованные прямоугольники).
На фиг.4 показано выявление последовательности ДНК-мишени, комплементарной мотиву Vβ13.1-LGRAGLTY, в случайным образом выбранных образцах РВМС, взятых у пациентов, страдающих MS. кДНК, полученную из образцов РВМС, взятых у случайным образом выбранных пациентов, страдающих MS (n=48), сначала амплифицировали с помощью ПЦР с обратной транскриптазой (ОТ-ПЦР), используя 5'-Vβ13.1-специфический праймер и 3'-Сβ-праймер. Амплифицированные ПЦР-продукты затем подвергали гибридизации с меченным с помощью дигоксигенина олигонуклеотидным зондом, специфичным для мотива LGRAGLTY. Исходный клон МВР83-99 (MS7-E2.6) и неродственный Т-клеточный клон (MS32-B9.8) применяли в качестве положительного и отрицательного контролей соответственно. MS-7 и MS-27 представляли собой исходные образцы РВМС, из которых получали клон MS7-E2.6 (MS-7 в таблице 1) и клон MS27-C3.1 (MS-27 в таблице). Звездочками показана позитивная экспрессия DRB1*1501.
На фиг.5 показано выявление мотива Vβ13.1 -LGRAGLTY в случайным образом выбранных образцах РВМС, взятых у здоровых людей. Виды РВМС, взятые у 20 здоровых людей (NS), анализировали аналогично тому, как это представлено в описании к фиг.4. Исходный клон (MS7-E2.6) и неродственный Т-клеточный клон (MS32-B9.8) использовали в качестве положительного и отрицательного контролей соответственно. Звездочками показана позитивная экспрессия DRB1*1501.
На фиг.6 приведено полуколичественное сравнение экспрессии мотива LGRAGLTY в образцах РВМС, взятых у страдающих MS пациентов и у здоровых людей. Экспрессию мотива Vβ13.1-LGRAGLTY анализировали с помощью полуколичественной ПЦР по сравнению с экспрессией Сβ в каждой кДНК, полученной из РСМС страдающих MS пациентов и здоровых людей. Относительный уровень экспрессии рассчитывали из следующего уравнения: (экспрессия мотива LGRAGLTY/экспрессия of Cβ) × 100%.
На фиг.7 показано выявление мотива Vβ13.1-LGRAGLTY в короткоживущей Т-клеточной линии МВР83-99, полученной из пациентов, страдающих MS. Из крови 5 страдающих MS пациентов с помощью синтетического пептида 83-99 МВР получали панель независимых короткоживущих Т-клеточных линий МВР83-99. Для всех этих Т-клеточных линий подтверждали специфическую реактивность в отношении пептида МВР83-99 (количество импульсов в минуту (СРМ) в ответ на обработку в линии МВР83-99/количество импульсов в минуту в контроле > 5). Продукты кДНК амплифицировали с помощью ПЦР, используя 5'-Vβ13.1-специфичный праймер и 3'-Сβ-праймер ПЦР. Амплифицированные ПЦР-продукты затем гибридизовали с меченным с помощью дигоксигенина олигонуклеотидного зонда, соответствующего мотиву Vβ13.1-LGRAGLTY, с использованием метода Саузерн-блоттинга. кДНК-продукты, полученные из исходного клона МВР83-99 (MS7-E2.6) и неродственного Т-клеточного клона (MS32-B9.8), использовали в качестве положительного и отрицательного контролей соответственно.
Описание предпочтительных вариантов осуществления изобретения
С целью лучшего понимания изобретения ниже определены некоторые понятия.
"ПЦР" обозначает полимеразную цепную реакцию, например, как она в целом описана в патенте US No. 4683202 (выдан 28 июля 1987 г. на имя Mullins), который включен в настоящее описание в качестве ссылки. ПЦР представляет собой метод амплификации, согласно которому отобранные олигонуклеотиды или праймеры гибридизуют с нуклеиновыми кислотами-матрицами в присутствии полимеризующего агента (такого как полимераза) и четырех нуклеотидтрифосфатов, и из праймеров получают продукты удлинения. Затем эти продукты денатурируют и используют в качестве матриц в циклической реакции, при которой амплифицируется значительное количество копий применяемых нуклеиновых кислот, что облегчает их последующее обнаружение. Известны многочисленные методики ПЦР, и они могут применяться согласно способу по изобретению.
"Праймер" обозначает олигонуклеотид естественного происхождения или синтетический, который обладает способностью инициировать синтез ДНК, комплементарной определенной последовательности ДНК на молекуле-матрице.
"Полученный из/выведенный из" в контексте понятия "праймер(ы) или зонд(ы), полученный(ые) или выведенный(ые) из" обозначает, что праймер или зонд не ограничен указанной(ыми) нуклеотидной последовательностью(ями), но также включает(ют) вариации указанной(ых) нуклеотидной(ых) последовательности(ей), включая нуклеотидные добавления, делеции или замены в той степени, чтобы вариации указанной(ых) последовательности(ей) сохранили способность действовать в качестве праймера при обнаружении ДНК Т-клеточного рецептора, которая кодирует последовательность Vβ13.1-LGRAGLTY, т.е. Lue Gly Arg Ala Gly Leu Thr Tyr (SEQ ID NО:3).
"Иммуногенный", если это понятие применяется для описания пептида, обозначает, что пептид обладает способностью индуцировать иммунный ответ, опосредуемый либо Т-клеткой, либо антителом, либо обоими факторами. "Антигенный" обозначает, что пептид может распознаваться в свободной форме антителами и молекулами МНС в случае антигенспецифичных Т-клеток.
"Связанное с иммунной системой заболевание" обозначает заболевание, при котором в патогенез болезни вовлечена иммунная система. Подгруппой связанных с иммунной системой заболеваний являются аутоиммунные заболевания. Аутоиммунные заболевания в контексте настоящего описания включают (но не ограничиваясь ими) ревматоидный артрит, миастению тяжелую паралитическую, рассеянный склероз, системную красную волчанку, аутоиммунный тиреоидит (тиреоидит Хашимото), болезнь Грейвса, воспалительное заболевание кишечника, аутоиммунный увеоритинит, полимиозит и определенные типы диабета. На основе настоящего описания специалист в данной области может легко определить другие аутоиммуные заболевания, которые могут лечиться в помощью композиции и способов по настоящему изобретению. "Опосредуемая Т-клетками болезнь" обозначает болезнь, возникающую в организме в результате распознавания Т-клетками пептидов, присутствующих в норме в организме.
Понятие "лечить" или "лечение" относится к защите животного от болезни, что включает предупреждение, торможение (супрессию) или подавление заболевания. Предупреждение болезни включает введение композиции по настоящему изобретению животному до возникновения болезни. Торможение болезни включает введение композиции по настоящему изобретению животному после возникновения болезни, но до появления ее клинических симптомов. Подавление болезни включает введение композиции по настоящему изобретению животному после возникновения клинических симптомов болезни. Хорошо известно, что в медицине не всегда понятно, когда в процессе возникновения болезни должна вводиться композиция по настоящему изобретению.
Одним из объектов изобретения является пара праймеров, включающих последовательность, полученную из:
(а) первого праймера, который представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или нуклеотидной последовательности, комплементарной ей; и
(б) второго праймера, представляющий собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который не включает последовательность, указанную в (а), и который присутствует в области от Vβ до Jβ гена Т-клеточного рецептора в Vβ13.1-подгруппе Т-клеток, причем последовательности, указанные в (а) и (б), не присутствуют на одной и той же цепи гена Т-клеточного рецептора.
Предпочтительно первый праймер представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий из 15-30 нуклеотидов, который включает нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей.
Праймеры по изобретению создают для амплификации фрагмента гена, кодирующего Т-клеточный рецептор из человеческих Т-клеток подгруппы Vβ13.1, причем фрагмент включает аминокислотный мотив Lue Gly Arg Ala Gly Leu Thr Tyr (SEQ ID NО:3). Ген из Vβ13.1-подгруппы Т-клеток, кодирующий Т-клеточный рецептор, который содержит мотив LGRAGLTY, был помещен в банк генов под регистрационным номером AF117132. Последовательность гена Vβ13.1-подгруппы Т-клеток, который кодирует Т-клеточный рецептор, включающий мотив LGRAGLTY, представлена в настоящем описании в виде SEQ ID NО:2. Согласно способу по изобретению фрагмент длиной примерно 400 пар оснований гена Т-клеточного рецептора из Vβ13.1-подгруппы Т-клеток амплифицируют с помощью двух праймеров, причем первый праймер расположен в CDR3-области, а второй праймер расположен в Сβ-области. Vβ-Dβ-Jβ-область гена Т-клеточного рецептора должна находиться между CDR3- и Сβ-областями включительно. Согласно предпочтительному варианту осуществления праймеры представляют собой описанную выше пару праймеров.
Праймеры по изобретению также включают олигонуклеотиды, полученные из праймеров (а) - (б). Последовательность считают выведенной из праймера (а) или (б), если она представляет собой или содержит практически такую же последовательность, что и последовательность одного из праймеров, и сохраняет способность к избирательному отжигу примерно до той же CDR3- или Сβ-области Vβ-Dβ-Jβ-области гена Т-клеточного рецептора из Vβ13.1-подгруппы Т-клеток, как описано выше. Более конкретно, праймер может отличаться от праймера (а) или (б) по длине или по типу нуклеиновой кислоты в одном или в нескольких положениях в последовательности, если он при этом сохраняет избирательность по отношению к выявленным участкам Vβ-Dβ-Jβ-области гена Т-клеточного рецептора Vβ13.1-подгруппы Т-клеток. Например, праймер может представлять собой олигонуклеотид, состоящий по меньшей мере из 15 нуклеотидов, причем эти 15 нуклеотидов идентичны набору из 15 последовательных нуклеиновых кислот, отобранных или выведенных из последовательности праймеров (а)-(б). Праймер также может представлять собой любой олигонуклеотид, состоящий примерно из 30 нуклеотидов или менее, который включает сегмент, имеющий последовательность, отобранную или выведенную из любого из праймеров (а)-(б). Число нуклеотидов в праймере должно быть достаточно большим для сохранения избирательности и достаточно малым для сохранения эффективности или функциональной способности при синтезе с использованием праймеров и в способе на основе ПЦР. Праймер может иметь вариации, включая нуклеотидные делеции, добавления или замены в той степени, чтобы вариации последовательности праймеров (а)-(б) сохранили способность действовать в качестве праймера в процессе обнаружения Vβ13.1-LGRAGLTY.
Способ обнаружения Vβ13.1-LGRAGLTY по изобретению основан на использовании пары описанных выше праймеров в процессе выявления присутствия любого мотива Vβ13.1-LGRAGLTY в образце. Образец, подлежащий тестированию в отношении присутствия Vβ13.1-LGRAGLTY, представляет собой нуклеиновую кислоту, предпочтительно ДНК. ДНК может представлять собой геномную ДНК, кДНК, ДНК, предварительно амплифицированную с помощью ПЦР, или любую другую форму ДНК. Образец может быть выделен, прямо или косвенно, из любой ткани организма животного или человека, которая экспрессирует гены β-цепи Т-клеточного рецептора. Предпочтительной тканью организма являются мононуклеарные клетки периферической крови (РВМС). Если образец представляет собой геномную ДНК, то она может быть выделена непосредственно из ткани организма. Если образец представляет собой кДНК, то она может быть выделена косвенным путем с помощью обратной транскрипции мРНК, непосредственно выделенной из ткани организма. Если образец представляет собой ДНК, предварительно амплифицированную с помощью ПЦР, то она может быть выделена косвенно путем амплификации геномной ДНК, кДНК или любой другой формы ДНК.
Согласно предпочтительному варианту осуществления часть гена Т-клеточного рецептора из Vβ13.1-подгруппы Т-клеток, т.е. часть, содержащую последовательность, которая кодирует мотив LGRAGLTY, амплифицируют с целью повышения возможности выявления присутствия Vβ13.1-LGRAGLTY (5'-CTAGGGCGGGCGGGACTCACCTAC-3' (SEQ ID NO:1). Амплификация может быть осуществлена с помощью ПЦР с использованием любой конкретной методики ПЦР или оборудования, которое обеспечивает чувствительную, избирательную и быструю амплификацию части образца.
Например, ПЦР-амплификация может быть осуществлена согласно процессу, при котором готовят реакционную смесь, содержащую следующие ингредиенты: 5 мкл 10 × ПЦР-буфера II (100 мМ Трис-HCl, рН 8,3, 500 мМ КСl), 3 мкл 25 мМ MgCl2, 1 мкл 10 мМ смеси дНТФ, 0,3 мкл полимеразы Taq (5 ед./мкл) (типа AmpliTaq Gold, фирма Perkin Elmer, Норвалк, штат Коннектикут), 30 пмолей праймера А и 30 пмолей праймера Б. В свете настоящего описания специалист в данной области может выбрать приемлемые праймеры А и Б для ПЦР-амплификации части гена Т-клеточного рецептора из Vβ13.1-подгруппы Т-клеток. Описанная выше смесь может применяться для амплификации 1 мкл образца ДНК. Далее в контексте настоящего описания подлежащая амплификации ДНК может быть обозначена как "матрица".
После добавления образца ДНК в вышеописанную реакционную смесь ПЦР может быть осуществлена со следующим профилем амплификации: 1 мин при 95°С (денатурация); 20 с при 56°С (отжиг или ренатурация) и 40 с при 72°С (удлинение), всего с использованием 35 циклов.
При осуществлении ПЦР матрица может быть подвергнута тепловой денатурации и отжигу до двух олигонуклеотидных праймеров. Олигонуклеотиды ограничивают область нуклеотидной последовательности, подлежащей амплификации. В реакционную смесь включают теплостойкую ДНК-полимеразу. Полимераза удлиняет праймеры, ренатурированные до комплементарной ДНК, путем добавления соответствующих комплементарных нуклеотидов. Предпочтительные полимеразы имеют следующие характеристики: они должны сохранять стабильность при температурах, составляющих по меньшей мере 95°С, иметь процессивность (количество повторяющихся актов катализа) 50-60 и обладать скоростью удлинения, превышающей 50 нуклеотидов в минуту.
В обычной реакции ПЦР-амплификации применяют примерно 40 ПЦР-циклов. Однако некоторые ПЦР-реакции могут осуществляться при использовании всего лишь 15-20 циклов или при использовании большого количества циклов, вплоть до 50. Каждый цикл включает стадию плавления, при которой матрицу нагревают до температуры выше примерно 95°С.
Затем температуру ПЦР понижают, что позволяет осуществить отжиг праймеров до матрицы. На этой стадии отжига температуру реакции поддерживают на уровне примерно от 55°С до 72°С в течение приблизительно 20 с. В зависимости от специфичности реакции этот промежуток может быть удлинен или укорочен.
Затем температуру ПЦР повышают, что позволяет осуществить максимальное удлинение праймеров с помощью полимеразы. На стадии удлинения температуру реакции поддерживают на уровне примерно от 70°С до 75°С в течение приблизительно 40 с. В зависимости от специфичности реакции могут использоваться более высокие или низкие температуры и/или этот промежуток может быть удлинен или укорочен.
Кроме того, перед началом первого цикла реакционная смесь может быть подвергнута начальной денатурации в течение примерно от 5 мин до 15 мин. Аналогично этому, после завершения конечного цикла реакционная смесь может быть подвергнута конечному удлинению в течение примерно 5 мин-10 мин.
Амплификация может быть осуществлена с помощью двухстадийной ПЦР. При использовании этой методики первую реакцию ПЦР-амплификации осуществляют для того, чтобы амплифицировать первую область, которая включает представляющую интерес область и длиннее ее. Затем проводят вторую реакцию ПЦР-амплификации, используя первую область в качестве матрицы для того, чтобы амплифицировать представляющую интерес область. Если какой-либо из праймеров, применяемых в первой ПЦР, может использоваться во второй ПЦР, то вторую ПЦР называют "полузамкнутой". Если ни один из праймеров, применяемых в первой ПЦР, не может использоваться во второй ПЦР, то вторую ПЦР называют "замкнутой".
Согласно предпочтительному варианту осуществления способа по настоящему изобретению мотив Vβ13.1-LGRAGLTY амплифицируют с помощью двухступенчатой ПЦР. В первой ПЦР образец амплифицируют, используя первый праймер, который ренатурируют до Vβ-области гена Т-клеточного рецептора, и второй праймер, который ренатурируют до Сβ-области гена Т-клеточного рецептора, используя описанные выше реакционную смесь и профиль реакции. Первая ПЦР позволяет амплифицировать первую область длиной примерно 600 пар оснований и осуществить удлинение от Vβ через стык Vβ-Dβ-Jβ до Сβ. Вторая ПЦР является "замкнутой" или "полузамкнутой"; часть первой области амплифицируется с помощью пары праймеров (а)-(б). Вторая ПЦР позволяет амплифицировать представляющую интерес область.
После амплификации в продукте амплификации выявляют любую ДНК, кодирующую Vβ13.1-LGRAGLTY в образце. Это обнаружение может быть осуществлено с помощью разнообразных методов. Например, аликовота продукта амплификации может быть внесена в гель для электрофореза, к которому подключают электрическое поле для разделения молекул ДНК по размеру. Согласно другому методу аликвоту продукта амплификации вносят в гель, окрашенный SYBR зеленым, бромидом этидия или другим веществом, которое может связываться с молекулой ДНК и испускать сигнал, который может быть обнаружен. Например, бромид этидия связывается с ДНК и испускает видимый свет при облучении ультрафиолетовым светом. В другом варианте высушенный гель может содержать радио- или химически меченный олигонуклеотид (который далее в контексте настоящего описания может быть обозначен как "олигонуклеотидный зонд"), комплементарный части последовательности амплифицированной матрицы, с помощью которого при экспозиции геля на пленку получают авторадиограмму.
Согласно следующему варианту осуществления настоящее изобретение относится к олигонуклеотидному зонду, включающему
(а) олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или нуклеотидной последовательности, комплементарной ей; и
(б) частица для мечения.
Предпочтительно олигонуклеотид "(а)" состоит примерно из 15-30 нуклеотидов и включает 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который содержит нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей.
Предпочтительно частиц для мечения предпочтительно выбирают из 32P или дигоксингенина.
Типичный радиоактивномеченный олигонуклеотид, который может применяться для обнаружения продуктов амплификации, полученный с помощью праймеров по настоящему изобретению, получают из Vβ-Dβ-Jβ-области. Если Vβ13.1-LGRA GLTY-область амллифицируют с использованием описанной выше двухстадийной "полузамкнутой" ПЦР, в которой применяют праймер, соответствующей последовательности, кодирующей мотив LGRAGLTY, то может использоваться любой олигонуклеотид, состоящий примерно из 10 или большего количества нуклеотидов, и предпочтительно из примерно 18 или большего количества нуклеотидов, комплементарный части любой цепи амплифицированной Vβ13.1-LGRAGLTY- области. Более предпочтительно в качестве зонда может применяться олигонуклеотид 5'-CTAGGGCGGGCGGGACTCACCTAC-3' (SEQ ID NO:1) или комплементарнная ему нуклеотидная последовательность.
Настоящее изобретение также включает набор для тестирования, в который входит первый праймер (а), состоящий примерно из 15-30 нуклеотидов, который включает по меньшей мере 10 последовательных нуклеотидов SEQ ID NО:1 или нуклеотидной последовательности, комплементарной ей.
Согласно одному из предпочтительных вариантов осуществления набор для тестирования также включает второй праймер (б), где второй праймер представляет собой нуклеотидную последовательность, состоящую примерно из 15-30 нуклеотидов, которая не включает последовательность (а) и которая присутствует в области от Vβ до Jβ гена Vβ13.1 Т-клеточного рецептора в Т-клетках, причем последовательности (а) и (б) не присутствуют на одной и той же цепи гена Т-клеточного рецептора.
Более предпочтительно первый праймер представляет собой олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22 или 23 последовательных нуклеотида SEQ ID NО:1 или последовательности, комплементарной ей. Наиболее предпочтительным является олигонуклеотид, состоящий примерно из 15-30 нуклеотидов, который включает нуклеотидную последовательность SEQ ID NО:1 или последовательность, комплементарную ей.
В этом варианте осуществления набор для тестирования дополнительно включает по меньшей мере один реагент, пригодный для амплификации ДНК мотива Vβ13.1-LGRA GLTY с помощью методов ПЦР, как описано выше.
Примерами реагентов, которые могут быть включены в набор, являются (но не ограничиваясь ими) буферы, дезоксинуклеозидтрифосфаты, термостабильная ДНК-полимераза, такая как полимераза Taq, ДНК Vβ13.1-LGRAGLTY в качестве положительного контроля и ДНК, не относящиеся к Vβ13:1-LGRAGLTY, в качестве отрицательно контроля. Другие реагенты, которые также могут быть включены в набор для тестирования, известны специалистам в данной области.
Согласно другому предпочтительному варианту осуществления набор для тестирования дополнительно включает частицу для мечения. Предпочтительно частица для мечения представляет собой 32Р или дигоксингенин.
Настоящее изобретение также относится к способу лечения аутоиммунного заболевания. Это заболевание представляет собой одно из заболеваний, при котором по меньшей мере у некоторых пациентов в Vβ13.1-подгруппе Т-клеток обнаружены включающие мотив LGRAGLTY Т-клеточные рецепторы. У пациентов могут присутствовать другие типы Т-клеток и/или Vβ13.1-подгруппы Т-клеток, у которых отсутствуют Т-клеточные рецепторы, включающие мотив LGRAGLTY.
Способ лечения аутоиммунного заболевания предусматривает:
(а) получение клона МВР83-99 Vβ13.1-подгруппы Т-клеток из организма человека;
(б) выявление присутствия в Т-клетках нуклеиновой кислоты, кодирующей мотив LGRAGLTY, с помощью описанного выше способа; и если нуклеиновая кислота обнаружена,
(в) введение пептида Lue Gly Arg Ala Gly Leu Thr Tyr (SEQ ID NO: 3) человеку.
Аутоиммунное заболевание может представлять собой любое аутоиммунное заболевание, при котором Т-клеточные рецепторы, несущие мотив LGRAGLTY, обнаружены на Т-клетках подгруппы Vβ13.1. Аутоиммунные заболевания, подпадающие под объем настоящего изобретения, включают (но не ограничиваясь ими) ревматоидный артрит, миастению тяжелую паралитическую, рассеянный склероз, системную красную волчанку, аутоиммунный тиреоидит (тиреоидит Хашимото), болезнь Грейвса, воспалительное заболевание кишечника, аутоиммунный увеоритинит, полимиозит и определенные типы диабета. Предпочтительным аутоиммунным заболеванием является рассеянный склероз (MS).
Если нуклеиновая, кислота, к