Рекомбинантная термостабильная люцифераза, способ ее получения, изолированная нуклеиновая кислота, экспрессирующий вектор, набор для использования в биолюминесцентном анализе, аналитический тест для определения присутствия в образце соа
Иллюстрации
Показать всеИзобретение относится к области генной и белковой инженерии и может быть использовано в биолюминесцентных анализах различного назначения. Получены новые мутантные формы люциферазы, характеризующиеся повышенной по сравнению с соответствующими ферментами дикого типа термостабильностью и в ряде случаев изменением длины волны испускаемого света. Все предложенные мутеины отличаются тем, что природный аминокислотный остаток в положении, соответствующем положению 357 в последовательности люциферазы Photinus pyralis, заменен другим, предпочтительно остатком незаряженной полярной аминокислоты, в частности тирозина. Приобретаемые мутантными люциферазами по изобретению новые свойства позволяют эффективно использовать их в качестве репортерного агента в различных аналитических системах. 6 с. и 17 з.п. ф-лы, 15 ил., 6 табл.
Реферат
Настоящее изобретение относится к новому белку, в частности мутантным ферментам люциферазам, которые проявляют отличительные свойства по сравнению с соответствующим ферментом дикого типа, к ДНК, кодирующей данные белки, к применению данного фермента в аналитических тестах и к наборам, включающим их.
Люцифераза светляков катализирует окисление люциферина в присутствии АТФ, Мg2+ и молекулярного кислорода с испусканием света. Данная реакция имеет квантовый выход примерно 0,88. Свойство испускания света привело к ее применению в самых разнообразных люминометрических аналитических тестах, в которых определяют уровни АТФ. Примеры таких тестов включают таковые, которые основаны на описанных в ЕР-В-680515 и WO 96/02665, и многие другие, которые обычно используют в лабораториях.
Люциферазу получают непосредственно из насекомых, в частности жуков, таких как светляки или личинки светляков. Определенные виды, из которых получали люциферазы, включают японских светляков GENJI или KEIKE, Luciola cruciata и Luciola lateralis, восточно-европейского светляка Luciola mingrelica, северо-американского светляка Photinus pyralis и личинок светляка Lampyrus noctiluca.
Однако поскольку многие из генов, кодирующих данные ферменты, были клонированы и секвенированы, их можно также получить с использованием технологии рекомбинантных ДНК. Последовательности рекомбинантной ДНК, кодирующие ферменты, используют для трансформации микроорганизмов, таких как Е.coli, которые затем экспрессируют желаемый ферментный продукт.
Цвет испускаемого данными ферментами света при использовании в тестах в лаборатории совершенно одинаковый. Было бы полезно, если бы длина волны менялась, либо для того, чтобы легче улавливать специфическим детектором, либо для применения в системах, где требуются многочисленные репортеры, например для мониторинга различных событий, происходящих в одном и том же образце. Одним аспектом отличительных репортерных молекул является применение молекул люциферазы, которые испускают свет при различных длинах волн. Это можно достичь с использованием репортерных молекул, включающих люциферазы, полученные из различных видов светляков или личинок светляков. Однако альтернативной стратегией является получение мутантных люцифераз с использованием технологии рекомбинантных ДНК для того, чтобы получить различие в длине волны сигнала. Примеры таких мутантов предоставлены в WO 95/18853.
Кроме того, стабильность при нагревании люцифераз дикого и рекомбинантного типа такова, что они очень быстро теряют активность при воздействии температуры выше примерно 30°С, особенно выше 35°С. Данная нестабильность вызывает проблемы, когда фермент используется или хранится при высокой окружающей температуре, или если анализ проводится в условиях реакции при высокой температуре, например, для того, чтобы повысить скорость реакции.
Известны из ЕР-А-524448 и WO/95/25798 мутантные люциферазы, обладающие повышенной термостабильностью. В первой из них описывается мутантная люцифераза, имеющая мутацию в положении 217 люциферазы японского светляка, в частности, заменой остатка треонина на остаток изолейцина. В последней описываются мутантные люциферазы, обладающие 60% гомологией по отношению к люциферазе из Photinus pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, но в которых аминокислотный остаток, соответствующий остатку 354 Photinus pyralis или 356 вида Luciola, мутирован таким образом, что он является отличным от глутамата и, в частности, отличным от глутамата, аспартата, пролина или глицина.
В совместно рассматриваемой заявке на выдачу патента Великобритании №9823468.5 и на ее основе международной патентной заявки дополнительно описаны такие мутанты. В данном случае описаны белки, которые обладают люциферазной активностью и по меньшей мере 60% гомологией по отношению к люциферазе дикого типа, такой как фермент из Photinus pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, но которые включают мутации в различных положениях в белке, в том числе среди прочего:
(a) аминокислотный остаток, соответствующий остатку 214 в люциферазе Photinus pyralis и остатку 216 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis; или
(b) аминокислотный остаток, соответствующий остатку 232 в люциферазе Photinus pyralis и остатку 234 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis; или
(с) аминокислотный остаток, соответствующий остатку 295 люциферазы Photinus pyralis и остатку 297 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis.
Заявители установили, что с использованием мутирования (или введения) аминокислоты в различное положение в белке люциферазы можно достичь существенных сдвигов в длине волны испускаемого света и/или повышенной термостабильности фермента. Кроме того, может быть усилен протонный поток испускаемого света, делая фермент более подходящим для анализов in vivo, где устраняется свойственная личинке светляка кинетика фермента, или анализов in vitro, где отсутствуют СоА или другие вещества, “индуцирующие свойственную личинке светляка кинетику фермента”.
Настоящее изобретение относится к рекомбинантному белку, обладающему люциферазной активностью и по меньшей мере 60% гомологии по отношению к люциферазе дикого типа, где в последовательности фермента аминокислотный остаток, соответствующий остатку 357 в люциферазе Photinus pyralis, мутирован по сравнению с соответствующей люциферазой дикого типа так, что люцифераза способна испускать свет при другой длине волны по сравнению с соответствующей люциферазой дикого типа и/или обладает повышенной термостабильностью по сравнению с соответствующей люциферазой дикого типа.
Последовательности люциферазы дикого типа, которые могут составить основу рекомбинантных форм по изобретению, включают Photuris pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, Hotaria parvula, Pyrophorus plagiophthalamus, Lampyris noctiluca, Pyrocoelia miyako, Photuris pennsylvanica или Phrixothrix (“железнодорожные” светляки - смотри Biochem. 38 (1999) 8271-8279).
Биолюминесцентные ферменты из видов, которые могут использовать субстрат D-люциферин (4,5-дигидро-2-[6-гидрокси-2-бензо-тиазолил]-4-тиазолкарбоновая кислоту), для испускания света, могут составить основу мутантных ферментов по изобретению.
Определенные последовательности люцифераз дикого типа, которые могут составить основу рекомбинантных форм по изобретению, включают Photuris pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, Hotaria parvula, Pyrophorus plagiophthalamus, Lampyris noctiluca, Pyrocoelia miyako и Photuris pennsylvanica.
В частности, люциферазы являются ферментами, получаемыми из фермента Photuris pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis. В ферментах Luciola mingrelica, Luciola cruciata или Luciola lateralis соответствующий аминокислотный остаток находится в положении 359 в последовательности.
Показано, что последовательности всех различных люцифераз являются высоко консервативными, обладающими высокой степенью гомологии между ними. Это означает, что соответствующие области последовательностей ферментов легко определяются при исследовании последовательностей для установления наиболее сходных областей, хотя, если необходимо, можно использовать коммерчески доступное программное обеспечение (например, “Bestfit” от Генетической компьютерной группы Университета шт. Висконсин; смотри Devereux et al. (1984) Nucleic Acid Research 12: 387-395) для того, чтобы определить соответствующие области или определенные аминокислоты в различных последовательностях. Альтернативно или дополнительно можно определить соответствующие аминокислоты со ссылкой на L.Ye et al., Biochim. Biophys Acta 1339 (1997) 39-52, где приведены последовательности ферментов с нумерацией, которая также используется и в настоящей заявке.
В отношении возможной замены аминокислотного остатка, соответствующего остатку 357 в люциферазе Photuris pyralis, то большинство последовательностей дикого типа имеют кислый остаток (аспарагиновую кислоту или глутаминовую кислоту) в данном положении. Исключением являются некоторые формы люциферазы Photuris pennsylvanica, в которых соответствующий остаток (356) является неполярным остатком, валином, или некоторые формы люциферазы Phrixothrix, где соответствующее положение является V354 в PvGR или в PhRE, где это лейцин L354. Таким образом, в целом аминокислота, использованная в качестве заменяющей аминокислоты в данном положении, является другой, чем аспарагиновая кислота, глутаминовая кислота, валин или лейцин.
Следовательно, в большинстве случаев остаток кислой аминокислоты заменяется на некислый остаток, включая основные аминокислоты, такие как лизин или аргинин, неполярные аминокислоты, такие как лейцин, валин или изолейцин, незаряженные полярные аминокислоты, такие как тирозин, аспарагин, глутамин, фенилаланин, серин, триптофан или треонин. В частности, его можно заменить незаряженной полярной аминокислотой, такой как тирозин, аспарагин, серин или треонин. Особенно предпочтительными аминокислотными остатками для замены в данном положении являются тирозин, фенилаланин или триптофан и наиболее предпочтительно тирозин. Говоря в общем, ароматические остатки в данном положении приводят к наибольшим сдвигам и также могут способствовать возникновению термостабильности.
Там, где последовательности дикого типа включают некислые аминокислотные остатки в данном положении, их соответствующим образом мутируют в другие некислые остатки.
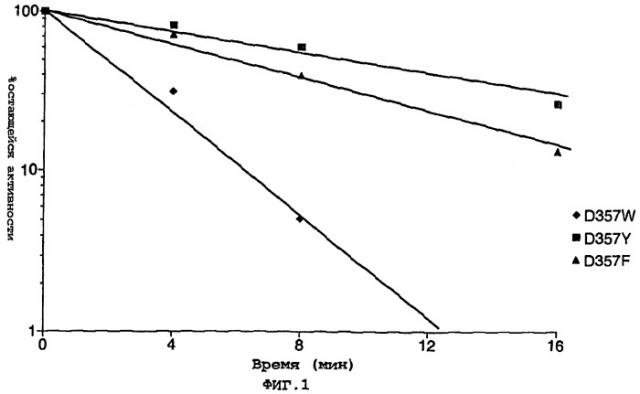
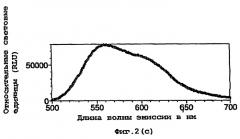
Было установлено, что при мутировании фермента таким образом, сдвигается длина волны испускаемого люциферазой света, в некоторых случаях до 50 нм к красной области спектра. Так, мутантная люцифераза Photinus pyralis D357Y испускает свет при длине волны около 612 нм по сравнению с ферментом дикого типа, который испускает свет при длине волны 562 нм.
Сдвиг длины волны на 50 нм представляет существенную потенциальную возможность для применения в анализах, поскольку сдвиг такой величины может быть легко определен спектрально. Различные окрашенные люциферазы можно использовать в качестве репортерных молекул в исследованиях по экспрессии генов, делая возможным прослеживать более чем за одним геном, например, как описано в WO 95/18853. Множественное аналитическое исследование можно также проводить с использованием люциферазы в качестве меток.
Тот факт, что свет в данном случае окрашен в интенсивный красный цвет, особенно полезен в аналитической методологии. Красный мутант может быть полезен при анализе раствора на АТФ, который содержит пигменты или другие соединения, которые могут абсорбировать более короткие длины волн света. Например, окрашенный в красный цвет раствор не будет абсорбировать красный свет. Примеры окрашенных в красный цвет растворов, которые часто являются объектом такого анализа, включают образцы крови или раствор культуральной среды с эукариотическими клетками, который может содержать окрашенный в красный цвет индикатор рН.
При использовании смеси колориметрических агентов, таких как люциферазы, может быть полезной способность образовывать интенсивный красный сигнал, особенно, где другой агент в образце образует зеленый сигнал. Фотоумножитель, используемый в спектральном анализе с фотокатодом, можно установить для детектирования либо одного, либо обоих пиков, образующихся в одной образце. Другими словами, возможно различать фотонный поток от красного или зеленого эмиттера в одном и том же образце.
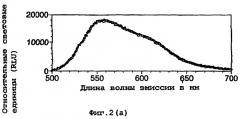
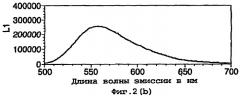
Кроме того, было установлено, что на сдвиг длины волны может оказывать влияние присутствие кофактора кофермента А(СоА). В результате данного свойства возникает возможность того, что данный фермент можно использовать в тесте на кофактор.
Как описано ниже, было исследовано влияние кофактора кофермента А на спектр испускаемого света в условиях in vitro. По мере увеличения концентрации кофермента А изменяется спектральное распределение, и при наиболее высоких концентрациях СоА в спектре преобладают длины волн в области 590-630 нм с выраженным пиком при 610 нм.
Таким образом, в соответствии с дополнительным аспектом изобретения обеспечивается аналитический тест для определения присутствия в образце СоА, где данный тест включает добавление к образцу, в котором, как полагается, находится СоА, люциферазы, как описано выше, вместе с другими реагентами, которые необходимы для проведения реакции люцифераза/люциферин, определение длины волны испускаемого пробой света и соотнесение этого с присутствием или отсутствием СоА.
Такой аналитический тест может быть полезен при определении состояния роста или активности клеток, например микроорганизмов или эукариотических клеток.
Например, концентрация СоА в клетках Е. coli является относительно высокой и в значительной мере варьирует в зависимости от метаболического статуса. Мутантные ферменты по изобретению можно использовать для мониторинга метаболического статуса организма, в частности концентрации СоА in vivo, поскольку длина волны испускания варьирует в зависимости от концентрации СоА. Такие аналитические тесты могут быть особенно полезными в ситуациях, где СоА является важным первичным метаболитом при продукции антибиотиков (например, у стрептомицетов).
Концентрации СоА в клетках также являются важным индикатором биосинтеза жирных кислот и варьируют в зависимости от потребности клетки в том или ином компоненте. При ряде метаболических нарушений, таких как карциногенез и сахарный диабет, имеют место нарушения метаболитов жирных кислот и, соответственно, необычные уровни СоА. Тесты по изобретению можно использовать при диагностике таких состояний. Например, можно определить концентрации СоА в клеточном образце, таком как образец крови, от пациента, при определении длины волны света, испускаемого люциферазой по изобретению, использованной в тесте. Данный результат можно сравнить с таковым, полученным с пробой здоровых клеток, для определения того, изменяется ли длина волны, и таким образом, что СоА присутствует в измененной концентрации. Это может указывать на наличие болезненного состояния у пациента. Клетки перед анализом соответствующим образом лизируют с использованием известного литического агента.
Полагается, что аминокислотный остаток в положении 357 критически связан с сайтом связывания кофермента А. Когда поверхность фермента люциферазы была смоделирована (с использованием программного обеспечения для моделирования белков SYBL, Tripos Ltd.) до разрешения 1 ангстрем (Å), было отмечено наличие полярного “кармана”. Оказалось, что данный “карман” образован остатками Н310, Е354 и D357 и составляет 8-10 Å. При обзоре молекулы сверху данный “карман” является частью более крупного “кармана”, образованного остатками Н310, Е354, D357 и 1232. Оказалось, что остатки Н310 и Е354 образуют мостик через углубление, что создает вид двух меньших “карманов” (смотри фигуру 8).
Не ограничиваясь конкретной теорией, представляется возможным, что мостиковые остатки могут быть достаточно гибкими, чтобы высвобождаться, когда фермент находится в растворе для обеспечения более крупного кармана (≈12 Å глубиной и ≈8 Å шириной), который позволяет связывать СоА. Это совпадает с энергетическими расчетами.
Когда клетки Е. coli, экспрессирующие мутанты Photuris-люциферин-4-монооксигеназы по изобретению, росли при смене различных источников углерода, определяли спектр испускаемого света в условиях in vivo. Переключение от богатой среды (LB) до определенной минимальной среды с ацетатом или глюкозой в качестве единственного источника углерода приводило к сдвигу к более длинным длинам волн испускаемого света и снижению вклада более коротких длин волн. Это может обеспечить еще дополнительно средство контролирования длины волны испускаемого света для аналитических целей.
Было установлено, что мутация положения 357 в белке приводит к повышенной термостабильности.
Белки могут включать дополнительные мутации в последовательности, при условии, что люциферазная активность белка в значительной мере не нарушается. Мутации стабильно усиливают свойства фермента или определенным образом лучше приспосабливают его для предназначенной цели. Это может означать, что они приводят к повышенной термостабильности и/или сдвигам цветовых свойств и/или Km для АТФ ферментов. Примеры мутаций, которые приводят к цветовым сдвигам описаны в WO 95/18853. Мутации, которые влияют на значения Km, описаны, например, в WO 96/22376 и заявке на международный патент № PCT/GB 98/01026.
В основном было установлено, что воздействие мутаций является аддитивным в плане изменений в свойствах.
Мутантные люциферазы по изобретению могут включать другие специфические мутации, которые повышают термостабильность по сравнению с люциферазой дикого типа, например мутации, описанные в WO 00/24878. В частности, по меньшей мере один:
(a) аминокислотный остаток, соответствующий аминокислоте 354 люциферазы Photuris pyralis (356 в люциферазе Luciola) мутирован;
(b) аминокислотный остаток, соответствующий положению 215 в люциферазе Photuris pyralis или (217 в люциферазе Luciola), является другой гидрофобной аминокислотой; или
(c) аминокислотный остаток, соответствующий остатку 214 в люциферазе Photuris pyralis или остатку 216 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis;
(d) аминокислотный остаток, соответствующий остатку 232 в люциферазе Photuris pyralis или остатку 234 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis;
(e) аминокислотный остаток, соответствующий остатку 295 в люциферазе Photuris pyralis или остатку 297 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis;
(f) аминокислотный остаток, соответствующий аминокислоте 14 люциферазы Photinus pyralis или остатку 16 Luciola mingrelica или 17 Luciola cruciata или Luciola lateralis;
(g) аминокислотный остаток, соответствующий аминокислоте 35 люциферазы Photinus pyralis, или остатку 37 Luciola mingrelica, или остатку 38 Luciola cruciata или Luciola lateralis;
(h) аминокислотный остаток, соответствующий аминокислотному остатку 105 люциферазы Photinus pyralis или остатку 106 гена Luciola mingrelica, 107 Luciola cruciata или 108 Luciola lateralis;
(i) аминокислотный остаток, соответствующий аминокислотному остатку 234 люциферазы Photinus pyralis или остатку 236 Luciola mingrelica, Luciola cruciata или Luciola lateralis;
(j) аминокислотный остаток, соответствующий аминокислотному остатку 420 люциферазы Photinus pyralis или остатку 422 Luciola mingrelica, Luciola cruciata или Luciola lateralis;
(k) аминокислотный остаток, соответствующий аминокислотному остатку 310 люциферазы Photinus pyralis или остатку 312 Luciola mingrelica, Luciola cruciata или Luciola lateralis;
является отличным от аминокислоты, которая имеется в соответствующей последовательности дикого типа и где фермент люциферазы обладает повышенной термостабильностью по сравнению с ферментом, имеющим в данном положении аминокислоту соответствующей люциферазы дикого типа.
Таким образом, предпочтительными примерами белков по изобретению являются мутированные люциферазы дикого типа, где более чем одна аминокислота, например до 100 аминокислотных остатков, предпочтительно не более чем 40 аминокислот и более предпочтительно до 30 аминокислот, являются другими по отношению к аминокислоте в соответствующем положении в соответствующем ферменте дикого типа.
Таким образом, в предпочтительном воплощении белок по изобретению включает люциферазу Photinus pyralis, где в дополнении к мутации в положении 357, как описано выше, по меньшей мере один:
(a) аминокислотный остаток, соответствующий аминокислоте 354 люциферазы Photinus pyralis, является отличным от глутамата;
(b) аминокислотный остаток, соответствующий положению 215 в люциферазе Photinus pyralis, является гидрофобной аминокислотой, отличной от аланина;
(c) аминокислотный остаток, соответствующий остатку 214 в люциферазе Photinus pyralis, является отличным от треонина;
(d) аминокислотный остаток, соответствующий остатку 232 в люциферазе Photinus pyralis, является отличным от изолейцина;
(e) аминокислотный остаток, соответствующий остатку 295 в люциферазе Photinus pyralis, является отличным от фенилаланина;
(f) аминокислотный остаток, соответствующий аминокислоте 14 люциферазы Photinus pyralis, является отличным от фенилаланина;
(g) аминокислотный остаток, соответствующий аминокислоте 35 люциферазы Photinus pyralis, является отличным от лейцина;
(h) аминокислотный остаток, соответствующий аминокислотному остатку 105 люциферазы Photinus pyralis, является отличным от аланина;
(i) аминокислотный остаток, соответствующий аминокислотному остатку 234 люциферазы Photinus pyralis, является отличным от аспарагиновой кислоты;
(j) аминокислотный остаток, соответствующий аминокислотному остатку 420 люциферазы Photinus pyralis, является отличным от серина;
(k) аминокислотный остаток, соответствующий аминокислотному остатку 310 люциферазы Photinus pyralis, является отличным от гистидина.
Альтернативно белок по изобретению включает белковую люциферазную последовательность фермента Luciola mingrelica, Luciola cruciata или Luciola lateralis, и где в дополнении к мутации в положении 359, как описано выше, по меньшей мере один:
(a) аминокислотный остаток, соответствующий аминокислоте 356 люциферазы Photinus pyralis, является отличным от глутамата;
(b) аминокислотный остаток, соответствующий положению 215 в люциферазе Photinus pyralis, является гидрофобной аминокислотой, отличной от аланина или треонина;
(c) аминокислотный остаток, соответствующий остатку 216 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, является отличным от глицина (для Luciola mingrelica основные последовательности) или аспарагина (Luciola cruciata или Luciola lateralis) основные последовательности;
(d) аминокислотный остаток, соответствующий остатку 234 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, является отличным от серина;
(e) аминокислотный остаток, соответствующий остатку 297 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, является отличным от лейцина;
(f) аминокислотный остаток, соответствующий аминокислоте 16 Luciola mingrelica, или аминокислоте 17 Luciola cruciata или Luciola lateralis, является отличным от фенилаланина;
(g) аминокислотный остаток, соответствующий остатку 37 Luciola mingrelica или 38 в Luciola cruciata или Luciola lateralis, является отличным от лизина;
(h) аминокислотный остаток, соответствующий аминокислотному остатку 106 Luciola mingrelica, или аминокислотный остаток Luciola cruciata или 108 Luciola lateralis, является отличным от глицина;
(i) аминокислотный остаток, соответствующий аминокислотному остатку 236 Luciola mingrelica, Luciola cruciata или Luciola lateralis, является отличным от глицина;
(j) аминокислотный остаток, соответствующий остатку 422 Luciola mingreiica, Luciola cruciata или Luciola lateralis, является отличным от треонина;
(k) аминокислотный остаток, соответствующий аминокислотному остатку 312 Luciola mingrelica, Luciola cruciata или Luciola lateralis, является отличным от треонина (для Luciola mingrelica основные последовательности) или валина (для Luciola cruciata или Luciola lateralis) основные последовательности.
Конкретные в каждом случае замещенные аминокислоты, приводящие к появлению повышенной термостабильности, можно определить обычными способами, как показано ниже. В каждом случае различные замены могут приводить к повышенной термостабильности. Замену можно проводить направленным на сайт мутагенезом ДНК, кодирующей нативный или подходящий мутантный белки, что, очевидно, понятно специалисту в данной области. Изобретение в данном случае связано с определением положений, которые связаны с термостабильностью.
Однако в основном может быть желательным планировать замену аминокислотой других свойств вместо аминокислоты дикого типа. Так, гидрофильные аминокислотные остатки можно в некоторых случаях предпочтительно заменять на гидрофобные аминокислотные остатки и наоборот. Аналогично кислые аминокислотные остатки можно заменять на основные остатки.
Например, белок может включать белок, обладающий люциферазной активностью и по меньшей мере 60% гомологией по отношению к люциферазе из Photinus pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, где в последовательности фермента по меньшей мере один:
(а) аминокислотный остаток, соответствующий остатку 214 в люциферазе Photinus pyralis и остатку 216 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, мутирован и является отличным от треонина в случае люциферазы Photinus pyralis; или
(b) аминокислотный остаток, соответствующий остатку 232 в люциферазе Photinus pyralis и остатку 234 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis мутирован и является отличным от изолейцина в случае люциферазы Photinus pyralis; или
(c) аминокислотный остаток, соответствующий остатку 295 в люциферазе Photinus pyralis и остатку 297 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, мутирован и является, например, отличным от фенилаланина в случае люциферазы Photinus pyralis;
и фермент люциферазы обладает повышенной термостабильностью по сравнению с люциферазой дикого типа.
Показано, что последовательности всех различных люцифераз являются высококонсервативными, обладающими значительной гомологией между ними. Это означает, что соответствующие области последовательностей ферментов легко определяются при исследовании последовательностей для установления наиболее сходных областей, хотя, если необходимо, можно использовать коммерчески доступное программное обеспечение (например, “Bestfit” от Генетической компьютерной группы Университета шт. Висконсин; смотри Devereux et al. (1984) Nucleic Acid Research 12: 387-395) для того, чтобы определить соответствующие области или определенные аминокислоты в различных последовательностях.
Альтернативно или дополнительно можно определить соответствующие аминокислоты при обращении к L. Ye et al., Biochim. Biophys Acta 1339 (1997), 39-52.
В отношении возможной замены аминокислотного остатка, соответствующего остатку 214 в люциферазе Photinus pyralis, то полярную аминокислоту треонин соответственно заменяют на неполярную аминокислоту, такую как аланин, глицин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан или цистеин. Особенно предпочтительной заменой остатка треонина, соответствующего остатку 214 в Photinus pyralis, является аланин. Более предпочтительной заменой является цистеин. Однако другие полярные остатки, такие как аспарагин в данном положении, могут также усиливать термостабильность соответствующего фермента, имеющего треонин в данном положении. Другие аминокислоты, имеющиеся в данном положении в люциферазах дикого типа, включают глицин (Luciola mingrelica, Hotaria parvula), аспарагин (Pyrophorus plagiophthalamus, GR, YG, YE и OR, Luciola cruciata, Luciola lateralis, Lampyris noctiluca, Pyrocelia miyako, Photuris pennsylvanica LY, KW, J19) и серин (Phrixothix). Их можно преимущественно заменить на неполярные или другие неполярные боковые цепи, такие как аланин и цистеин.
В отношении возможной замены аминокислотного остатка, соответствующего остатку 232 в люциферазе Photinus pyralis, то неполярную аминокислоту изолейцин соответственно заменяют на другую неполярную аминокислоту, такую как аланин, глицин, валин, лейцин, пролин, фенилаланин, метионин, триптофан или цистеин. Другие аминокислоты, имеющиеся в данном положении в последовательностях дикого типа, включают серин и аспарагин. Соответственно, данные полярные остатки заменяют на неполярные остатки, такие, как указаны выше. Особенно предпочтительной заменой остатка, соответствующего остатку 232 в люциферазе Photinus pyralis и остатку люциферазы 234 Luciola mingrelica, Luciola cruciata или Luciola lateralis, в группе является аланин.
Замены аминокислотного остатка, соответствующего остатку 295 в люциферазе Photinus pyralis и остатку 297 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, также могут оказывать влияние на термостабильность белка. (Это относится к положению 292 в люциферазе Phrixothix). В основном аминокислота в данном положении является неполярной аминокислотой фенилаланином или лейцином. Их соответственно заменяют на другие неполярные аминокислоты. Например, у Photinus pyralis неполярную аминокислоту фенилаланин соответственно заменяют на другую неполярную аминокислоту, такую как аланин, лейцин, глицин, валин, изолейцин, пролин, метионин, триптофан или цистеин. Особенно предпочтительной заменой остатка фенилаланина, соответствующего остатку 214 в люциферазе Photinus pyralis, является лейцин.
Также возможна мутация аминокислотного остатка, соответствующего аминокислоте 14 люциферазы Photinus pyralis или аминокислоте 16 или 17 в люциферазе Luciola (13 в люциферазе Phrixothix). Данный аминокислотный остаток (который обычно является фенилаланином, но также может быть лейцином, серином, аргинином или в некоторых случаях тирозином) соответственно заменяют на другую аминокислоту, в частности на другую неполярную аминокислоту, такую как аланин, валин, лейцин, изолейцин, пролин, метионин или триптофан, предпочтительно аланин.
Также может быть эффективной мутация аминокислотного остатка, соответствующего аминокислоте 35 люциферазы Photinus pyralis или аминокислотному остатку 37 в люциферазе Luciola mingrelica (38 в других видах Luciola spp.). Данная аминокислота варьирует среди ферментов дикого типа, которые могут включать в данном положении лейцин (Photinus pyralis), но также лизин, гистидин, глицин, аланин, глутамин или аспарагиновую кислоту. Соответственно, аминокислотный остаток в данном положении заменяют на неполярный аминокислотный остаток или другую неполярную аминокислоту, такую как аланин, валин, фенилаланин, изолейцин, пролин, метионин или триптофан. Предпочтительной аминокислотой в данном положении является аланин, что отличается от фермента дикого типа.
Мутации по аминокислоте, соответствующей положению 14 последовательности Photinus pyralis, и/или мутация по аминокислотному остатку, соответствующему аминокислоте 35 люциферазы Photinus pyralis, предпочтительно являются не единственными мутациями в ферменте. Соответственно, они сопровождаются другими мутациями, определенными выше, в частности таковыми в положениях, соответствующих положениям 214, 395 или 232 люциферазы Photinus pyralis.
Замены аминокислотного остатка, соответствующего остатку 105 в люциферазе Photinus pyralis и остатку 106 люциферазы Luciola mingrelica, или остатку 107 Luciola cruciata или 108 Luciola lateralis (102 Phrixothix), также могут оказывать влияние на термостабильность белка. В основном аминокислота в данном положении является неполярной аминокислотой аланином, или глицином, или серином у Phrixothix. Их соответственно заменяют на другие неполярные аминокислоты. Например, у Photinus pyralis неполярную аминокислоту аланин соответственно заменяют на другую неполярную аминокислоту, такую как фенилаланин, лейцин, глицин, валин, изолейцин, пролин, метионин или триптофан. Особенно предпочтительной заменой остатка аланина, соответствующего остатку 105 в люциферазе Photinus pyralis, является валин.
Замены аминокислотного остатка, соответствующего остатку 234 в люциферазе Photinus pyralis и остатку 236 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis (231 Phrixothix), также могут оказывать влияние на термостабильность белка. В основном аминокислота в данном положении является аспарагиновой кислотой или глицином и в некоторых случаях глутамином или треонином. Их соответственно заменяют на неполярные или другие неполярные аминокислоты, какие подходят. Например, у Photinus pyralis аминокислотный остаток, являющийся аспарагиновой кислотой, соответственно заменяют на неполярную аминокислоту, такую как аланин, лейцин, глицин, валин, изолейцин, пролин, метионин или триптофан. Особенно предпочтительной заменой остатка фенилаланина, соответствующего остатку 234 в люциферазе Photinus pyralis, является глицин. Там, где в данном положении находится неполярный аминокислотный остаток, такой как глицин (например, в люциферазе Luciola), его можно заменить на другую неполярную аминокислоту.
Замены аминокислотного остатка, соответствующего остатку 420 в люциферазе Photinus pyralis и остатку 422 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis (417 в зеленых Phrixothix и 418 в красных Phrixothix), также могут оказывать влияние на термостабильность белка. В основном аминокислота в данном положении является незаряженной полярной аминокислотой серином, или треонином, или глицином. Их соответственно заменяют на другие незаряженные полярные аминокислоты. Например, в Photinus pyralis серин можно заменить на аспарагин, глутамин, треонин или тирозин и, особенно, треонин.
Замены аминокислотного остатка, соответствующего остатку 310 в люциферазе Photinus pyralis и остатку 312 люциферазы Luciola mingrelica, Luciola cruciata или Luciola lateralis, также могут оказывать влияние на термостабильность белка. Аминокислотный остаток в данном положении варьирует среди известных люциферазных белков, будучи гистидином в люциферазе Photinus pyralis, Pyrocoelia miyako, Lampyris noctiluca и некоторых формах Photuris pennsylvanica, треонином - в люциферазе Luciola mingrelica, Hotaria parvula и Phrixothix (где он является аминокислотой 307), валином - в люциферазе Luciola cruciata и Luciola lateralis, и аспарагином - в люциферазе некоторых Pyrophorus plagiophthalamus. Таким образом, в основном аминокислота в данном положении является гидрофильной аминокислотой, которая может быть замещена на другой аминокислотный остаток, который повышает термостабильность фермента. Особенно предпочтительной заменой остатка гистидина, соответствующего остатку 310 в люциферазе Photinus pyralis, является аргинин.
Другие мутации также могут присутствовать в ферменте. Например, в предпочтительном воплощении белок также имеет аминокислоту в положении, соответствующем аминокислоте 354 люциферазы Photinus pyralis (356 в люциферазе Luciola), замененную с глутамата, в частности, на аминокислоту, отличную от глицина, пролина или аспарагиновой кислоты. Соответственно, аминокислотой в данном положении является триптофан, валин, лейцин, изолейцин и аспарагин, но наиболее предпочтительно лизин или аргинин. Данная мутация описана в WO 95/25798. Было установлено, что гидрофобные остатки в данном положении усиливают сдвиг длины волны фермента. Кроме того, присутствие крупной гидрофобной (V или I), полярной (N) или положительной заряженной (К или R) аминокислоты в положении 354 повышает термостабильность.
В альтернативном предпочтительном воплощении белок также обладает аминокислотой в положении, соответствующем аминокислоте 217 в люциферазе Luciola (215 в Photinus pyralis), замещенной на гидрофобную аминокислоту, в частности на изолейцин, лейцин или валин, как описано в ЕР-А-052448.
Белки по изобретению включают как люциферазы дикого типа, так и рекомбинантные. Они обладают 60% гомологией по отношению к последовательностям дикого типа, как таковые у фермента Photinus pyralis, Luciola mingrelica, Luciola cruciata или Luciola lateralis, в том смысле, что по меньшей мере 60% аминокислот, находящихся в ферментах дикого типа, находятся в белках по изобретению. Такие белки могут обладать более высокой степенью гомологии, в частности по меньшей мере 70%, более предпочтительно по меньшей мере 80% и наиболее предпочтительно по меньшей мере 90% по отношению к ферментам дикого типа, перечисленным выше. Подобные белки данного типа включают аллельные варианты, белки от других видов насекомых, а также ферменты, полученные рекомбинантными методами. Их можно легко идентифицировать, так как они кодируются нуклеиновыми кислотами, которые гибридизируют с последовательностями, которые кодируют ферменты дикого типа в условиях гибридизации с определенной ионной силой. Такие условия, очевидно, понятны специалистам в данной области, и их примеры приводятся у Sambrook et al. (1989) Molecular Cloning, Cold Spring Harbor Laboratory Press). В общих чертах, условия с низкой ионной силой можно определить, как 3×SCC примерно при от комнатной температуры до примерно 65°С, и условия с высокой ионной силой, как 0,1×SSC при примерно 65°С. SSC является названием буфера из 0,15 М NaCl, 0,015 М цитрата натрия. 3×SSC является в три раза сильнее, чем SSC, и так далее.
В частности, гомологию определенной последовательности по отношению к последовательностям по изобретению можно оценить с использованием метода множественного сравнительного анализа первичной структуры, описанного Lipman and Pearson (Lipman D.J. & Pearson W.R. (1985) Rapid and Sensitive Protein Similarity Searches, Science, vol.227, pp.1435-1441). Следует высчитать “оптимизированную” процентную схему по следующим параметрам для алгоритма Липмана-Пирсона: ktup = 1, пробел = 4 и длина пробела = 12. Последовательности, для которых требуется оценить гомологию, следует использовать в качестве “испытуемой последовательности”, что означает, что основную последовательность для сравнения, такую как последовательность Photinus pyralis, или любую из других последовательностей, о которых сообщали Ye et al. выше, следует вводить в алгоритм первой.
Конкретными примерами белков по изобретению являются последовательности люциферазы дикого типа с одной или более мутацией, как указано выше.
Изобретение дополнительно обеспечивает нуклеиновые кислоты, которые кодируют люциферазы, как описано выше. Соответственно, нуклеиновые кислоты основаны на последовательностях дикого типа, которые хорошо известны в данной области. Подходящий метод мутации для проведения желаемой мутации в аминокислотной последовательности легко определить, основываясь на сведениях о генетическом коде.
В предпочтительном воплощении изобретения нуклеиновая кислота является синтетическим геном. Соответст