1-этаноламид pgf2 фармацевтическая композиция
Иллюстрации
Показать всеИзобретение описывает соединение: 1-этаноламид PGF2α, формулы I
которое представляет собой эффективное соединение для снижения внутриглазного давления у млекопитающего, но не действует через FP-рецептор, через который действуют многие глазные гипотензивные простагландины. 2 н. и 2 з.п. ф-лы, 16 табл., 15 ил.
Реферат
1. Область изобретения
Настоящее изобретение относится к глазным гипотензивным липидам. В частности, настоящее изобретение относится к 1-этаноламиду PGF2α (простагландина F2α) и родственным соединениям, и к содержащим эти соединения фармацевтическим композициям, а также к способам применения этих соединений для снижения внутриглазного давления у млекопитающих.
2. Краткое описание уровня техники
Из уровня техники хорошо известно о многочисленных глазных гипотензивных агентах, применяемых для лечения различных гипертензивных состояний глаза, включая первичную и вторичную глаукому, представляющую серьезную проблему для здоровья человека. Лекарственные препараты, использующиеся для лечения глазной гипертензии (глаукомы), включают в себя антагонисты β-адренорецепторов и различные простагландины. Имеется значительный объем научной и патентной литературы, касающейся простагландинов и их использования для лечения глазной гипертензии. Например, см. Bito L.Z. Biological Protection with Prostaglandins Cohen, M.M., ed., Boca Raton. Fla., CRC Press Inc., 1985, pp. 231-252; и Bito, L.Z., Applied Pharmacology in the Medical Treatment of Glaucomas Drance, S.M. and Neufeld, A.H. eds., New York, Grune & Stratton, 1984, pp. 477-505.
Патент US 5288754 содержит, кроме того, ссылки на уже известный уровень техники, направленные на простагландины и родственные соединения, активные в качестве средств для снижения внутриглазного давления у млекопитающих. Сам патент США описывает "Polar С-1 Esters of Prostaglandins" ("Полярные С-1-эфиры простагландинов"), включая С-1-амиды и С-1-замещенные амиды карбоновой кислоты соединения, известного как PGF2α. Дополнительные производные простагландина, родственные PGF2α, которые были выявлены из изучения уровня техники, проведенного в исследовательских лабораториях заявителя настоящей заявки, и которые проявляют высокую внутриглазную гипотензивную активность, показаны ниже формулой и идентифицированы произвольными номерами как "известное соединение 1 " и "известное соединение 2". Известное соединение 1 описано в патентах US 5352708, 5607978 и 5688819, а известное соединение 2 описано в патенте US 5545665.
Значительное большинство глазных гипотензивных агентов, имеющих структуру простагландина или близко родственную ему структуру, действуют через известные "простагландиновые" рецепторы. В частности, известно, что соединение PGF2α проявляет свое глазное гипотензивное действие через FP-рецептор. Как раскрыто в работе Abramovitz с соавт. (J. Biol. Chem., 269:2632, 1994), включенной здесь в качестве ссылки, под термином "FP-рецептор" подразумевают рецептор к простагландину человека. Структура PGF2α, содержащая нумерацию, обычно используемую в номенклатуре простагландинов и родственных соединений, изображена ниже.
PGF2α
Настоящее изобретение направлено на класс соединений, родственных 1-этаноламиду PGF2, которые наряду с известными соединениями 1 и 2, были неожиданно обнаружены в качестве средств, обладающих сильной глазной гипотензивной активностью, но которые не проявляют своего глазного гипотензивного действия ни через FP-рецептор, ни через какой-либо другой известный к настоящему времени простагландиновый рецептор, например DP, ЕР, ЕP2, ЕР3, ЕP4, FP, IP и ТР.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на соединения Формулы 1, где пунктирные линии означают отсутствие связи или связь при условии, что в формуле нет двух соседних двойных связей;
присоединения волнистых линий означают альфа(α, вниз)- или бета(β, вверх)-конфигурацию, там, где волнистые линии присоединены к двойной связи, они означают либо Z(цис)-, либо Е(транс)-конфигурацию;
штриховые линии обозначают альфа(α)-конфигурацию, а сплошные треугольники - бета(β)-конфигурацию;
m представляет собой целое число от 0 до 5;
n представляет собой целое число от 1 до 6 при условии, что соединение, представленное формулой, не является 1-этаноламидом PGF2α;
q и r независимо друг от друга являются целыми числами от 0 до 6;
X представляет собой СН2, O или S, при условии, что когда Х представляет собой O или S, пунктирная линия, примыкающая к X, обозначает отсутствие связи;
R означает СН3, фенил, фурил, тиенил, С3-8-циклоалкил, или фенил, фурил или тиенил, замещенные одним или двумя заместителями, выбранными из группы, состоящей из F, C1, Вr, С1-6-алкила, NO2, CN, СOOН и СOO-(С1-6-алкила);
R1, R2, R3 и R4 независимо друг от друга представляют собой Н или C1-6-алканоил с нормальной или разветвленной цепью, бензоил или низший С1-6-алкил;
R5 представляет собой Н или С1-6-алкил с нормальной или разветвленной цепью и
R6 представляет собой Н или С1-4-алкил с нормальной либо разветвленной цепью
или фармацевтически приемлемую соль данного соединения, причем указанные соединения снижают внутриглазное давление у млекопитающего, но не проявляют свою глазную гипотензивную активность ни через FP-простагландиновый рецептор, ни через какой-либо другой общеизвестный простагландиновый рецептор.
Настоящее изобретение также относится к выделенному в основном чистому 1-этаноламиду PGF2α, который, как было неожиданно установлено, присутствует в основных биологических системах в качестве природного соединения. Кроме того, настоящее изобретение направлено на фармацевтические композиции, содержащие в качестве активного компонента 1-этаноламид PGF2α и/или одно или более соединений в соответствии с Формулой 1, и на способ лечения млекопитающих, включая человека, при необходимости такого лечения, эффективным количеством фармацевтической композиции, содержащей в качестве активного компонента 1-этаноламид PGF2α и/или одно или более соединений в соответствии с Формулой 1, для снижения внутриглазного давления.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
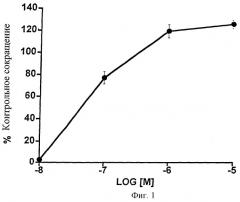
Фиг.1 представляет собой график влияния возрастающих доз 1-этаноламида PGF2α на гладкую мышцу сфинктера радужной оболочки кошки. Точки обозначают средние значения ± SEM (среднеквадратичная ошибка, standard error of the mean); n=4.
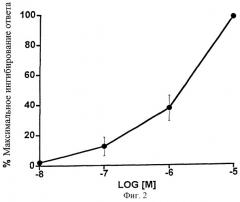
Фиг.2 представляет собой график, показывающий ингибирующее влияние возрастающих доз 1-этаноламида PGF2α на область стимулированного сокращения изолированного сосуда семенного протока морской свинки. Точки обозначают средние значения ± SEM; n=4.
Фиг.3 представляет собой график, показывающий влияние возрастающих доз 1-этаноламида РGF2α на изолированную подвздошную кишку цыпленка. Точки обозначают средние значения ± SEM; n=4.
Фиг.4 представляет собой график, показывающий влияние возрастающих доз 1-этаноламида PGF2α на изолированную подвздошную кишку морской свинки. Точки обозначают средние значения ± SEM; n=4.
Фиг.5 представляет собой график, показывающий влияние возрастающих доз 1-этаноламида PGF2α на изолированную гладкую мышцу аорты крысы. Точки обозначают средние значения ± SEM; n=4.
Фиг.6 представляет собой график, показывающий увеличение концентрации внутриклеточного Ca2+ [Ca2+];, вызванное возрастающими дозами PGF2α () и 1-этаноламида PGF2α(•) в клетках CRL 1497. Точки являются средними значениями ± SEM; n=4.
Фиг.7 представляет собой график, показывающий сосудорасширяющее действие 1-этаноламида простагландина F2α () и простагландина F2α (•) на предварительно сокращенный гистамином сегмент яремной вены кролика. Точки являются средними значениями ± SEM; n=6 для 1-этаноламида PGF2α, n=7 для PGF2α.
Фиг.8 представляет собой график, показывающий увеличение концентрации внутриклеточного Ca2+ [Ca2+]i, вызванное возрастающими дозами PGF2α () и 1-этаноламида PGF2α (•) в клетках НЕК-293, стабильно трансфицированных рекомбинантным FP-рецептором кошки. Точки являются средними значениями ± SEM; n=3.
Фиг.9 представляет собой график, показывающий общее накопление инозитфосфата, вызванное возрастающими дозами 17-фенилпростагландина F2α () и 1-этаноламида PGF2α (•) в клетках НЕК-293, стабильно трансфицированных рекомбинантным FP-рецептором кошки. Даны средние значения ± SEM; n=3.
Фиг.10 представляет собой график, показывающий общее накопление инозитфосфата, вызванное возрастающими дозами 17-фенилпростагландина F2α () и 1-этаноламида PGF2α (•) в клетках НЕК-293, стабильно трансфицированных рекомбинантным FP-рецептором человека. Даны средние значения ± SEM; n=3.
Фиг.11 представляет собой график, показывающий анализ конкуренции связывания меченого лиганда в сравнении с 5 нМ 3H-17-фенил-РGF2α с использованием клеток НЕК-293, стабильно трансфицированных рекомбинантным FP-рецептором кошки. Изображена конкуренция, осуществленная с помощью немеченого 1-этаноламида PGF2α (•) и немеченого 17-фенил-РGF2α (). Точки являются средними значениями ± SEM; n=3 экспериментам, выполненным с тремя повторностями.
Фиг.12 представляет собой график, показывающий анализ конкуренции связывания меченого лиганда в сравнении с 5 нМ 3H-17-фенил-РGF2α с использованием клеток НЕК-293, стабильно трансфицированных рекомбинантным FP-рецептором человека. Изображена конкуренция, осуществленная с помощью немеченого 1-этаноламида PGF2α (•) и немеченого 17-фенил- PGF2α (). Точки являются средними значениями ± SEM; n=3 экспериментам, выполненным с тремя повторностями.
Фиг.13 представляет собой график, показывающий влияние 0,1% 1-этаноламида PGF2α (•) на внутриглазное давление собаки. Контралатеральные глаза для контроля обрабатывали наполнителем (о). Точки являются средними значениями ± SEM; n=6.
Фиг.14 представляет собой график, показывающий влияние 0,1% 1-этаноламида PGF2α (•) на диаметр зрачка собаки. Контралатеральные глаза для контроля обрабатывали наполнителем (о). Точки являются средними значениями ± SEM; n=6.
Фиг.15 представляет собой график, показывающий влияние 1-этаноламида PGF2α (•) на гиперемию поверхности глаза собаки. Контралатеральные глаза для контроля обрабатывали наполнителем (о). Точки являются средними значениями ± SEM; n=6.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В связи с настоящим изобретением было неожиданно обнаружено, что 1-этаноламид PGF2α является природным соединением и может быть образован из анандамида, природного каннабиномиметика, с помощью рекомбинантной СОХ-2 и PGF-синтазы. Известно, что СОХ-2 (циклооксигеназа-2) представляет собой эндопероксидсинтазу простагландина, которая является индуцибельной и не обязательно присутствует в тканях (см. Meade et al. (1993) J. Biol. Chem. 268: 6610-6614). Поскольку не ожидалось, что СОХ-2 будет присутствовать в нестимулированных тканях, полученные из настоящего изобретения данные о том, что значительные количества этаноламида PGF2α образовывались после введения белым мышам анандамида, являются неожиданными. Кроме того, этаноламид PGF2α также неожиданно был обнаружен у мышей, не получавших анандамида, что подтверждает тот факт, что 1-этаноламид PGF2α является конститутивным и может вести себя как эндогенно синтезируемый гормон.
В соответствии с изобретением, 1-этаноламид РGF2α был синтезирован с целью получения этого вещества в изолированном и химически чистом виде и для обеспечения возможности составления фармацевтических композиций, содержащих это вещество. Синтез этаноламида PGF2α также дает возможность синтезировать все соединения в пределах Формулы 1, но лишь с такими модификациями в процессе синтеза, которые легко доступны для практикующего химика-органика и, в частности, для химика, работающего в области химии простагландинов и родственных соединений. Таким образом, настоящее изобретение охватывает соединения Формулы 1.
Предпочтительные соединения в объеме правовой охраны изобретения представлены Формулой 1а, и особенно предпочтительными являются соединения в пределах Формулы 1а, где пунктирные линии между атомами углерода 10 и 11, 8 и 12, 17 и 18 означают отсутствие связи, а между атомами углерода 5 и 6 означают связь. Кроме того, поскольку представляет интерес замещение гидроксильных функциональных групп соединений Формулы 1а или Формулы 1 (от R1-группы до R4), в настоящий момент предпочтительными являются соединения, в которых одна или более гидроксильных групп не этерифицированы и не алкилированы (один или более заместитель от R1 до R4 представляет собой Н), или, если эти группы этерифицированы, этерифицирующая группа представляет собой алканоил, имеющий от 1 до 6 углеродных атомов (формил, ацетил, пропаноил, бутаноил, пентаноил, гексаноил или какой-либо С3-6-алканоил с разветвленной цепью). Поскольку представляет интерес заместитель, обозначенный как R5 в Формуле 1а или Формуле 1, предпочтительными являются соединения, в которых R5 является Н или низшим С1-3-алкилом, наиболее предпочтителен Н. R6 предпочтительней представляет собой Н или низший С1-3-алкил, наиболее предпочтителен Н, и n предпочтительно равно 2.
Вновь возвращаясь к Формуле 1а и Формуле 1, конфигурация групп OR1, OR2 и OR3 предпочтительней представляет собой альфа(С-9, С-11 и С-15-α)-конфигурацию, а конфигурация двойной связи 5-6 - предпочтительней Z(цис)- конфигурацию.
Наиболее предпочтительными соединениями согласно настоящему изобретению являются 1-этаноламид PGF2α и его ацилированные или алкилированные производные, представленные Формулой 2, где заместители от R1 до R4 определены как для Формулы 1, но ацилированные соединения являются более предпочтительными, чем алкилированные.
1-этаноламид PGF2α=R1=R2=R3=R4=H
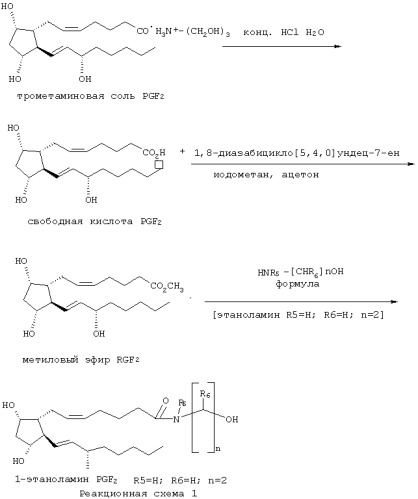
Синтез соединений изобретения проиллюстрирован с помощью синтеза 1-этаноламида PGF2α, представленного реакционной схемой 1, а также подробно раскрыт ниже. Обратимся теперь к схеме реакции. Коммерчески доступную триэтаноламмониевую соль (соль трометамина, трис(гидроксиметил)аминометана) карбоновой кислоты PGF2α обрабатывают кислотой для выделения свободной карбоновой кислоты. Свободную карбоновую кислоту PGF2α превращают в метиловый эфир обработкой метилирующим агентом (предпочтительно, йодистым метилом) в присутствии акцептора кислоты (предпочтительно, 1,8-диазабицикло[5.4.0]ундец-7-ена) с получением метилового эфира РGF2α. Затем метиловый эфир PGF2α обрабатывают этаноламином для получения 1-этаноламида PGF2α. Таким образом, вся "амидная" группа вводится в молекулу в ходе реакции между метиловым эфиром PGF2α и производным гидроксиалкиламина Формулы 3, где R5, R6 и n такие, как определены выше для Формулы 1, и где Формула 3 представляет собой этаноламин, в котором R5 и R6 означают Н, и n равно 2. Гидроксиалкиламины Формулы 3 доступны благодаря химической литературе и с успехом используются в работе практикующего химика-органика. Соединения, для которых в Формуле 1 одна или более пунктирных линий представляют собой связь, и/или где конфигурация гидроксильных групп или конфигурация заместителей около одной или более двойных связей иные, чем в 1-этаноламиде PGF2α, могут быть получены с помощью реакций, аналогичных изображенным на реакционной схеме 1, но при использовании в качестве исходного соединения производного С-1-карбоновой кислоты простагландина соответствующей структуры и стереохимии. Эти исходные соединения доступны благодаря химической литературе и используются в работе практикующего химика-органика. Соединения, для которых в Формуле 1 одна или более групп от R1 до R4 отличается от Н, то есть соединения, где один или более атомов углерода С-9, С-11, С-15 и гидроксигруппа гидроксиалкильного фрагмента в амидной части этерифицированы или алкилированы, могут быть получены реакциями этерификации или алкилирования из "свободных гидроксильных" соединений. Вообще говоря, модификации а- и ω-боковых цепей соединений Формулы 1, как определено для этой формулы, используются в работе практикующего химика-органика в соответствии с патентами США №5545665, 5834498 и 5352708 или по аналогии с ними. Описания этих патентов приводятся здесь в виде ссылок.
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ
Соединения изобретения являются уникальными, поскольку представляют собой сильнодействующие глазные гипотензивные агенты, которые, тем не менее, не действуют через FP-рецептор. Это показано с помощью нескольких аналитических методов, которые хорошо известны в данной области и используются для определения внутриглазной гипотензивной активности, а также для определения рецептора, через который действуют эти соединения. Внутриглазная гипотензивная активность 1-этаноламида PGF2α и его фактическая инертность в отношении FP- или других известных рецепторов простагландинов, продемонстрированная несколькими методами, являются особенно поразительными и неожиданными при сравнении биологического распределения этого соединения с "предшественником" PGF2α.
Описание биологических исследований и результаты исследований приведены ниже.
МЕТОДЫ ИССЛЕДОВАНИЯ ИЗОЛИРОВАННОЙ ТКАНИ
Напряжение гладкой мышцы изолированных тканей измеряли изометрически с помощью датчиков силового смещения (Grass FT-03) и записывали на Grass Polygraphs (модели 7G и 79Е). Ванночки для органов содержали раствор Кребса, выдержанный при 37°С и насыщенный смесью газов 95% O2/5% СO2 для получения рН 7,4. Раствор Кребса имел следующий состав (мМ): NaCl, 118,0; КСl, 4,7; КН2РO4 1,2; СаСl2, 1,9; MgSO4, 1,18; NaHCO3, 25,0; глюкоза, 11,7; индометацин, 0,001.
(а) РАДУЖНАЯ ОБОЛОЧКА КОШКИ
Взрослых домашних кошек умерщвляли введением внутривенно сверхдозы пентобарбитала натрия (Anthony, Arcadia, CA). Глаза сразу же энуклеировали и помещали в лед. Мышцу сфинктера радужной оболочки закрепляли вертикально с натяжением от 50 до 100 мг в ванночке для органов емкостью 10 мл, имеющей двойные стенки. Перед началом каждого эксперимента был предусмотрен период стабилизации длительностью 60 мин. Активность определяли по ответным реакциям сокращения. Соединения добавляли в ванночку кумулятивно и, по меньшей мере, 30 минут после полной отмывки отводили на восстановление и возвращение к исходному растяжению. В качестве контроля определяли ответную реакцию на 10-7 М PGF2α в начале и в конце каждого эксперимента и между кривыми зависимости "доза - ответ". Для каждой ткани было проанализировано не более двух соединений.
(б) АОРТА КРЫСЫ
Взрослых крыс Sprague Dawley весом 180-220 г подвергали наркозу с помощью ингаляции СО2, после чего декапитировали и обескровливали. Грудную аорту извлекали и очищали от всех прилегающих тканей. Для удаления крови просвет аорты промывали. Аорту разделяли на три небольших сегмента длиной 5-8 мм. Каждый сегмент закрепляли с натяжением 2 г в ванночке для органов емкостью 10 мл, имеющей двойные стенки, с помощью двух проволочных крючков, размещенных вдоль просвета сосуда. Такое размещение позволяет измерять силу сокращений, развиваемых круговым слоем гладкой мышцы. Ткани уравновешивали в течение 1 часа перед кумулятивным добавлением соединений в ванночки для органов. В качестве контроля в начале и в конце каждого эксперимента определяли ответную реакцию на 10-7 М U-46619 (тромбоксаномиметика). На восстановительный период после полной отмывки лекарственного препарата отводили 30-45 минут. Для каждой ткани было проанализировано только одно исследуемое соединение.
(в) ПОДВЗДОШНАЯ КИШКА ЦЫПЛЕНКА
Подвздошная кишка цыпленка представляет собой модель для изучения ЕР3-рецептора. Участки подвздошной кишки цыпленка длиной 1,5 см подвешивали с натяжением 1 г. После 1 часового периода уравновешивания получали стандартную кривую "доза-ответ" для PGF2α с 30 минутными отмывками между отдельными дозами. Затем некумулятивно добавляли анализируемое соединение. Под конец в качестве второго контроля добавляли максимальную дозу РGЕ2 (10-6 М). Затем для каждой концентрации вычисляли сократительную активность как % от максимального ответа на PGE2, достигнутого при концентрации 10-6 М.
(г) ПОДВЗДОШНАЯ КИШКА МОРСКОЙ СВИНКИ
Подвздошная кишка морской свинки представляет собой модель для изучения EP1-рецептора. Сегмент подвздошной кишки морской свинки размером приблизительно 1,5 см подвешивали с натяжением 1 г в ванночке для органов, имеющей двойные стенки. После 1-часового периода уравновешивания получали кривую зависимости "доза - ответ" для PGE2. Между дозами допускались 30-минутные периоды отмывки. Аналогичным образом получали кривую "доза - ответ" для 1-этаноламида РGF2α. В качестве контроля в конце вводили 10-6 М РGЕ2. Данные выражали как % от максимального ответа на РGЕ2.
(д) СОСУД СЕМЕННОГО ПРОТОКА МОРСКОЙ СВИНКИ
Активность в отношении подтипа простагландин-чувствительного ЕР3-рецептора определяли также по способности простаноидов ингибировать судорожную реакцию гладкой мышцы, вызванную действием электрического тока на изолированный сосуд семенного протока морской свинки. Участки сосуда семенного протока морской свинки размером 1,5 см подвешивали с начальным натяжением 1 г и уравновешивали в течение, по меньшей мере, 30 минут. Затем каждые 30 секунд ткани подвергали раздражению электрическим импульсом 20 вольт. После стабилизации судорожной реакции для PGE2 получали в кумулятивную стандартную кривую зависимости "доза - ответ". Затем с помощью кривой зависимости "кумулятивная доза - ответ" оценивали исследуемые соединения. Ткани промывали и уравновешивали в течение 1 часа между добавлением соединений. В качестве стандартного контроля в конце эксперимента снова оценивали PGE2. Активность вычисляли как процент ингибирования пика судорожной реакции мышцы.
(е) ЯРЕМНАЯ ВЕНА КРОЛИКА
Новозеландским кроликам-альбиносам обоего пола весом 2-4 кг вводили 1000 ед. гепарина в маргинальную глазную вену, после чего умерщвляли с помощью углекислого газа. Внешние яремные вены очищали от жира и прилегающей соединительной ткани и извлекали. Вены рассекали и каждое кольцо длиной 3-4 мм подвешивали между двумя металлическими крючками в ванночке для органов, имеющей двойные стенки. Ткани уравновешивали в течение 1 часа с натяжением 0,75 г, которое повторно регулировали по мере расслабления тканей. Для сокращения ткани и определения ответной реакции применяли однократные дозы гистамина: 10-5 М, затем 2-3×10-6 M, с отмывкой после каждой дозы. Затем на 5 минут прикладывали антагонист ТР-рецептора SQ29548 в концентрации 10-6 М (Ogletree et al. (1985) J. Pharmacol. Exp. Ther. 234 435-441), после чего добавляли 2-3×10-6 М гистамина для стимуляции сократительной реакции. Через 30 мин после предварительной обработки гистамином анализировали реакцию расслабления путем добавления кумулятивных доз исследуемых соединений с 10-8-10-7 М PGE2 в конце каждой кривой зависимости "доза - ответ" в качестве контроля. На восстановительный период после отмывки тканей отводили 30-50 минут. Релаксационную активность вычисляли как % от контрольного тонуса, вызванного гистамином.
(ж) ТРОМБОЦИТЫ ЧЕЛОВЕКА
Простаноидную активность по отношению к DP-, TP- и IP-рецепторам определяли по их способности вызывать агрегацию (ТР-рецепторная активность) или ингибировать АДФ-индуцированную агрегацию тромбоцитов человека in vitro (DP- и IP-рецепторная активность). Свежую цельную кровь получали от здоровых доноров-волонтеров и смешивали с цитратно-декстрозным раствором (ACD -(citric) acid, (sodium) citrate, dextrose). Кровь центрифугировали со скоростью 1000 об/мин для получения обогащенной тромбоцитами плазмы (PRP). К 400 мкл PRP добавляли 4,5 мкл простаноида или наполнителя и инкубировали 2 мин при 37°С в агрегометре Пэйтона, наблюдая за агрегационной активностью. Для полной агрегации добавляли АДФ до конечной концентрации 2×10-5 М. Ингибирование агрегации вычисляли как процентную разницу между агрегацией, вызванной 2×10-5 М АДФ в отсутствие и в присутствии лекарственного препарата. Агрегационную активность вычисляли как процент агрегации, вызванной простаноидом, относительно агрегации, вызванной 2×10-5 М АДФ. В начале и конце каждого эксперимента определяли контрольные агрегационные реакции лишь для 2×10-5 М АДФ.
(з) КЛЕТКИ CRL 1497: Са2+-СИГНАЛ
Клетки человека CRL 1497 сеяли в культуральные флаконы в модифицированной Дульбекко среде Игла (DMEM), содержащей 10% эмбриональной телячьей сыворотки, 2 мМ 1-глутамина и 0,05 мг/мл гентамицина (все получено от Gibco, Grand Island, NY). Клеточные культуры поддерживали во влажной атмосфере (95% воздуха, 5% СO2) и растили до получения монослоя.
Клетки извлекали из культуральных флаконов приблизительно через 1 мин после обработки смесью 0,05% трипсин/0,53 мМ ЭДТА в сбалансированном солевом растворе Хенкса (HBSS, Gibco, Grand Island, NY) при 37°С. Протеолитическую активность ингибировали добавлением 5 мл DMEM с 10% эмбриональной телячьей сыворотки. Клетки последовательно промывали раствором Хенкса и средой, содержащей 140 мМ NaCl, 50 мМ КСl, 1 мМ MgCl2, 1,5 мМ CaCl2, 10 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота): трис (тригидрооксиметиламинометан), 5 мМ глюкозы, 5 мМ пируватаМа, 0,1% бычьего сывороточного альбумина, при рН 7,4.
Центрифугирование между промывками осуществляли при комнатной температуре в течение 15 минут при 200 g. Клетки подсчитывали, ресуспендировали в упомянутой выше среде и инкубировали с 2×10-6 М смеси Fura 2 и ацетоксиметилового эфира на встряхиваемой водяной бане в течение 30 минут при 37°С. Далее клетки промывали в вышеуказанной среде и ресуспендировали до концентрации 2×106 клеток/мл. Затем аликвоты по 0,5 мл клеточной суспензии добавляли в микропробирки с автоматическими крышками для того, чтобы на каждое экспериментальное определение концентрации внутриклеточного свободного Са2+ ([Са2+]i) приходилось 106 клеток.
Флюоресценцию измеряли на флюоресцентном спектрофотометре Perkin-Elmer LS-5 в интервале длин волн возбуждения и излучения от 340 до 492 нм, соответственно, с обеими щелями по 10 нм. Для каждого экспериментального определения 106 клеток отмывали (при 200 g в течение 5 мин) и суспендировали в 2 мл кювете с буфером, содержащим 120 мМ NaCl, 6 мМ КСl, 1 мМ MgSO4, 1,5 мМ СаСl2, 20 мМ HEPES, 1 мг/мл глюкозы и 1 мг/мл пиру вата Na. Перемешивание осуществляли с помощью установленной наверху лопастной мешалки, при температуре 37°С. Для получения fmax клетки лизировали дигитонином (10 мкл из 100 мг/мл ДМСО). Затем для получения fmin последовательно добавляли EGTA (этиленгликольтетрауксусная кислота) (100 мМ) и 10 N NaOH для подведения рН раствора до 8,5.
(и) РЕКОМБИНАНТНЫЙ FP-РЕЦЕПТОР КОШКИ И ЧЕЛОВЕКА; СТАБИЛЬНЫЕ ТРАНСФЕКТАНТЫ
Клетки НЕК-293 выращивали в DMEM с 10% сыворотки плода коровы (FBS), 250 мкг/мл G418 (Life Technologies) и 200 мг/мл гентамицина или пенициллина/стрептомицина. Отбор стабильных трансфектантов проводили с помощью 200 мкг/мл гигромицина, причем оптимальную концентрацию определяли, исследуя кривые гибели клеток в зависимости от концентрации гигромицина.
Клетки для трансфекции выращивали на 10 см чашках до 50-60% монослоя. Плазмиду рСЕР4, содержащую вставки кДНК для FP-рецептора человека (20 мкг), добавляли к 500 мкл 250 мМ CaCl2. Затем по каплям прибавляли HBSS × 2 (280 мМ NaCl, 20 мМ HEPES кислоты, 1,5 мМ Na2HPO4, pH 7,05-7,12) до 500 мкл при постоянном перемешивании при комнатной температуре. Через 30 мин к смеси добавляли 9 мл DMEM. Затем к клеткам, предварительно отмытым 10 мл фосфдтно-солевого буфера (PBS), прибавляли смесь ДНК/ПМЕМ/фосфат кальция.
Клетки инкубировали в течение 5 часов при 37°С во влажной атмосфере (95% воздуха, 5% СO2). Затем раствор фосфата кальция удаляли и клетки в течение 2 мин обрабатывали 10% раствором глицерина в DMEM. Раствор глицерина меняли затем на среду DMEM, содержащую 10% сыворотки плода коровы (FBS). Клетки инкубировали в течение ночи, и среду меняли на DMEM/10% FBS, содержащую 250 мкг/мл G418 и пенициллин/стрептомицин. На следующий день добавляли гигромицин В до конечной концентрации 200 мг/мл.
Через десять дней после трансфекции отделяли гигромицин В-устойчивые клоны и помещали их в отдельную лунку на 24-лу ночной плате. После достижения монослоя каждый клон переносили в одну лунку 6-луночной платы, а затем в 10 см чашку. Клетки поддерживали в условиях селекции гигромицином до использования.
Стабильные трансфектанты, содержащие FP-рецептор кошки, получали аналогичным образом, используя липофектамин. Клетки также выращивали до 50-60% монослоя в 10 см чашках и с помощью липофектамина трансфицировали плазмидой рСЕР4, включающей вставки кДНК, кодирующей FP-рецептор кошки. Селекцию с помощью гигромицина В начинали через 48 часов после трансфекции. Через восемь дней после трансфекции устойчивые к гигромицину В клоны отделяли и переносили в 24-лу ночные платы.
Исследования Са2+-зависимой передачи сигналов на рекомбинантных FP-рецепторах кошки и человека проводили аналогично тому, как описано для клеток CRL 1497.
(к) ОБРАЗОВАНИЕ ИНОЗИТФОСФАТА
Рецептор-опосредованный гидролиз фосфоинозитида (PI) определяли измерением накопления суммарного инозитфосфата (IP) в клетках, предварительно инкубированных с 3H-миоинозитом. Постоянные клеточные линии НЕК 293, экспрессирующие FP-рецепторы человека или кошки, засевали в 10 см чашки (по 106 клеток на каждую чашку в DMEM с 10% FBS). На следующий день клетки инкубировали с 18 мкКи мио-[2 3H]инозита (Amersham; 10-20 мкКи/ммоль) в 6 мл DMEM с 10% FBS при 37°С в течение 24 часов. Затем клетки дважды промывали фосфатно-солевым буфером (PBS), инкубировали в течение 5 мин с 1 мл трипсин-ЭДТА и суспендировали в 10 мл DMEM, содержащей 25 мМ HEPES. Клетки осаждали центрифугированием при 1000 об/мин и ресуспендировали в DMEM/25 мМ HEPES с 10 MMLiCI в течение 10 мин. Аликвоты по 200 мкл клеточной суспензии инкубировали с 50 мкл лекарственного препарата в течение 30 мин при 37°С (двойное определение), после чего с помощью 750 мкл смеси хлороформ-метанол-4 н. НСl=100:200:2 останавливали стимуляцию агониста с последующим добавлением 250 мкл хлороформа и 0,5 N HCl для экстракции инозитфосфатов. 750 мкл водного слоя наносили на колонку, заполненную 0,5 мл анионобменной смолы Dowex AG 1-X8 (формиатная форма, 100-200 меш, BioRad) для отделения компонентов с радиоактивной меткой. Процедура элюирования состояла из трех 3 мл промывок с 5 мМ инозита, затем двух 750 мкл элюций 1,3 М формиатом аммония с 0,1 М муравьиной кислоты. Элюат смешивали с 10 мл сцинтилляционной жидкости Аквазоль (Packard Instrument Co.) и с помощью жидкостного сцинтилляционного счетчика определяли общую концентрацию 3Н] инозитфосфатов.
(л) СВЯЗЫВАНИЕ МЕЧЕНОГО ЛИГАНДА
Препараты плазматической мембраны клеток НЕК 293, стабильно трансфицированных FP-рецептором человека или кошки, получали следующим образом. Клетки, промытые ТМЕ-буфером, соскабливали со дна флакона и гомогенизировали в течение 30 с с помощью Brinkhman PT 10/35 политрона. При необходимости, для подведения объема до 40 мл в центрифужные пробирки добавляли ТМЕ-буфер, содержащий 100 мМ трис-основания, 20 мМ MgCl2, 2 мМ ЭДТА; физиологическое значение рН получали прибавлением 10 н. HCl.
Клеточный гомогенат центрифугировали со скоростью 19000 об/мин при 4-6°С в течение 20 мин на роторе Ti-60 Beckman. Осадок затем ресуспендировали в ТМЕ-буфере для получения конечной концентрации белка 1 мг/мл, как определено с помощью Biorad анализа. Количественные анализы связывания радиоактивных лигандов выполняли в объеме 200 мкл.
Связывание [3Н](N)17-фенил-РGF2α (удельная активность 85 Ки/ммоль) определяли в двух повторностях, и опыты повторяли три раза. Инкубации проводили в течение 60 мин при 25°С и останавливали добавлением 4 мл ледяного 50 мМ трис-НСl буфера с последующей быстрой фильтрацией через фильтры Whatman GF/B и тремя дополнительными промывками по 4 мл в клеточном коллекторе (Brandel). Проводили анализы конкурентного связывания, используя конечную концентрацию 5 нМ [3H](N)17-фенил-РGF2α, а неспецифическое связывание определяли с помощью 10-5 М немеченого 17-фенил-РGF2α.
(м) ВНУТРИГЛАЗНОЕ ДАВЛЕНИЕ (ВГД)
Исследования внутриглазного давления у собак с привлечением пневматонометрии проводили на находящихся в сознании собаках породы коротконогая гончая обоего пола (10-15 кг). Животные оставались в сознании на протяжении всего исследования и слегка удерживались рукой. Лекарственные препараты вводили местно в один глаз в виде капли объемом 25 мкл, другой глаз для контроля обрабатывали 25 мкл наполнителя (0,1% полисорбата 80-10 мМ трис). Для анестезии роговицы во время тонометрии использовали 0,1%-ный раствор пропаракаина. Внутриглазное давление определяли непосредственно перед введением препарата и через 2, 4 и 6 часов после введения каждый день на протяжении 5 дней исследования. Лекарство вводили сразу после регистрации первого значения ВГД.
(н) ДИАМЕТР ЗРАЧКА
Диаметр зрачка собаки измеряли с помощью оптического стержня (миллиметровой линейки, содержащей полукруглые отметки стандартной ширины (мм) в качестве контроля. Слегка придерживая собаку рукой, при нормальном комнатном освещении измеряли диаметр зрачка путем подбора полукруга к зрачку. Для собак с очень темными зрачками использовали специальный точечный фонарик, но только очень быстро во избежание сужения зрачка. Диаметр зрачка измеряли в то же время, что ВГД и гиперемию.
(о) ГИПЕРЕМИЯ ГЛАЗНОЙ ПОВЕРХНОСТИ
Гиперемию глазной поверхности определяли визуально и рассчитывали по системе, использующейся в обычной клинической практике.
Гиперемию глазной поверхности оценивали одновременно с измерением внутриглазного давления. Необходимо отметить, что необработанные глаза собак часто имели розовато-красный оттенок. Таким образом, следовая и даже слабая гиперемия не обязательно выходит за пределы нормального диапазона.
РЕЗУЛЬТАТЫ
Эффекты 1-этаноламида простагландина F2α на сфинктер радужной оболочки кошки изображены на Фиг.1 и представлены в виде таблицы (Таблица 1). 1-Этаноламид простагландина F2α (1-этаноламид РGF2α) вызывал дозозависимое сокращение гладкой мышцы сфинктера радужной оболочки кошки. Была получена величина эффективной концентрации (ЭК)50, равная 58 нМ. Данные указывают на критическую концентрацию в области 10 нМ.
1-Этаноламид простагландина F2α был умеренно эффективен при ингибировании области раздражения, вызвавшего сокращение изолированного препарата сосуда семенного протока морской свинки. Данные показыны на Фиг.2 и представлены в виде таблицы (Таблица 2).
Фиг.3 показывает влияние 1-этаноламида РGF2α на изолированную подвздошную кишку цыпленка. Сравнение реакции с контрольным соединением (простагландином Е2, 10-6 М) подтверждает, что 1-этаноламид PGF2α может вести себя отчасти как слабый агонист. Данные представлены в Таблице 3. 1-Этаноламид РGF2α оказался менее эффективным для подвздошной кишки цыпленка (Фиг.4, Таблица 4), которая, как сообщалось, является моделью для изучения EP1-рецептора.
Эффекты возрастающих доз 1-этаноламида PGF2α на изолированную аорту крысы показаны на Фиг.5 и в Таблице 5. При высоких дозах, 10-6 и 10-5 М, наблюдалась остаточная активность. Поскольку аорта крысы является моделью для изучения ТР-рецептора, активность в отношении ТР-рецептора дополнительно оценивали во время агрегации тромбоцитов. Кроме того, определяли ингибирование