Способ получения трансгенного животного
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии, в частности к способу получения трансгенного животного. Способ предусматривает введение ДНК в генетический материал животного. При этом ДНК кодирует гомологичный фактор рестрикции комплемента дискордантного вида и последовательность, обеспечивающую экспрессию кодирующей ДНК в клетках трансгенного животного. Клетки, выделенные от такого трансгенного животного, можно трансплантировать животному указанного дискордантного вида без острого отторжения. Изобретение может быть использовано для получения материалов для трансплантации. 1 з.п. ф-лы, 18 ил.
Реферат
Настоящее изобретение относится к биологически совместимому материалу для использования в трансплантатах, а также к получению и применению такого материала.
Пересадка недостающей или поврежденной животной (особенно человеческой) ткани, включая органы, в последние четыре десятилетия приобрела характер обычной терапии в клинической медицине. Эти методы пересадки варьируются, например, от использования полиэтилентерефталата, поставляемого под товарным знаком ДАКРОН фирмой Дюпон, для замены поврежденных кровеносных сосудов до использования подкожной вены ноги в качестве аутотрансплантата к артериям, блокированным по обходу, и до трансплантации сердца от одного человека другому.
Трансплантация органов подверглась значительному развитию с получением иммунодепрессантов, позволяющих достичь высоких результатов при относительно умеренной стоимости. Быстро возросла необходимость в пересадке органов. В настоящее время во всем мире осуществляется более 20000 пересадок органов в год, что, однако, составляет только около 15% от необходимого количества, как оценивается по текущим критериям. Отношение предложение/спрос донорских органов всех типов нельзя решить на основе существующих источников. Возможно, это наилучшим образом иллюстрируется на примере удовлетворения потребности в пересадке сердца. Первая пересадка сердца, осуществленная доктором Барнардом в 1967 году, вызвала громадный интерес во всем мире. В течение года в 22 странах была осуществлена 101 пересадка сердца 64 различными хирургическими бригадами. Разочарование, последовавшее после получения плохих результатов, привело к тому, что к началу 1970 годов во всем мире осуществлялось менее 30 пересадок в год. Однако введение в практику иммунодепрессии циклоспоринами революционизировало пересадку сердца так, что большинство хирургических центров теперь ожидает успешных результатов в пересадке сердца из числа более чем 80% трансплантатов в год (и выживаемости пациентов). По мнению экспертизы, этот процент выживаемости может быть повышен и далее. Успех данной методики, несомненно, предопределил то, что профессиональные медики и публика вообще стали более уверенными в том, что пересадка сердца представляет реальную альтернативу смерти, и все большее число пациентов подвергается данной методике. В настоящее время в мире ежегодно осуществляется свыше 2000 пересадок сердца.
Сегодня наибольшая вероятность смерти при пересадке сердца приходится на период ожидания пригодного донорского органа. Если искусственное сердце позволяет получить для таких пациентов аппараты краткосрочной помощи, то аппараты длительного пользования предполагают наличие большего числа центров по пересадке сердца и доноров. Потенциальное количество людей, которым помогла бы выжить пересадка сердца, никогда не устанавливалось научными методами, однако опубликованные оценки необходимости в пересадке сердца варьируются в широких пределах от 50 до 250 миллионов человек в год в зависимости от выбранных критериев, возраста реципиента, заболевания и так далее. Какой бы ни была фактическая цифра, уже совершенно ясно, что существующее в настоящее время количество доноров не в состоянии решить данную потребность. Аналогичные замечания можно привести и в отношении пересадки почек и печени и весьма вероятно, что вскоре, в результате широко применяемой теперь терапевтической методики трансплантации поджелудочной железы или островка Лагерганса для лечения диабета, первейшей заботой станет сокращение и этой ткани.
Существуют и другие недостатки, ассоциируемые с современным состоянием трансплантационной терапии. Конечно, донорские органы не всегда пригодны для использования при пересадке, так как многие доноры сами являются жертвами какого-то несчастного случая (например, дорожной аварии), который вызвал смерть в результате повреждения определенного органа, иного, нежели тот, который подлежит трансплантации; трансплантируемый орган может быть поврежден в результате иного случая или связанной с этим трудности.
Кроме того, из-за непредсказуемости в пригодности донорских органов терапию трансплантатами часто нельзя планировать в качестве обычной операции, И слишком уж часто хирургические бригады и администрация больниц должны реагировать на момент идентификации донорского органа и заниматься несоциальной деятельностью, что добавляется к административным и персональным трудностям.
В отношении трансплантатов сердца, печени и легких, если происходит отторжение ткани, пересадку обычно нельзя осуществить до тех пор, пока за короткий промежуток времени не появится другой пригодный донор.
Помимо вышеприведенных медицинских трудностей, существующая практика трансплантации в некоторых случаях ассоциируется с социальными затруднениями. Во-первых, могут быть религиозные возражения в пересадке органов от потенциальных доноров, в частности у народов, верящих в перевоплощение. Несомненно, существует целый ряд других этических и социальных трудностей, встречающихся при пересадке органов от умерших людей, в частности в некоторых странах, где требуется согласие на подобную операцию. Наконец, вызывает беспокойство появление коммерческой торговли донорами с живой почкой, в особенности в некоторых регионах третьего мира, и было бы желательно запретить или ослабить такую торговлю.
Как подчеркивалось выше, общепринятая трансплантационная хирургия со всеми ее недостатками заключается в пересадке органов от одного животного определенного вида (как правило, человека) другому животному этого же вида. Такие трансплантации называются аллотрансплантатами. Из-за трудностей в получении общепринятого аллотрансплантата, как отмечается выше, внимание должно быть уделено возможности использования ксенотрансплантатов при пересадке. Ксенотрансплантация является общим термином, используемым для имплантации тканей, включая клетки и органы, через видовые барьеры.
Уже есть несколько примеров успешного использования ксенотрансплантатов в терапевтической пересадке. Например, последние годы свидетельствуют об использовании свиной ткани для замены аортального клапана, свиной кожи для лечения пациентов с сильными ожогами, а также пупочной вены коровы в качестве трансплантата для замены вен. Все эти ксенотрансплантаты имеют одну общую особенность: они обеспечивают только механическую замену ткани. Однако используемая ткань биологически является нефункциональной. Причиной этого является то, что иммунные процессы, происходящие в человеке, немедленно (в течение минут или часов) разрушают целлюлярную целостность тканей от большинства видов. Такие ксенотрансплантаты известны как дискордантные ксенотрансплантаты.
Свирепость такого разрушения является филогенетически ассоциированной. Так, ткань от шимпанзе, примата, являющегося близким родственником человека, может сохраняться в человеке аналогичным образом, что и аллотрансплантат; такой ксенотрансплантат известен как конкордантный ксенотрансплантат.
Хотя можно подумать, что конкордантные ксенотрансплантаты могут ответить на вопрос относительно трудностей с аллотрансплантатами, на практике это не совсем так. Шимпанзе намного мельче человека, а органы шимпанзе, как правило, не функционируют в человеке. В отношении почек данную проблему можно решить за счет трансплантации почек других шимпанзе с целью замены поврежденных почек человека, однако в отношении печени и сердца это невозможно. Кроме того, шимпанзе медленно размножаются в природе и плохо вылавливаются, а потребность в шимпанзе в качестве экспериментальных животных (в особенности в настоящее время, для исследования синдрома приобретенного иммунного дефицита (СПИД)) означает, что вновь спрос обгоняет предложение. Кроме того, может существовать некая социальная трудность, связанная с общественным мнением относительно использования других приматов в качестве доноров ксенотрансплантатов.
Поэтому внимание вновь обращается на дискордантные ксенотрансплантаты. Вообще полагают, что причиной того, почему дискордантные ксенотрансплантаты так быстро терпят неудачу, является существование в реципиентных видах "встречающихся в природе" антител против еще не определенных антигенов донорских видов (Shons et al., (Europ.Surg.Res., 5, 26-36 1973)). Антитела названы "встречающимися в природе", поскольку они присутствуют в живых существах, которые не имеют никакого иммунологического признака от донорского вида.
Быстрое отторжение, известное как гиперострое антитело -опосредованное отторжение трансплантата органа, хорошо документировано. В начале 60-х годов, когда обычным лечением стала пересадка почек, было замечено, что трансплантированные почки время от времени отторгались реципиентом, хотя операция все еще продолжалась. Во время операции по пересадке почка, как правило, становится красной и твердой по консистенции вскоре после того, как сшиты сосуды реципиента и донора. Такие трансплантаты часто вырабатывают мочу почти сразу же. В форме отторжения, когда трансплантат разрушается в то время, как пациент все еще находится на столе (гиперострое отторжение), деструктивные процессы начинаются в первые несколько минут или вскоре после трансплантации. Когда это происходит, почка становится голубоватой и пятнистой, а затем застойной. Консистенция органа также изменяется. Как правило, трансплантат становится отечным, не происходит выработки мочи и вновь трансплантированная почка затем немедленно отторгается. Стало ясно, что в данный процесс вовлечена гуморально-опосредованная иммунологическая реакция между предварительно образованными циркулирующими антителами в реципиенте и антигенами в донорской почке. Единственным путем устранения данной проблемы при аллотрансплантации является проверка перед трансплантацией того, что никаких антител не существует в реципиенте против донорских клеток. С увеличением знания тестирования на такие антитела (известного как перекрестная проба) стало ясно, что эта генерализация относительно того, что антитело в реципиенте вступает во взаимодействие против антигенов в доноре, не является правильной, и что гиперострое отторжение трансплантата, когда оно вовлекает трансплантаты между отдельными пациентами одного и того же вида, ограничивается существованием специфических видов антитела, известного как положительная перекрестная проба с тепловыми лимфоцитотоксинами (лимфоцитотоксический тест); и почти несомненно, эти антитела принадлежат к подклассу иммуноглобулина Г (ИгГ). Кроме того, присутствие этих антител всегда обусловлено методикой пред существующей сенсибилизации либо в результате ранних переливаний крови, либо в результате беременности, либо, наиболее часто, в результате предшествующего повреждения трансплантата.
Полагают, что механизм гиперострого отторжения ксенотрансплантата аналогичен механизму гиперострого отторжения аллотрансплантата, как подчеркивалось выше. Обширная литература по механизму отторжения ксенотрансплантата, она охватывает около 83 лет. В течение этого периода времени только три публикации касались предположения механизма отторжения ксенотрансплантата, который не вовлекает антитела. Предположение основывалось на вовлечении в отторжение ксенотрансплантата альтернативного метаболического пути активации комплемента. Предположение впервые появилось в 1976 году в работе Schilling et al., (Surgery, Gynaecology and Obstetrics 142; 29-32 (1976)). Предположение было выдвинуто вновь в 1988 и 1989 годах (те же данные были опубликованы дважды) Miyagawa et al., (Transplantation, 46(6) 825-830 (1988) и Transplantation Proceedings, 21(1), 520-521 (1989)). Однако результаты не были убедительными, поскольку оба эксперимента испытывали, в основном, одну и ту же ошибку. Выбранная заявителем модель представляла собой модель ксенотрансплантата, в которой не существовали антитела перекрестных видов. Однако сейчас кажется, что анализы, использованные для обнаружения антител перекрестных видов, были неправильными, и что выводы, сделанные в данных работах, основывались на недостоверных данных.
Большинство шагов, предпринимаемых в настоящее время экспериментально для устранения или ослабления отторжения ксенотрансплантатов, включает химиотерапевтическое вмешательство в иммунную систему реципиента, в значительной степени на неспецифической основе, например с использованием циклоспорина А и других иммунодепрессантов, путем плазмофореза, путем обработки фактором яда кобры, абсорбции антитела белком A Staphylococcus и так далее. Этот подход естественно следует из химиотерапии, которая поддерживает аллотрансплантаты.
Настоящее изобретение предполагает совершенно другой подход: вместо неспецифического вмешательства в иммунную систему реципиента изобретение позволяет осуществить совместное введение вещества, которое оказывает воздействие на донорский трансплантат, рассматриваемый как "свой", посредством определенных компонентов иммунной системы реципиента. В особенно предпочтительных вариантах изобретения саму донорскую ткань модифицируют до появления иммунологичности к реципиенту, которому в некоторых отношениях надлежит быть "самим".
Также обнаружено, что гиперострое отторжение ксенотрансплантата необязательно опосредовано антителами. Этот вывод возникает на основе двух наблюдений. Во-первых, в отсутствие антитела, но в присутствии комплемента, наблюдается гиперострое отторжение; во-вторых, в присутствии антитела, но в отсутствие комплемента, не наблюдается никакого гиперострого отторжения.
Изобретение основано на обнаружении того, что активация комплемента играет главную роль в гиперостром отторжении ксенотрансплантата, независимо от того, сопровождается или нет такая активация связыванием молекул соответствующих антител. Активацию альтернативного метаболического пути комплемента можно индуцировать целым рядом клеточных продуктов. Эти продукты не ограничиваются чужеродными клетками, такими как бактерии или ксенотрансплантаты, однако существуют на многих клетках. Так, в принципе, многие клетки человека могут активировать альтернативный метаболический путь комплемента, вызывая обширное автоиммунное отторжение. Если это не происходит, то от того, что существует целый ряд белков, сводящих на нет комплемент, присутствующих в естественном состоянии в сыворотке и на поверхности клеток. Эти молекулы (упоминаемые как "гомологичные факторы рестрикции комплемента") предотвращают полную активацию само-комплемента либо путем классического, либо путем альтернативного метаболического пути под действием продуктов собственно клеток, тем самым препятствуя автоиммунному отторжению "своего". Функционирование таких молекул иллюстрируется при ночной пароксизмальной гемоглобинурии. При таком заболевании "мембранный якорь" по крайней мере одной из этих молекул (фактор распада) отсутствует. Таким образом, белок не удерживается в мембране эритроцитных клеток и отсоединяется от клетки, активируя альтернативный метаболический путь комплемента, после чего лизируется, вызывая тем самым гемоглобинурию.
В соответствии с первым вариантом настоящего изобретения предлагается способ трансплантации животной ткани в реципиент, причем ткань имеет происхождение от донора отличающегося от реципиента вида, донорский вид представляет собой дискордантный вид в отношении реципиента, отличающийся тем, что трансплантируют ткань в реципиент и получают в сочетании с трансплантируемой тканью один или более гомологичных факторов рестрикции комплемента, активных в реципиентном виде, для предотвращения полной активации комплемента.
Слово "ткань", употребляемое в данном описании, означает любой биологический материал, подлежащий трансплантации, и включает органы (особенно внутренние жизненные органы, такие как сердце, легкое, печень и почку, поджелудочную железу и щитовидную железу), роговицу, кожу, кровеносные сосуды и другую соединительную ткань, клетки, включая кровяные и гемопоэтические клетки, островки Лангерганса, клетки мозга и клетки от эндокринных и других органов, а также общие воды организма (например, плазменно-белковый консервант), и все они могут быть кандидатами для трансплантации от одного вида другому.
"Дискордантный вид" - это вид (как правило, васкуляризованный), ксенотрансплантат которого в реципиент обычно дает начало гиперострому отторжению, то есть отторжению в пределах минут или часов, а не дней (Calne, Transplant. Proc., 2:550, 1970). Такие гиперострые отторжения должны быть хорошо известны специалистам в данной области знания и могут иметь место в пределах 24 часов, в пределах 6 часов или даже в пределах одного часа после трансплантации.
Комплемент и его активация в настоящее время хорошо известны и описаны в работе Roitt, Essential Immunology (Fifth Edition, 1984) Blackwell Scientific Publications, Oxford. Активность, приписываемая комплементу (С’), зависит от функционирования девяти белковых компонентов (от С1 до С9), действующих последовательно, из которых первый состоит из трех основных субфракций, называемых C1q, C1r и C1s. Комплемент может быть активирован классическим или альтернативным метаболическим путем, причем оба пути будут описаны вкратце.
При классическом метаболическом пути антитело связывается с С1, субъединица C1s которой приобретает эстеразную активность и вызывает активацию и перенос к сайтам на мембране или иммунном комплексе вначале С4, а затем С2. Этот комплекс обладает активностью "С3-конвертазы" и расщепляет С3 в растворе с получением маленького пептидного фрагмента С3а и остаточной молекулы С3b, которые имеют совершенно разные функции. С3а обладает активностью анафилатоксина и не играет никакой другой роли в каскаде амплификации комплемента. С3b является мембранно-связанным и может вызывать иммунную адгезию комплекса антиген-антитело-С3b, тем самым облегчая последующий фагоцитоз.
При альтернативном метаболическом пути активность конвертазы С3 представлена благодаря С3bВ, активацию которого можно запустить внешними агентами, в частности микробными полисахаридами, такими как эндотоксин, действующий независимо от антитела. Конвертазу образуют под действием Фактора I на комплексе С3b и Фактора В. Этот комплекс образует петлю с положительной обратной связью, в которой продукт распада С3 (С3b) помогает образовать более чем один фермент расщепления.
Как в классическом, так и в альтернативном метаболическом пути уровень С3b поддерживают под действием инактиватора С3b (Фактора I). С3b легко объединяется с Фактором Н с образованием комплекса, который разрушается Фактором I и теряет свои гемолитические и иммунно-адгезивные свойства.
Классический и альтернативный пути являются общими после осуществления стадии С3. С5 расщепляется с получением фрагментов С5а и С5b. С5а обладает активностью анафилатоксина и дает начало хемотаксису полиморфно-ядерных нейтрофилов. С5b связывается в виде комплекса с С6 и С7, образуя термоустойчивый сайт на мембране, который пополняет конечные компоненты С8 и С9 с образованием мембранно-атакующего комплекса (MAC). Он представляет собой кольцевую структуру, вставленную в мембрану и простирающуюся из нее, которая образует трансмембранный канал, полностью проницаемый электролитами и водой. Благодаря высокому внутреннему коллоидно-осмотическому давлению происходит результирующий приток ионов натрия и воды, что приводит к лизису клеток.
Гомологичные факторы рестрикции комплемента (HCRFS), пригодные в настоящем изобретении, могут вообще интерферировать с любой частью каскада активации комплемента. HCRFS может интерферировать исключительно с той частью, которая составляет классический метаболический путь, или исключительно с той частью, которая составляет альтернативный метаболический путь, или, более обычно, может интерферировать с той частью, которая является общей как для классического, так и для альтернативного метаболических путей. Предпочтительно, чтобы регулятор HCRFS интерферировал с общей частью пути метаболизма. HCRFS может быть идентичен натуральному HCRF или может просто иметь соответствующую функцию. Синтетические и полусинтетические HCRFS, включая полученные методами рекомбинантных ДНК, а также их варианты, включены в понятие термина HCRFS.
Как упомянуто выше, гомологичные факторы рестрикции комплемента представляют собой вещества, которые регулируют действие комплементного каскада таким образом, чтобы понизить или предотвратить его литическую активность; они используются животным телом для мечения ткани как "своей" с тем, чтобы можно было избежать аутоиммунной реакции. В предлагаемом изобретении в принципе можно, чтобы HCRFS был либо мембранно-связанным, или свободным в сыворотке, хотя на практике было бы предпочтительнее иметь HCRFS мембранно-связанным на клетках ткани ксенотрансплантата. Таким путем этому фактору легче быть "в ассоциации" с тканью трансплантата. Предпочтительные HCRFs включают путативные факторы клеточной мембраны, включая рецептор C3b/C4b (CR1), рецептор С3.dg (CR2), стимулятор гемолиза (фактор распада, DAF), инактиватор С3b и белок мембранного кофактора (МСР). Путативные сывороточные HCRF включают Фактор Н, стимулятор гемолиза (DАF)и С4-связующий белок (C4bp). Эти HCRFs все регулируют вниз активность комплемента путем интерференции на стадии С3. Гомологичный фактор рестрикции (HRF), который блокирует у С8, также является путативным мембранным фактором.
Многие, но не все, гены для пригодных HCRFS расположены в RCA (регулятор активации комплемента), локус которого картирует с диском q32 хромосомы 1 (Rey-Campos et al., J.Exp Med. 167: 664-669 (1988)).
Хотя существует некоторая путаница с номенклатурой и расположением HCRFs, факторы С4ВР, CRI, DAF и фактор Н идентифицированы Rey-Campos et al., (выше), а также в их более ранней работе (J.Exp.Med, 166: 246-252 (1987)). Белок мембранного кофактора (МСР) обрабатывают как синоним С4-связующего белка (С4bр), и может быть, что эти два фактора являются либо родственными, либо идентичными. Pother и Till ("The Complement System", Springer-Verlag, Berlin (1988)) приводят регуляторные факторы конвертазы С3 в разделе 1,2.3.2; они установили равенство между С4-связующим белком (С4bр) и стимулятором гемолиза, а также между фактором Н, BIH-белком и акселератором инактиватора С3b. Нет сомнения в том, что номенклатура, локализация и характеристика HCRFS будут продолжать развиваться, однако следует понять, что настоящее изобретение предполагает использование всех HCRFS в соответствии с требованием пригодности и предпочтения.
Другие отсылки на HCRFS включают следующие:
Фактор I (также известный ранее как инактиватор С3b или KAF): Tamura and Nelson (J.Immunol., 99: 582-589 (1967);
Фактор Н: Pangburn et al., (J.Exp.Med., 146: 257-270 (1977);
С4-связующий белок: Fujita et al., (J.Exp.Med., 148: 1044-1051 (1978));
DAF (известный так же как CD55): Nicholson-Weller et al., (J.Immunol., 129: 184 (1982));
Белок мембранного кофактора (МСР; также известный как CD46 и впервые описанный как qp45-70 и далее известный как qp66/56): Seya et al./ (J.Exp.Med., 163: 837-855 (1986));
CRI (также известный как CD35): Medof et al., (J.Exp.Med., 156: 1739-1754 (1982)) и Ross et al., (J.Immunol., 129: 2051-2060 (1982));
CR2 (также известный как CD21, рецептор 3d/EBV и р140: Iida et al., (J.Exp.Med., 158: 1021-1033 (1983)) и Weis et al., (PNAS 81: 881-885 (1984)).
Ниже приведено распределение ткани некоторых белков RCA:
CR1: Мембрана (ограниченная): эритроциты; моноциты; большинство клеток В и некоторые клетки Т; полиморфно-ядерные лейкоциты; фолликулярные дендритные клетки; подоциты;
CR2: Мембрана (ограниченная): большинство клеток В; фолликулярные дендритные клетки; некоторые эпителиальные клетки и несколько линий Т-клеток;
МСР: Мембрана (широкая): все периферические кровяные клетки (кроме эритроцитов); эпителиальные, эндотелиальные и фибробластные клеточные линии; трофобласт и сперма;
DAF: Мембрана (широкая): все периферические кровяные клетки; эпителиальные, эндотелиальные и фибробластные клеточные линии; трофобласт и сперма;
С4bр: Плазма: печеночный синтез;
Н: Плазма: печеночный синтез; фибробластные и моноцитарные линии клеток.
Что касается белков, вовлеченных в гомологичную рестрикцию на уровне мембраноатакующего комплекса, использование которого также предусматривается настоящим изобретением, то существует общее согласие (однако, еще не доказательство) в форме белковой последовательности, что следующие белки массой 65 кДа (или около этого) являются идентичными: С8-связующие белки (Schonermark et al., J.Immunol., 136: 1772 (1986)); гомологичный фактор рестрикции (HRF) (Zaiman et al., Immunology, 83: 6975 (1986)), а также МАС-ингибирующий белок (MIP) (Watts et al., (1988)).
Белок C8bp/HRF/MIP присоединен к поверхности клетки при помощи гликолипидного якоря, как и CD59 и DAF: известно, что эти белки функционально отсутствуют при ночной пароксизмальной гемоглобинурии.
Белок массой 18-20 кДа также вовлечен на уровне MAC. Полагают, что следующие белки являются идентичными (а может быть и нет):
P-18 (Sudita et al., (J.Biochem., 104: 633 (1988));
HRF - 20 (Okada et al.,(Intl.Immunol., 1 (1989));
CD59 (Davies et al., (J.Exp.Med., (сентябрь 1989)));
а также мембранный ингибитор реакционноспособного лизиса (MIRL) (Hologuin et al., (J.Clin.Invest., 84: 7 (1989))).
Доказательством путативной идентичности этих белков является то, что белковые и/или кДНК-последовательности для CD59 и HRF-20 показаны идентичными: вероятно, что они те же, что и P-18/MIRL. Следует отметить, что существует некоторая гомология последовательности CD59/HRF-20 с последовательностью мышиного LY-6 антигена, который вовлечен в активацию Т-клеток (Gronx et al., (J.Immunol., 142: 3013 (1989))).
SP-40.40 также вовлечен в регуляцию MAC (Kivszbaum et al., EMBO 8, 711 (1989)).
Предпочтительно, чтобы HCRFS вмешивался в активацию комплемента на стадии С3. Оба МСР и DAF блокируют петлю с положительной обратной связью при альтернативном метаболическом пути активации С3, и они составляют предпочтительные HCRFS.
HCRFS предлагается в ассоциации с трансплантируемой тканью. Это означает, что HCRFS вводят таким образом, чтобы ткань трансплантата была мечена как "своя", однако другой чужеродный материал, такой как поражающие бактерии, так не метят. Один или более HCRFS можно вводить в ткань трансплантата парентерально, но локально. Однако на практике это может быть непредпочтительным из-за трудности обеспечения адекватной локализации HCRFS на ткани трансплантата, а также из-за другой трудности, заключающейся в том, что HCRFS может быть введен реципиенту неоднократно после того, как получен трансплантат, и эту трудность можно устранить за счет использования специальных систем доставки фармацевтических средств.
Вообще, было бы более удобно получить HCRFS таким образом, чтобы он интегрировал с клеточной мембраной на донорской ткани. Хотя могут быть какие-то легкие инфекции трансплантированной ткани, вызывающие пригодную экспрессию, на сегодняшний день наиболее предпочтительным путем достижения данной цели является трансгенный путь для донорской ткани, состоящий в том, что ткань содержит и экспрессирует нуклеиновую кислоту, кодирующую один или более HCRFS, активных в реципиентном виде, когда она трансплантирована в реципиент. Такая трансгенная ткань может продолжать экспрессию HCRFS неограниченное время. Генетически HCRFS может происходить от реципиентного вида или, менее предпочтительно, от близкого вида, для которого возможны конкордантные ксенотрансплантаты.
Хотя, в принципе, трансгенная донорская ткань может происходить от культуры клеток, предпочтительно, чтобы донорская ткань происходила от трансгенного животного. Трансгенное животное должно экспрессировать (или быть способным экспрессировать) HCRFS по крайней мере в трансплантируемой ткани. Однако даже и это неважно, поскольку существует возможность привязать HCRFS к клеточным мембранам донорской ткани с помощью определенного связующего (такого, как гибридное моноклональное антитело (Milstein и Cuello, Nature, 305: 537 (1983)) или рецептора.
Реципиентный вид является главным образом человеческим, но не исключительно. Другие приматы также могут быть пригодными реципиентами, как и многие другие виды, если позволяют соображения экономики и этики.
Донорским видом может быть любой пригодный вид, который отличается от реципиентного вида и который, принимая во внимание физиологию реципиентного вида, способен продуцировать приемлемую для трансплантации ткань. Для человеческих реципиентов пригодны свиные доноры, хотя пригодны и другие виды.
В соответствии со вторым вариантом настоящего изобретения предлагаются трансплантируемые животные клетки или ткань донорского вида, причем клетки или ткань ассоциируются с одним или более гомологичными факторами рестрикции комплемента, активными в искомом реципиентном виде, для предотвращения полной активации комплемента, при этом донорский вид является дискордантным видом относительно реципиентного вида.
В соответствии с третьим вариантом настоящего изобретения предлагается трансгенное животное, имеющее трансплантируемую ткань, которая не позволяет произойти отторжению ксенотрансплантата при трансплантации в иммунную систему по крайней мере одного дискордантного вида. Дискордантный вид - это такой вид, который обычно гиперостро отторгает ксенотрансплантат из животного.
Следовательно, настоящее изобретение предусматривает использование животной ткани, полученной от донорского вида, и одного или более гомологичных факторов рестрикции комплемента, активных в реципиентном виде, причем донорский вид является дискордантным видом относительно реципиентного вида, при получении ткани, трансплантируемой в реципиентный вид.
В соответствии с четвертым вариантом настоящего изобретения предлагается трансгенное животное, имеющее клетки, способные экспрессироватъ гомологичный фактор рестрикции комплемента другого вида. Гомологичный фактор рестрикции, как правило, активен в виде, являющемся дискордантным относительно вида трансгенного животного. Клетки могут быть от одной определенной ткани, предпочтительно описанной со ссылкой на первый вариант изобретения, или от более чем одной, или от всех тканей, и в этом случае животное может стать донором более чем одной ткани. Такое трансгенное животное может рассматриваться как коллекция нетрансформированных (в смысле непролиферативных) клеток.
В соответствии с пятым вариантом настоящего изобретения предлагается нетрансформированная клетка животного, способная экспрессировать один или более гомологичных факторов рестрикции комплемента, активных в виде, являющемся дискордантным относительно клетки животного.
В соответствии с шестым вариантом настоящего изобретения предлагается рекомбинантная ДНК, включающая ДНК, кодирующую по крайней мере один гомологичный фактор рестрикции комплемента, и одну или более последовательностей с тем, чтобы кодирующая ДНК была экспрессирована нетрансформированной животной клеткой. Животной клеткой может быть клетка трансгенного животного, генетически инкорпорирующего конструкцию. В качестве альтернативы клеткой может быть культивированный орган дли другая ткань, как например, островок Лагерганса.
В соответствии с седьмым вариантом настоящего изобретения предлагается генетическая конструкция, пригодная для инкорпорирования в генетический материал животного, с получением трансгенного животного, конструкция включает ДНК, кодирующую по крайней мере один гомологичный фактор рестрикции комплемента и одну или более последовательностей, с тем, чтобы кодирующая ДНК была экспрессирована по крайней мере в некоторых клетках трансгенного животного, генетически инкорпорирующего конструкцию. Такая генетическая конструкция может быть в форме мини-хромосомы, известной как YAC. Как указано выше, гомологичный фактор рестрикции комплемента является активным, как правило, в виде, дискордантном относительно вида трансгенного животного.
В соответствии с восьмым вариантом настоящего изобретения предлагается способ получения трансгенного животного, включающий инкорпорирование в генетический материал животного ДНК, кодирующей по крайней мере один гомологичный фактор рестрикции комплемента и одну или более последовательностей для того, чтобы кодирующая ДНК экспрессировалась по крайней мере в некоторых клетках трансгенного животного.
Способы получения трансгенных животных становятся все более распространенными, и подробные стадии могут быть взяты из известных общепринятых источников. Например, в заявке РСТ WO-A-8800239 раскрываются стадии, необходимые, в принципе, для конструирования трансгенного животного.
Фактический способ инкорпорирования конструкции в клетки трансгенного животного может быть выполнен микроинъекцией, сперма-опосредованным введением или любым другим пригодным образом. Предварительные генетические манипуляции могут быть осуществлены в прокариоте, как, в основном, и предпочитается.
ДНК, кодирующую HCRFS, либо получают в форме кДНК, либо выводят с использованием традиционных методик клонирования. ДНК, кодирующая стимулятор гемолиза (DAF), вероятно наилучшим образом охарактеризована и описана в работе Medof et al., (PNAS, 84: 2007-2011 (1987)).
Физическая карта кластера генов RCA приведена в работе Rey-Campos et al., (1988) (выше). Варианты DAF и их получение методами рекомбинантных ДНК раскрываются в заявке на Европатент А-0244267; такие варианты могут быть использованы в настоящем изобретении.
Из-за лучшего представления генетики DAF и известной последовательности кДНК, кодирующей DAF, этот фактор является предпочтительным гомологичным фактором рестрикции комплемента.
Другие предпочтительные признаки 2-7 вариантов настоящего изобретения аналогичны признакам первого варианта, mutatis mutandis.
Изобретение будет теперь проиллюстрировано следующими примерами. В примерах отсылка сделана на чертежи, на которых:
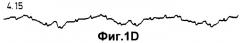
фиг.1А-1Е показывают последовательные записи ЭКГ для сердца кролика, трансплантированного новорожденным поросятам в соответствии с Примером 1;
фиг.2 показывает результат радиомммуноанализа, который говорит о том, что используемые в Примере 1 свиньи не имеют значительных количеств антивидовых антител;
фиг.3 показывает некоторые стадии белкового электрофореза, используемого в Примере 4;
фиг.4 показывает определенные стадии двумерного перекрестного электрофореза, используемого в Примере 4;
фиг.5 показывает "20-Rockets", полученные в результате проведения Примера 4 ;
фиг.6 показывает результат анализа клеточного лизиса с радиоактивным хромом в Примере 5;
фиг.7 иллюстрирует титры литических противохомячковых антител от крысиного реципиента трансплантата сердца хомячка перед трансплантацией (день 0) и на 5, 7 и 9 дни после трансплантации, как описано в Примере 6;
фиг.8 показывает графически оптические плотности (OD) фракцией G200; гистограмма иллюстрирует титры в каждой фракции литических противохомячковых антител от крысиного реципиента сердца хомячка, как описано в Примере 6;
фиг.9 показывает блоттинг по Саузерну ДНК, экстрагированной из линий клеток Т5, b10 и DB3, как описано в Примере 7;
фиг.10 показывает значения высвобождения 51Сr, показательные для линии клеток Т5 человека, подверженных лизису кроличьим комплементом, но не человеческим комплементом, в присутствии свиных противочеловеческих антител, как описано в Примере 7;
фиг.11 показывает значения высвобождения, показательные для неэффективности человеческих антител лизировать линию клеток Т5 человека либо человеческим, либо кроличьим комплементом, как описано в Примере 7;
фиг.12 показывает значения высвобождения 51Сr, которые демонстрируют, что человеческие антитела могут лизировать гибридому типа "мышь-мышь" (DB3) в присутствии и кроличьего комплемента, и человеческого комплемента, как описано в Примере 7;
фиг.13 показывает высвобождение 51Сr, показывающее, что гибридная человеко-мышиная линия клеток В10 лизируется человеческими антителами в присутствии кроличьего комплемента, но не лизируется человеческими антителами в присутствии человеческого комплемента, как описано в Примере 7;
фиг.14 показывает потребление 3Н-аденина (в импульсах в минуту) клетками СНО, которое говорит о том, что эти клетки уничтожаются иммунной крысиной сывороткой в присутствии человеческого комплемента или кроличьего комплемента, как описано в Примере 8;
фиг.15 показывает потребление 3Н-аденина (в импульсах в минуту) клетками СНО, трансфецированны