Ген, обусловливающий устойчивость растений к болезням, и его применение
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к выделенной молекуле ДНК, обеспечивающей устойчивость растений к болезням, а также к способу придания растениям устойчивости к болезням. Выделяют молекулу ДНК, которая включает ген NIM1. Конструируют рекомбинантный вектор, включающий активный в растении промотор, функционально связанный с вышеуказанной молекулой ДНК. Проводят трансформацию растения данным вектором. Изобретение позволяет снизить производственные затраты и повысить сбор сельскохозяйственной продукции. 3 с. и 6 з.п. ф-лы, 19 ил., 18 табл.
Реферат
Настоящее изобретение относится к устойчивости растений к болезням и к выявлению и селекции растений, устойчивых к болезням. В частности, настоящее изобретение относится к выявлению, выделению и характеристике гена, обусловливающего, устойчивость растений к широкому спектру болезней.
Растения постоянно подвергаются воздействию широкого спектра патогенных организмов, к которым относятся вирусы, бактерии, грибы и нематоды. Культурные растения являются особенно уязвимыми, поскольку их обычно выращивают в виде генетически однородных монокультур, при этом потери при поражении болезнью могут быть серьезными.
Однако большинство растений имеют собственные врожденные механизмы защиты от патогенных организмов. Естественная изменчивость по признаку устойчивости к фитопатогенам была выявлелена селекционерами растений и фитопатологами и использована для селекции многих культурных растений. Эти естественные гены устойчивости к болезням часто обусловливают высокие уровени устойчивости или иммунитета по отношению к патогенам.
У многих видов растений первоначальная инокуляция патогеном, вызывающим омертвение, может иммунизировать растения в отношении последующего заражения. Эта приобретенная устойчивость к болезням впервые описана в 1901 году и, вероятно, играет важную роль в сохранении растений в природе. Особенно полно описанными примерами иммунитета растений являются феномен системной приобретенной устойчивости (SAR от англ. systemic acquired resistance) и индуцированная устойчивость у таких растений, как табак, Arabidopsis и огурец. В этих системах инокуляция патогеном, вызывающим омертвение, приводит к системной защите от последующих заражений этим патогеном, а также целым рядом других важных с сельскохозяйственной точки зрения бактерий, грибов и вирусных патогенов.
Системная приобретенная устойчивость также может вызываться химическим иммунизирующими соединениями, определенными химическими веществами, которые вызывают иммунный ответ у растений. Такие соединения могут быть естественного происхождения, например, салициловая кислота (CK), или могут представлять собой синтезированные химические вещества, такие, как 2,6-дихлоризоникотиновая кислота (ИНК) и S-метиловый эфир бензо(1,2,3)тиадиазол-7-карботионовой кислоты (БТК). Обработка патогеном или иммунизирующим соединением индуцирует экспрессию по крайней мере девяти наборов генов у табака, наиболее хорошо охарактеризованного вида растений. В других растениях могут экспрессироваться различные количества и типы генов. Уровень индукции связанных с SAR генов, вызванный иммунизирующими соединениями, более чем в 10000 раз превышает основной уровень. В частности, SAR характеризуется экспрессией SAR-генов, в том числе генов, связанных с патогенезом (PR от англ. pathogenesis-related).
SAR-гены индицируются после заражения патогеном. Некоторые из этих генов играют определенную роль в придании растениям системной приобретенной устойчивости. Эти растительные протеины индуцируются в значительных количествах в ответ на заражение различными патогенами, включая вирусы, бактерии и грибы. PR-протеины первоначально были открыты в растениях табака (Nicotiana tabacum), отличающихся гиперчувствительностью к заражению вирусом мозаики табака (TMV). Затем PR-протеины были обнаружены у многих видов растений (см. Redolfi и др. (1983), Neth J. Plant Pathol 89: 245-254; Van Loon (1985), Plant Mol. Biol. 4: 111-116; Uknes и др., (1992) Plant Cell 4: 645-656). Такие протеины, вероятно, являются общей защитной системной реакцией растений на заражение патогенами.
Связанные с патогенезом протеины включают протеины SAR8.2a и SAR8.2b, кислые и основные формы протеинов табака PR-1a, PR-1b и PR-1c, основные протеины PR-1’, PR-2, PR-2’, PR-2’’, PR-N, PR-O, PR-O’, PR-4, PR-P, PR-Q, PR-S и PR-R, пероксидазы огурца, основную пероксидазу огурца, хитиназу, которая является основной копией PR-P или PR-Q, бета-1,3-глюканазу (глюкан-эндо-1,3-бета-глюкозидаза, КФ 3.2.1.39), которая является основной копией PR-2, PR-N или PR-O, и индуцируемую патогеном хитиназу огурца. Такие PR-протеины описаны, например, у Uknes и др. (1992) в The Plant Cell 4: 645-656 и в указанных в этой статье ссылках.
SAR- или SAR-подобные гены экспрессируются во всех видах растений, обладающих системной приобретенной устойчивостью. Экспрессия таких генов может быть выявлена зондированием с использованием известных последовательностей ДНК гена SAR, что описано, например, у Lawton и др. (1992), Proceedings of the Second European Federation of Plant Pathology (1983), В: Mechanisms of Defence Responses in Plants, под ред. В.Fritig и М.Legrand, Kluwer Academic Publishers, Dordrecht, стр.410-420; у Uknes и др. (1992), The Plant Cell 4: 645-656; у Ward и др., (1991) The Plant Cell 3: 1085-1094. Методы гибридизации и клонирования хорошо известны в данной области и описаны, например, в Molecular Cloning, A Laboratory Manual, 2-е изд., тома 1-3, под ред. Sambrook и др., Cold Spring Harbor Laboratory Press (1989), и в указанных в данной работе ссылках.
Альтернативно этому SAR- или SAR-подобные гены могут быть обнаружны другими методами, такими, как скрининг протеинов, ±-скрининг (дифференциальный скрининг) и т.д, как описано, например, у Liang и Pardee (1992), Science 257: 967-971; у St. John и Davis (1979), Cell 16: 443.
Несмотря на многочисленные исследования и применение сложных и обширных мероприятий, направленных на защиту урожая, включая генетическую трансформацию растений, потери от болезней ежегодно продолжают составлять миллионы долларов. Гены устойчивости к болезням клонировали ранее, однако трансгенные растения, трансформированные такими генами, как правило, обладали устойчивостью только к некоторым штаммам определенных видов патогенов. Несмотря на попытки клонировать гены, относящиеся к SAR, ген, контролирующий устойчивость к широкому спектру болезней, ранее не был выделен и охарактеризован.
Некоторые независимые данные свидетельствует о том, что полученная эндогенно салициловая кислота (СК) принимает участие в пути трансдукции сигнала, объединяя восприятие заражения патогеном с началом развития системной приобретенной устойчивости. Мутанты, сохраняющие способность накапливать СК в ответ на заражение патогеном, но уже потерявшие способность индуцировать гены SAR или устойчивость после обработки СК или ИНК, были описаны у Delaney и др., Proc. Natl. Acad. Sci. 92: 6602-6606 (1995) и в заявке WO 94/16077, в полном объеме включенной в настоящее описание в качестве ссылки.
Было обнаружено, что эти мутанты содержат мутантный ген, и этот ген в своей дикой форме контролирует экспрессию гена SAR и само явление SAR. Согласно изобретению было установлено, что мутантный ген придает мутантным растениям чувствительность к широкому спектру болезней и обусловливает отсутствие у них способности индуцироваться патогенами и химическими индукторами.
Настоящее изобретение относится к идентификации, выделению и характеристике гена дикого типа (NIM1), т.е. гена, который придает растениям возможность активировать SAR и экспрессию гена SAR в ответ на биологические и химические индукторы.
Мутантный ген был выявлен в подвергнутых мутагенезу растениях Arabidopsis. Было обнаружено, что эти растения имеют дефект по сравнению с их нормальной реакцией на заражение патогеном в том отношении, что они не экспрессируют гены, связанные с системной приобретенной устойчивостью (SAR) и не способны проявлять такую устойчивость. Эти мутанты содержат дефектный ген, который обозначен как nim1 (ген, отвечающий за неиндуцируемость иммунитета).
Настоящее изобретение также относится к применению клонированного гена NIM1 и его вариантов для создания трансгенных растений, обладающих устойчивостью к широкому спектру болезней, и к полученным таким образом трансгенным растениям. Изобретение также относится к применению клонированного гена NIM1 и его вариантов для скрининга с целью выявления соединений, способных индуцировать у растений устойчивость к широкому спектру болезней.
Краткое описание чертежей
На фиг.1 показано воздействие химических индукторов на индукцию экспрессии гена PR в растениях дикого типа и в nim1-растениях.
На фиг.2 показана экспрессия гена PR-1 в зараженных патогеном Ws-O-растениях и в nim1-растениях через 6 дней после начала заражения.
На фиг.3 показаны уровни накопления СК в Ws-О-растениях и в nim1-растениях, зараженных Р.syringae.
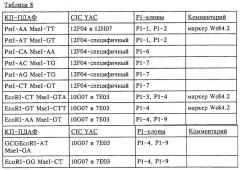
На фиг.4 приведена генетическая карта NIM1-области, полученная с помощью методов ПДАФ и ПДПП.
На фиг.5 приведена физическая карта NIM1-области, полученная с помощью анализа клонов YAC.
На фиг.6 приведена физическая карта удлиненного набора последовательностей фрагментов (contig) P1/ВАС.
На фиг.7 приведена физическая карта, показывающая положения клонов Р1 и ВАС относительно фланкирующих ПДАФ-маркеров и YAC.
На фиг.8 приведена физическая карта еще одного удлиненного набора последовательностей фрагментов Р1/ВАС, содержащего ген NIM1.
На фиг.9 приведена объединенная генетическая и тонкая физическая карты NIM-области.
На фиг.10 приведена карта NIM-области.
На фиг.11 приведена объединенная карта NIM-области, включающая новые ПДАФ-маркеры.
На фиг.12 представлено схематическое изображение рекомбинантов D169 и С105.
На фиг.13 представлена общая карта хромосомной области вокруг NIM1 с выявленными рекомбинантами, включая ВАС, YAC и космиды в NIM1-области.
На фиг.14 представлена последовательность области длиной 9,9 т.п.н. клона ВАС-04, содержащая ген NIM1.
(На фиг.15 приведена нуклеотидная последовательность гена NIM1 и аминокислотная последовательность продукта гена NIМ1, включая изменения в различных аллелях..
На фиг.16 показана экспрессия NIM1, индуцируемая ИНК, БТК, СК и патогеном, в аллелях дикого типа и в мутантных аллелях nim1.
На фиг.17 показана экспрессия PR-1 в растениях, имеющих мутацию nim1, и в растениях дикого типа.
На фиг.18 показан уровень устойчивости к болезням у различных nim1-мутантов.
На фиг.19 приведена аминокислотная последовательность, включающая экспрессируемую последовательность Tag-областей протеина NIM1 и кДНК протеиновых продуктов последовательностей 4-х генов риса (см. SEQ ID NO: 3).
Определения
| АК: | аминокислота |
| ПДАФ: | полиморфизм длин амплифицированных фрагментов |
| avrRpt2: | авирулентный ген Rpt2, выделенный из Pseudomonas syringae |
| ВАС: | бактериальная искусственная хромосома |
| БТК: | S-метиловый эфир бензо(1,2,3)тиадиазол-7-карботионовой кислоты |
| Col: | экотип Arabidopsis Columbia |
| КФ: | комбинации ферментов |
| ИНК: | 2,6-дихлоризоникотиновая кислота |
| Ler: | экотип Arabidopsis Landsberg erecta |
| NIM1: | ген дикого типа, обусловливающий устойчивость растения к болезням |
| nim: | мутантный аллель NIM1, обусловливающий чувствительность растения к болезням |
| nim1: | мутантная линия растения |
| ОРС: | открытая рамка считывания |
| КП: | комбинации праймеров |
| СК: | салициловая кислота |
| SAR: | системная приобретенная устойчивость |
| ПДПП: | полиморфизм длин простых последовательностей |
| Ws-O: | экопит Arabidopsis Wassilewskija |
| YAC: | искусственная хромосома дрожжей |
Ген NIM1 был клонирован методами картирования и "прогулки" вдоль хромосомы, которые показали, что ген входит в область длиной 105 т.п.н. (см. фиг.13 и таблицу 16). Эта область ограничена L84.6b-маркером слева и L84.T2-маркером справа. Только три перекрывающиеся космиды, полученные из ДНК дикого типа из области длиной 105 т.п.н., восстанавливают (комплементируют) мутантный фенотип; nim1 (фиг.13 и таблица 16). Эти три космиды перекрываются только в области длиной 9,9 т.п.н., обозначенной левым концом космидного клона D7 и правым концом космидного клона D5, как показано на фиг.13. Многие другие космиды, сконструированные на основе других участков области длиной 105 т.п.н., не восстанавливают фенотип nim1 (фиг.13 и таблица 16). Практически полноразмерный клон кДНК гена NIM1 позволяет выявить интрон-экзонные пограничные последовательности и определить аминокислотную последовательность генного продукта. Только NIM1-область гена внутри комплементарной области длиной 9,9 t.ii.il имеет изменения последовательности в различных мутантных аллелях nim1 (таблица 18). Обнаружено, что три других потенциальных области гена не имеют изменений последовательности, которые связаны с фенотипом nim1. Изменения последовательностей, обнаруженные в NIM1-области гена, согласуются с измененной функцией или с потерей функции генного продукта. Серьезность изменения в NIM1-области гена в определенном мутантном аллеле приблизительно коррелирует с наблюдаемой физиологической ролью этого nim1-аллеля. Только NIM1-область гена имела выявляемую РНК (транскрипция), и в этой РНК обнаружены многочисленные изменения, согласующиеся с физиологической ролью NIM1 в патогенезе (таблица 18 и фиг.16).
Настоящее изобретение относится к выделенному генному фрагменту, гену NIM1, который представляет собой ключевой компонент пути метаболизма системной приобретенной устойчивости (SAR) в растениях. Ген NIM1 связан с активацией SAR химическими и биологическими индукторами и в сочетании с такими индукторами необходим для SAR и экспрессии SAR-генов.
Локализацию гена NIM определяют с помощью анализа методами молекулярной биологии генома мутантных растений, для которых известно, что они несут мутантный ген nim1, который придает растениям-хозяевам очень высокую чувствительность к широкому диапазону патогенов и лишает их способности реагировать на патогены и химические индукторы SAR. nim1-Мутанты пригодны в качестве "универсальных чувствительных к болезням растений" (УЧБ)/благодаря их чувствительности ко многим штаммам и патотипам патогенов, растения-хозяина, а также к патогенам, которые в норме не заражают растение-хозяина, но которые заражают других хозяев. Они могут быть получены путем обработки семян или другого биологического материала мутагенными агентами с последующей селекцией потомства растений в отношении УЧБ-фенотипа путем обработки растений потомства известными химическими индукторами (например, ИНК) системной приобретенной реакции и последующего заражения растений известным патогеном. При таких обстоятельствах у мутантов с неиндуцируемой устойчивостью развиваются серьезные симптомы болезни, в то время как у немутантных растений химическое соединение индуцирует системную приобретенную устойчивость. nim1-Мутанты могут быть отобраны как из мутантных популяций, полученных в результате химического или радиоционного мутагенеза, так и из популяций, образованных с помощью инсерций (вставок) Т-ДНК и транспозониндуцируемого мутагенеза.
Методы получения мутантных линий растений хорошо известны в данной области. min-Фенотип растений применяют в качестве инструмента для идентификации выделенного фрагмента гена, который придает растениям способность экспрессировать устойчивость к широкому спектру болезней.
Настоящее изобретение относится к выделенной молекуле ДНК, включающей мутантный ген NIМ1, который представляет собой ген nim1.
При использовании мутанта nim1 или растения для выделения гена NIM1 дикого типа, необходимого для конститутивной экспрессии генов SAR, признаки устойчивости в комбинации с другими характеристиками, важными для продуктивности и качества, могут быть включены в линии растений с помощью селекции. Подходы и методы селекции известны в данной области и описаны, например, в следующих публикациях: Welsh J.R., Fundamentals of Plant Genetics and Breeding, John Wiley & Sons, NY (1981); Crop Breeding, под ред. Wood D.R., American Society of Agronomy Madison, Wisconsin (1983); Mayo O., The Theory of Plant Breeding, 2-е изд., Clarendon Press, Oxford (1987); Singh, D.P., Breeding for Resistance to Diseases and Insect Pests, Springer-Verlag, NY (1986); Wricke и Weber, Quantitative Genetics and Selection Plant Breeding, Walter de Gruyter and Co., Berlin (1986).
Еще одним объектом изобретения является химерный ген, включающий активный в растении промотор, функционально связанный с гетерологичной молекулой ДНК, кодирующей аминокислотную последовательность продукта гена NIM1 и его варианты по изобретению.
Методологии конструирования растительных кассет экспрессии, а также интродукции чужеродной ДНК в растения в целом описаны в данной области техники. Как правило, для интродукции в растения чужеродной ДНК использовали Ti-плазмидные векторы для доставки чужеродной ДНК. Для такой доставки также применялось непосредственное введение ДНК, липосомы, электропорация, микроинъекция и микроснаряды. Такие методы описаны в данной области, например, в следующих публикациях: Bilang и др. (1991), Gene 100: 247-250; Scheid и др., (1991) Mol. Gen. Genet. 228: 104-112; Guerche и др., (1987) Plant Science 52: 111-116; Neuhause и др., (1987) Theor. Appl. Genet. 75: 30-36; Klein и др., (1987) Nature 327: 70-73; Howell и др., (1980) Science 208: 1265; Horsch и др., (1985) Science 227: 1229-1231; DeBlock и др., (1989) Plant Physiology 91: 694-701; Methods for Plant Molecular Biology (под ред. Weissbach и Weissbach) Academic Press, Inc. (1988); Methods in Plant Molecular Biology (под ред. Schuler и Zielinski) Academic Press, Inc. (1989), а также в заявке на патент США 08/438666, поданной 10 мая 1995, и в заявке WO 93/07278, причем обе эти публикации в полном объеме включены в настоящее описание в качестве ссылки. Следует отметить, что метод трансформации должен зависеть от растительной клетки, подлежащей трансформации.
Также очевидно, что компоненты кассеты экспрессии могут быть модифицированы с целью усиления экспрессии. Например, могут применяться усеченные последовательности, нуклеотидные замещения или другие модификации. Трансформированные растительные клетки с такими модифицированными системами экспрессии далее должны проявлять сверхэкспрессию или конститутивную экспрессию генов SAR, что необходимо для активации SAR.
Молекула ДНК или фрагмент гена, обусловливающие у растений устойчивость к болезням благодаря тому, что они обеспечивают экспрессию гена SAR,) могут быть включены в растительные или бактериальные клетки с использованием общепринятого метода рекомбинатной ДНК. Как правило, такая технология предусматривает встраивание (инсерцию) молекулы ДНК в систему экспрессии, для которой молекула ДНК является гетерологичной (т.е. в которой она в норме не присутствует). Гетерологичную молекулу ДНК встраивают в систему экспрессии или в вектор в соответствующей ориентации и в правильной рамке считывания. Вектор содержит необходимые элементы для транскрипции и трансляции встроенных последовательностей, кодирующих протеины. Может использоваться большое количество векторных систем, известных в данной области, таких, как плазмиды, вирусные бактериофаги и другие модифицированные вирусы. Пригодные векторы включают, но не ограничены ими, вирусные векторы, такие, как векторные системы лямбда Igti1, Igt10 и Charon 4, плазмидные векторы, такие, как pBI121, pBR322, pACYC177, pACYC184, серии pAR. pKK223-3, pUC8, pUC9, pUC18, pUC19, pLG339, pRK290, pKC37, pKC101, pCDNAII, и другие аналогичные системы. Последовательности ДНК могут быть клонированы в векторе с использованием стандартных в данной области методов клонирования, описанных у Maniatis и др. в Molecular Cloning: A Laboratory Manual, Cold Spring Laboratory, Cold Spring Harbor, New York (1982).
Еще одним объектом изобретения является рекомбинантный вектор, включающий химерный ген по изобретению.
С целью получения эффективной экспрессии гена или фрагмента гена по настоящему изобретению в векторе экспрессии должен присутствовать промотор. РНК-полимераза в норме связывается с промотором и инициирует транскрипцию гена. Промоторы варьируются по силе, т.е. по способности обеспечивать транскрипцию. В зависимости от используемой системы клетки-хозяина может применяться любой из многочисленных приемлемых промоторов. Приемлемые промоторы включают промотор убикитина, nos-промотор, промотор гена малой субъединицы рибулозобифосфаткарбоксилазы, промотор малой субъединицы связывающего хлорофилл А/В-полипептида, промотор 35S вируса мозаики цветной капусты и промоторы, выделенные из генов растений, При этом можно назвать, например, статью Vallejos и др., "Localization in the Tomato Genome of DNA Restriction Fragments Containing Sequences Homologous to the RRNA (45S), the major chlorophyll A/BBinding Polypeptide and the Ribulose Bisphosphate Carboxylase Genes," Genetics 112: 93-105 (1986), в которой описан состав малых субъединиц. Промотор nos и промотор 35S вируса мозаики цветной капусты хорошо известны в данной области.
Когда ген устойчивости к болезням по настоящему изобретению уже клонирован в системе экспрессии, им легко трансформировать растительную клетку. Ткани растения, пригодные для трансформации, включают ткани листа, ткани корня, меристемы и протопласты.
Для трансформации растительных клеток могут использоваться бактерии рода Agrobacterium. Пригодные виды этой бактерии включают Agrobacterium tumefaciens и Agrobacterium rhizogens. Особенно целесообразно использовать вид Agrobacterium tumefaciens (например, штаммы LBA4404 или ЕНА105) вследствие его хорошо известной способности трансформировать растения.
Другой подход к трансформации растительных клеток геном включает внесение инертных или биологически активных частиц в растительные ткани и клетки. Этот метод описан в US 4945050, US 5036006 и US 5100792, выданных на имя Sanford и др. В целом этот способ заключается в нанесении инертных или биологически активных частиц на клетку в условиях, обеспечивающих их прохождение через оболочку клетки и проникновение внутрь клетки. Когда используют инертные частицы, вектор может интродуцироваться в клетку путем покрытия частиц вектором, содержащим требуемый ген. В альтернативном варианте клетка-мишень может быть окружена вектором таким образом, чтобы вектор проникал в клетку вслед за частицей. Биологически активные частицы (например, высушенные дрожжевые клетки, высушенная бактерия или бактериофаг, каждый из которых содержит ДНК, которую предполагается интродуцировать) также могут быть внесены в ткань растительной клетки.
Выделенный фрагмент гена по настоящему изобретению может использоваться для придания устойчивости к болезням широкому спектру растительных клеток, включая клетки голосемянных, однодольных и двудольных растений. Хотя ген может быть встроен в любую растительную клетку, входящую в эти широкие классы растений, особенно целесообразным является встраивание в клетки культурных растений, таких как рис, пшеница, ячмень, рожь, кукуруза, картофель, морковь, батат, сахарная свекла, фасоль, горох, цикорий, салат, капуста, цветная капуста, брокколи, турнепс, редис, шпинат, спаржа, лук, чеснок, баклажан, перец, сельдерей, тыква крупноплодная, тыква обыкновенная, цуккини, огурец, яблоня, груша, айва, дыня, слива, вишня, персик, нектарин, абрикос, земляника, виноград, малина, ежевика, ананас, авокадо, папайя, манго, банан, соя, табак, томат, сорго и сахарный тростник.
В пригодных условиях система экспрессии по настоящему изобретению может использоваться для трансформации клетки практически любого культурного растения. Трансформированные клетки могут регенирироваться в целые растения, в результате чего ген придает устойчивость к болезням целым трансгенным растениям. Как указано выше, система экспрессии может быть модифицирована таким образом, что ген устойчивости к болезням экспрессируется постоянно или экспрессия является конститутивной.
Трансформация
Настоящая система может применяться в любом растении, которое может быть трансформировано и регенерировано. Такие методы трансформации и регенерации хорошо известны в данной области. Помимо указанных выше публикаций можно назвать также следующие: An G., Watson B.D. и Chiang С.С., Transformation of tobacco, tomato, potato, and Arabidopsis thaliana using a binary Ti vector system, Plant Physiol. 81: 301-305, 1986; Fry J., Barnason А. и Horsch R.B., Transformation of Brassica napus with Agrobacterium tumefaciens based vectors, PI. Cell Rep. 6: 321-325, 1987; Block M.D., Genotype independent leaf disc transformation of potato (Solanum tuberosum) using Agrobacterium tumefaciens, Theor. appl. genet. 76: 767-774, 1988; Deblock M., Brouwer D.D. и Tenning P., Transformation of Brassica napus and Brassica oleracea using Agrobacterium tumefaciens and the Expression of the bar and neo genes in the transgenic plants, Plant Physiol. 91: 694-701, 1989; Baribault T.J., Skene K.G.M., Cain P.A. и Scott N.S., Transgenic grapevines: regeneration of shoots expressing beta-glucuronidase, PI. Cell Rep. 41: 1045-1049, 1990; Hinchee M.A.W., Newell C.A., ConnorWard D.V., Armstrong T.A., Deaton W.R., Sato S.S. и Rozman R.J., Transformation and regeneration of non-solanaceous crop plants, Stadler. Genet. Symp. 203212.203-212, 1990; Barfield D.G. и Pua E.C., Gene transfer in plants of Brassica juncea using Agrobacterium tumefaciens-mediated transformation, PI. Cell Rep. 10: 308-314, 1991; Cousins Y.L., Lyon B.R. и Llewellyn D.J., Transformation of an Australian cotton cultivar: prospects for cotton improvement through genetic engineering, Aust. J. Plant Physiol. 18: 481-494, 1991; Chee P.P. и Slightom J.L., Transformation of Cucumber Tissues by Microprojectile Bombardment Identification of Plants Containing Functional and Nonfunctional Transferred Genes, GENE 118: 255-260, 1992; Christou P., Ford T.L. и Kofron M., The development of a variety-independent gene-transfer method for rice. Trends. Biotechnol. 10: 239-246, 1992; D'Halluin К., Bossut M., Bonne E., Mazur В., Leemans J. и Botterman J., Transformation of sugarbeet (Beta vulgaris L.) and evaluation of herbicide resistance in transgenic plants, Bio/Technol. 10: 309-314. 1992; Dhir S.K., Dhir S., Savka M.A., Belanger F., Kriz A.L., Farrand S.K. и Widholm J.M., Regeneration of Transgenic Soybean (Glycine Max) Plants from Electroporated Protoplasts, PLANT PHYSIOL 99: 81-88, 1992; На S.B., Wu F.S. и Thorne Т.К., Transgenic turf-type tall fescue (Festuca arundinacea Schreb.) plants regenerated from protoplasts, PI. Cell Rep. 11: 601-604, 1992; Blechi A.E., Genetic Transformation The New Tool for Wheat Improvement 78th Annual Meeting Keynote Address, CEREAL FOOD WORLD 38: 846-847, 1993; Casas A.M., Kononowicz A.K., Zehr U.B., Tomes D.T., Axtell J.D., Butler L.G., Bressan R.A. и Hasegawa P.M., Transgenic Sorghum Plants via Microprojectile Bombardment, PROC NAT ACAD SCI USA 90: 11212-11216, 1993; Christou P., Philosophy and Practice of Variety Independent Gene Transfer into Recalcitrant Crops, IN VITRO CELL DEV BIOL-PLANT 29P: 119-124, 1993; Damiani P., Nenz E., Paolocci F. и Arcioni S., Introduction of Hygromycin Resistance in Lotus spp Through Agrobacterium Rhizogenes Transformation, TRANSGENIC RES 2: 330-335, 1993; Davies D.R., Hamilton J. и Mullineaux P., Transformation of Peas, PI. Cell Rep. 12: 180-183, 1993; Dong J.Z. и Mchughen A., Transgenic Flax Plants from Agrobacterium Mediated Transformation Incidence of Chimeric Regenerants and Inheritance of Transgenic Plants, PLANT SCI 91: 139-148, 1993; Fitch M.M.M., Manshardt R.M., Gonsalves D. и Slightom J.L., Transgenic Papaya Plants from Agrobacterium Mediated Transformation of Somatic Embryos, PI. Cell Rep. 12: 245-249, 1993; Franklin C.I. и Trieu T.N., Transformation of the Forage Grass Caucasian Bluestem via Biolistic Bombardment Mediated DNA Transfer, PLANT PHYSIOL 102: 167, 1993; Golovkin M.V., Abraham M., Morocz S., Bottka S., Feher А. и Dudits D., Production of Transgenic Maize Plants by Direct DNA Uptake into Embryogenic Protoplasts, PLANT SCI 90: 41-52, 1993; Guo G.Q., Xu Z.H., Wei Z.M. и Chen H.M., Transgenic Plants Obtained from Wheat Protoplasts Transformed by Peg Mediated Direct Gene Transfer, CHIN SCI BULL 38: 2072-2078. 1993; Asano Y. и Ugaki M., Transgenic plants of Agrostis alba obtained by electroporationmediated direct gene transfer into protoplasts, PI. Cell Rep. 13, 1994; Ayres N.M. и Park W.D., Genetic Transformation of Rice, CRIT REV PLANT SCI 13: 219-239, 1994; Barcelo P., Hagel С., Becker D., Martin А. и Lorz H., Transgenic Cereal (Tritordeum) Plants Obtained at High Efficiency by Microprojectile Bombardment of Inflorescence Tissue, PLANT J 5: 583-592, 1994; Becker D., Brettschneider R. и Lorz H. Fertile Transgenic Wheat from Microprojectile Bombardment of Scutellar Tissue, PLANT J 5: 299-307, 1994; Biswas G.C.G., Iglesias V.A., Datta S.K. и Potrykus I., Transgenic Indica Rice (Oryza Sativa L) Plants Obtained by Direct Gene Transfer to Protoplasts, J BIOTECHNOL 32: 1-10, 1994; Borkowska M., Kleczkowski K., Klos В., Jakubiec J. и Wielgat В., Transformation of Diploid Potato with an Agrobacterium Tumefaciens Binary Vector System.1. Methodological Approach, ACTA PHYSIOL PLANT 16: 225-230, 1994;
Brar G.S., Cohen B.A., Vick C.L. и Johnson G.W., Recovery of Transgenic Peanut (Arachis Hypogaea L) Plants from Elite Cultivars Utilizing Accell(R) Technology, PLANT J 5: 745-753, 1994; Christou P., Genetic Engineering of Crop Legumes and Cereals Current Status and Recent Advances, AGRO FOOD IND HI TECH 5: 17-27, 1994; Chupeau M.C., Pautot V. и Chupeau Y., Recovery of Transgenic Trees After Electroporation of Poplar Protoplasts, TRANSGENIC RES 3: 13-19, 1994; Eapen S. и George L., Agrobacterium Tumefaciens Mediated Gene Transfer in Peanut (Arachis Hypogaea L), PI. Cell Rep. 13: 582-586, 1994; Hartman C.L., Lee L., Day P.R. и Turner N.E., Herbicide Resistant Turfgrass (Agrostis Palustris Huds) by Biolistic Transformation, BID-TECHNOLOGY 12: 919-923, 1994; Howe G.T., Goldfarb В. и Strauss S.H., Agrobacterium Mediated Transformation of Hybrid Poplar Suspension Cultures and Regeneration of Transformed Plants, Plant Cell Tissue & Organ Culture 36: 59-71, 1994; Konwar B.K., Agrobacterium Tumefaciens Mediated Genetic Transformation of Sugar Beet (Beta Vulgaris L), J PLANTBIOCHEM BIOTECHNOL 3: 37-41, 1994; Ritala A., Aspegren К., Kurten U., Salmenkalliomarttila M., Mannonen L., Hannus R., Kauppinen V., Teeri Т.Н. и Enari T.M., Fertile Transgenic Barley by Particle Bombardment of Immature Embryos, PLANT MOL BIOL 24: 317-325, 1994; Scorza R., Cordts J.M., Ramming D.W. и Emershad R.L., Transformation of Grape (Vitis Vinifera L) Somatic Embryos and Regeneration of Transgenic Plants, J CELL BIOCHEM: 102, 1994; Shimamoto К., Gene Expression in Transgenic Monocots, CURR OPINBIOTECHNOL 5: 158-162, 1994; Spangenberg G., Wang Z.Y., Nagel J. и Potrykus I., Protoplast Culture and Generation of Transgenic Plants in Red Fescue (Festuca Rubra L), PLANT SCI 97: 83-94, 1994; Spangenberg G., Wang Z.Y., Nagel J. и Potrykus I., Gene Transfer and Regeneration of Transgenic Plants in Forage Grasses, J CELL BIOCHEM: 102, 1994; Wan Y.C. и Lemaux P.G., Generation of Large Numbers of Independently Transformed Fertile Barley Plants, PLANT PHYSIOL 104: 3748, 1994; Weeks J.T., Anderson O.D. и Blechi A.E., Stable Transformation of Wheat (Triticum Aestivum L) by Microprojectile Bombardment, J CELL BIOCHEM: 104, 1994; Ye X.J., Brown S.K., Scorza R., Cordts J. и Sanford J.C., Genetic Transformation of Peach Tissues by Particle Bombardment, JAMER SOCHORTSCI 119: 367-373, 1994; Spangenberg G., Wang Z.Y., Nagel J. и Potrykus I.,
PROTOPLAST CULTURE AND GENERATION OF TRANSGENIC PLANTS IN RED FESCUE (FESTUCA RUBRA L), Plant Science 1994 97: 83-94, 1995.
Поскольку nim1-растения в качестве растений-хозяев могут также обладать чувствительностью к патогенам, в отличие от обычного круга хозяев, из которого они, как очевидно, выпадают, эти растения также имеют большое практическое значение для молекулярного, генетического и биологического изучения взаимосвязей растение-патоген. Кроме того, УЧБ-фенотип nim1-растений также позволяет использовать их для скрининга фунгицидов. nim1-Мутанты, отобранные для определенного хозяина, имеют большое практическое значение для скрининга фунгицидов с помощью этого хозяина и патогенов хозяина. Преимущество состоит в УЧБ-фенотипе мутанта, что позволяет решить проблемы, возникающие вследствие того, что хозяева обладают различной чувствительностью к различным патогенам и патотипам или даже устойчивостью к некоторым патогенам или патотипам.
К патогенам по изобретению относятся, но не ограничены ими, вирусы и вироиды, например, вирус мозаики табака или огурца, вирус круговой пятнистости или вирус некроза, вирус курчавости листьев пеларгонии, вирус крапчатости красного клевера, вирус карликовости куста томата и подобные вирусы, грибы, например, Phythophthora parasitica и Peronospora tabacina, бактерии, например, Pseudomonas syringae и Pseudomonas tabaci, насекомые, такие, как, тли, например, Myzus persicae, и чешуекрылые, например, Heliothus spp., и нематоды, например, Meloidogyne incognita. Методы по изобретению пригодны в отношении многочисленных организмов, вызывающих болезни кукурузы, включая возбудителей ложной мучнистой росы, таких, как Scleropthora macrospora, Sclerophthora rayissiae, Sclerospora graminicola, Peronosclerospora sorghi, Peronosclerospora philippinensis, Peronosclerospora sacchari и Peronosclerospora maydis, ржавчины, таких, как Puccinia sorphi, Puccinia polysora и Physopella zeae, другие грибы, такие, как Cercospora zeae-maydis, Colletotrichum graminicola, Fusarium monoliforme, Gibberella zeae, Exserohilum twcicum, Kabatiellu zeae и Bipolaris maydis, и бактерии, такие, как Erwinia stewartii, но не ограничены ими.
Описание перечисленных последовательностей
SEQ ID NO: 1: геномная последовательность длиной 9919 пар оснований, приведенная на фиг.14.
SEQ ID NO: 2: геномная последовательность длиной 5655 пар оснований, приведенная на фиг.15.
SEQ ID NO: 3: аминокислотная (АК) последовательность NIM-протеина дикого типа, кодируемая/кодирующей последовательностью (cds) SEQ ID NO: 2.
SEQ ID NO: 4: АК последовательность (33-155) риса Rice-1, приведенная на фиг.19.
SEQ ID NO: 5: АК последовательность (215-328) риса Rice-1, приведенная на фиг.19.
SEQ ID NO: 6: АК последовательность (33-155) риса Rice-2, приведенная на фиг.19.
SEQ ID NO: 7: АК последовательность (208-288) риса Rice-2, приведенная на фиг.19.
SEQ ID NO: 8: АК последовательность (33-155) риса Rice-3, приведенная на фиг.19.
SEQ ID NO: 9: АК последовательность (208-288) риса Rice-3, приведенная на фиг.19.
SEQ ID NO: 10: АК последовательность (33-155) риса Rice-4, приведенная на фиг.19.
SEQ ID NO: 11: АК последовательность (215-271) риса Rice-4, приведенная на фиг.19.
Депонирование
Следующие векторные молекулы были депонированы в Американской коллекции типовых культур (American Type Culture Collection, 12301 Parklawn Drive Rockville, MD 20852, U.S.A.) в указанные ниже сроки:
плазмида ВАС-04 была депонирована в АТСС 8 мая 1996 г. под номером АТСС 97543;
плазмида Р1-18 была депонирована в АТСС 13 июня 1996 г. под номером АТСС 97606;
космида D7 была депонирована в АТСС 25 сентября 1996 г. под номером АТС 97736.
Примеры
Пример 1: Выявление NIM1-клонов с помощью клонирования, основанного на картировании: генетическое картирование высокого разрешения и физическое картирование NIM1 в Arabidopsis
1. Растительный материал и выделение nim1-мутантов
Мутанты nim1 выделяли из двух популяций растений Arabidopsis экотипа Ws-О согласно методу, описанному у Delaney и др. (1995), PNAS 92, 6602-6606. Одна мутантная популяция была в форме М 2-библиотеки, происходящей из семян, которые подвергали индуцированному мутатагенезу с помощью этилметансульфоната (ЭМС) (получены от фирмы Lehle, Round Rock, ТХ), а вторая была в форме популяции Т-ДНК, происходящей из семян, полученных из Ohio State University Arabidopsis Biological Resource Center (Columbus, OH).
Основой для скрининга мутантов с неиндуцируемым иммунитетом (nim1) был поиск с использованием подвергнутых индуцированному мутагенезу популяциий растений, у которых устойчивость к вирулентному патогену не могла индуцироваться ИНК (2,6-дихлоризоникотиновая кислота; Metraux и др., 1991, в Advances in Molecular Genetics of Plant-Microbe Interactions, том 1, 432-439, под ред. Hennecke и Verma; Kessmann и др., 1993, в Mode of action of agrochemicals, под ред. Y Honma; Vernooij и др., 1995, Molec. PI. Microbe Interaction 8, 228-234).
Растения из мутантных популяций выращивали с высокой плотностью в больших поддонах в поступающей в продажу смеси для выращивания. Когда растения достигали 2-недельного возраста, поддоны опрыскивали 0,25 мг/мл ИНК. Через 4 дня растения опрыскивали суспензией спор Peronospora parasitica, изолят EmWa (EmWa) с концентрацией от 5×104 до 1×105 спор/мл. Обычно этот гриб вирулентен в отношении экотипа Arabidopsis Ws-O, если устойчивость первоначально не индуцировалась у этих растений с помощью ИНК или аналогичного соединения.
После инкубации в условиях с высокой влажностью выявляли растения с видимыми симптомами болезни, как правило, на 7-й день после заражения. Эти растения не проявляли устойчивости к грибам, несмотря на обработку индуцирующим устойчивость химическим соединением, и поэтому их рассматривали как потенциальные мутантные растения, не имеющие иммунитета, nim-мутанты (non-immunity). Из 360000 растений выявлено 75 потенциальных nim-мутантов.
Эти потенциальные мутантные растения извлекали из ящика для рассады, помещали в условия с низкой влажностью и позволяли дать семена. Растения, полученные из этого семенного материала, подвергали скринингу аналогично тому, как проводили скрининг в отношении чувствительности к изоляту грибов EmWa, и в этом случае также после предварительной обработки ИНК. Потомство растений, которое проявляло симптомы заражения, обозначали как nim-мутанты. Таким образом было выявлено шесть nim-мутантов. Одну линию (nim1) выделяли из популяции Т-ДНК и пять из популяции, обработанной ЭМС.
2. Оценка реакций растений на ИНК и другие химические индукторы устойчивости к болезням
I. Фенотипический анализ nim1
Салициловая кислота (СК) и S-метиловый эфир бензо(1,2,3)тиадиазол-7-карботионовой кислоты (БТК) представляют собой два химических соединения, которые аналогично ИНК индуцируют у растений дикого типа устойчивость к широкому спектру болезней, которую называют системной приобретенной устойчивостью (SAR). Поскольку ИНК не индуцирует устойчивость у nim1- растений, у этих растений также оценивали возникновение устойчивости к болезням в ответ на предварительную обработку СК и БТК как это, в частности, описано у Delaney и др., 1995, PNAS 92, 6602-6606).
Растения опрыскивали 1, 5 или 15 мМ СК или 0,25 мг/мл БТК и через 5 дней заражали инокулятом EmWa (как описано выше в примере 1). Как СК, так и БТК не могли защитить nim1-растения от поражения грибом, что видно по наличию симптомов болезни и росту гриба на этих растениях. Таким образом, nim1-растения нечувствительны к любому из индуцирующих SAR химических соединений, позволяя предположить, что мутация расположена ниже по ходу транскрипции от точки (ек) вступления этих химических соединений в процесс индукции устойчивости.
nim1-Растения также оценивали в отношении их чувствительности к болезням при заражении двумя несовместимыми инокулятами Р. parasitica Wela и Noco (т.е. эти штаммы гриба не вызывали заболевания у растений Ws-O дикого типа), nim1-Растения опрыскивали суспензией конидий, содержащей 5-10×104 спор/мл штамма Wela или Noco, и инкубировали при высокой влажности в течение 7 дней. В отличие от растений дикого типа у nim1-растений развились симптомы болезни в ответ на заражение и Wela и Noco. Симптомы состояли в некротической пятнистости и в пригибании к земле, при наличии определенной споруляции. После окрашивания лактофенолом голубым гифы гриба становились хорошо заметными на листьях nim1-растений. Таким образом, nim1-растения являются чувствительными к несовместимым в норме изолятам Р.parasitica. Эти результаты свидетельствуют о том, что nim1-растения не только дефектны в отношении индуцируемой устойчивости к болезням, но они также дефектны в отношении естественной устойчивости к микроорганизмам, которые в норме не являются для них патогенными.
II. Биохимический анализ nim1
СК, ИНК и БТК индуцируют у Arabidopsis SAR и экспрессию генов SAR, которые включают связанные с патогенезом гены (Pathogenesis Related genes) PR-1, PR-2 и PR-5. Поскольку эти соединения не индуцируют устойчивость к болезням у nim1, с которыми в норме они несовместимы (как описано в примере 1.2, см. выше), эту мутантную линию анализировали в отношении экспрессии гена SAR после обработки СК, ИНК или БТК.
После обработки nim1-растений СК, ИНК или БТК ткани растений собирали и анализировали на накопление РНК генов PR-1, PR-2 и PR-5. После этого общую РНК выделяли из обработанных тканей и подвергали электрофорезу на агарозном геле. Получали трехкратно повторенные блоты геля и каждый из них гибридизовали с зондом для одного из этих трех генов SAR согласно методу, описанному у Delaney и др., 1995, PNAS 92, 6602-6606. В отличие от того, что происходит в случае растений дикого типа, химические соединения не ндуцировали накопление РНК ни в одном из этих трех генов SAR в nim1-растениях, как показано на фиг.1. Совокупность полученных результатов свидетельствует о том, что химические соединения не индуцируют ни SAR, ни экспрессию генов SAR в nim1-растениях.
Поскольку хим