Способ получения амидированного пептида
Иллюстрации
Показать всеИзобретение относится к области биохимии и генной инженерии и может быть использовано в производстве амидированных форм гормонов и других пептидов, применяемых в медицине и сельском хозяйстве. На основании результатов определения последовательностей пептидов, полученных при триптическом переваривании пептидилглицин-альфа-амидирующей монооксигеназы (РАМ) из мозговидной карциномы щитовидной железы крыс, синтезированы олигонуклеотидные последовательности, которые использованы для изолирования полноразмерных ДНК, кодирующих РАМ. Экспрессия полученных фрагментов ДНК в гетерогенных системах позволяет получить рекомбинантную форму РАМ, которая может быть использована в реакции амидирования пептидных субстратов с С-концевым глицином с тем же эффектом, что и нативный фермент. 12 ил., 2 табл.
Реферат
Настоящее изобретение относится к альфа-амидирующим ферментам, производству альфа-амидирующих ферментов и их использованию в производстве альфа-амидированных продуктов путем воздействия ферментов на удлиненные глицином субстраты. В определенных предпочтительных вариантах осуществления альфа-амидирующий фермент согласно изобретению может быть использован при получении полезных альфа-амидированных гормонов и других продуктов, используемых в сельском хозяйстве и медицине, включая кальцитонины, факторы освобождения гормонов роста, пептид, связанный с геном кальцитонина.
Внутриклеточное превращение (расщепление и/или изменение функциональных групп) предшественников нативных белков после их трансляции из кодирующей последовательности нуклеиновых кислот ясно представлено в различных документах.
Обычно клетки млекопитающих или других эукариотов могут осуществлять определенные операции пострансляционной обработки, тогда как прокариоты этого делать не могут. Некоторые прокариоты, например такие как E-coli, широко используются в качестве хозяев для получения белков млекопитающих с использованием технологии рекомбинантной ДНК (rДНК), поскольку они могут легко наращиваться путем ферментации и поскольку они генетически точно охарактеризованы. Однако многие белки млекопитающих, полученные с помощью генной инженерии, требуют посттрансляционной обработки, и это часто заставляет обращаться к использованию сложных химических операций in vitro, которые из-за их высокой стоимости ограничивают широкомасштабное промышленное применение.
Один из видов изменения активности включает в себя амидирование аминокислот, расположенных на карбоксильном конце белков. Многие встречающиеся в природе гормоны и пептиды содержат такое изменение, которое часто является существенным для их биологической активности. Примером является кальцитонин, где замещение неамидированного пролинового остатка на амидированный пролин нативной формы приводит к 3000-кратному уменьшению биологической активности.
Агент, который влияет на амидирование С-конца (альфа), узнает глициновый остаток, который следует непосредственно за аминокислотой, подвергаемой амидированию (R-X-гли, где R - основная последовательность белка, Х - остаток, который подвергается амидированию и гли - глициновый остаток). Глицин расщепляется и фактически отдает аминосоставляющую в предпоследнюю аминокислоту, в результате чего происходит ее амидирование.
Первыми авторами, сообщившими приблизительный молекулярный вес для альфа-амидирующего фермента, были Брэдбари и др. (Narure 298, 1982, 686-88). Они высказали предположение, что минимальная кажущаяся молекулярная масса, определенная на сефадексе G-100, составляет приблизительно 60000 Дальтон (1 Дальтон 1,6601×10-27 кг).
Последующие исследования показали, что молекулярная масса такого фермента, определенная методом гель-фильтрации, составляет от 60000 до 70000 Дальтон. Эти исследования включают в себя работы Хусайни и Тайта С.С. (FEBS. Letters, 152 №2, 1983, 277-281), Эйпер и др. (PNAS, 80, 1983, 5144-5148), Гомес и др. (FEBS Letters, 167, №1, 1984, 160-164) и Кайзер Дж. С. и др. (PNAS 81, 1984, 3228-3232).
Эйпер и др. (PNAS 80, 1983, с.5144-48) сообщил, что помимо молекулярного кислорода требуется два кофактора для максимальной активности фермента амидирования; ими являются аскорбиновая кислота и ион меди (11).
Химическая реакция, приводящая к амидированию карбоксильного конца пептида, требует источника аминогруппы. Брэдбари А.Ф. и др. (Nature 298, 1982, 686-688) показал, что глицин расщепляется и отдает аминосоставляющую предпоследней амино кислоте, приводя к амидированию последней. Требование в отношении глицина как донора аминогруппы было подтверждено другими авторами.
Лэндимор и др. (ВВRС 117, №1, 1983, 289-293) показали, что D-аланин также может служить в качестве донора аминогруппы в реакции амидирования. Проведенная Кайзером и др. (PNAS, 81, 1984, 3228-3232) последующая работа показала две различные ферментные активности в мозгу крысы, которые способны обеспечивать катализацию реакции альфа-амидирования. Образцы с большей молекулярной массой (70000 Дальтон) обладают специфичностью, ограниченной глицином у карбоксильного конца субстрата. Фермент с более низкой молекулярной массой принимает субстрат с β-аланином в качестве С-концевой аминокислоты.
Оптимальное значение рН для альфа-амидирующего фермента, экстрагированного и частично очищенного из свиного гипофиза, по сообщению Брэдбари А.Ф. и Смита Д.Дж. (ВВRС, 112, №2, 1983, 372-377) составляло приблизительно 7.0. Эйппер и др. (PNAS 80, 1983, 5144-5148) подтвердили эти результаты сообщением об оптимальном рН величиной 7,0 для альфа-амидирующего фермента, который был частично очищен от крысиного гипофиза. Они также отметили, что ферментативная активность быстро спадает при рН ниже 6,5 или выше 7,5.
Во всех вышеуказанных публикациях (включенных здесь путем ссылки на них) экстракты и частично очищенные ферментативные смеси содержат дополнительно протеолитические ферменты, способные вызывать разрушение потенциальных субстратов и продуктов, а также и самих альфа-амидирующих ферментов, таким образом замедляя амидирование с помощью таких ферментов пептидов и полипептидов, выделенных очисткой из природных источников или полученных с использованием технологий получения рекомбинантной ДНК.
Ранее измерение амидирующей активности было основано на преобразовании D-субстратов, таких как трипептиды, D-Тир-Вал-Гли-СООН, в D-Тир-Вал-CONH2. Однако использование формы "D" другими исследователями было связано с необходимостью нейтрализовать присутствие посторонних протеолитических ферментов в загрязненных препаратах амидирующих ферментов, использованных этими экспериментаторами. Эти посторонние ферменты могут иметь ярко выраженное протеолитическое влияние на субстраты с L-аминокислотой, одновременно оказывая слабое влияние на D-субстраты. Никто до настоящего времени не смог показать, что их ферментативные препараты с α-амидирующей активностью могут эффективно амидировать любые физиологически соответствующие им субстраты, т.е. L-субстраты, с получением биологически активных альфа-амидированных L-продуктов.
Как показано здесь, препараты согласно настоящему изобретению могут эффективно амидировать L-субстраты, а в отношении D-субстратов иметь активность от 60 до 1000 раз более высокую, чем наивысшая активность, указанная в любом ранее опубликованном источнике, который известен заявителям.
Ферментативные препараты, которые способны амидировать карбоксильные концы пептидов и белков, известны из различных опубликованных источников. Например, Брэдбари А.Ф. (Nature 298, 1982, 686-688) сообщает, что альфа-амидирующая активность присутствует в гипофизе свиней. Препарат из свиного гипофиза был способен преобразовывать пептиды, которые оканчиваются глицином, в соответствующий безглициновый пептидил-амид. Брэдбари и др. указывают, однако, что препараты не будут амидировать пептиды или полипептиды, выделенные очисткой из природных источников.
Отмечается, что описанные препараты содержат другие протеолитические ферменты, которые разрушают природные пептиды или полипептиды, и что неприродный D-тирозиновый остаток был использован специально, чтобы свести к минимуму такое разрушение.
Далее авторы указывают, что несмотря на использование после гомогенизации субклеточного фракционирования и гель-фильтрующей хроматографии для очистки амидирующего фермента, он остается загрязненным протеолитическим ферментом.
Хусайн И. и Тэйт С.С. (FEBS Letters, 152, №2, 1983, 277-281) описывает альфа-амидирующую активность в нейросекреторных железах гипофиза быка.
Эйпер и др. (PNAS, том 80, 1983, стр.5144-5148) сообщили о наличии альфа-амидирующей активности фермента в передней, промежуточной и задней долях крысиного гипофиза, промежуточном гипофизе быка. Однако в этой ссылке также имеется указание на применение синтетического D-Тир-Вал-Гли субстрата для исследования альфа-амидирующей активности и признание наличия загрязнений получаемых препаратов.
Гомес и др. (FEBS Letters 167, №1, 1984, 160-164) определили, что гипоталамус крыс также обладает альфа-амидирующей ферментативной активностью.
Брэдбари А.Ф. и Смит Д.Дж. (Сообщения Восьмого американского симпозиума по пептидам, стр.249-252 (1983), редакторы Хруби В.Дж. и Рич Д.Х.) описывают наличие активности альфа-амидирующего фермента в щитовидных железах крыс.
Мэйнс и др. (Endocrinology, 114, 1984, 1522-1530) сообщили, что клеточная линия, полученная из передней доли гипофиза мыши (АТТ-20), обладала альфа-амидирующей ферментативной активностью, которая явно снижалась с течением времени в культуре.
Некоторые низшие формы, например, морская собака (Squalus acanthias), по сообщению Одонохью Т.Л. и др. (Peptides 3, 1982, 353-395) содержат амидированные пептиды в экстрактах гипофиза. Шеллер Р.Х. и др. (Cell 32, 1983, 7-22) сообщили о наличии сигнальных пептидов амидирования у морских улиток. Несмотря на кажущееся всемирное распространение этого вида активности в природе, имеется мало информации по вопросу о физико-химических свойствах ферментов.
Это может быть связано с очень низкими уровнями присутствия ферментов в этих нейроэндокринных органах.
Наличие амидированных пептидов в определенных тканях не обязательно связано с высокими уровнями альфа-амидирующего фермента. Например, ткань передней части гипофиза крыс обладает высокой альфа-амидирующей активностью, но не содержит подходящих субстратов (Эйпперт и др. PNAS, 80, 5144-5148 /1983/). Ткань задней части гипофиза крыс содержит амидированные пептиды (окситоцин и вазопрессин), но обладает очень низкой альфа-амидирующей активностью (Эйперт и др., Endo, 116, 2497-2504 (1985)/. Поэтому, пока отдельные ткани не будут испытаны в отношении альфа-амидирующей активности, существующие или потенциальные уровни фермента не могут быть предсказаны.
Краткое изложение сущности изобретения
Целью настоящего изобретения является получение альфа-амидирующих ферментативных препаратов, которые могут обеспечить эффективное производство полезных альфа-амидированных продуктов, в т.ч. из субстратов, содержащих L-аминокислоты, например, пептидных или полипептидных субстратов, выделенных очисткой из природных источников или полученных с помощью технологии рекомбинантной ДНК.
Дополнительной целью настоящего изобретения является создание эффективного и экономичного способа производства таких препаратов.
Дополнительной целью является также создание моноклональных антител, специфичных в отношении альфа-амидирующего фермента, иммобилизированных антител, смол для очистки, колонок для проведения хроматографии по иммуносродству и им подобных, которые при использовании указанных антител эффективно очищают альфа-амидирующий фермент.
Дополнительной целью является создание клеток-хозяев с помощью генной инженерии, которые способны обеспечить высокопродуктивную экспрессию альфа-амидирующего фермента.
Дополнительной целью настоящего изобретения является получение альфа-амидированных продуктов из субстратов, содержащих на С-конце глициновый остаток путем обработки их α-амидирующим ферментом по изобретению.
Эти и другие цели станут очевидны из рассмотрения последующего описания. Согласно настоящему изобретению, заявители предусматривают новые альфа-амидирующие ферментативные препараты достаточной чистоты, чтобы проявить удельную альфа-амидирующую активность, по меньшей мере, 25 мЕ на мг белка и предпочтительно выше 50 или выше 150 мЕ/мг протеина. Все единицы удельной активности, указанные здесь, приведены в пересчете на преобразование Дансил-D-Три-Гли-СООН в Дан-сил-D-Тир-Вал-СОNН2. Одна мЕ определяется как величина активности, необходимая для преобразования одного наномоля (нмоль) Дансил-D-Тир-Вал-Гли-СООН в один наномоль Дансил-D-Тир-Вал-Гли-СОNН2 за минуту при 37°С и рН 7,0 в присутствии ионов аскорбиновой кислоты (в конечной концентрации 3 мМ), молекулярного кислорода в молярном избытке относительно субстрата и ионов меди в концентрации достаточной, чтобы получить максимальную активность (обычно около 2 мм, в зависимости от чистоты фермента).
Альфа-амидирующие ферменты согласно изобретению, обладающие активностью пептидил глицин альфа-амидирующей монооксигеназы, способны обеспечивать катализацию превращения пептидильного соединения, имеющего глициновый остаток у, по меньшей мере, С-конца пептидной цепи, в соответствующее пептидил амидное соединение, имеющее аминогруппу вместо глицина. Используемый здесь термин "пептидная цепь" означает любой полипептид, имеющий, по меньшей мере, две аминокислоты, соединенные между собой с помощью пептидной связи. Термин "пептидильное соединение" включает в себя любое соединение, имеющее пептидную цепь. Термин "соответствующий пептидил амид" касается любого продукта реакций, в котором глицин на С-конце пептидной цепи замещен аминогруппой.
Целесообразно, чтобы реакция альфа-амидирования происходила в присутствии кислорода и восстанавливающего вещества. Такие восстановители могут включать в себя, но не ограничиваются этим, аскорбиновую кислоту, соли аскорбиновой кислоты, дигидроксифумарат, металлические соединения цианида, тетрагидроптерин. Было установлено, что определенные кофакторы способствуют течению реакции или замедляют снижение активности фермента. Эти кофакторы включают, но не ограничены этим, каталазу, этанол, калий иодид и ионы меди. Очищенные ферментативные препараты согласно изобретению предпочтительно свободны от протеолитической активности, способной вызывать разрушение альфа-амидирующего фермента, продуктов или реактантов реакции альфа-амидирования, за счет чего они могут обеспечивать катализ реакции альфа-амидирования, когда субстрат и продукт содержат L-аминокислоты.
Как будет подробно описано здесь далее, заявители провели очистку огромного количества образцов специфических белков, которые обладают альфа-амидирующей активностью. "Альфа-амидирующая активность" в том смысле, как она здесь используется, означает любую активность, имеющую тенденцию оставлять только одну аминогруппу в положении, ранее занимаемом глицином на С-конце пептидного субстрата.
"Альфа-амидирующий фермент" в том смысле, как он здесь используется, относится к любому препарату или индивидуальному соединению, которое проявляет альфа-амидирующую активность и к активным гомологам и их фрагментам.
Ферментативные препараты, выделенные в соответствии с настоящим изобретением, могут быть очищены до однородности. Термин "однородный" здесь относится к ферментативным препаратам, проявляющим единственную четко определенную полосу после электрофореза в полиакриламидном геле с Nа-ДС и демонстрирующим единственную последовательность аминокислот в соответствующих исследованиях.
Определенные альфа-амидирующие ферменты, очищенные до однородного состояния в соответствии с настоящим изобретением, проявляли удельные ферментативные активности выше 1500 мЕ/мг белка.
Ферментативные композиции, приготовленные в соответствии с настоящим изобретением, могут быть использованы при производстве полезных альфа-амидированных пептидных продуктов. В качестве субстрата используется пептидное соединение, имеющее глициновый остаток у по меньшей мере С-конца пептидной цепи, где замещение глицина на С-конце аминогруппой приводит к получению требуемого продукта. Субстрат вводится в реакцию предпочтительно в присутствии кислорода и восстанавливающего агента и контакт с ферментативным препаратом, полученным в соответствии с настоящим изобретением, в течение времени, достаточного для преобразования пептида в соответствующий пептидиламид. Скорость реакции в значительной мере зависит от рН, температуры, сродства субстрата, концентрации кофакторов и других параметров, которые могут изменяться известным образом, чтобы оптимизировать реакцию. Реакция обычно должна развиваться в течение времени, выбранного с учетом требуемого процента преобразования (субстрата в продукт). В предпочтительных вариантах осуществления используются кофакторы, такие как те, что рассмотрены выше, чтобы способствовать развитию реакции и/или повышению и стабилизации активности фермента.
Огромное количество полезных продуктов, включая природные гормоны и им подобные, для которых альфа-амидирование предпочтительно или необходимо, может быть получено путем проведения реакции удлиненных глицином пептидильных соединений с альфа-амидирующим ферментативным препаратом в соответствии с настоящим изобретением. Эти продукты включают в себя, но не ограничиваются этим, различные кальцитонины, факторы высвобождения гормонов роста, пептиды, связанные с геном кальцитонина, и им подобные. Гормоны, на которые здесь приводится ссылка, включают в себя разновидности амидированных на С-конце белков, которые проявляют характерную активность указанных гормонов, как это ясно сведущим в этой области специалистам. Например, кальцитонин включает все виды, которые проявляют способность регулировать усвоение кальция в костных тканях, что является характеристикой известных кальцитонинов. Любые нуклеотидные последовательности или последовательности аминокислот, заявляемые здесь, включают в себя последовательности гомологов, в которых замещения, добавления или исключения не оказывают физического влияния на функции, выполняемые указанной последовательностью. Целесообразно, чтобы, по меньшей мере, 40%, а наиболее целесообразно, чтобы 50% аминокислот соответствовали тем, что заявлены. В отношении нуклеотидной последовательности кодоны могут, конечно, быть замещены эквивалентными кодонами, кодирующими те же аминокислоты.
В определенных предпочтительных вариантах осуществления, реакция альфа-амидирования может быть облегчена путем иммобилизации фермента на твердом носителе, который является нерастворимым в водной среде и стойким к разрушению в условиях реакции, и пропускания субстрата через иммобилизованный фермент, предпочтительно в присутствии кофакторов. В том смысле, как здесь используется термин "иммобилизация", он подразумевает связь фермента с подложкой или носителем. Носители, которые могут оказаться полезными для этой цели, включают в себя, но вовсе не ограничены этим, пористое стекло или активированный абсорбент, сефарозу, активированную бромцианом. Иммобилизированные таким образом ферменты могут быть многократно использованы путем удаления реакционной смеси с твердотельного носителя, который продолжает удерживать фермент для последующего использования.
Заявители открыли, что ферментативные препараты в соответствии с настоящим изобретением могут быть получены и очищены с помощью целого ряда способов. Установлено, что мягкая сердцевинная ткань пораженной раком (карциномой) щитовидной железы, предпочтительно полученная от крыс, клеточные линии ее и/или среда культуры клеток из указанных клеточных линий являются особенно желательными источниками исходного нативного альфа-амидирующего фермента. Загрязненный альфа-амидирующий фермент может быть очищен путем воздействия на исходную сырую композицию как хроматография исключения, так и анионобменной хроматографии, предпочтительно сильной анионобменной хроматографии. В том смысле, как здесь используется термин "сильная" анионобменная хроматография, он относится к анионобменной хроматографии, проводимой на любой смоле, которая сохраняет постоянный средний положительный заряд в диапазоне рН 2-12. В определенных предпочтительных вариантах осуществления настоящего изобретения хроматография исключения по размерам предшествует сильной анионобменной хроматографии, а хроматография исключения может предваряться другой анионобменной хроматографией. В одном предпочтительном варианте осуществления одна сильная анионобменная хроматография проводится при основном рН, тогда как другая проводится при кислотном рН.
При использовании проб фермента, очищенных до достижения однородности в соответствии с настоящим изобретением, в качестве антигена были получены моноклональные и поликлональные антитела, специфичные в отношении фермента. Антитела, полученные таким образом из любых видов, могут быть очищены и иммобилизованы на твердом носителе с целью получения колонки для проведения хроматографии по иммуносродству. Эта колонка может быть использована для очистки исходного ферментативного материала.
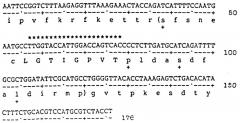
Фермент, очищенный в соответствии с настоящим изобретением, был подвергнут триптическому перевариванию; фрагменты были упорядочены известными способами, и полученные данные о последовательности использовались для синтеза олигонуклеотидных проб. Используя маркированные олигонуклеотидные пробы, полученные таким образом, заявители выделили ген, кодирующий альфа-амидирующий фермент из библиотеки кДНК, полученной из поли А+ РНК, извлеченной из срединной мягкой ткани карциномы щитовидной железы крысы. Этот ген, который более точно характеризован в разделе подробного описания этой заявки, может быть вставлен в соответствующий экспрессионный вектор и перенесен в любую клетку-хозяина, способную его экспрессировать. Соответствующие хозяева включают в себя, но не ограничиваются этим, E.coli дрожжевые штаммы, как S. cereviside, или клетки высших эукариотов, такие, как клеточная линия, из которой фермент был первоначально получен путем очистки. Можно ожидать, что промышленное массовое производство будет существенно облегчено созданием таких микроорганизмов.
Массовое промышленное производство ферментов может быть облегчено и с помощью методов очистки, включающих в себя как вытеснительную хроматографию, так и анионобменную хроматографию, где формы фермента, удерживаемые анионобменной хроматографической колонкой, элюируются с использованием физиологического раствора, имеющего концентрацию около 250 мМ и предпочтительно выше 350 мМ или 500 мМ. При высокой концентрации физиологического раствора даже наиболее сильноудерживаемые виды фермента будут элюированы. Хроматография исключения по размеру должна быть проведена так, чтобы отделять виды с кажущимся молекулярным весом от около 58000 до 67000 дальтон и предпочтительно от около 60000 дальтон до около 65000 дальтон. Очищенный препарат способен амидировать пептидильное соединение, которое было получено путем очистки из природных источников или получено с использованием технологий рекомбинантной ДНК, т.е. пептиды содержали L-аминокислоты.
Краткое описание чертежей
Фиг.1-4 относятся к примеру 1 и поясняют его.
Фиг.5-9 относятся к примеру 2 и поясняют его.
Фиг.10 относится к примеру 7 и поясняет его.
Фиг.11 относится к примеру 4 и поясняет его.
Подробное описание отдельных предпочтительных вариантов
Нами показано, что однородный альфа-амидирующий фермент (пептидил-глицин α-амидирующая монооксигеназа) может быть получен с помощью многоэтапного способа, использующего сочетание хроматографии исключения по размеру и ионообменной хроматографии из экстрактов твердых тканей твердых опухолей, клеточных линий опухолей и тканевой культуры из таких клеточных линий.
Фермент экстрагировали из мозговидной карциномы щитовидной железы крыс (МТС), полученной от крыс Вистар, описанных Рузом В.А. и др. (Endocrinology 1979, 150, №1, 27-32). Эта ткань депонирована как 1У1-10028. Фермент также экстрагировался и из других источников, в частности из линий клеток карциномы щитовидной железы крыс. Линия клеток (СА-77) была получена из опухолей карцином щитовидной железы крыс с помощью нескольких пассажей, как описано Мужинским и др. (JВС 1983, том 258, стр.11678-83). Эта линия клеток депонирована как 1У1-10029. Линия клеток человека (НТТ 54(34)) была разработана Рузом в медицинском центре Кливленда, штат Огайо, с использованием мозговидной карциномы щитовидной железы человека для первичной культуры. Эта линия (НТТ 54(34)) человека была депонирована в качестве экспоната 1У1-10031. (См. "Признание депозита микроорганизмов для целей патентования", свидетельствующее об этих депонентах, и "Будапештские свидетельства" №34, 3 ноября 1983, включенные в настоящее описание полностью путем ссылки).
Было показано, что определенные среды тканевых культур как от линий клеток человека, так и крыс, обладали значительными уровнями активности альфа-амидирующего фермента, указывая, что часть фермента выделена из клеток. Фермент может быть получен и очищен предварительной обработкой исходного материала анионобменной хроматографией. Проба, например, может быть помещена на препаративный анионобменник, такой, как патрон с диэтиламино этилом ("ДЕАЕ"), таким как CUNO 250, поставляемым в продажу фирмой CUNO Корп.
Удаляемая с колонки композиция, обладающая альфа-амидирующей активностью, затем подвергается обработке хроматографией исключения на смоле соответствующего разрешения, например, сверхтонкой колонке Сефакрил S-200, которая поставляется фирмой Фармация Фаин Кемикал.
Обладающая активностью выделенная фракция затем подвергается ионообменной хроматографии с использованием сильной анионобменной матрицы. Смола, которая может быть в этом случае использована, - это сильная анионобменная смола Моно Q НR5/5 фирмы Фармация Файн Кемикал, и для однородной очистки фермента может потребоваться одно или более пропускание через колонку. Колонка Моно Q HR5/5 имеет размер частиц 10 μm, объемы пор 40% и гель, заряженная группа которого СН2-N+(СН3)3, а ионообменная емкость составляет 0,28-0,36 ммоль/мл.
Каждый этап очистки может контролироваться как в отношении содержания белка, так и уровня альфа-амидирующей активности. Эта информация используется для вычисления удельной активности фермента, которая служит индикатором относительно его чистоты.
Пептидил-глицин альфа-амидирующая монооксигеназа, очищенная в соответствии с настоящим изобретением, фермент, полученный из крыс 1У1-10032; фермент, полученный от человека 1У1-10033, имеет кажущийся молекулярный вес около 60000-65000 дальтон (при определении гельфильтрацией).
Фермент был очищен так, что он проявлял удельную ферментативную активность, по меньшей мере, приблизительно 25 мЕ/мг белка и предпочтительно, по меньшей мере, приблизительно 50 мЕ/мг белка. Удельная активность выше около 150 мЕ/мг белка особенно целесообразна. Альфа-амидирующий фермент был также очищен так, что проявлял единственную однородную точно определенную полосу после электрофореза на SDS-PAGE.
Очищенная пептидил-глицин альфа-амидирующая монооксигеназа используется для амидирования альфа-карбоксильной группы полипептида, имеющего концевой глициновый остаток, где глицин работает в качестве донора аминогруппы. Субстрат может быть выделен путем очистки из природных источников, синтезирован из аминокислот или получен с использованием технологии рекомбинантных ДНК. Полипептид с глициновым концом соединяется с кислородом в присутствии эффективного количества фремента. Количество фермента, которое требуется при этом, зависит от нескольких переменных, хорошо известных в этой области, включая в себя в частности, но не ограничиваясь ими, следующие: удельную активность данного ферментативного препарата, количество и химическую природу преобразуемого субстрата, время, в течение которого преобразование должно происходить, температуру и рН реакционной смеси. Сведущим в этой области специалистам известны другие переменные, которые могут оказать влияние на точное количество фермента, требуемого в данной ситуации. Кислород обычно присутствует в молярном избытке в реакции относительно концентрации субстрата. Требуемая концентрация ионов меди может быть обеспечена с помощью любой соли, содержащей анион, которая не оказывает вредного влияния на реакцию. Для фермента, имеющего удельную ферментативную активность только около 1 мЕ/мг белка, максимальное альфа-амидирование имеет место при относительно высокой концентрации (около 4 мМ) ионов меди. Когда чистота фермента увеличивается, требования к концентрации для экзогенного (внешнего) иона меди снижается. Ферментативная активность может быть также усилена за счет наличия аскорбатионов, которые могут быть получены с помощью любой соли аскорбиновой кислоты с катионом, который не оказывает ухудшающего воздействия на реакцию. Для очищенного фермента, имеющего удельную ферментативную активность приблизительно 50 мЕ/мг белка, максимальная активность альфа-амидирования наблюдается при концентрации аскорбата около 5 мМ. Альфа-амидирующая активность может быть увеличена путем добавления каталазы. Оптимальное значение рН для преобразования биологически соответствующего субстрата в амидированные продукты составляет от 6,5 до 7,5.
Моноклональные и поликлональные антитела, направленные против фермента, были получены иммунной реакцией с использованием однородного фермента в качестве антигена у мышей и цыплят, соответственно. Как моноклональные, так и поликлональные антитела были получены и очищены заявителями, как это показано в примере 8. Антитела, специфичные к альфа-амидирующему ферменту по изобретению, хранятся в лабораториях заявителей.
Антитела могут быть иммобилизированы на твердой матрице, нерастворимой в среде, в которой она используется. Целесообразно, чтобы матрица была стойкой к разрушению. Иммобилизация антител облегчает отделение α-амидирующего фермента из природных и/или рекомбинантных источников. Оно осуществляется путем смешивания иммобилизированных антител с исходными препаратами фермента. Антитела будут связывать только молекулы альфа-амидирующего фермента. Загрязняющие белки не соединяются с антителами и легко удаляются путем элюирования или легкого центрифугирования. После удаления загрязнений α-амидирующий фермент может быть удален с иммобилизованных антител путем изменений в ионной силе или рН или путем добавления хаотропных ионов ("Хроматография сродства: Принципы и Способы, Руководство, Фармакия Файн Уппсала, Швеция) и извлечен в высоко очищенном виде.
Фермент был также достаточно очищен, чтобы определить его аминокислотную последовательность. Эта информация использовалась для выделения нуклеиновой кислоты, кодирующей фермент.
Последующее введение данной НК в соответствующий одноклеточный организм или клетку эукариотического хозяина осуществляется с использованием стандартных способов получения рекомбинантной ДНК, например приведенных в работе Маниатис и др. (Молекулярное клонирование: Лабораторное руководство, Колд спринг Харбор, 1982, или By P. редактор. Способы ферментологии, том 68. Академик Пресс 1979, введена в описание путем ссылки). Полученные клетки, содержащие гетерогенную ДНК, кодирующую альфа-амидирующий фермент, обеспечивают производство достаточных количеств фермента, чтобы осуществить посттрансляционное альфа-амидирование in vitro, а также теоретически предполагают возможность их использования для осуществления этой модификации пептида или полипептида in vivo.
Хотя настоящее изобретение описывается предпочтительными вариантами его осуществления, многие изменения и модификации станут очевидны сведующим в этой области специалистам. Предпочтительные варианты осуществления изобретения далее приведены на примерах.
Сравнительные примеры
А. Сравнение испытательных систем для определения удельной активности заявляемых препаратов
Ранее уже использовалось несколько систем испытания активности. Большинство работ, указанных в известном уровне техники, использовали исследования, основанные на преобразовании D-Тир-Вал-Гли в D-Тир-Вал-амид. Это исследование является количественным и использует радиоизотопное соединение (125 I-D-Тир-Вал-Гли), которое смешано с избыточным немеченного материала (D-Тир-Вал-Гли). Измеренное преобразование меченого атома обеспечивает экстраполяцию относительно немеченного материала и это, в свою очередь, позволяет произвести расчет активности.
Хотя это исследование было использовано Заявителями, определения активности заявляемых препаратов были основаны на прямом измерении преобразования Дансил-Тир-Вал-Гли в Дан-сил-Тир-Вал-амид.
Для того чтобы обеспечить сравнение удельной активности препаратов, известных из уровня техники, с теми препаратами, которые заявляются согласно настоящему изобретению, были проведены эксперименты по сравнению систем исследования.
Экспериментальные протоколы сведены следующим образом.
I. Монодансил L-Тир-Вал-Гли
Альфа-амидирующий ферментативный препарат, выделенный из опухоли карциномы щитовидной железы крыс и из среды тканевой культуры, выделенной после культивирования СА-77, был использован в качестве источника фермента в этих экспериментах. Концентрация фермента, использованного во всех экспериментах, оставалась постоянной, за исключением тех случаев, где это указано.
Реакционная смесь для преобразования заместителя монодансила содержала
5 μл фермента
5 μл 30 мМ аскорбата
5 μл 20 мМ CuSO4
5 μл 100 μг/мл панкриатической каталазы быка
5 μл, содержащих 2 наномоля субстрата
25 μл 150 мМ ТЕS рН 7,0
Образцы были подготовлены в двух экземплярах и инкубированы при 37°С в течение 10, 20 и 30 минут. Ферментативная реакция прерывалась при добавлении 10 μл 500 мМ ЕDТА. Субстрат и продукт были разделены с использованием обратно-фазовой хроматографии на оборудовании для жидкостной хроматографии высокого давления фирмы Хюллет Паккард 1090, количественная оценка осуществлялась с использованием интегратора HP-392. Преобразование монодансил L-Тир-Вал-Гли в альфа-амидированный продукт оказалось линейным во времени.
II. 125I-D-Тир-Вал-Гли
D-Тир-Вал-Гли и D-Тир-Вал-CONH2 были иодированы с использованием иода фирмы Пирси Кемикал Компани. Меченый субстрат и продукт были использованы для калибровки катионообменной колонки с сульфил-пропилом. 125I-D-Тир-Вал-Гли добавляли к 650 μ М D-Тир-Вал-Гли и использовали в качестве субстрата. Реакционная смесь для преобразования субстрата содержала
5 μл фермента
5 μл аскорбата (30 мМ)
5 μл 100 μг/мл каталазы
5 μл 20 μM CuSO4
5 μл субстрата, 600 μМ конечной концентрации
25 μл 150 мМ ТЕS рН 7,0
Пробы были инкубированы на 10, 20 и 30 минут при 37°С. Реакция останавливалась путем добавления 500 мМ ЕДТА. Проба была разбавлена 10 мМ натрий-фосфатным буфером рН 5.2 и помещена на катионообменную колонку с сульфил-пропилом. Субстрат не присоединялся к колонке, амидированный продукт был элюирован 500 мМ NaCl. Преобразование меченого субстрата в продукт имело линейный характер во времени.
III. D-Тир-Вал-Гли
Условия реакций, использованные для амидирования D-Тир-Вал-Гли, были идентичны тем, что описаны для дансилового и иодированного субстратов. Концентрация субстрата в реакционной смеси была 650 μМ. Разделение субстрата и продукта достигалось градиентной элюацией после НРLС с обращенной фазой, использующей систему HP-1090 для жидкостной хроматографии. Вытекающая из колонки жидкость контролировалась на длине волны 280 нм. Уровень чувствительности для этого исследования значительно ниже, чем чувствительность при исследовании дансиловых или иодированных субстратов. Для того чтобы соответствовать этому более низкому уровню чувствительности, реакции альфа-амидирования осуществлялись в течение более длительных отрезков времени и/или с увеличенным количеством альфа-амидирующего фермента.
Анализ данных фракционного преобразования 125I-D-Тир-Вал-Гли в 125I-D-Тир-Вал-амид и Дансил-Тир-Вал-Гли в дансил-Тир-Вал-амид показывает, что в каждый момент времени приблизительно в 1,55 раза больше иодинированного субстрата было преобразовано, чем дансилового субстрата. Таким образом, при сравнении системы исследования, известной из уровня техники, с системой исследования с дансиловым субстратом, используемой Заявителем, уже должен быть использован коэффициент преобразования приблизительно 1,5.
Кроме того, был использован более строгий кинетический анализ для сравнения исследования с дансил-Тир-Вал-Гли (Заявителей) с исследованием D-Тир-Вал-Гли (ранее известный). Этот анализ показал:
| Субстрат | Кm | Vмакс |
| D-Тир-Вал-Гли/ранее известный/ | 37 | 31 |
| Дансил-Тир-Вал-Гли /Заявителей/ | 1,7 | 21 |
Как можно видет