Способ получения растворимого фибрин-мономера
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к способу получения растворимого фибрин-мономера, который может быть использован для определения тканевого активатора плазминогена и/или его ингибитора. Способ состоит в обработке фибриногена тромбиноподобным ферментом анцистрон, выделенным из яда змеи Agkistrodon hays (семейство Agkistrodon; род halys), обитающей на территории РФ, и в последующем растворении образовавшегося поперечнонесшитого фибрина путем диализа против 0,01 н. HCl и полученный прозрачный раствор содержит очищенный ДезАА фибрин-мономер. Изобретение обеспечивает доступность и снижение стоимости используемого тромбиноподобного фермента, повышение ТАП-стимулирующего эффекта полученного ДезАА фибрин-мономера. 3 ил.
Реферат
Изобретение относится к области медицины, в частности к способу получения растворимого фибрин-мономера, который может быть использован для определения тканевого активатора плазминогена и/или его ингибитора.
Известно, что тканевый активатор плазминогена (ТАП), являющийся одним из основных физиологических активаторов фибринолитической системы, эффективно активирует плазминоген только в присутствии фибрина. Исследования показали, что растворимый фибрин-мономер также является мощным стимулятором активации плазминогена под действием ТАП. Использование растворимого стимулятора создает возможность определения активности ТАП по скорости активации плазминогена в гомогенной среде. Разработаны чувствительные способы определения функциональной активности ТАП и его ингибитора (ПАИ-1), которые основаны на сопряжении реакции активации плазминогена ТАП в присутствии растворимого стимулятора (фибрин-мономера или ВrСN-фрагментов фибриногена) и реакции гидролиза хромогенного субстрата образующимся плазмином [Chmielewska J. and Wiman В., Clin. Chem., 1986, 32 (3), 482-485; Verheijen J.H. et al. Thrombos. Haemost, 1982, 48 (3), 266-269]. Эти способы широко используются за рубежом для диагностики заболеваний пациентов, характеризующихся склонностью к тромбозам, тромбоэмболиям и другим тромботическим нарушениям, а также для контроля активности ТАП во время тромболитической терапии.
Наиболее близким к заявляемому способу по своим характеристикам является способ получения растворимого фибрин-мономера обработкой раствора фибриногена (с концентрацией 20 мг/мл) тромбино-подобным ферментом батроксобином (0,05 BAU/мл) из яда змеи Bothrops atrox [Wiman В. and Ranby M. Determination of soluble fibrin in plasma by a rapid and quantitative spectrophotometric assay, Thrombos. Haemost., 1986, 55(2), 189-193]. Суть способа-прототипа заключается в том, что батроксобин расщепляет аминотерминальные связи Арг15-Гли16 в А-α-цепях фибриногена. В результате отщепления двух фибринопептидов А образуется фибрин-мономер, который спонтанно полимеризуется с образованием поперечнонесшитого полимера фибрина. Через 18-20 часов реакции образовавшийся сгусток растворяют добавлением равного объема 7 М мочевины. Полученный раствор фибрин-мономера (дез-АА-фибрин-мономера) в 3,5 М мочевине хранят в виде замороженных образцов при -70°С.
Существенным недостатком известного способа получения растворимого фибрин-мономера является малая доступность и дороговизна батроксобина и аналогичных импортных тромбиноподобных ферментов, выделенных из яда змеи Bothrops atrox, а также то, что этот вид змеи не обитает на территории Российской Федерации. Это существенно затрудняет получение растворимого фибрин-мономера для определения ТАП и его ингибитора в клинико-диагностических лабораториях Российской Федерации.
Задачей настоящего изобретения является упрощение способа получения реагента, необходимого для лабораторной диагностики нарушений фибринолиза, путем применения нового доступного тромбиноподобного фермента и исключение низкомолекулярных веществ, в частности мочевины, в полученном реагенте. Отсутствие мочевины в полученном реагенте позволяет исключить его влияние на определение ТАП при вариации концентрации фибрин-мономера и в результате повысить чувствительность определения активатора.
Для решения поставленной задачи предлагается способ получения растворимого фибрин-мономера путем обработки фибриногена новым тромбиноподобным ферментом с последующим растворением поперечнонесшитого фибрина путем диализа в кислой среде. Согласно изобретению в качестве тромбино-подобного фермента используют фермент анцистрон (Анцистрон® производства ООО “Технология-Стандарт”, Россия), выделенный из яда змеи Agkistrodon halys (семейство Agkistrodon; род halys), обитающей на территории РФ. Применение диализа в кислой среде позволяет не только растворить фибрин, но и очистить полученный реагент фибрин-мономера от примеси низкомолекулярных веществ.
Согласно заявляемому способу для получения растворимого фибрин-мономера используют раствор фибриногена с концентрацией 5-20 г/л. Концентрацию анцистрона варьируют в интервале 0,01-0,1 NIH/мл. Реакцию превращения фибриногена в поперечнонесшитый фибрин проводят при рН 7,2-8,3 и при температуре 25-37°С.
Реактивы и оборудование
1. Фибриноген человека, лиофилизирован, производитель 000 “Технология-Стандарт”, Россия.
2. Анцистрон® (тромбино-подобная белковая фракция из яда змеи Agkistrodon halys), лиофилизирован, производитель ООО “Технология-Стандарт”, Россия.
3. Спектрофотометр UV-1202, производитель “Shimadzu”, Германия.
4. рН-метр, “рН 29”, производитель “Radiometer”, Дания.
5. Магнитная мешалка, ММЗМ, Россия.
Дополнительные реактивы, необходимые для выполнения примеров практического применения заявляемого способа
1. Рекомбинантный ТАП (3-й Международный стандарт N 98/714, National Institute of Biological Standarts and Control, NIBSC, Великобритания) с активностью 560000 МЕ/мг, лиофилизирован.
2. Глу-плазминоген, получен в лаборатории кафедры химической энзимологии химического факультета МГУ им. М.В. Ломоносова, используя известный способ.
3. Тритон-Х-100, производитель “Koch-Light Laboratories Ltd”, Великобритания.
4. Пептидный субстрат плазмина НСО-Ала-Фен-Лиз-п-нитроанилид, гидрохлорид (APL-pNA), производитель ООО “Технология-Стандарт”, Россия.
5. Батроксобин, реагент из яда змеи Bothrops atrox фирмы Pentapharm®AG, Швейцария.
6. Полистирольные 96-луночные микропланшеты, производитель ООО “Биомедикал”, Россия.
7. Микропланшетный ридер Anthos 2020, производитель “Anthos Latec Instruments”, Австрия.
8. Термостатированная качалка Shaker ST3 производитель “ELMI”, Эстония.
Пример 1
К 1 мл раствора фибриногена человека (20 мг/мл) в 0,15 М Трис-НСl буфере, рН 7,2, добавляют 40 мкл раствора анцистрона в воде с активностью 0,25 NIH/мл. Реакционный раствор инкубируют при 37°С в течение 6 часов. Образовавшийся гель поперечнонесшитого полимера фибрина диализируют против двух смен 0,01 н. раствора HCl (250 и 500 мл соответственно) при 4°С. К концу диализа раствор становится прозрачным в результате растворения геля поперечнонесшитого фибрина. Концентрацию полученного раствора фибрин-мономера (дез-АА-фибрин-мономера) определяют по его оптической плотности при 280 нм (Е1% 280=16,2) и хранят при 4°С. В этих условиях раствор фибрин-мономера остается прозрачным и полностью сохраняет свои ТАП-стимулирующие свойства более 6 месяцев.
Пример 2
К 1 мл раствора фибриногена человека (5 мг/мл) в 0,15 М Трис-НСl буфере, рН 8,3, добавляют 40 мкл раствора анцистрона с активностью 2,5 NIH/мл. Реакционный раствор инкубируют при 25°С в течение 8 часов. Образовавшийся гель поперечнонесшитого полимера фибрина диализируют так, как описано в примере 1.
Пример 3
К 1 мл раствора фибриногена (10 мг/мл) в 0,15 М Трис-НСl буфере, рН 7,4, добавляют 40 мкл раствора анцистрона в воде (2,5 NIH/мл) и инкубируют в течение 5 часов при 37°С. Образовавшийся гель поперечнонесшитого фибрина разрушают механически, центрифугируют при 15000 g в течение 15 минут и измеряют оптическую плотность супернатанта при 280 нм. Остаточная концентрация непрореагировавшего фибриногена в супернатанте не превышает 3-5% после 5 часов реакции.
Пример 4
Для сравнения реагентов фибрин-мономера, полученных заявляемым способом и способом-прототипом, изучают их стимулирующий эффект на активацию плазминогена ТАП. Реакцию активации плазминогена ТАП проводят в присутствии хромогенного субстрата плазмина (HCO-Ala-Phe-Lys-p-nitroanilide, APL-pNA). Скорость этой сопряженной реакции измеряют по скорости образования п-нитроанилина при 405 нм. В качестве субстрата ТАП используют Глу-плазминоген, выделенный из плазмы крови человека аффинной хроматографией на Лиз-сефарозе 4В по методике, описанной в работе [Castellino F.J. et al. Methods Enzymol., 1981, 80, 365-378]. В качестве стимулятора ТАП используют фибрин-мономер, полученный заявляемым способом с помощью анцистрона (ФМА, раствор в 0,01 н. HCl) или фибрин-мономер, полученный по способу-прототипу [Wiman В. and Ranby M., Thrombos. Haemost., 1986, 55(2), 189-193] с помощью батроксобина (ФМБ, раствор в 3,5 М мочевине).
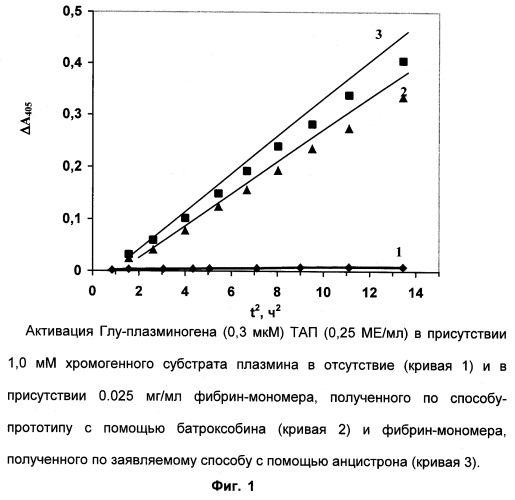
В каждую ячейку 96-луночной планшеты вносят 100 мкл раствора 0,1 М Трис-ацетатного буфера (рН 8,3), содержащего 0,6 мкМ Глу-плазминогена, 2,0 мМ APL-pNA, 0 или 0,025 мг/мл ФМА или ФМБ, 0,15 М NaCl и 0,1% Тритона Х-100. После инкубации закрытой планшеты в течение 10-15 мин в термостатируемой качалке (ELMI, ST 3) в ячейки вносят 100 мкл раствора рекомбинантного ТАП (0,5 МЕ/мл) в том же буфере. В контрольную ячейку вместо раствора ТАП добавляют 100 мкл буфера. Каждый тест повторяют 3-4 раза. В ходе инкубации планшеты при 37°С и слабом покачивании измеряют оптические плотности при 405 нм образцов (А405) и контроля (А0 405, фоновый гидролиз без ТАП) через каждые 15-20 мин в течение 2-4 часов. Строят зависимость ΔA405 (A405-A0 405) от t2. Скорость сопряженной реакции пропорциональна концентрации ТАП. Из фиг.1 видно, что при равной концентрации ТАП скорость активации Глу-плазминогена в присутствии обоих фибрин-мономеров значительно выше, чем в их отсутствие. Однако стимулирующий эффект фибрин-мономера, полученного заявляемым способом, по активации Глу-плазминогена ТАП не уступает, а даже превосходит стимулирующий эффект фибрин-мономера, полученного способом-прототипом.
Пример 5
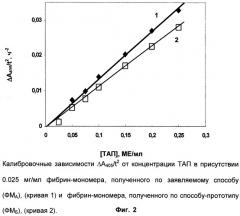
Эксперименты по примеру 4 проводят в присутствии 0,025 мг/мл ФМА или ФМБ и различных концентраций ТАП. Концентрацию рекомбинантного ТАП в ячейках варьируют в интервале 0,05-1,0 МЕ/мл. В контроле вместо раствора ТАП добавляют 100 мкл буфера. Каждый тест повторяют 3-4 раза. В ходе инкубации планшеты при 37°С и слабом покачивании измеряют оптические плотности образцов (А405) и контроля А0 405 (фоновый гидролиз) через каждые 15-20 мин в течение 2-4 часов. Из зависимостей ΔА405 (А405-А0 405) от t2 определяют тангенсы углов наклона для различных концентраций ТАП. Получают калибровочные зависимости скорости сопряженной реакции (ΔА405/t2) от концентрации ТАП в присутствии ФМА и ФМБ (фиг.2).
Пример 6
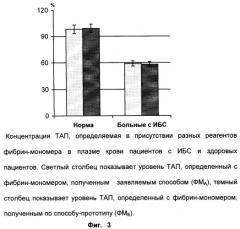
На фиг.3 представлены результаты определения ТАП сопряженным методом, описанным в примере 4, с применением реагентов фибрин-мономера, полученных заявляемым способом (ФМА) или способом-прототипом (ФМБ), в плазме крови пациентов с ишемической болезнью сердца (ИБС) и здоровых людей. Как видно из фиг.3, результаты определения ТАП в присутствии двух фибрин-мономеров практически не отличаются друг от друга. У больных с ИБС концентрация ТАП была равна 58,9±1,8% (n=22) при использовании фибрин-мономера, полученного заявляемым способом. У тех же 22 больных с ИБС концентрация ТАП была равна 57,4±1,9% при использовании фибрин-мономера, полученного способом-прототипом, и статистически не отличалась (Р>0,5) от концентрации ТАП, полученной с применением ФМA. Кроме того, из фиг.3 следует, что результаты определения ТАП с применением двух фибрин-мономеров у здоровых лиц статистически не отличаются друг от друга (Р>0,5). У здоровых лиц концентрация ТАП была равна 99,8±4,8% (n=35) при использовании ФМA. У тех же 35 здоровых концентрация ТАП была равна 97,4±4,3% при использовании ФМБ. Коэффициент линейной корреляции (r) между определениями с использованием разных фибрин-мономеров был равен 0,97 (Р<0,001).
Данный пример иллюстрирует, что фибрин-мономер, полученный заявляемым способом, не уступает по эффективности фибрин-мономеру, полученному по способу-прототипу, при определении ТАП в плазме крови пациентов.
Таким образом, заявляемый способ получения фибрин-мономера из фибриногена позволяет заменить дорогой импортный тромбиноподобный фермент батроксобин на более дешевый и доступный отечественный тромбиноподобный фермент анцистрон. Использование диализа в кислой среде для растворения поперечнонесшитого полимера фибрина позволяет получить раствор фибрин-мономера, не содержащий 3,5 М мочевину. Поскольку ТАП-стимулирующий эффект фибрин-мономера, полученного заявляемым способом, не уступает, а даже превосходит ТАП-стимулирующий эффект фибрин-мономера, полученного способом-прототипом, то фибрин-мономер, полученный по заявляемому способу, может быть использован для определения ТАП и/или его ингибитора при диагностике тромбоэмболических заболеваний, а также контроля его уровня в ходе инфузии ТАП при тромболитической терапии пациентов.
Способ получения растворимого дезАА фибрин-мономера путем обработки фибриногена тромбиноподобным ферментом с последующим растворением полученного поперечнонесшитого полимера фибрина, отличающийся тем, что в качестве тромбиноподобного фермента используют фермент, выделенный из яда змеи Agkistrodon halys (анцистрон), а поперечнонесшитый полимер фибрина растворяют путем диализа против 0,01 н. раствора НСl и полученный прозрачный раствор содержит очищенный деэАА фибрин-мономер.