N-(2-арилпропионил)сульфонамиды и содержащие их фармацевтические препараты
Иллюстрации
Показать всеИзобретение относится к новым N-(2-арилпропионил)сульфонамидам формулы 1
где R2 означает фенил, тиофенил, необязательно замещенный 1-3 заместителями, независимо выбранными из галогена, С1-С4-алкила, фенила, фенокси, бензила, бензоила, С1-С7-ацилокси, 2-тиеноила или 1-оксо-2-изоиндолила;
R означает линейный или разветвленный C1-C16-алкил, трифторметил, циклогексил, о-толил, 3-пиридил, п-цианофенилметил, п-аминометилфенилметил, 3-циано-1-пропил, алкоксиэтиленовую группу СН3-(CH2)ni-(OCH2CH2)mi-, в которой ni и mi равно целому числу от 1 до 3, или группу P1P2N-CH2-CH2-, в которой P1 и Р2 представляют собой независимо Н, C1-С3-алкил, бензилоксикарбонил, α-, β- или γ-пиридокарбонил, карбоксикарбонил или карбалкоксикарбонил, или P1 и P2, вместе с атомом азота, к которому они присоединены, образуют морфолино;
R’ означает Н или линейный или разветвленный C1-С3-алкил,
или их соли с сильными и средними основаниями.
Соединения формулы 1 обладают ингибирующей активностью в отношении индуцированных интерлейкином-8 хемотаксиса и дегрануляции нейтрофилов и могут быть использованы в фармацевтической композиции для профилактики и лечения поражений ткани. 4 н. и 9 з.п. ф-лы, 2 фиг., 2 табл.
Реферат
Настоящее изобретение относится к N-(2-арилпропионил)сульфонамидам и фармацевтическим препаратам на их основе, используемым для профилактики и лечения поражений тканей благодаря способствованию рекрутингу полиморфно-ядерных нейтрофилов (PMN лейкоцитов) в очаги воспаления.
Хемотаксисом называется клеточная реакция, которая вызывает миграцию специфических клеток крови (макрофагов, гранулоцитов, полиморфно-ядерных нейтрофилов) по градиенту концентрации стимулирующего агента, которая следует за химическим стимулом (хемотаксином). Наиболее характерными хемотаксинами являются продукты расщепления комплемента С5а, некоторые N-формилпептиды, образующиеся при лизисе бактериальной поверхности, или синтетической природы, такой как формил-метионил-лейцил-фенилаланин (f-MLP), и главным образом ряд цитокинов, приписываемых интерлейкину ИЛ-8. Интерлейкин ИЛ-8 является эндогенным хемотаксическим фактором, который вырабатывается большинством содержащих ядро клеток (фибробластами, макрофагами, эндотелиальными и эпителиальными клетками) в ответ на обработку TNF-a (фактором некроза опухоли), интерлейкинами IL-la и IL-lfi и липополисахаридами стенок бактериальных клеток (LPS), также как и собственно нейтрофилами в случае, когда они подвергаются воздействию LPS и N-формилпептидов бактериальной природы (fMPL-подобные пептиды). Этот хемотаксический фактор [также известный как фактор активации нейтрофилов (NAF), хемотаксический фактор Т клеток, производимый моноцитами хемотаксический фактор нейтрофилов (MDNCF)] регулирует ряд ИЛ-8-подобных хемокинов [GROa, fi, V и NAP-2], которые связываются с ИЛ-8 рецептором (Chanq et al., J. Immunol., 148, 451, 1992).
Нейтрофилы под воздействием хемотаксических факторов претерпевают изменение предрасполагающей к миграции и активации формы, которое заканчивается реакцией дегрануляции, поглощением кислорода и генерацией активных форм кислорода.
Все эти события, которые происходят в течение нескольких секунд с момента воздействия хемотаксинов на нейтрофилы, биохимически характеризуются временным увеличением внутриклеточного уровня ионов Са2+, ионов Na+ и цAМФ с последующими изменениями мембранного потенциала. Увеличение вызванной хемотаксином внутриклеточной концентрации ионов Са2+ сопровождается активацией G белков, фосфолипаз С и A2 и каскада арахидоновой кислоты с образованием продуктов циклооксигеназы и липооксигеназы (смотри L.Наrvath в Regulation of neutrophil chemotaxis, Ann. Reports in Med. Chem., page 233-235, vol.24, 1992, и цитированную там литературу). Нейтрофилы являются ранней защитой от бактериальных инфекций из-за их способности к быстрой миграции из периферической крови через места соединения эндотелия и межклеточного вещества тканей в участки, где они оказывают свое специфическое действие, т.е. разрушают микроорганизмы, удаляют поврежденные клетки и стимулируют восстановление тканей (М.A.Goucerot-Podlcalo et al., Pathol. Biol. (Paris), 44, 36, 1996).
В специфических патологических условиях, характеризуемых усилением рекрутинга нейтрофилов, благоприятное по сути восстанавливающее здоровье действие нейтрализуется усилением повреждения ткани, которое замедляет лечебный процесс и в наиболее серьезных случаях приводит к смерти пациента.
Совсем недавно неожиданные убедительные данные подтвердили гипотезу о том, что поражения при ишемии и реперфузии и гипероксическое повреждение легких связаны с присутствием активированных нейтрофилов и что поражение клетки напрямую зависит от этой активации. Это доказано на экспериментальных моделях [N.Sekido et al., Nature, 365, 654, 1993, и Т.Matsumoto et al., Lab. Investig., 11, 119, 1997] и клинико-патологическими исследованиями у людей [А.Mazzone et al., Recent Prog. Med., 85, 397, 1994; Т.С.Fisher и H.J.Meiselmann, Thromb. Res., 74 (Suppl.1), S21-S34, 1994; G.Ricevuti et al., Atheroscl., 91, 1, 1991], исходя из которых повреждения клетки напрямую и строго связывают со степенью и распространением инфильтрата. PMN лейкоцитов, причем все чаще предполагается, что цитокин ИЛ-8 является наиболее специфическим и мощным активатором. При патогенезе таких состояний среди различных активирующих нейтрофилы хемотаксических факторов, таких как С5а, PAF, LTB4, которые опосредуют прямую миграцию этих нейтрофилов, ИЛ-8 может играть важную роль также в том, что его выработка мононуклеарными фагоцитами может опосредовать миграцию других клеток воспаления и путем выработки ИЛ-8 заново, и путем индуцирования его выработки близлежащими неиммунными клетками [А.Р.Metiko et al., J Clin. Invest, 90, 791 (1992)].
У пациентов, пораженных острой дыхательной недостаточностью (ARDS), увеличенное присутствие нейтрофилов в дыхательных путях и в легочных жидкостях (которое характеризует заболевание) в значительной мере коррелирует с высокой концентрацией цитокина. С другой стороны, концентрации NAP-1/ИЛ-8, присутствующие в легочных эдемных жидкостях этих пациентов, соответствуют оптимуму концентраций, требующихся для индукции хемотаксиса нейтрофилов (Е.J.Miller et al., Am. Rev. Respir. Dis., 146, 437, 1992); в заключение, явно существует строгая зависимость между смертностью и высокими концентрациями ИЛ-8 в альвеолярных жидкостях (A.Kurdowska et al., J. Immunol., 157, 2699, 1996).
В этом контексте особенно значимыми являются результаты, полученные с использованием аНТН-ИЛ-8 антител, способных нейтрализовывать эффекты цитокинов на моделях острой дыхательной недостаточности и эндотоксиемического повреждения легких путем внутритрахеального введения малыми дозами инактивированного нагреванием Streptococcus pyogenes (ОК-432) (К.Yokoi et al., Lab. Invest., 16, 375, 1997).
У пациентов, пострадавших от острого инфаркта миокарда, в течение 22 часов с момента его начала было показано значительное увеличение ИЛ-8 в сыворотке крови (13-1100 нг/л). Это увеличение может играть первостепенную роль в развитии повреждения миокарда благодаря высокому стимулирующему влиянию цитокина на нейтрофилы и роль последних в повреждении ткани (Y.Abe et al., Br.Heart J., 70, 132, 1993), которая в клиническом развитии случая ишемии явно зависит в большей степени от процесса реперфузии, чем от времени продолжительности ишемии.
Недавно было доказано, что воздействие анти-ИЛ-8 антител уменьшает эдему головного мозга и распространение области повреждения на модели реперфузии при временной очаговой ишемии головного мозга кролика (Т.Matsumoto et al., Lab. Invest., 77, 119, 1997). Значительное увеличение ИЛ-8 в ткани головного мозга, наблюдаемое на этой модели, свидетельствует о том, что и локальная продукция ИЛ-8 в перфузированных тканях и его присутствие в активированных нейтрофилах в стенках сосудов обуславливают степень повреждения ткани.
Считается, что рецепторное взаимодействие между нейтрофилом и хемотаксическим агентом имеет решающее значение для хемотаксиса; ИЛ-8 участвует в нем через два различных рецептора (CXCR1 и CXCR2), присутствующих на поверхности нейтрофилов человека и некоторых Т клетках (L. Xu et al., J.Leukocyte Biol., 57, 335, 1995). Это может быть доказано путем использования N-(2-гидрокси-4-нитрофенил)-N’-(2-бромфенил)мочевины, которая избирательно ингибирует связывание ИЛ-8 с мембранным рецептором нейтрофилов CXCR2 с IC50 22 нм (J.R.White et al., J. Biol. Chem., 273, 10095, 1998). Следствием является блокировка хемотаксиса нейтрофилов человека, стимулированных ИЛ-8 (1 нМ) и GROa (10 нМ) со сходными значениями IC50 (20-60 нМ) [но не в случае хемотаксиса, стимулированного компонентом комплемента С5а в диапазоне концентраций от 50 до 330 нМ], а не задержка мобилизации внутриклеточных ионов Ca2+, индуцированная ИЛ-8 или оптимальными концентрациями LIB4, у тех же самых нейтрофилов человека.
Использование фенилмочевин в лечении интерлейкин-8(ИЛ-8)-опосредованных патологий было недавно заявлено в изобретении WO 98/07418 (28.02.1998).
В ходе исследований, направленных на выявление вклада, который отдельные энантиомеры (S) и (R) кетопрофена дают в противовоспалительной активности рацемата, и их роли в модуляции цитокинов (Р.Ghezzi et al., J. Exp. Pharm. Ther., 1998 в печати), к удивлению было обнаружено, что соли отдельных энантиомеров с хиральными или нехиральными органическими основаниями в зависимости от дозы ингибировали увеличение внутриклеточной концентрации ионов Ca2+ ([Ca2+]i), индуцированного ИЛ-8 у PMN лейкоцитов (заявка на выдачу патента Италии №MI 98A000146 (28.01.1998), принадлежащая настоящему заявителю). Одно конкурентное исследование с ионами La (лантана) доказало, что эффекты ингибирования этими солями ответа нейтрофилов на ИЛ-8 являлись ни следствием рецепторного взаимодействия, ни ослабленной экспрессии некоторого количества рецепторов ИЛ-8, а результатом избирательного блокирования действия катионов Ca2+ в количестве, достаточном для предупреждения хода событий, типичного для вызванной цитокином активации нейтрофила: хемотаксиса и дегрануляции нейтрофилов (с высвобождением эластазы, катепсина и других ферментов). Более того, отдельные энантиомеры ингибируют хемотаксис и увеличение [Ca2+]i, индуцированное С5а и fMLP, хотя и менее эффективно.
Основным отличием между двумя энантиомерами является более низкая эффективность (по крайней мере в 10-100 раз) энантиомера (R) в качестве ингибитора СО ферментов.
Поэтому по сравнению с энантиомером (S) энантиомер (R) обладает более слабой ингибирующей активностью по отношению к синтезу простагландинов, которые, в свою очередь, оказывают ингибирующее и контролирующее действие по отношению к высвобождению цитокинов, которые, подобно TNF-a, способствуют усилению величины провоспалительных эффектов, типичных для нейтрофилов. Как следствие, энантиомер (S) является менее терапевтически эффективным в лечении нейтрофил-зависимых патологий и воспалительных состояний, таких как псориаз, идиопатический фиброз легких, острая дыхательная недостаточность, реперфузионные повреждения и гломерулонефрит.
Сейчас было обнаружено, что N-ацилсульфонамиды 2-арилпропионовых кислот являются эффективными ингибиторами хемотаксиса и дегрануляции нейтрофилов, индуцированных ИЛ-8. Сходные свойства также были доказаны для R(2)-[(4-изобутил)фенил]пропионамида (описанного в W.H.Pirke and J.Me Cune, J.Chromatography, 469, 67, 1989). Поэтому изобретение также относится к их использованию в лечении нейтрофил-зависимых патологий.
Более конкретно настоящее изобретение относятся к новым N-(2-арилпропионил)сульфонамидам общей формулы (1)
в которой R2 является арильной группой, R является линейной или разветвленной С1-С16-алкильной группой, трифторметильной, циклогексильной, орто-толильной, 3-пиридильной 2-пиридилэтильной, пара-цианфенилметильной, пара-аминофенилметильной,
3-циан-1-пропильной, 4-аминобутильной группой, алкоксиэтилен СН3-(CH2)ni-(OCH2CH2)mi-группой, в которой ni равно 0 или 1 и mi равно целому числу от 1 до 3, или P1P2N-CH2-CH2-группой, в которой P1 и P2 независимо являются водородом, C1-С3-алкильной, бензилоксикарбонильной, α -, β - или γ -пиридокарбонильной, карбоксикарбонильной или карбалкоксикарбонильной, или P1 и Р2, вместе с атомом азота, с которым они связаны, образуют фталимидный, пиперидиновый, морфолиновый остаток;
R’ является водородом или линейной или разветвленной C1-С3-алкильной группой, предпочтительно водородом.
"Арильная группа" предпочтительно означает фенильную группу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или различными, выбранными из атомов галогенов, С1-С4-алкильной, С1-С4-алкоксильной, гидроксильной, С1-С7-ацилоксильной, цианогруппы, нитрогруппы, аминогруппы, C1-С3-ациламино, галоген-С1-С3-алкильной, галоген-С1-С3-алкоксигруппы, бензоильной группы или арильного радикала известных противовоспалительных 2-арилпропионовых кислот, таких как ибупрофен, кетопрофен, напроксен, супрофен, карпрофен, пирпрофен, фенопрофен.
Предпочтительными арильными остатками 2-арилпропионовой кислоты являются 4-изобутилфенил, 3-бензоилфенил, 5-бензоил-2-ацетоксифенил, 3-феноксифенил, 5-бензоилтиен-2-ил, 4-тиеноилфенил, 1-оксо-2-изоиндоленилфенил, 3-хлор-4-(2,5-дигидро-1Н-пиррол-1-ил)фенил, 6-метокси-β -нафтил, 5-бензоил-2-тиофенил, 1-гидроксифенил или остаток формулы
в котором А является бензильной, бензоильной или N-гидроксибензилиминовой, 1-гидроксифенил-1-метильной группой, В является водородом, гидроксигруппой, C1-С3-ацилоксигруппой или аминогруппой.
R2 предпочтительно является арильным остатком известной противовоспалительной 2-арилпропионовой кислоты, как описано выше.
Особенно предпочтительными значениями PR2 являются 4-(2-метилпропил)фенил, 3-феноксифенил, 2-[4-(1-оксо-2-изоиндолинил)фенил], 5-бензоилтиен-2-ил, 4-тиеноилфенил.
C1-С3-ацилоксигруппой предпочтительно является ацетильная группа; линейной или разветвленной С1-С16-алкильной группой предпочтительно является метильная, гексильная, додецильная или гексадецильная группа; C1-С3-алкильной группой предпочтительно является метильная группа.
Особенно предпочтительными соединениями по изобретению формулы (1) являются такие, в которых метильная группа имеет конфигурацию R.
Соединения по изобретению могут быть получены с использованием методов, таких как взаимодействие в инертном растворителе эквимолекулярных количеств кислоты формулы (2)
в которой R2’ имеет те же значения, что и R2, или является группой, которая может быть преобразована в R2 путем удаления любых защитных групп,
с эквимолекулярными количествами сульфонамида формулы (3)
в которой R и R’ имеют описанные выше значения,
в присутствии эквимолекулярного количества и/или незначительного избытка конденсирующего агента, например карбодиимида (такого как дициклогексилкарбодиимид), растворимого карбодиимида (такого как гидрохлорид N-(3-деметиламинопропил)-N’-этилкарбодиимида) или 1,1’-карбонилдиимидазола и каунтер-основания, выбранного из группы, включающей триэтиламин, 4-(N,N-диметиламино)пиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен и 1,5-диазабицикло[4.3.0]нон-5-ен.
Альтернативно, подобный эффективный процесс заключается во взаимодействии сульфонамид-аниона формулы (3’)
в которой R имеет описанные выше значения,
в инертном растворителе с подходящей реактивной формой кислот формулы (2); хлориды кислот формулы (2) являются наиболее предпочтительными реакционноспособными формами в процессе приготовления хиральных N-ацилсульфонамидов по изобретению, во избежание трудностей, связанных с теми частичными рацемизациями, которые могут иметь место во время взаимодействия сульфонилхлорида формулы (4) с анионом амида формулы (5)
В том случае, когда R2’ в соединениях, полученных в соответствии с описанными выше методами, представляет собой бензоильную группу, указанная бензоильная группа могла бы приводить к различным соединениям формулы (1) посредством известных реакций оксимов или посредством восстановления карбонильной группы через спирт до углеводорода (бензила) при поглощении одного или двух эквивалентов водорода в присутствии подходящего катализатора.
N-Ацилсульфонамидогруппа соединений формулы (1) является группой, достаточно кислотной для образования солей прибавления сильных и средних оснований, таких как L-лизин, L-аргинин, трометамин или хиральные амины, такие как эфедрин, цинхонин, цинхонидин и т.д., тем самым обеспечивая оптическое разделение указанных сульфонамидов на их отдельные энантиомеры (R) и (S). Различные хроматографические методы, необязательно на хиральных носителях (смотри, например, W.H.Pirkle and J.McCune, цитированные выше), такие как ТСХ или различные способы колоночной хроматографии, могут быть использованы для очистки и разделения энантиомеров и диастереомеров, оптическая чистота которых оценивается с использованием R-(-)-2-[(4’-изобутил)фенил]пропионамида в качестве эталона.
Хлорангидриды алкилсульфоновой, арилсульфоновой или гетероарилсульфоновой кислот, а также их амиды являются известными коммерчески доступными и удобными при получении соединений. Поэтому, например, после преобразования полиоксиэтиленового спирта формулы СН3-(CH2)ni-(OCH2CH2)ni-OH (в которой ni и mi имеют описанные выше значения) в соответствующие тозилаты или галогениды (X=Сl, Вr или I), взаимодействие последних с избытком тиомочевины дает соответствующие соли изотиоурония: СН3-CH2)ni-(OCH2CH2)min-S-(C=NH)-NH2·HX, которые напрямую преобразуются в соответствующие сульфонилхлориды: Н3-(CH2)ni-(OCH2CH2)min-SO2Cl путем хлорирования при комнатной температуре, а затем в соответствующие сульфонамиды (J.М.Sprague and Т.В.Johnson, J. Am. Chem. Soc., 59, 1837, 1937).
2-Алкиламиноэтансульфонамиды формулы P1P2-N-CH2-CH2-SO2NH2, в которой P1 и Р2 являются C1-С3-алкильной группой или, как описано выше, образуют кольцо с атомом азота, являются известными соединениями или могут быть получены с использованием известных методов. Для синтеза амидов таурина (смотри, например. Miller et al., J. Am. Chem. Soc., 62, 2099, 1940, и Н.Mcllwain, J. Chem. Soc., 75, 1941, в качестве основного метода получения 2-диалкиламиноэтансульфонамидов, в A. Le Berre and С.Porte, Bull. Soc. Chim. (France), 11-602, 1978 описано добавление вторичных аминов (диметиламина, пиперидина или морфолина) к этиленсульфонамиду [CH2=CH-SO2NH2], синтез которого описан в A.S.Matlack, J. Org. Chem., 23, 729, 1958, и в цитируемых в ней ссылках.
Известно, что сульфонамиды формулы (3) и сульфонилхлориды формулы (4) являются соединениями, которые могут быть получены с использованием хорошо известных методов.
2-Арилпропионовые кислоты формулы (2) являются хорошо известными соединениями, используемыми в качестве обезболивающих и противовоспалительных лекарств. Известно несколько процедур для их получения как в качестве отдельных энантиомеров, так и в качестве рацематов. Описано множество эффективных методов для оптического разделения рацематов. Энантиоселективный синтез обычно относится к (S) энантиомерам арилпропионовых кислот, но они также могут быть модифицированы с получением (R) энантиомеров путем соответствующего подбора реагентов (хиральных помощников), например, для использования алкиларилкетонов в качестве субстратов для α -арилалкановых кислот (смотри В.М.Trost and J.H.Rigby, J. Org. Chem., 14, 2936, 1978; для α -арилирования кислоты Meldrum. J.T.Piney and В.A.Rowe, Tetrah. lett., 21, 965, 1980; для использования тартаровой кислоты в качестве хирального помощника G.Castaldi et al., J. Org. Chem., 52, 3018, 1987; для использования α -гидроксиэфиров в качестве хиральных реагентов R.D.Larsen et al., J. Am. Сhim. Soc. 111, 7650, 1989, и US 4940813 и цитированные в них ссылки).
Более детально, ариловые кислоты формулы (2), в которых R2 является 3-бензоил-2-гидроксифениловой или 3-бензоил-2-аминофениловой группой, являются известными соединениями. Способ их получения описан в заявке на выдачу патента Италии 1283649 (23.04.1998), принадлежащей настоящему заявителю.
Конкретными примерами соединений изобретения являются: R(-)-N-2-[(4-изобутилфенил)пропионил]метансульфонамид и его соль L(+)-лизина;
R(-)-N-2-[(3-бензоилфенил)пропионил]метансульфонамид;
R(-)-N-(2-[3-(1ε -гидрокси-1ε -фенил)метил]пропионил)метансульфонамид;
R(-)-N-метил,N-2-[(4-изобутилфенил)пропионил]метансульфонамид;
R(-)-N-[2-(3-бензилфенил)пропионил]метансульфонамид;
(±)N-[2-(5’-бензоил-2’-ацетоксифенил)пропионил]метансульфонамид;
гидрохлорид R(-)-N-2-[(4-изобутилфенил)пропионил]-2-аминоэтилсульфонамида;
R(-)-N-[2-(4-изобутилфенил)пропионил]-2-фталимидоэтансульфонамид;
амид R(-)-N-[2-(3-бензоилфенил)пропионил],N’-карбобензилокситаурина;
амид R(-)-N-[2-(3-феноксифенил)пропионил],N’-карбобензилокситаурина;
амид R(-)-N-[2-[4-(1-оксо-2-изоиндолинилфенил]пропионил],N’-карбобензилокситаурина;
N-[2-(5-бензоилтиен-2-ил)пропионил]-(2-карбобензилоксиамино)этансульфонамид;
N-[2-(4-тиеноилфенил)пропионил]-(2-карбобензилоксиамино)этансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-(2-карбобензилоксиамино)этансульфонамид;
R(-)-N-[2-(3-бензоилфенил)пропионил]-(2-амино)этансульфонамид;
R(-)-N-[2-(3-феноксифенил)пропионил]-(2-амино)этансульфонамид;
N-[2-(5-бензоилтиен-2-ил)пропионил]-(2-амино)этансульфонамид;
N-[2-(4-тиеноилфенил)пропионил]-(2-амино)этансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]циклогексилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]додецилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-пара-цианофенилметансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3-циано-1-пропансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-2-метоксиэтансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6-диоксагептилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6-диоксаоктилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)лропионил]-3,6,9-триоксадецилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6,9-триоксаундецилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]циклогексилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]додецилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-пара-цианофенилметансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3-циано-1-пропансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-2-метоксиэтансульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6-диоксагептилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6-диоксаоктилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6,9-триоксадецилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-3,6,9-триоксаундецилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-2-диметиламиноэтилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-2-(пиперидин-1-ил)этилсульфонамид;
R(-)-N-[2-(4-изобутилфенил)пропионил]-2-(морфолин-4-ил)этилсульфонамид.
Соединения по изобретению изучали, используя PMN клетки, полученные седиментацией на декстране гепаринизированной крови от здоровых добровольцев; мононуклеарные клетки удаляли посредством Ficoll/Hypaque, тогда как эритроциты удаляли обработкой гипотоническими растворами. Жизнеспособность PMN лейкоцитов подсчитывали путем эксклюзии Turk и трипановым синим, тогда как доля содержащих ядро РМ-клеток в цитоцентрифугате оценивалась путем окрашивания Diff Quinck (W.J.Ming et al., J. Imnunol., 138, 1469, 1987).
В каждом из ниже описанных тестов in vitro PMN инкубировали с соединениями по изобретению в течение 10 минут при температуре 37° С.
В тестах на хемотаксис и в тестах по определению уровня ионов Ca2+ в цитозоле рекомбинантный ИЛ-8 человека (Рерrо Tech.) использовали в качестве стимулирующего агента: лиофилизированный белок растворяли в HBSS (сбалансированном солевом растворе Хенкса) в концентрации 100 нг/мл и использовали после растворения в HBSS в концентрации 10 нг/мл в тестах на хемотаксис и в концентрации 25-50 нг/мл при определении клеточных модификаций [Ca2+]i.
В тестах на хемотаксис использовали (в соответствии W.Falket et al., J. Immunol. Metods, 33, 239, 1980) PVP фильтры с 5 мм пористостью и плексигласовую микрокамеру, способную выполнять 48 повторений. Микрокамера состоит из куска плексигласа, содержащего 48 ячеек емкостью 25 [мл каждая, и снабжена крышкой, которая на своей обратной стороне содержит 48 пор, расположенных таким образом, что когда крышка закрыта и прикручена к подлежащей части, в микрокамере создаются компартменты емкостью 50 мкл.
Равные концентрации тестируемых соединений помещали в верхние ячейки, содержащие суспензию PMN, а в нижние ячейки, которые содержали носитель, необязательно добавляли ИЛ-8 (или другой стимулирующий агент).
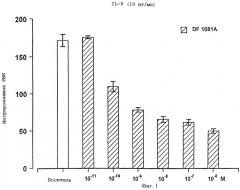
В качестве примера, R(-)-N-2-[(4-изобутилфенил)пропионил]метансульфонамид (DF 1681), в зависимости от дозы ингибировал хемотаксис, индуцированный ИЛ-8 (10 нг/мл), в диапазоне концентраций от 10-6 до 10-11 М. Представленные как среднее значение + S.D. трех независимых опытов результаты, выраженные в виде количества мигрировавших PMN, представлены на фиг. 1 в виде гистограмм.
(S)(+)-N-2-[(4-Изобутилфенил)пропионил]метансульфонамид и R(-)-N-2-[(4-изобутилфенил)пропионил]метансульфонамид имели значения IC50 в диапазоне от 10-7 до 10-8 М.
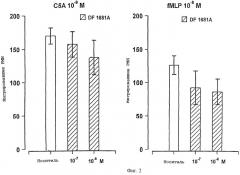
Представленные на фиг. 2 результаты подтверждают тот факт, что соединения по изобретению избирательно ингибируют ИЛ-8-индуцированный хемотаксис вместо хемотаксиса, индуцированного С5а (10-9 М) или f-MLP (10-8 М), по крайней мере для диапазона концентраций DF 1681 от 10-6 до 10-7 М [представленные как среднее значение + S.D. трех независимых тестов результаты выражены в виде количества мигрировавших PMN].
Изменения [Са2+]i в цитозоле определяли на экспериментальной модели, описанной C.Bizzarri et al. (Blood, 86, 2388, 1995), с использованием предметных стекол, содержащих прилипшие PMN с добавленным 1 μ М Fura-2AM для оценки изменений [Ca2+]i в реальном времени. В свою очередь PMN цитоцентрифугаты ресуспендировали в среде RPMI 1640 с 5% FCS (фетальной бычьей сывороткой) в концентрации 3× 106/мл и затем помещали на круглые стеклянные предметные стекла диаметром 25 мм, которые помещали в инкубатор на 30 минут при температуре 37° С. После того как трехкратными последовательными отмываниями BSS (сбалансированным солевым раствором) удаляли неприлипшие клетки, все прилипшие клетки в дальнейшем инкубировали максимум 4 часа перед добавлением Fura-2-АМ.
В качестве примера, результаты, полученные с R(-)-N-2-[3-(бензоилфенил)пропионил]метансульфонамидом (DF 1661) и R(-)-N-2-[(4-изобутилфенил)пропионил]метансульфонамидом (DF 1681) с использованием PMNs лейкоцитов от трех разных доноров, представлены в таблице 1. Эти лейкоциты были признаны ответившими на ИЛ-8 (50 нг/мл) тогда, когда в ответ на стимул [Ca2+]i, была выше, чем контрольный уровень, на 34% (нормализованный к 100).
| Таблица 1 | |
| ИЛ-8 (50 нг/мл) | 254±23 (n=20) |
| DF 1661 (10-6 М) + ИЛ-8 (50 нг/мл) | 184+16 (n=10) |
| DF 1681 (10-6 М) + ИЛ-8 (50 нг/мл) | 159+16 (n=10) |
Ответы, выраженные в % по сравнению с контрольными значениями [Са2+]i, равны среднему значению ответивших клеток и включают среднюю ошибку измерения (SEM); n равно числу повторов. В ходе этих тестов процент неответивших клеток различался в различных группах: 30% в группе, на которую воздействовали только ИЛ-8, 40% в группе, на которую предварительно воздействовали DF 1661, и 70% в группе, на которую предварительно воздействовали DF 1681.
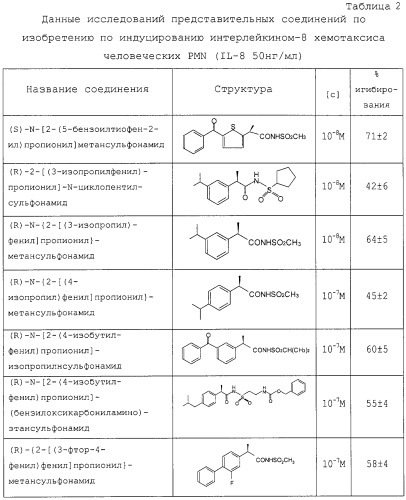
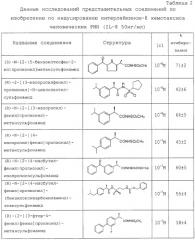
N-2-Арилпропионилсульфонамиды по изобретению формулы (1) характеризуются способностью ингибировать in vitro хемотаксис PMN лейкоцитов человека, стимулированный интерлейкином 8, см. таблицу 2. Ацилсульфонамиды изобретения в зависимости от дозы ингибируют хемотаксис PMN лейкоцитов человека, со значением IC50 (дозы, ингибирующей эффект на 50%) в диапазоне концентраций от 10-7 до 10-9 М с замечательным уровнем избирательности и специфичности к ИЛ-8-индуцированному хемотаксису. Концентрации выше на один или два порядка требуются для ингибирования in vitro хемотаксиса, индуцированного другими хемотаксическими факторами: С5а, формилпептидами бактериальной и синтетической природы (f-LMP). Специфичность соединений изобретения доказывается тем фактом, что они ингибируют стимулированное ИЛ-8 увеличение в PMN человека внутриклеточной концентрации [Ca2+]i, чье увеличение связывают с активацией PMNL человека [J.H.Liu et al., J.Infect. Dis., 166, 1089 (1992)].
Независимо от абсолютной структуры метильной группы соединения по изобретению значительно не влияют на продукцию СО и простагландинов. Фактически на LPS-стимулированных макрофагах мышей (1 мг/мл) показано, что соединения по изобретению (в диапазоне концентраций от 10-5 до 10-7 М) ингибируют продукцию PGE2, обычно менее чем это статистически значимо, и никогда не выше чем 10-15% от значения контроля.
Это не относящееся к делу ингибирование синтеза PGE2 является полезным, так как соединения по изобретению, в отличие от некоторых 2-арилпропионовых кислот, в случае макрофагов мышей (LPS-стимулированных) не являются подходящими стимулами для усиления синтеза TNFα , который в свою очередь способствует усилению активации и хемотаксиса нейтрофилов и синтеза ИЛ-8. Эти эффекты (неусиление синтеза TNF-α ) также влияют в случае синтеза TNFα , стимулированного пероксидом водорода.
Принимая во внимание эти экспериментальные данные и то, что интерлейкин 8 (ИЛ-8) и его аналоги являются вовлеченными в процесс инфильтрации нейтрофилами при патологиях, таких как псориаз (B.J.Nickoloff et аl., Am.J.Pathol., 138, 129, 1991), ревматоидный артрит (M.Selz et al., J.Clin. Invest. 87, 463, 1991), язвенный колит (Y.R.Mahkla et al., Clin. Sci., 82, 273, 1992), респираторный дистресс-синдром взрослых (ARDS) и идиопатический фиброз (Р.С.Саrrе et al., J. Clin. Invest., 88, 1802, 1991, и E.J.Miller et al., Am. Rev. Respir. Dis. цитированный выше), гломерулонефрит (Т.Wada et al., J. Exp. Med., 180, 1135, 1994), соединения по изобретению могут быть использованы при лечении этих патологий.
Для этих терапевтических целей соединения по изобретению удобно представлены в фармацевтических композициях с использованием общепринятых методик и наполнителей, таких как описанные в "Remington's Pharmaceutical Sciences Handbook" Mack Publishing Co., New York, 18th Ed,, 1990.
Композиции по изобретению могут вводиться внутримышечно, внутривенно, в виде шариков, в дерматологических препаратах (кремах, лосьонах, спреях и мазях), а также перорально в виде капсул, таблеток, сиропов, композиций с контролируемым высвобождением и тому подобное.
Средняя дневная доза зависит от различных факторов, таких как тяжесть болезни и состояния пациента (возраст, пол и вес). Доза как правило варьируется от 1 или нескольких миллиграмм до 1500 мг соединений ежедневно, необязательно разделенных на части для многократного введения. Более высокие дозировки также могут вводиться ввиду низкой токсичности соединений по изобретению, даже для длительного курса лечения.
Следующие примеры подробнее иллюстрируют изобретение.
ПОЛУЧЕНИЯ
Способ, используемый для получения алкилсульфонамидов, арилалкилсульфонамидов, гетероалкилсульфонамидов и алкоксиполиоксиэтиленсульфонамидов формулы СН3-(СН3)ni-(OCH2-CH2)mi-SO2NH2, в которой ni равно нулю или 1 и mi равно целому числу от 1 до 3, осуществляют, как описано J.M.Sprague and Т.В.Jonson J.A.C.S., 59,. 1837, 1937, и Е.Miller et al., ibidem, 62, 2099 (1940).
Так, например, гидрохлорид 2-этоксиэтилтиомочевины получают путем взаимодействия 2-этоксиэтилхлорида с небольшим молярным избытком тиомочевины в спирте при перегонке с обратным холодильником. При барботировании Сl2 в растворе соли, охлажденном до примерно 25° С, выделяется маслянистая желтая масса, которую растворяют в этиловом эфире и сушат над сульфатом натрия. Растворитель выпаривают с получением 2-этоксиэтилсульфонилхлорида, который медленно добавляют к раствору гидроксида аммония с получением 2-этоксиэтансульфонамида, который, если требуется, кристаллизуют из разбавленного спирта или очищают методом колоночной хроматографии. С использованием описанного выше процесса приготавливают следующие соединения:
2-метоксиэтансульфонамид;
2-(2-метоксиэтокоси)этансульфонамид или 3,6-диоксагептилсульфонамид;
(2-этоксиэтокси)этансульфонамид или 3,6-диоксаоктилсульфонамид;
3,6,9-триоксадецилсульфонамид;
3,6,9-триоксаундецилсульфонамид.
ПРИМЕР 1
ОСНОВНЫЕ МЕТОДЫ ПРИГОТОВЛЕНИЯ N-АЦИЛСУЛЬФОНДМИДА
А) путем взаимодействия хлорангидрида кислоты формулы (2) с анионом сульфонамида формулы (3)
R(-)-N-[2-(4-изобутил)пропионил]метансульфонамида
а) Получение хлорангидрида кислоты формулы (2)
Суспензию R(-)-2-(4-изобутил)пропионовой кислоты (R-ибупрофен, 4 г, 0019 моль) в тионилхлориде (7,4 мл) перегоняли с обратным холодильником в течение 4 часов, затем оставляли охлаждаться при комнатной температуре. Избыток тионилхлорида выпаривали в вакууме. Остатки тионилхлорида удаляли двукратным промыванием оставшейся массы несколькими каплями сухого диоксана и выпаривали растворитель в вакууме. 4,66 г (0,019 моль) R(-)-2-(4-изобутил)пропионилхлорида получали в виде желтого масла, которое растворяли в нескольких миллилитрах безводного тетрагидрофурана (ТГФ).
b) получение аниона сульфонамида
Метансульфонамид (2,3 г, 0,0243 моль) добавляли к суспензии трет-бутоксида калия (2,73 г, 0,244 моль) в безводном ТГФ (28 мл); смесь перемешивали в течение 30 минут при комнатной температуре. После этого добавляли R(-)-2-(4-изобутил)пропионилхлорид (4,66 г, 0,019 моль) при перемешивании и оставляли реакционную смесь перемешиваться в течение ночи при комнатной температуре.
Выделенные неорганические соли отфильтровывали, растворитель выпаривали в вакууме и маслянистый остаток распределяли между CH2Cl2 (30 мл) и насыщенным раствором фосфата мононатрия. Органическую фазу промывали водой (2× 10 мл) и водные фазы экстрагировали CH2Cl2 (2× 10 мл). Объединенные органические экстракты сушили над Na2SO4 и выпаривали растворитель, затем к раствору маслянистого остатка в безводном метаноле (10 мл) добавляли две микрокапсулы концентрированной серной кислоты для того, чтобы этерифицировать в метиловый эфир любые следы непрореагировавшей R(-)-2-(4-изобутил)пропионовой кислоты. Смесь выдерживали в течение ночи при комнатной температуре, растворитель осторожно выпаривали в вакууме, остаток распределяли между водой (10 мл) и метиленхлоридом (25 мл). Водные фазы отбрасывали и органическую фазу экстрагировали насыщенным раствором NаНСО3 (2× 20 мл). Основные фазы объединяли, подкисляли концентрированной НСl и экстрагировали CH2Cl2 (3× 15 мл). После обычного промывания до нейтральных значений рН объединенные органические экстракты сушили над Na2SO4 и растворитель выпаривали в вакууме с получением 1,86 г (0,0066 моль) R(-)-N-[2-(4-изобутил)пропионил]метансульфонамида; т.пл. 103-105° C (разл.); [α ]D=-68° (с=1; СН3ОН); ЯМР (ДМСО-d6): δ 7,3 (д, 2Н, J=8 Гц); 7,09 (д, 2Н, J=7 Гц); 3,42 (кв, 1H, J=8 Гц); 2,8 (с, 3Н); 2,45 (д, 2Н, J=7 Гц); 1,55 (м, 1H); 1,3 (д, 3Н, J=8 Гц); 0,95 (д, 6Н, J=7 Гц).
В) прямой конденсацией кислоты формулы (2) с сульфонамидом формулы (3) в присутствии конденсирующего агента
N,N-Диметиламинопиридин (2,363 г, 0,0194 моль), гидрохлорид N-(3-диметиламинопропил)-N’-этилкарбодиимида (3,721 г, 0,0194 моль) и метансульфонамид (1,845 г, 0,0194 моль) добавляли последовательно к раствору R-(-)-ибупрофена (4 г, 0,0194 моль) в безводном CH2Cl2 (30 мл); смесь оставляли перемешиваться в течение ночи. Растворитель выпаривали, остаток омыливали этилацетатом (40 мл) и комбинированные органические фазы промывали водой (15 мл) и 20% водным раствором лимонной кислоты (2× 10 мл) и сушили над Na2SO4, затем растворитель выпаривали с получением 2,2 г (0,0076 моль) R(-)-N-[2-(4-изобутилпропионил]метансульфонамида в виде белого твердого вещества, т.пл. 103-105° С (разл.); [α ]D=-68° (с=1; СН3ОН).
ПРИМЕР 2
С помощью процедур, описанных в примере 1, приготавливали следующие соединения.
S(+)-N-[2-(4-изобутил)пропионил]метансульфонамид:
т.пл. 109-111° С (разл.); [α ]D=+73° (с=1; СН3ОН); 1H-ЯМР (CDCl3): δ 7,65 (ушир.с, 1H, NH); 7,2-7,0 (м, 4Н); 3,65 (кв, 1H, J=8 Гц); 3,25 (с, 3Н); 2,5 (д, 2Н, J=7 Гц); 1,85 (м, 1H); 1,5 (д, 3Н, J=8 Гц); 0,95 (д, 6Н, J=7 Гц).
R(-)-N-[2-(3-бензоилфенил)пропионил]метансульфонамид:
бледно-желтоое масло; [α ]D=-73° (с=1; СН3ОН); 1H-ЯМР (СDСl3): δ 8,25 (ушир.с, 1H, NH), 7,80-7,35 (м, 9Н), 3,80 (кв, J=7 Гц, 1H), 3,21 (с, 3Н), 1,55 (д, J=7 Гц, 3Н).
S(+)-N-[2-(3-бензоилфенил)пропионил]метансульфонамид:
бледно-желтое масло; [α ]D=+67° (с=1; СН3ОН); 1Н-ЯМР (СDСl3): δ 8,5 (ушир.с, 1H, NH), 7,9-7,45 (м, 9Н), 3,75 (кв, J=7 Гц, 1H), 3,21 (с, 3Н), 1,55 (д, J=7 Гц, 3Н).
S(+)-N-[2-(2-фтор-4-бифенилил)пропионил]метансульфонамид:
т.пл. 130-132° С; [α ]D=+44° (с=1; СН3ОН); 1H-ЯМР (СDСl3): δ 7,8 (ушир.с, 1H, NH); 7,50-7,30 (м, 5Н); 7,05-6,90 (м, 3Н); 3,65 (кв, 1H, J=7 Гц); 3,20 (с, 3Н); 1,50 (д, 3Н, J=7 Гц).
R(-)-N-[2-(2-фтор-4-бифенилил)пропионил]метансульфонамид:
т.пл. 106-108° С; [α ]D=-42° (с=1; СН3ОН); 1H-ЯМР (СDСl3): δ 7,9 (ушир.с, 1H, NH); 7,50-7,30 (м, 5Н); 7,10-6,95 (м, 3Н); 3,65 (кв, 1H, J=7 Гц); 3,20 (с, 3Н); 1,50 (д, 3Н, J=7 Гц).
ПРИМЕР 3
R(-)-N-Метил,N-[2-(4-изобутил)пропионил]метансульфонамид N-ацилсульфонамиды являются достаточно кислыми веществами, дающими после реакции с диазоалканами, N-ацил-N-алкилсульфонамиды вследствие процесса, описанного здесь и далее.
Раствор R(-)-N-[2-(4-изобутил)пропионил]метансульфонамида (0,3 г, 0,0001 моль) в сухом этиловом эфире, охлажденный на ледяной бане (Т=4° С), добавляли по каплям к 0,67 н. раствору диазомет