Способ дифференциальной диагностики обструкции аортокоронарных шунтов
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к сердечно-сосудистой хирургии. Способ позволяет повысить точность и специфичность дифференциальной диагностики обструкции аортокоронарных шунтов. Проводят чреспищеводное ультразвуковое сканирование, при этом используют фармакологическую пробу с сублингвальным приемом 10 мг нифедипина и при значении систолодиастолического индекса на пике нифедипиновой пробы ≤0,68 диагностируют функциональную обструкцию, а при значении
систолодиастолического индекса на пике нифедипиновой пробы >0,68 диагностируют морфологическую обструкцию. 8 ил.
Реферат
Изобретение относится к медицине и может использоваться в сердечно-сосудистой хирургии.
Известен способ чреспищеводного ультразвукового исследования [1], при помощи которого возможно визуализировать аортокоронарные шунты в двухмерном и цветном допплеровском режимах и определять в них скоростные характеристики кровотока, по которым судят о степени проходимости аортокоронарных шунтов.
Данный способ является наиболее близким к предлагаемому по технической сущности и достигаемым результатам и выбран в качестве прототипа.
Недостатком этого способа является то, что при его помощи можно лишь констатировать обструкцию аортокоронарных шунтов без возможности дифференцировать морфологические (сужение атеросклеротической бляшкой, тромбом, ввернувшейся в просвет сосуда интимой, компрессия лигатурой или периадвентициальной гематомой) и функциональные (спазм аортокоронарного шунта) ее причины. Поэтому способ имеет относительно низкую специфичность (75%).
Целью изобретения является повышение точности и специфичности способа.
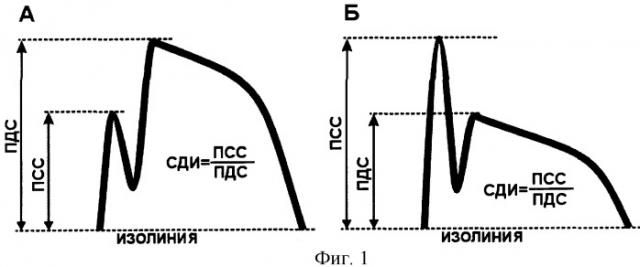
Поставленная цель достигается техническим решением, представляющим собой определение систоло-диастолического индекса (СДИ) - отношения пиковой систолической скорости кровотока в аортокоронарном шунте к пиковой диастолической (фиг.1) при чреспищеводном ультразвуковом сканировании до и после сублингвального приема 10 мг нифедипина. Функциональную (спазм аортокоронарного шунта) обструкцию диагностируют при значении СДИ ≤0,68, а морфологическую (сужение аортокоронарного шунта атеросклеротической бляшкой, тромбом, ввернувшейся в просвет сосуда интимой, компрессия лигатурой или периадвентициальной гематомой) при значении СДИ>0,68. При этом специфичность диагностики морфологической обструкции аортокоронарных шунтов достигает 98%, функциональной - 95%.
Новым в предлагаемом способе является проведение фармакологического теста с сублингвальным приемом нифедипина в средней терапевтической дозе (10 мг) и диагностика функциональных причин обструкции при значении СДИ≤0,68, а морфологических причин обструкции при значении СДИ>0,68.
Совокупность данных признаков обеспечила достижение цели изобретения.
С ростом числа процедур аортокоронарного шунтирования становится необходимым подтверждение проходимости и документирование успешности оперативной коррекции коронарного атеросклероза. Поэтому существует острая потребность в диагностическом методе, который мог бы обеспечить надежное динамическое наблюдение за проходимостью и функциональным состоянием аортокоронарных шунтов, тем более что проходимость последних далека от абсолютной и колеблется в пределах 69-77% [2, 3].
Причинами обструкции аортокоронарных шунтов в послеоперационном периоде могут являться как морфологические (сужение атеросклеротической бляшкой, тромбом, ввернувшейся в просвет аортокоронарного шунта интимой, компрессия лигатурой или периадвентициальной гематомой), так и функциональные нарушения (спазм аортокоронарного шунта). Дифференциальная диагностика этих принципиально разных состояний очень важна, поскольку это определяет дальнейшую лечебную тактику: при выявлении морфологической обструкции необходимо проведение повторного оперативного вмешательства, при выявлении функциональной обструкции достаточно курса терапии вазодилататорами.
Поэтому нами были разработаны критерии обструкции аортокоронарных шунтов, выявляемые при помощи чреспищеводного ультразвукового сканирования. Для этого мы исследовали скоростные характеристики кровотока в 51 аортокоронарном шунте, имевшем различные варианты обструкции по данным рентгеноконтрастной селективной шунтографии. Чреспищеводное ультразвуковое сканирование проводилось на аппарате Aloka SSD-2200 (Aloka, Япония) с использованием ротационного секторного датчика частотой 5 МГц. Рентгеноконтрастная шунтография проводилась на ангиографическом комплексе Angioscop D-33 (Siemens, Германия). В результате проведенного исследования установлено, что при функциональной обструкции аортокоронарных шунтов на пике нифедипиновой пробы происходит расслабление спазмированного сосуда, что ведет к уменьшению СДИ до нормальных цифр (≤0,68), а при морфологической обструкции аортокоронарного шунта исходно высокие значения СДИ (>0,68) при пробе с нифедипином сохраняются на прежнем уровне. При этом чувствительность способа составила 99%, специфичность в диагностике морфологических причин обструкции аортокоронарных шунтов - 98%, функциональных - 95%. Поэтому с тем, чтобы дифференцировать функциональные и морфологические препятствия кровотоку, проведение нифедипинового теста является необходимым условием дифференциальной диагностики причин обструкции аортокоронарных шунтов и определения дальнейшей лечебной тактики.
Изобретение будет понятно из следующего описания и приложенных чертежей.
На фиг.1 изображена схема расчета систолодиастолического индекса в режиме импульсного допплеровского спектра при преобладании диастолической (А) и систолической (Б) фазы сдвига допплеровского спектра частот:
ПСС - пиковая систолическая скорость; ПДС - пиковая диастолическая скорость; СДИ - систолодиастолический индекс.
На фиг.2 изображены данные, получаемые при поперечном и продольном сканировании аортокоронарного шунта в В-режиме: ВАо - восходящая аорта; АКШ - аортокоронарный шунт; ПКС - правый коронарный синус аорты, ЛКС - левый коронарный синус аорты; ЛЖ - левый желудочек; ПЖ - правый желудочек; ЛП - левое предсердие.
На фиг.3 изображен сдвиг допплеровского спектра частот в области проксимальной трети аортокоронарного шунта к диагональной ветви: С - систолическая фаза, Д - диастолическая фаза.
На фиг.4 изображен сдвиг допплеровского спектра частот в области проксимальной трети аортокоронарного шунта к задней межжелудочковой артерии в исходном состоянии (А) и на пике теста с сублингвальным приемом нифедипина (Б): С - систолическая фаза, Д - диастолическая фаза.
На фиг.5 изображена селективная рентгеноконтрастная ангиограмма аортокоронарного шунта к задней межжелудочковой артерии (А) и маммарно-коронарного шунта к передней межжелудочковой артерии (Б). Ход шунтов показан стрелками.
На фиг.6 изображен сдвиг допплеровского спектра частот в области проксимальной трети аортокоронарного шунта к задней межжелудочковой артерии в исходном состоянии (А) и на пике теста с сублингвальным приемом нифедипина (Б): С - систолическая фаза, Д - диастолическая фаза.
На фиг.7 изображена селективная рентгеноконтрастная ангиограмма аортокоронарного шунта к задней межжелудочковой артерии (А) и маммарно-коронарного шунта к передней межжелудочковой артерии (Б). Ход шунтов показан стрелками.
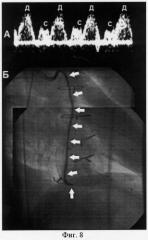
На фиг.8 изображены сдвиг допплеровского спектра частот в области проксимальной трети аортокоронарного шунта к задней межжелудочковой ветви (А) и селективная рентгеноконтрастная ангиограмма маммарно-коронарного шунта к передней межжелудочковой ветви (Б): С - систола; Д - диастола. Ход шунтов показан стрелками.
Интубацию пищевода осуществляют после внутримышечной премедикации 2 мл 2% р-ра метоклопрамида, 1 мл 0,5% р-ра диазепама и местной анестезии ротоглотки 10% аэрозолем лидокаина. Исходное положение пациента - лежа на правом боку. Используется ультразвуковая программа для исследования почечных или периферических вен. Целесообразно использовать встроенные допплеровские фильтры для низких или средних объемных скоростей, а также высокочувствительный фильтр движения тканей. Это необходимо для снижения уровня помех от рядом расположенных движущихся структур сердца. Чреспищеводный секторный датчик 5 МГц вводится в пищевод на расстояние 35-40 см от резцов и ротируется кпереди до достижения удовлетворительной визуализации структур сердца. После этого датчик продвигают в краниальном направлении, получая изображение аортокоронарных анастомозов и проксимальных сегментов аортокоронарных шунтов в горизонтальной и сагиттальной плоскостях (фиг.2). При достижении удовлетворительной визуализации контрольный объем импульсного допплера устанавливается в середину просвета сосуда, включается режим импульсного допплеровского спектра (фиг.3), после чего производится измерение пиковой систолической и пиковой диастолической скоростей кровотока и вычисляется систолодиастолический индекс (фиг.1). Такая последовательность действий производится в отношении каждого аортокоронарного шунта. Если величина систолодиастолического индекса не превысила 0,68, делают заключение о нормальной проходимости аортокоронарного шунта. В противном случае констатируют обструкцию аортокоронарного шунта, и с целью дифференцировки функциональных и морфологических ее причин производится сублингвальный прием 10 мг нифедипина. Через 3-5 минут, на пике действия нифедипина, повторно проводятся измерения, перечисленные выше. При этом функциональную обструкцию (спазм) аортокоронарного шунта диагностируют в том случае, если величина систолодиастолического индекса снизилась до нормальных цифр и составила ≤0,68. В противном случае, если величина СДИ сохраняется на уровне >0,68, диагностируют морфологическую обструкцию аортокоронарного шунта.
Данная методика может использоваться у всех пациентов и позволяет производить измерения, начиная с первых суток после операции, в т.ч. в амбулаторных условиях.
Пример 1
Пациент З., 67 лет, находился в отделении сердечной недостаточности с 14.01.2003 с диагнозом: ишемическая болезнь сердца, стенокардия напряжения 3 функционального класса, постинфарктный кардиосклероз (Q-образующий переднеперегородочный инфаркт миокарда от октября 2002 г.), недостаточность кровообращения 2А стадии (III функциональный класс по NYHA). Жалобы при поступлении на боли стенокардитического характера при ходьбе до 30 м. На электрокардиограмме: ритм синусовый, 57 в минуту, отклонение электрической оси сердца влево, рубцовые изменения в переднеперегородочной области левого желудочка. По данным эхокардиографии: уплотнены стенки корня аорты, фиброзное кольцо и створки аортального клапана, умеренно уплотнены створки митрального клапана, умеренно расширено фиброзное кольцо, регургитация I степени. Гипокинез передних, переднеперегородочных и заднеперегородочных сегментов. Увеличены в размерах левые отделы. Сократительная способность левого желудочка нерезко снижена. Аорта на уровне синусов Вальсальвы - 31 мм; левое предсердие - 43 мм; конечный диастолический размер левого желудочка - 65 мм; конечный систолический размер левого желудочка - 54 мм; фракция выброса левого желудочка - 43%; толщина межжелудочковой перегородки - 10 мм, задней стенки левого желудочка - 9 мм. На коронарной ангиографии: тип кровоснабжения правый, стеноз огибающей артерии до 25% в проксимальной трети; стеноз правой коронарной артерии 75% в средней трети; окклюзия передней межжелудочковой артерии в устье.
23.01.2003 выполнена операция маммарно-коронарного шунтирования передней межжелудочковой артерии левой внутренней грудной артерией на ножке, аутовенозного аортокоронарного шунтирования задней межжелудочковой артерии на работающем сердце. В течение первых двух недель послеоперационного периода отмечались эпизоды, подозрительные на стенокардитические, которые с переменным успехом купировались приемом нитратов короткого действия. Был заподозрен гемодинамически значимый стеноз аортокоронарного шунта. Пациенту было проведено чреспищеводное ультразвуковое сканирование аортокоронарного шунта к задней межжелудочковой артерии (фиг.4А). Сдвиг допплеровского спектра частот характеризовался уменьшением диастолического компонента: пиковая систолическая скорость кровотока составила 17,78 см/с, пиковая диастолическая - 11,75 см/с, СДИ - 1,513. Эти изменения могли быть интерпретированы как гемодинамически значимый дистальный стеноз. Однако на пике пробы с нифедипином произошло снижение пиковой систолической скорости кровотока до 9,3 см/с, повышение пиковой диастолической скорости - до 14,53 см/с и соответственно уменьшение систолодиастолического индекса до 0,64 (фиг.4Б). Поэтому данное состояние было интерпретировано как функциональная обструкция (спазм) аортокоронарного шунта. Пациенту был назначен двухнедельный курс амлодипина и изосорбида-5-мононитрата, на фоне которого отмечена положительная динамика в виде исчезновения болевых эпизодов. На контрольной шунтографии не выявлено стенозирования аортокоронарного шунта к задней межжелудочковой артерии (фиг.5). Маммарно-коронарный шунт к передней межжелудочковой артерии также проходим.
Пример 2
Пациент Л., 55 лет, находился в отделении сердечно-сосудистой хирургии с 28.10.2002 с диагнозом: ишемическая болезнь сердца, прогрессирующая стенокардия, недостаточность кровообращения 1 стадии (II функциональный класс по NYHA). Жалобы при поступлении на боли стенокардитического характера при минимальной физической нагрузке. На электрокардиограмме: ритм синусовый, 72 в минуту, нормальное положение электрической оси сердца, элевация сегмента ST в отведениях V1-V4, неспецифические изменения зубца Т в отведениях III и aVF. По данным эхокардиографии: уплотнены фиброзное кольцо и створки аортального клапана. Размеры камер и толщина стенок сердца - в пределах нормы. Гипокинез передних, переднеперегородочных и части заднеперегородочных сегментов. Аорта на уровне синусов Вальсальвы - 27 мм; левое предсердие - 37 мм; конечный диастолический размер левого желудочка - 50 мм; конечный систолический размер левого желудочка - 32 мм; фракция выброса левого желудочка - 60%; толщина межжелудочковой перегородки и задней стенки левого желудочка - по 10 мм. На коронарной ангиографии: тип кровоснабжения правый, стеноз правой коронарной артерии 75% в средней трети, субтотальный стеноз передней межжелудочковой артерии в средней трети.
5.11.2002 выполнена операция маммарно-коронарного шунтирования передней межжелудочковой артерии левой внутренней грудной артерией на ножке, аутовенозного аортокоронарного шунтирования задней межжелудочковой артерии на работающем сердце. В ближайшем послеоперационном периоде отмечались эпизоды загрудинных болей небольшой интенсивности. Был заподозрен гемодинамически значимый стеноз аортокоронарного шунта. Пациенту было проведено чреспищеводное ультразвуковое сканирование аортокоронарного шунта к задней межжелудочковой артерии (фиг.6А). Сдвиг допплеровского спектра частот характеризовался уменьшением диастолического компонента: пиковая систолическая скорость кровотока составила 13,64 см/с, пиковая диастолическая - 8,61 см/с, СДИ - 1,584. На пике нифедипиновой пробы пиковые систолическая и диастолическая скорости кровотока снизились до 9,33 см/с и 7,44 см/с соответственно, и СДИ составил 1,254 (фиг.6Б). Данное состояние было интерпретировано как морфологическая обструкция аортокоронарного шунта. На контрольной шунтографии было обнаружено выраженное равномерное сужение на всем протяжении аортокоронарного шунта с его окклюзией в области анастомоза с задней межжелудочковой артерией (фиг.7). Пациенту было выполнено повторное вмешательство - маммарно-коронарное шунтирование задней межжелудочковой артерии (дистальнее места обструкции) на работающем сердце. В послеоперационном периоде стенокардия отсутствовала. При контрольном чреспищеводном ультразвуковом исследовании на пике нифедипиновой пробы в сдвиге допплеровского спектра частот отмечено преобладание диастолического компонента: пиковая систолическая скорость кровотока составила 5,64 см/с, пиковая диастолическая - 11,48 см/с, СДИ - 0,491 (фиг.8А). На контрольной шунтографии обнаружен полностью проходимый маммарно-коронарный шунт к задней межжелудочковой артерии (фиг.8Б).
Предложенный способ дифференциальной диагностики апробирован на 22 пациентах. Получены данные о высокой чувствительности (99%) и специфичности в диагностике морфологических (98%) и функциональных (95%) причин обструкции аортокоронарных шунтов. Таким образом, использование метода оправдано для определения лечебной тактики, либо для селекции кандидатов на ангиографию с целью минимизации числа неоправданных инвазивных исследований.
Литература
1. Врублевский А.В., Бощенко А.А., Карпов Р.С. Мультиплановое чреспищеводное ультразвуковое исследование в диагностике атеросклеротического поражения магистральных коронарных артерий и грудного отдела аорты. // Ультразвуковая и функциональная диагностика. - 2002. - №2, - с. 62-75.
2. The CASS Principal Investigators and their associates. Coronary Artery Surgery Study (CASS): a randomized trial of coronary artery bypass surgery, survival data // Circulation. - 1983. - Vol. 68. - P. 939-950.
3. Takaro Т., and the VA Coop Study Participants. Long-term survival results of the randomized trial of coronary bypass surgery for stable angina. Abstr. // Circulation. - 1983. - Vol. 68, suppl. III. - P. III-292.
Способ дифференциальной диагностики обструкции аортокоронарных шунтов путем проведения чреспищеводного ультразвукового сканирования, отличающийся тем, что используют фармакологическую пробу с сублингвальным приемом 10 мг нифедипина и при значении систолодиастолического индекса на пике нифедипиновой пробы ≤0,68 диагностируют функциональную обструкцию, а при значении систолодиастолического индекса на пике нифедипиновой пробы >0,68 диагностируют морфологическую обструкцию.