Пептидное соединение, восстанавливающее функцию органов дыхания
Иллюстрации
Показать всеИзобретение относится к лекарственным средствам для лечения заболеваний дыхательной системы и может быть использовано как средство, восстанавливающее функцию органов дыхания при лечении различных форм легочной патологии. Предлагается новый тетрапептид аланил-глутамил-аспартил-лейцин общей формулы Ala-Glu-Asp-Leu, обладающей биологической активностью, проявляющейся в восстановлении функции органов дыхания. Предлагается фармакологическое средство, содержащее в качестве активного пептидного агента эффективное количество тетрапептида аланил-глутамил-аспартил-лейцин общей формулы Ala-Glu-Asp-Leu. Использование нового тетрапептида в медикаменте способствует восстановлению функции органов дыхания. 3 н. и 1 з.п. ф-лы, 8 табл.
Реферат
Изобретение относится к лекарственным средствам для лечения заболеваний дыхательной системы и может быть использовано как средство, восстанавливающее функцию органов дыхания при лечении различных форм легочной патологии.
В настоящее время отмечена тенденция к увеличению заболеваний органов дыхания, в частности неспецифические заболевания легких, занимают третье место после сердечно-сосудистых заболеваний и злокачественных новообразований по значимости в общей заболеваемости и смертности. В связи с этим возрастающую социальную значимость приобретает разработка новых лекарственных средств, применяемых для лечения заболеваний дыхательной системы. Это, прежде всего, инфекционные респираторные заболевания, бронхиты, эмфизема, бронхиальная астма. Проявлениями этих заболеваний являются кашель, выделение мокроты, одышка. Поэтому лечение и профилактика болезней органов дыхания включает ряд комплексных мероприятий. Это воздействие на возбудителя болезни в случае инфекционных (бактериальных и (или) вирусных) заболеваний и симптоматическое лечение противокашлевыми, отхаркивающими и бронхолитическими средствами, а также иммунокоррегирующая и муколитическая терапия.
Среди средств, используемых для лечения инфекционных заболеваний, следует указать сульфаниламидные препараты в сочетании с другими антибактериальными средствами: бисептол, брифесептол, фтизоэтам (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.147, С.160, С.907), антибиотики класса фторхинолонов и противовирусные препараты, например, римантадин (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.729). Среди средств, применяемых для симптоматического лечения, необходимо отметить средства, уменьшающие отек слизистых оболочек бронхов: ксилометазолин, нафазолин (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.434, С.567), противокашлевые препараты: кодеин, бутамират, глауцин, пренокдиазин (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.413, С.170, С.232, С.688), а также муколитические препараты. Последние применяются для разжижения мокроты при обструктивном бронхите, пневмонии, бронхолиолите, бронхиальной астме, ателектазах при закупорке бронхов. Нередко их также назначают для профилактики осложнений при операциях на органах дыхания. К числу средств, разжижающих мокроту, относятся ферменты: трипсин, химотрипсин, рибонуклеаза, ферменты: трипсин, химотрипсин, рибонуклеаза и соединения, содержащие серу (ацетилцистеин, карбоцистеин) (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.1079), производные алкалоида визицина: бромгексин, амброксол (Регистр лекарственных средств России, Энциклопедия лекарственных средств. - Москва, 2003. - С.161, С.80). Наиболее широко применяются средства, содержащие серу и производные визицина. Препараты серосодержащих веществ особенно эффективны при бронхитах и других заболеваниях, сопровождающихся затрудненным откашливанием. Поскольку отхаркивающие средства устраняют только один симптом заболевания органов дыхания - кашель с затрудненным отделением мокроты, - обычно их применяют в комплексе с другими препаратами: антибактериальными и противовирусными, жаропонижающими, противоотечными, иммуностимуляторами, витаминами (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.1079).
У больных хроническим обструктивным бронхитом (бронхит, сопровождающийся спазмом бронхов) хороший эффект наблюдается при сочетании препаратов, расширяющих бронхи, со средствами, разжижающими мокроту. В качестве бронхорасширяющих средств используются лекарства, стимулирующие аденорецепторы, такие как: фенотерол, сальбутамол (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.872, С.742). Кроме того, они обладают противоотечным эффектом. М-холиноблокаторы (ипратропил бромид) расслабляют гладкие мышцы бронхов и устраняют бронхоспазм (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.352). Производное ксантина теотард (Регистр лекарственных средств России. Энциклопедия лекарственных средств. - Москва, 2003. - С.802) оказывает противоастматическое, бронхолитическое, сосудорасширяющее и миорелаксирующее действие. Все перечисленные лекарственные средства уменьшают количество слизи, отделяемой мерцательным эпителием бронхов, уменьшают воспаление и отек слизистой оболочки, облегчают отделение мокроты.
Однако медикаментозное лечение во многих случаях не приводит к положительным результатам, поскольку проводится с помощью лекарственных средств, направленных либо на уничтожение причины заболевания, либо на уменьшение симптомов. При этом на функциональное состояние легких и бронхов и не лишены побочных эффектов и противопоказаний. Так, многие из перечисленных лекарственных средств отрицательно воздействуют на желудочно-кишечный тракт, противопоказаны при печеночной недостаточности, инфаркте миокарда, аритмии, эпилепсии. В значительном числе случаев их применение приводит к развитию аллергических реакций, а также к тошноте и рвоте, болям в эпигастральной области.
Необходимо отметить, что в настоящее время практически не существует препаратов, направленных на восстановление функций легочной ткани и слизистой оболочки бронхов после развития патологического процесса вне зависимости от причин, его вызвавших.
Известен препарат полипептидной природы (патент РФ №1681427 на изобретение “Способ получения вещества, повышающего антибактериальную резистентность легких”, 1989, МКИ А 61 К 35/24), полученный из органического сырья (легких животных). Использование этого препарата в медицинской практике ограничено в связи со сложностью способа получения, малым выходом активных веществ, значительной вариабельностью их физико-химических свойств, а также из-за возможного возникновения у больных побочного действия в виде аллергических реакций.
Известен препарат полипептидной природы (патент РФ №1681426 на изобретение "Способ получения средства, восстанавливающего дыхательную функцию легких", 1989, МКИ А 61 К 35/24), полученный из органического сырья (трахеи животных), обладающий аналогичной биологической активностью и который является наиболее близким аналогом, принятым за прототип по отношению к фармакологическому средству (фармацевтической композиции).
Однако использование указанного препарата в медицинской практике ограничено в связи со сложностью способа получения, малым выходом активных веществ, значительной вариабельностью их физико-химических свойств, а также из-за возможного возникновения у больных побочного действия в виде аллергических реакций.
Следует отметить, что заявляемое пептидное соединение - тетрапептид - структурных аналогов не имеет.
Заявляемое изобретение направлено на получение нового биологически активного соединения пептидной природы, восстанавливающего функцию органов дыхания.
Технический результат изобретения заключается в создании нового пептидного соединения, а также фармакологического средства (фармацевтической композиции), содержащего это пептидное соединение в качестве активного пептидного агента, использование которого в медикаменте способствует восстановлению функции органов дыхания.
Возможность объективного проявления технического результата при использовании изобретения подтверждена достоверными данными, приведенными в примерах, содержащих сведения экспериментального характера, полученные по методикам, принятым в данной области.
Настоящее изобретение относится к новому тетрапептиду аланил-глутамил-аспартил-лейцин общей формулы Ala-Glu-Asp-Leu последовательности 1 [SEQ ID NO:1].
Тетрапептид получают классическим методом пептидного синтеза в растворе (Якубке Х.-Д., Ешкайт X. Аминокислоты, пептиды, белки: Пер. с нем. - М.: Мир, 1985. - 456 с.).
Настоящее изобретение относится к тетрапептиду аланил-глутамил-аспартил-лейцин общей формулы: Ala-Glu-Asp-Leu последовательности 1 [SEQ ID NO:1], обладающему биологической активностью, проявляющейся в восстановлении функции органов дыхания.
Действие тетрапептида Ala-Glu-Asp-Leu, направленное на восстановление функции органов дыхания, выявлено при его изучении в экспериментальной патологии, в частности при использовании следующих моделей:
- при остром воспалении легких в результате бактериального повреждения у крыс;
- при хроническом фиброзирующем воспалительном процессе - блеомициновом фиброзе легких у крыс;
- при сублетальном гипероксическом повреждении легких у крыс;
- при исследовании роста эксплантатов органотипической культуры легких половозрелых крыс,
Как известно, перечисленные патологии характеризуются существенными нарушениями морфологии легких, характерными для каждого из исследуемых видов экспериментальной патологии. Так, при остром бактериальном повреждении легких это проявилось в выраженной воспалительной реакции, экссудации в просвет альвеол, инфильтрации нейтрофильными лейкоцитами межальвеолярных перегородок, отеке периваскулярных и перибронхиальных пространств. В случаях длительного течения воспалительного процесса в легких (сублетальное гипероксическое повреждение, блеомициновый фиброз), независимо от этиологии заболевания, происходило значительное нарушение морфологии респираторных отделов легких, сопровождавшееся явлениями эмфиземы и фиброзирования с сохранением очагов воспаления. Эти изменения сопровождались развитием гемодинамических нарушений в малом круге кровообращения, компенсаторной гипертрофией миокарда, задержкой увеличения массы тела экспериментальных животных. Рассмотренные патологические состояния, независимо от вызвавших их причин, сопровождаются существенным изменением относительного клеточного состава бронхо-альвеолярной лаважной жидкости (БАЛЖ) в сторону увеличения количества нейтрофилов и, в меньшей степени, лимфоцитов, относительное количество альвеолярных макрофагов (AM) при этом значительно уменьшается. Как известно, AM являются активными полифункциональными клетками, от компетентности которых зависит состояние системы неспецифической резистентности, регуляция гуморального и клеточного иммунного ответа на уровне легких и организма в целом, а также процессов репарации. При развитии патологического процесса происходит угнетение фагоцитарной активности AM, гиперактивация окислительных процессов в клетках БАЛЖ, что способствует развитию нарушений внутренней структуры и функций органов дыхания.
В результате экспериментального изучения установлено, что тетрапептид Ala-Glu-Asp-Leu не обладает токсичностью.
Настоящее изобретение также относится к фармакологическому средству (фармацевтической композиции), восстанавливающему функцию органов дыхания, содержащему в качестве активного пептидного агента эффективное количество тетрапептида аланил-глутамил-аспартил-лейцин общей формулы Ala-Glu-Asp-Leu последовательности 1 [SEQ ID NO:1].
Понятие “фармакологическое средство”, используемое в данной заявке, подразумевает использование такой лекарственной формы, содержащей эффективное количество тетрапептида общей формулы Ala-Glu-Asp-Leu, которая может найти профилактическое и/или лечебное применение в медицине в качестве средства, восстанавливающего функцию органов дыхания.
Понятие "эффективное количество", используемое в данной заявке, подразумевает использование такого количества активного пептидного агента, которое в соответствии с его количественными показателями активности и токсичности, а также на основании знаний специалиста должно быть эффективным в данной лекарственной форме.
Для получения фармацевтических композиций, отвечающих изобретению, предлагаемый тетрапептид как активный ингредиент смешивается с фармацевтически приемлемым носителем согласно принятым в фармацевтике способам компаундирования.
Носитель может иметь различные формы, которые зависят от лекарственной формы препарата, желаемой для введения в организм, например, парентерального или перорального.
При изготовлении композиций в предпочтительной дозированной форме для перорального применения могут использоваться известные фармацевтические компоненты.
Для парентерального введения носитель обычно включает стерильный 0,9% раствор хлорида натрия или стерильную воду, хотя могут быть включены другие ингредиенты, способствующие стабильности препарата.
Сущность изобретения поясняется таблицами.
В Таблице 1 показано влияние тетрапептида Ala-Glu-Asp-Leu на динамику цитограммы БАЛЖ при остром бактериальном повреждении легких у крыс.
В Таблице 2 показано влияние тетрапептида Ala-Glu-Asp-Leu на динамику фагоцитарной активности альвеолярных макрофагов при остром бактериальном повреждении легких у крыс.
В Таблице 3 показано влияние тетрапептида Ala-Glu-Asp-Leu на биометрические показатели крыс на фоне трехкратного интратрахеального введения блеомицина.
В Таблице 4 показано влияние тетрапептида Ala-Glu-Asp-Leu на содержание иммунных комплексов в сыворотке крови и БАЛЖ на фоне трехкратного введения блеомицина при остром бактериальном повреждении легких у крыс.
В Таблице 5 показано влияние тетрапептида Ala-Glu-Asp-Leu на динамику биометрических показателей крыс при сублетальном гипероксическом повреждении.
В Таблице 6 показано влияние тетрапептида Ala-Glu-Asp-Leu на показатели цитограммы БАЛЖ и фагоцитарной активности AM при сублетальном гипероксическом повреждении.
В Таблице 7 показано влияние тетрапептида Ala-Glu-Asp-Leu на рост органотипических эксплантатов ткани легких крыс.
В таблице 8 представлено влияние тетрапептида на морфологические и биохимические показатели периферической крови морских свинок.
Настоящее изобретение иллюстрируется примером синтеза тетрапептида формулы Ala-Glu-Asp-Leu (пример 1), примерами, подтверждающими биологическую активность тетрапептида (примеры 2, 3, 4, 5), примером испытания тетрапептида на токсичность (пример 6), демонстрирующими его фармакологические свойства и подтверждающими возможность достижения терапевтически эффективной фармацевтической композиции.
Пример 1. Синтез тетрапептида Ala-Glu-Asp-Leu.
1. Название соединения: L-аланил-L-глутамил-L-аспартил-L-лейцин
2. Структурная формула:
H-Ala-Glu-Asp-Leu-OH
3. Брутто-формула без противоиона: C18H30N4O9
4. Молекулярный вес без противоиона: 446,45
5. Противоион: ацетат
6. Внешний вид: белый аморфный порошок без запаха
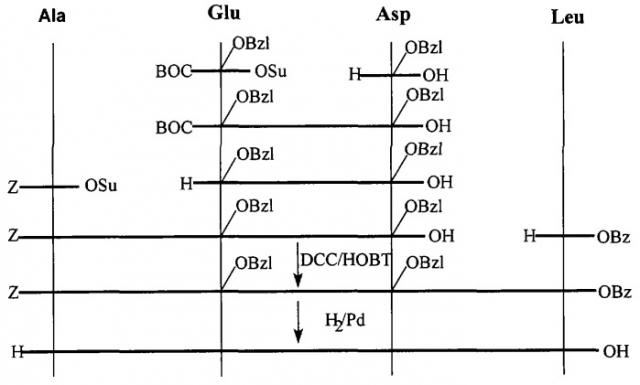
7. Способ синтеза: пептид получен классическим методом синтеза в растворе по схеме
Z - бензилоксикарбонильная группа,
BOC - трет.бутилоксикарбонильная группа,
OSu - N-оксисукцинимидный эфир,
OBzl - бензиловый эфир,
DCC -N,N'-дициклогексилкарбодиимид
НОВТ -N-оксибензотриазол
В качестве растворителя используют N,N'-диметилформамид, при введении аспарагиновой кислоты используют защиту α-СООН группы солеобразованием с триэтил-амином. Деблокирование ВОС-защитной группы проводят раствором трифторуксусной кислоты (TFA), Z-защитной группы - каталитическим гидрогенолизом. Выделение и очистку препарата осуществляют методом препаративной ВЭЖХ на колонке с обращенной фазой.
8. Характеристики готового препарата:
- аминокислотный анализ Glu 1,00; Asp 1,02; Ala 1,00; Leu 1,06;
- содержание основного вещества 98,33% (по ВЭЖХ, 220 нм);
- ТСХ - индивидуален, Rf=0,85 (ацетонитрил-уксусная к-та - вода 5:1:3);
- содержание влаги: 7%;
- рН 0,001% раствора: 4,40;
- удельное оптическое вращение: [α]D 22: - 42° (с=1, Н2O).
Пример синтеза:
1) BOC-Glu(OBzl)-Asp(OBzl)-OH (I), N-трет.бутилоксикарбонил-(γ-бензил)-глутамил-(β-бензил)аспартат.
N-оксисукцинимидный эфир N-трет.бутилоксикарбонил-(γ-бензил)глутаминовой кислоты BOC-Glu(OBzl)-Osu 4,34 г (0,0100 моль) растворяют в 20 мл диметилформамида, добавляют триэтиламин 1,72 мл (0,0125 моль) и β-бензиласпартат 2,80 г (0,0125 моль). Перемешивают при комнатной температуре в течение 24 час. Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3×30 мл), промывают 0,5 н. раствором серной кислоты (2×20 мл), водой, 5% раствором бикарбоната натрия (1×20 мл), водой, 0,5 н. раствором серной кислоты (2×20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40°С, остаток сушат в вакууме над Р2O5. Получают масло 5,68 г (≈l00%). Rf=0,42 (бензол-ацетон 2:1, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-1ВЭ 8-12 мкм, проявление УФ и хлор/бензидин).
2) TFA·H-Glu(OBzl)-Asp(OBzl)-OH (II), трифторацетат (γ-бензил)-глутамил-(β-бензил)-аспартата.
N-трет.бутилоксикарбонил-(γ-бензил)глутамил-(β-бензил)аспартат (I) 5,68 г (≈0,01 моль) растворяют в 20 мл смеси дихлорметан-трифторуксусная кислота (3:1). Через 2 часа растворитель упаривают в вакууме при 40°С, упаривание повторяют с новой порцией дихлорметана (2×10 мл), остаток сушат в вакууме над NaOH. Получают масло 5,80 г (≈100%). Rf=0,63 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
3) Z-Ala-Glu(OBzl)-Asp(OBzl)-OH (III), N-карбобензоксиаланил-(γ-бензил)-глутамил-(β-бензил)аспартат.
Трифторацетат (γ-бензил) глутамил-(β-бензил)аспартата (III) 5,65 г (0,01 моль) растворяют в 10 мл диметилформамида, добавляют триэтиламин 2,80 мл (0,02 моль) и N-оксисукцинимидный эфир N-карбобензоксиаланина 4,14 г (0,013 моль). Смесь перемешивают в течение 24 часов при комнатной температуре.
Продукт высаживают 0,5 н. раствором серной кислоты (150 мл), экстрагируют в этилацетат (3×30 мл), промывают 0,5 н. раствором серной кислоты (2×20 мл), водой, 5% раствором бикарбоната натрия (1×20 мл), водой, 0,5 н. раствором серной кислоты (2×20 мл), водой и сушат над безводным сульфатом натрия. Этилацетат фильтруют, упаривают в вакууме при 40°С, остаток закристаллизовывают в системе этилацетат/гексан. Продукт отфильтровывают и сушат в вакууме над P2O5. Выход 4,10 г (66%). Тпл.=154°С. Rf=0,48 (бензол-ацетон, 1:1), Rf=0,72 (н-бутанол-пиридин-уксусная кислота-вода, 15:10:3:12).
4) Z-Ala-Glu(OBzl)-Asp(OBzl)-Leu-OBzl (IV), бензиловый эфир N-карбобензокси-аланил-(γ-бензил)глутамил-(β-бензил)аспартиллейцина.
TosOH·H-Leu-OBzl, тозилат бензилового эфира лейцина 2,00 г (5 ммоль) суспендируют в 15 мл тетрагидрофурана и при перемешивании добавляют триэтиламин 0,7 мл (5 ммоль). Далее через 5 мин N-карбобензоксиаланил-(γ-бензил)глутамил-(β-бензил)аспартат (III) 2,0 г (3,1 ммоль), N-оксибензотриазол 0,5 г (3,5 ммоль) и охлаждают смесь до 0°С. Затем добавляют охлажденный до 0°С раствор N,N'-дициклогексилкарбодиимида 0,72 г (3,5 ммоль) в 5 мл тетрагидрофурана, перемешивают смесь при этой температуре в течение 2 часов и оставляют на ночь перемешиваться при комнатной температуре. Осадок дициклогексил-мочевины отфильтровывают, растворитель упаривают в вакууме, остаток растворяют в 30 мл этилацетата и промывают раствор 1 н. раствором соляной кислоты, водой, 5%-ным раствором бикарбоната натрия, водой, 1 н. раствором соляной кислоты, водой и сушат над безводным сульфатом натрия. Растворитель упаривают в вакууме и продукт закристаллизовывают в системе этилацетат/гексан. Выход 1,50 г (55%). Rf=0,62 (бензол-ацетон, 2:1).
5) H-Ala-Glu-Asp-Leu-OH (V), аланил-глутамил-аспартил-лейцин-гидроксид.
Бензиловый эфир N-карбобензоксиаланил-(γ-бензил)глутамил-(β-бензил)-аспартил-лейцина (IV) 1,5 г гидрируют в системе метанол-вода-уксусная кислота (3:1:1) над катализатором Pd/C. Контроль за полнотой деблокирования в ТСХ системах бензол-ацетон (2:1) и ацетонитрил-уксусная кислота-вода (5:1:3). По окончании реакции катализатор отфильтровывают, фильтрат упаривают в вакууме и остаток закристаллизовывают в системе вода/метанол. Продукт сушат в вакууме над КОН. Выход 600 мг (79%). Rf=0,85 (ацетонитрил-уксусная кислота-вода, 5:1:3).
Для очистки 540 мг препарата растворяют в 5 мл 0,1% трифторуксусной кислоты и подвергают высокоэффективной жидкостной хроматографии на колонке с обращенной фазой 50×250 мм Diasorb-130-C16T, 7 mkm. Хроматограф Beckman System Gold, 126 Solvent Module, 168 Diode Array Detector Module. Условия хроматографирования - A: 0,1% TFA; В: MeCN/0,1% TFA, градиент В 0→50% за 100 мин. Объем пробы 5 мл, детекция при 215 нм, сканирование 190-600 нм, скорость потока 10 мл/мин. Отбирают фракцию 62,0-67,0 мин.
Растворитель упаривают в вакууме при температуре не выше 40°С, упаривание многократно (5 раз) повторяют с 10 мл 10% раствора уксусной кислоты.
Окончательно остаток растворяют в 20 мл деионизованной воды и лиофилизуют. Получено 380 мг очищенного препарата в виде аморфного белого порошка без запаха.
6) Анализ готового препарата.
- Содержание основного вещества определяют методом ВЭЖХ на колонке Phenomenex LUNA C18, 4,6×250 mm. A: 0,1% TFA; B:MeCN/0,1% TFA; grad. В: 0→20% за 5 мин, 20%-50% за 15 мин. Скорость потока 1 мл/мин. Детекция при 220 нм, сканирование 190-600 нм, проба 20 μl. Содержание основного вещества 98,33%.
- Аминокислотный анализ проводят на анализаторе ААА "Т-339" Prague. Гидролиз в 6 н. НСl при 125°С 24 час. Glu 1,00; Asp 1,02; Ala 1,00; Leu 1,06;
- ТСХ: индивидуален, Rf=0,85 (ацетонитрил-уксусная к-та-вода, 5:1:3, пластинки ПТСХ-П-В-УФ Sorbfil, силикагель СТХ-IВЭ 8-12 мкм, проявление хлор/бензидин);
- содержание влаги: 7% (гравиметрически по потере массы при сушке 20 мг при 100°С).
- рН 0,001% раствора: 4,40 (потенциометрически);
- Удельное оптическое вращение: [α]D 22:-42° (с=1, Н2O), "Polamat A", Carl Zeiss Jena.
Пример 2. Влияние тетрапептида на функциональное состояние альвеолярных макрофагов в инфекционной модели острого воспаления в результате бактериального повреждения легких у крыс.
Эксперимент проведен на 120 белых беспородных крысах массой 200-230 г. Животные были рандомизированно разделены на группы по 10 (интактные), 60 (контрольные) и 50 (подопытные) животных. Для заражения применяли суточную культуру музейного штамма Staphilococcus aureus 209, тропную к легочной ткани грызунов. Использовали суспензию клеток 5×106 кл/мл с добавлением адьюванта Фрейнда в количестве 25% общего объема. Перед заражением животных подвергали переохлаждению при температуре -20°С в течение 1 часа. Затем проводили заражение крыс под легким тиопенталовым наркозом (8 мг/100 г массы тела) в стерильном боксе. Инъекции тетрапептида начинали со 2-х суток после заражения и проводили в течение 7 дней ежедневно внутрибрюшинно в дозе 0,2 мкг/кг.
Животные контрольной группы получали 0,9% раствор NaCl. Вывод животных из опыта осуществляли на 1, 3, 6, 10, 15 и 20 сутки цервикальной дислокацией. В каждый срок производили забор БАЛЖ для определения ее клеточного состава, проводили оценку фагоцитарной активности AM, продукции супероксид-аниона (СА) и суммарной свободно-радикальной продукции клетками БАЛЖ. На 1 и 6 сутки проводили морфологическое исследование легких.
Полученные результаты представлены в таблицах 1 и 2. Интратрахеальное введение животным стафилококка приводило к развитию острого бактериального воспалительного процесса с характерной морфологической динамикой и летальностью около 20% в первые 48 часов. У контрольных животных определялись серозный и фибринозный экссудат в просвете альвеол, выраженный отек периваскулярных и перибронхиальных пространств, очаговая и диффузная инфильтрация нейтрофилами межальвеолярных перегородок, слизь и нейтрофильные лейкоциты в просвете бронхов. На морфологическом уровне в контрольной группе к 6-м суткам происходило формирование устойчивых очаговых инфильтративных изменений в легочной ткани, проявляющихся в виде скоплений клеточного детрита, фибрина, пролиферации фибробластов с сохранением признаков интерстициального воспаления. На фоне воспалительного процесса происходило значительное возрастание количества нейтрофилов и AM в БАЛЖ, угнетение фагоцитарной активности AM, существенное изменение окислительного метаболизма.
Полученные результаты исследования показывают, что под влиянием тетрапептида абсолютное количество AM в БАЛЖ и их функциональная активность достоверно превышают контрольные значения с 3-х по 10-е сутки. При этом применение препарата существенно ускоряет динамику нормализации цитограммы БАЛЖ. Так, к 6-м суткам у животных подопытной группы отсутствовали выраженные признаки воспалительной реакции, в то время как показатели цитограммы БАЛЖ у животных контрольной группы достоверно превышали показатели у интактных животных.
При оценке динамики продукции в AM CA в ответ на стимуляторы респираторного взрыва было показано, что применение тетрапептида достоверно повышает базальную и зимозан-стимулированную продукцию СА. Применение тетрапептида также приводило к более быстрой нормализации свободно-радикальной продукции клеток БАЛЖ.
Применение тетрапептида Ala-Glu-Asp-Leu в дозе 0,2 мкг/кг массы тела способствовало ускорению процессов репарации в легочной ткани. Под действием препарата происходило более раннее ограничение воспалительной реакции, более быстрое рассасывание экссудата и, как следствие, ускоренное восстановление структурной целостности легких по сравнению с животными, не получавшими тетрапептид.
Пример 3. Влияние тетрапептида на протекание хронического фиброзирующего воспалительного процесса - блеомицинового фиброза легких у крыс.
Эксперимент проведен на 120 белых беспородных крысах массой 130-160 г. Животные были рандомизированно разделены на 3 группы по 40 животных в каждой. Раствор блеомицина из расчета 10,0 мг/кг массы тела животным вводили трехкратно интратрахеально с интервалом 2 недели. Тетрапептид вводили внутрибрюшинно в концентрации 0,2 мкг/кг массы тела в стерильном 0,9% растворе NaCl в течение 7 дней, начиная с 5-го дня от каждой инсталляции блеомицина. По 10 животных в каждой группе выводили из опыта цервикальной дислокацией на 15, 30, 45 и 60 сутки от начала эксперимента. В каждый срок производили забор БАЛЖ для определения ее клеточного состава, проводили оценку фагоцитарной активности AM, продукции супероксид-аниона (СА) и суммарной свободно-радикальной продукции клетками БАЛЖ. В крови и БАЛЖ определяли количество циркулирующих иммунных комплексов (ЦИК). После последнего введения блеомицина проводили морфологическое исследование легких.
Результаты проведенных исследований представлены в таблицах 3 и 4. Из данных таблиц видно, что интратрахеальные инсталляции блеомицина приводили к задержке увеличения массы тела у животных. В контрольной группе к 60-м суткам отмечено достоверное увеличение желудочкового индекса до 66,2±2,3%, обусловленное гипертрофией правого желудочка сердца, что свидетельствует о гемодинамических изменениях в малом круге кровообращения и формировании легочного сердца. У животных, получавших тетрапептид, показатели массы тела также имели тенденцию к повышению, однако достоверно не отличались от показателей у интактных животных на всех сроках наблюдения. Выраженность гипертрофии правого желудочка была существенно меньше, чем у животных контрольной группы, желудочковый индекс увеличился лишь до 46,6±1,4%.
После 3-ей инсталляции блеомицина морфологическими методами в легких обнаружены признаки выраженного интерстициального фиброза с формированием кист.
Наблюдали резкое утолщение межальвеолярных перегородок за счет разрастания соединительной ткани. Полученные данные характеризуют процесс в легких как диффузный интерстициальный фиброз с нарушением общей архитектоники органа, развитием участков компенсаторной эмфиземы и сохранением активности воспалительного процесса.
Применение тетрапептида полностью не предотвращало развитие очагов склероза, однако степень выраженности морфологических изменений в легких была существенно ниже по сравнению с контрольными животными. При этом соединительная ткань оставалась более рыхлой и содержала меньшее количество коллагеновых волокон.
Данные по содержанию ЦИК в сыворотке крови и БАЛЖ свидетельствуют о напряженности иммунопатологических процессов при блеомициновом повреждении легких. На фоне применения тетрапептида уровень ЦИК в крови достоверно превышал аналогичные показатели интактных животных, начиная с 30-х суток процесса, однако они были достоверно ниже показателей у контрольных животных. Уровень ЦИК в БАЛЖ под действием тетрапептида был достоверно ниже показателей у животных контрольной группы, начиная с 30-х суток эксперимента.
Процесс развития фиброза сопровождался значительными изменениями цитологического состава БАЛЖ с достоверным увеличением количества нейтрофильных лейкоцитов и лимфоцитов. Применение тетрапептида достоверно снижало количество лимфоцитов на 30-е и 60-е сутки по сравнению с контрольными животными (1,75±0,45×106 и 1,11±0,15×106 кл/легкие по сравнению с 5,13±0,51×106 и 4,16±0,45×106 кл/легкие соответственно). Под действием тетрапептида фагоцитарная активность AM достоверно превышала показатели у животных контрольной группы на 45-е и 60-е сутки исследования (фагоцитарный индекс был 75,6±4,5 и 78,6±3,2 по сравнению с 46,3±2,8 и 57,6±4,8 в контрольной группе). Тетрапептид также способствовал снижению базальной продукции СА в ответ на стимуляторы респираторного взрыва.
Таким образом, тетрапептид Ala-Glu-Asp-Leu подавлял выраженность воспалительной реакции, развивающейся в легких крыс после введения блеомицина, что проявлялось в уменьшении фиброзных изменений в легких, гемодинамических нарушений в малом круге кровообращения и гипертрофии миокарда. Отмечалось снижение уровня циркулирующих иммунных комплексов в БАЛЖ и крови, уменьшение численности лимфоцитов в БАЛЖ. Под действием препарата увеличилось количество и функциональная активность AM, усилилась их поглотительная активность. Регистрировалось снижение базального уровня СА и суммарной свободно-радикальной продукции. Все эти данные доказывают фармакологическую активность тетрапептида в дозе 0,2 мкг/кг массы тела в качестве препарата, восстанавливающего функцию легких.
Пример 4. Влияние тетрапептида на состояние легких крыс при сублетальном гипероксическом повреждении.
Эксперимент проведен на 96 белых беспородных крысах массой 200-230 г. Животные были разделены на следующие группы: 8 интактных животных, 48 контрольных и 40 подопытных. Оксигенацию 100% кислородом проводили в течение 60 часов в проточном режиме при нормобарических условиях в камере при расходе кислорода, обеспечивающем 8-10 полных смен газовой среды в час. Применение тетрапептида начинали с 3-х суток пребывания в нормальной атмосфере. Животным подопытной группы вводили тетрапептид внутрибрюшинно в дозе 0,2 мкг/кг массы тела в стерильном растворе 0,9% NaCl 10 инъекций через день. Морфологическое изучение легких проводили на 1, 10, 30, 40 и 50 сутки от начала опыта с соответствующим выведением животных из опыта методом цервикальной дислокации. Проводили биометрические исследования, определение цитограммы БАЛЖ и фагоцитарной активности AM. Клеточный состав БАЛЖ определяли окраской осажденных на покровные стекла клеток по Лейшману-Романовскому.
Результаты исследований представлены в таблицах 5 и 6. Полученные данные показывают, что после гипероксического повреждения у животных контрольной группы наблюдалось достоверное отставание в увеличении массы тела. В то же время, нарастание абсолютных и относительных значений массы сердца и легких свидетельствует о протекании в легких длительного патологического процесса с гемодинамическими нарушениями в малом круге кровообращения и компенсаторными явлениями гипертрофии миокарда. В легких происходило формирование эмфиземы, пневмосклероза, перибронхиального и периваскулярного фиброза. Процесс развития гипероксического повреждения сопровождался увеличением абсолютного количества нейтрофилов и лимфоцитов в БАЛЖ при том, что количество макрофагов практически не отличалось от нормы. Происходило достоверное снижение фагоцитарной активности AM на 10-е и 20-е сутки процесса.
Полученные данные свидетельствуют о том, что применение тетрапептида способствовало снижению выраженности патоморфологических изменений, таких как интерстициальный фиброз, образование очагов ателектазов, клеточной инфильтрации и, таким образом, способствовало более адекватному протеканию репаративных процессов в легких. Значения массы легких, сердца и замедление увеличения массы тела были менее выражены у подопытных животных по сравнению с животными контрольной группы. На фоне применения тетрапептида к 10-20-м суткам происходило достоверное уменьшение количества нейтрофилов, а также возрастание численности и фагоцитарной активности AM в БАЛЖ. В частности, на 10-е и 20-е сутки эксперимента фагоцитарный индекс составлял 50,8±2,3 и 45,5±2,6 по сравнению с показателями у животных контрольной группы - 27,3±2,7 и 26,4±2,8 соответственно (р<0,05).
Таким образом, в данной модели применение тетрапептида Ala-Glu-Asp-Leu в дозе 0,2 мкг/кг массы тела оказало протекторное действие на морфологию и физиологические функции легких.
Пример 5. Влияние тетрапептида на рост эксплантатов органотипической культуры легких половозрелых крыс.
Эксплантаты тканей легких половозрелых крыс линии Вистар культивировали в чашках Петри с коллагеновым покрытием дна. Питательная среда состояла из 35% среды Игла, 35% раствора Хенкса, 25% фетальной телячьей сыворотки и 5% куриного эмбрионального экстракта с добавлением глюкозы, инсулина, гентамицина и глютамина. Исследуемый тетрапептид Ala-Glu-Asp-Leu добавляли в культуральную среду в различной фиксированной концентрации от 0,01 до 20,0 нг/мл питательной среды. К эксплантатам контрольной группы добавляли такой же объем 0,9% раствора NaCl. После инкубирования в течение 3 суток при температуре 37°С оценивали увеличение площади эксплантатов под фазово-контрастным микроскопом. Биологическое действие препарата оценивали по изменению индекса площади (ИП) эксплантатов, выросших в среде с пептидом, по сравнению с контрольными.
Результаты эксперимента приведены в таблице 7, из которой следует, что тетрапептид Ala-Glu-Asp-Leu достоверно стимулирует рост эксплантатов органотипической культуры легких крыс в широком диапазоне концентраций от 1,0 до 10,0 нг/мл.
Таким образом, применение тетрапептида Ala-Glu-Asp-Leu способствует ускоренному обновлению клеточной популяции ткани легких с нормальными свойствами.
Пример 6. Изучение общетоксического действия тетрапептида.
Общетоксическое действие тетрапептида Ala-Glu-Asp-Leu исследовали в соответствии с требованиями “Руководства по экспериментальному (доклиническому) изучению новых фармакологических веществ” (2000): острой токсичности при однократном введении препарата, а также подострой и хронической токсичности при длительном введении тетрапептида.
Исследование по изучению острой токсичности проведено на 60 белых беспородных мышах-самцах массой 20-23 г. Животные были рандомизированно разделены на 6 равных групп. Препарат вводили животным однократно внутримышечно в объеме 0,25 мл в дозах 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг в стерильном 0,9% растворе NaCl. Животным контрольной группы в том же объеме вводили 0,9% раствор NaCl.
Исследования по изучению подострой токсичности проведено на 60 белых беспородных крысах-самцах массой 150-250 г. Ежедневно однократно животным подопытных групп вводили препарат внутримышечно в течение 90 дней в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл 0,9% раствора NaCl. Животным контрольной группы вводили в том же объеме 0,9% раствор NaCl. До введения препарата, на 30, 60 и 90 сутки после начала введения препарата у животных исследовали морфологический состав и свойства периферической крови. При завершении эксперимента исследовали биохимические и коагулологические показатели крови.
Исследования по изучению хронической токсичности проводили в течение 6 месяцев, исходя из длительности рекомендуемого клинического назначения препарата, на 100 морских свинках-самцах массой 300-350 г. Животные подопытных групп получали ежедневно однократно внутримышечно тетрапептид в течении 6 мес в дозах 1 мкг/кг, 0,1 мг/кг, 1 мг/кг в 0,5 мл 0,9% раствора NaCl. В контрольной группе животным вводили по аналогичной схеме 0,9% раствор NaCl в том же объеме. У животных в периферической крови общепринятыми методами определяли количество эритроцитов, гемоглобина, ретикулоцитов, тромбоцитов, лейкоцитов, лейкоцитарную формулу