Способ ингибирования роста опухолей головного мозга с помощью отобранных антагонистов интегринов
Иллюстрации
Показать всеИзобретение относится к медицине, онкологии, а именно к ингибированию роста опухолей головного мозга хозяина. Способ включает введение хозяину терапевтически эффективного количества антагониста интегрина αv, представляющего собой цикло(Arg-Gly-Asp-D-Phe-[N-Me]-Val). Способ позволяет значительно ингибировать онкогенез в головном мозге in vivo, в том числе независимо от антиангиогенеза, за счет индукции непосредственной гибели опухолевых клеток. 9 ил., 2 табл.
Реферат
Предпосылки изобретения
Область техники
Настоящее изобретение, в целом, относится к ингибированию роста опухолей, конкретно к ингибированию роста опухолей головного мозга.
Уровень техники
В описании настоящей заявки различные ссылки приводятся в круглых скобках. Описания этих публикаций целиком включены в настоящую заявку в качестве ссылок для более полного описания состояния области техники, к которой относится настоящее изобретение. Полные библиографические сведения по этим ссылкам можно найти в конце настоящей заявки, перед формулой изобретения.
Опухоли головного мозга, как и прочие солидные опухоли, требуют постоянного увеличения кровоснабжения для поддержания непрерывного роста свыше 1-2 мм3 (1,2). Это осуществляется с помощью ангиогенеза, процесса, который наблюдается в ответ на эндотелиальные факторы роста, высвобождаемые опухолевыми клетками. Ангиогенез включает индукцию пролиферации эндотелиальных клеток из микрососудистого русла, находящегося в состоянии покоя, миграцию неоэндотелия по направлению к опухолевому ложу и, наконец, созревание в новую капиллярную сеть (3). Опухоли головного мозга являются наиболее ангиогенными из всех новообразований у человека. Главными ангиогенными факторами, которые демонстрируются как гибридизацией in situ, так и специфичными антителами в срезах тканей пациентов с глиобластомой и медуллобластомой, наиболее распространенными злокачественными опухолями головного мозга, являются сосудистый эндотелиальный фактор роста (VEGF) и основной фактор роста фибробластов (bFGF) (4-7). Фактически, экспрессия VEGF и плотность микрососудов в глиальных опухолях прямо коррелирует со степенью злокачественных характеристик и общим результатом (8-9).
Недавно полученные данные наводят на мысль о том, что ангиогенез регулируется путем активации интегринов эндотелиальных клеток, семейства трансмембранных рецепторов, которые управляют адгезией клеток к белкам внеклеточного матрикса (ЕСМ), посредством связывания с аминокислотной последовательностью Arg-Gly-Asp (RGD) (10). В ответ на bFGF и VEGF эндотелиальные клетки увеличивают экспрессию интегринов αVβ3 и αVβ5, соответственно (11-13). Глиобластомы и эндотелий связанных с ними сосудов, как было установлено, экспрессируют интегрины αVβ3 и αVβ5 (14, 15). Опосредованная интегринами адгезия приводит к распространению внутриклеточных сигналов, которые способствуют выживанию, пролиферации и подвижности клеток, а также прорастанию капилляров (16, 17). Неспособность этих интегринов связаться с лигандом ведет к апоптозу эндотелиальных клеток (18, 19). Гликопротеин матрикса, витронектин, служит лигандом для αVβ3 и αVβ5 и вырабатывается в ведущем инвазивном крае злокачественных глиом (15, 20). Вместе эти открытия предполагают комплексное паракринное взаимодействие между опухолевыми клетками, ЕСМ головного мозга и интегринами эндотелиальных клеток для непрерывного ангиогенеза и роста злокачественных опухолей головного мозга.
Исследования с использованием анти-αVβ3 антитела, LM-609, или RGD циклического пептидного антагониста αVβ3 и αVβ5, который препятствует интегрин-ЕСМ взаимодействиям, показали реакцию, препятствующую ангиогенезу, в хориоаллантоисной мембране (САМ) цыплят и на мышиной химерной модели (21-23). Другие агенты, которые действуют на альтернативных участках процесса ангиогенеза, такие как антитела против VEGF или участка связывания с его рецептором тирозинкиназы, также были эффективны в отношении ингибирования ангиогенеза (24, 25).
Ранее проводившиеся исследования показали, что связывание клеток карциномы молочной железы, меланомы и аденокарциномы толстого кишечника HT29-D4 с витронектином зависит от αV, αVβ3 и αVβ5, соответственно (51-53). Витронектин, который вырабатывается опухолевыми и эндотелиальными клетками, распознается αVβ3 и αVβ5 и представляет собой белок ЕСМ, обнаруживаемый в участках инвазии и неоваскуляризации опухоли (54-55). Таким образом, помимо поддержки выживания эндотелиальных клеток посредством связывания с αV, и, следовательно, ангиогенеза, экспрессия витронектина может еще более усиливать адгезию опухолевых и эндотелиальных клеток, которые экспрессируют интегрины αVβ3 и αVβ5, что способствует их инвазии. В одном исследовании с использованием SCID мышиной/человеческой химерной модели рака молочной железы инвазия опухоли была значительно снижена после введения анти-αVβ3 антитела LM-609, что предполагает прямое воздействие на биологию опухолевых клеток посредством блокады αVβ3 (56).
Опухоли головного мозга, в силу их высокоинвазивной природы и высокой степени ангиогенеза, представляют собой отличную модель для дальнейшего изучения роли интегринов в прогрессировании опухолей. Многочисленные исследования показали, что плотность микрососудов коррелирует с исходами и степенью злокачественности астроцитом (57-59). Ингибиторы ангиогенеза, такие как TNP-470, тромбоспондин-1 и тромбоцитарный фактор 4, внедряли в экспериментальные опухоли головного мозга и показали ингибирование опухолевого роста (60-62). Однако до настоящего времени ни в одном исследовании не изучалось воздействие антагонизма в отношении интегринов на инвазию и ангиогенез опухолей головного мозга. Следовательно, существует необходимость изучения этого эффекта и, таким образом, создания нового способа лечения опухолей головного мозга.
Краткое описание изобретения
Настоящее изобретение основано на неожиданном открытии того факта, что направленный антагонизм в отношении интегринов, в частности, αVβ3 и αVβ5, может существенно ингибировать онкогенез головного мозга in vivo. Оно основано также на открытии того факта, что микроокружение опухоли головного мозга имеет ключевое значение для поведения опухоли и для определения ее чувствительности к таким биологически направленным лекарственным средствам. Настоящее изобретение основано также на открытии того факта, что антагонизм в отношении интегринов может оказывать антионкогенный эффект, независимо от анти-ангиогенеза, который может действовать синергически для задержки опухолевого роста. Например, именно настоящее изобретение открыло тот факт, что антагонизм в отношении интегринов может индуцировать непосредственную гибель клеток опухолей головного мозга.
Соответственно, в одном аспекте настоящего изобретения представляется способ ингибирования роста опухоли в головном мозге хозяина. Указанный способ включает введение хозяину, который нуждается в указанном ингибировании, терапевтически эффективного количества антагониста интегрина.
В одном варианте осуществления настоящего изобретения интегрин представляет собой αVβ3 или αVβ5. Антагонист представляет собой полипептидный антагонист α V, антитело против αVβ3, антитело против αVβ5 или комбинацию антител, соответственно, против αVβ3 и αVβ5.
Другим аспектом настоящего изобретения является представление способа ингибирования ангиогенеза в опухолевой ткани, расположенной в головном мозге хозяина. Указанный способ включает введение хозяину композиции, содержащей ингибирующее ангиогенез количество антагониста интегрина α V.
В одном варианте осуществления настоящего изобретения интегрин представляет собой αVβ3 или αVβ5. Антагонист представляет собой полипептидный антагонист αV, антитело против αVβ3, антитело против αVβ5 или комбинацию антител, соответственно, против αVβ3 и αVβ5.
Другим аспектом настоящего изобретения является представление способа ингибирования ЕСМ-зависимой клеточной адгезии клеток опухоли головного мозга, растущих в головном мозге хозяина. Указанный способ включает введение хозяину терапевтически эффективного количества антагониста интегрина αV, т.е. интегринов αVβ3 или αVβ5. В одном варианте осуществления настоящего изобретения антагонист представляет собой полипептидный антагонист αV или комбинацию антител, соответственно, против αVβ3 и αVβ5.
Еще одним аспектом настоящего изобретения является представление способа ингибирования витронектин-зависимой клеточной миграции в клетках опухоли головного мозга, растущих в головном мозге хозяина. Указанный способ включает введение хозяину терапевтически эффективного количества антагониста αV.
В одном варианте осуществления настоящего изобретения антагонист представляет собой полипептидный антагонист αV или антитело против αVβ3.
Еще одним аспектом настоящего изобретения является представление способа индуцирования апоптоза опухолевых клеток, растущих в головном мозге хозяина. Указанный способ включает введение хозяину терапевтически эффективного количества антагониста интегрина.
В одном варианте осуществления настоящего изобретения интегрин может представлять собой αVβ3 или αVβ5. Антагонист может представлять собой полипептидный антагонист αV.
Способы по настоящему изобретению хорошо подходят для применения при лечении опухолей головного мозга in vivo. Настоящее изобретение создает новый терапевтический подход к лечению опухолей головного мозга.
Описание фигур
Упомянутые выше и другие признаки настоящего изобретения, а также способ их достижения будут более ясными и доступными для понимания при использовании следующего описания в сочетании с прилагаемыми чертежами. Эти чертежи изображают только типичный вариант осуществления настоящего изобретения и не ограничивают, таким образом, его объем. Они служат целям достижения большей конкретности и детальности. На этих чертежах:
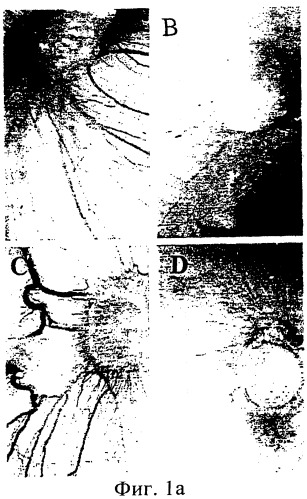
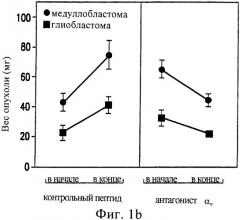
фиг.1а и 1b показывают ингибирование ангиогенеза (а) и роста опухоли на САМ (b) с помощью антагониста αV;
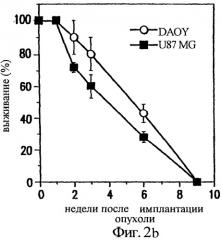
Фиг.2 показывает размер опухоли (А) и выживание мышей (В) после интрацеребральной инъекции клеток DAOY и U87MG;
фиг.3а и 3b показывают гистопатологию ортотопически инъецированных клеток опухоли головного мозга DAOY (а) и U87MG (b), у животных, ежедневно получавших неактивный (А) или активный пептид (B-D). Большие интрацеребральные опухоли (показаны стрелками) видны у контрольных животных (А), в то время как у животных, получавших αV-антагонист, опухоли не были выявлены (В) или были выявлены только микроскопические остаточные опухоли (С и D) (показаны стрелками);
фиг.4 показывает выживание мышей после ортотопической имплантации опухоли головного мозга, получавших активный или неактивный пептид;
фиг.5 показывает воздействие антагониста αV на ортотопически (в головной мозг) и гетеротопически (подкожно) имплантированные клетки DAOY;
фиг.6a-6d показывают профиль интегринов (а) и воздействие антагониста αV на адгезию (b), миграцию на витронектин (с) и жизнеспособность клеток на витронектине (d) для клеток опухоли головного мозга и клеток эндотелия капилляров головного мозга;
фиг.7 показывает воздействие циклического пентапептида на адгезию опухолевых клеток к белкам ЕСМ;
фиг.8 показывает эффект ингибирования адгезии, приводящий к гибели клеток (апоптозу), для клеток опухоли головного мозга и клеток капилляров головного мозга. Этот эффект ограничивается витронектином и тенасцином ЕСМ;
фиг.9 показывает иммуногистохимию опухолей головного мозга U87, ксенотрансплантированных в передний мозг бестимусных мышей, которых лечили активным (анти-αV) или контрольным пептидом.
Подробное описание изобретения
Одним аспектом настоящего изобретения является представление способа ингибирования опухолевого роста в головном мозге хозяина, включающего введение хозяину, который нуждается в указанном ингибировании, терапевтически эффективного количества антагониста интегрина.
Способ по настоящему изобретению можно использовать для лечения любых опухолей, которые растут в головном мозге, до тех пор, пока рост опухолей в головном мозге требует взаимодействия интегрина с его лигандом. Примеры такой опухоли включают, но не ограничивают, глиобластому, медуллобластому (астроцитому, другие примитивные злокачественные опухоли, происходящие из нейроэктодермы и стволовых клеток глии головного мозга). Для цели настоящего изобретения, предпочтительно, рост опухоли наблюдается интрацеребрально в головном мозге хозяина. Хозяином может быть любое млекопитающее, включая, без ограничения, крысу и человека. Рост опухоли ингибируется, если рост замедляется лечением.
Для цели настоящего изобретения интегрин представляет собой любой член специфического семейства гомологичных гетеродимерных трансмембранных рецепторов. Указанные рецепторы управляют адгезией клеток, посредством связывания с аминокислотной последовательностью Arg-Gly-Asp (RGD). Указанные рецепторы могут экспрессироваться как опухолевыми, так и нормальными клетками. Свойства интегринов хорошо известны и хорошо охарактеризованы и подробно описаны в цитируемых ссылках (1, 2), содержание которых, имеющее отношение к рассматриваемому вопросу, включено в настоящий документ в качестве ссылки.
Примеры интегринов включают, но не ограничивают, семейство αV, такие, как αVβ3, αVβ5, αVβ1, αVβ6αVβ 8 и т.п.
Антагонист интегрина представляет собой молекулу, которая блокирует или ингибирует физиологическую или фармакологическую активность интегрина путем ингибирования связывающей активности интегрина, рецептора, с его лигандом, различными белками матрикса, включая, без ограничения, витронектин, тенасцин, фибронектин и коллаген I. В одном варианте осуществления настоящего изобретения антагонист интегрина может представлять собой антагонист интегрина αVβ3 или интегрина αVβ5. Предпочтительные антагонисты интегрина могут представлять собой моноклональное антитело, фрагмент моноклонального антитела или пептид.
Например, антагонистом αVβ3 может быть любой фактор, который ингибирует связывание αVβ3 с одним из его многочисленных лигандов, а именно витронектином или тенасцином. Примеры антагонистов αVβ3 описаны в РСТ публикациях WO 96/37492 и WO 97/45137, содержание которых, имеющее отношение к рассматриваемому вопросу, включено в настоящий документ в качестве ссылки.
Подобно этому, антагонистом αVβ5 может быть любой фактор, который ингибирует связывание αVβ5 с его лигандом, а именно витронектином. Примеры антагонистов αVβ5 описаны в РСТ публикации WO 97/06791, содержание которой, имеющее отношение к рассматриваемому вопросу, включено в настоящий документ в качестве ссылки.
В одном варианте осуществления настоящего изобретения антагонист представляет собой полипептидный антагонист αV, а именно, полипептидный антагонист αVβ3 и αVβ5. Предпочтительно, полипептид представляет собой полипептид, содержащий Arg-Gly-Asp (RGD). В одном варианте осуществления полипептидный антагонист представляет собой RGD циклический пентапептидный антагонист αV.
В соответствии с другим вариантом осуществления настоящего изобретения, антагонист может представлять собой моноклональное антитело, иммуноспецифичное в отношении αVβ3 или αVβ5. Альтернативно, он может представлять собой комбинацию антител, соответственно, против αVβ3 и αVβ5. В одном варианте осуществления моноклональное антитело, иммуноспецифичное в отношении αVβ3, имеет иммунореактивные характеристики моноклонального антитела, обозначаемого как LM-609. В другом варианте осуществления моноклональное антитело, иммуноспецифичное в отношении αVβ5, имеет иммунореактивные характеристики моноклонального антитела, обозначаемого как Р1-F6. Как антитело LM-609, так и антитело P1-F6, хорошо известны в промышленности и являются коммерчески доступными от компании Chemicon, Temecula, California.
Для цели настоящего изобретения антагонисты можно использовать в отдельности или в комбинации друг с другом в способе по настоящему изобретению для ингибирования роста опухолей головного мозга.
Терапевтически эффективное количество представляет собой количество антагониста, достаточное для обеспечения поддающегося измерению ингибирования роста опухоли в головном мозге хозяина, подвергаемого лечению. Ингибирование роста опухоли можно определять микроскопически после окрашивания, как описано в настоящем документе, MRI-сканированием головного мозга мыши или инкорпорацией 3Н-тимидина; все эти методики хорошо известны специалистам.
Поскольку антагонист интегрина может принимать форму RGD-содержащего пептида, анти-αVβ3 моноклонального антитела или его фрагмента, анти-αVβ5 моноклонального антитела или его фрагмента, или комбинации моноклональных антител αVβ3 и αVβ5, следует оценить тот факт, что эффективность, и, следовательно, понятие “терапевтически эффективное количество” может варьироваться. Однако, как показано с помощью настоящих методик исследования, специалист может легко оценить эффективность антагониста-кандидата по настоящему изобретению.
Эффективность антагониста можно измерить с помощью ряда способов, включая, без ограничения, ингибирование ангиогенеза в анализе САМ, изучении опухоли in vitro и путем измерения ингибирования связывания натуральных лигандов с интегринами, такими как αVβ3 или αVβ5, как описано в настоящем документе, и с помощью других подобных исследований.
Пределы доз для введения антагониста зависят от формы антагониста и его эффективности в отношении конкретного интегрина. Специалист может подобрать подходящую дозу для конкретного антагониста с учетом описания настоящего изобретения без излишнего экспериментирования. Доза должна быть достаточно велика, чтобы оказывать желаемое действие, благодаря которому рост опухоли головного мозга ингибируется. Доза не должна быть настолько большой, чтобы вызывать появление побочных эффектов, таких как отек мозга или быстрое высвобождение цитокинов из опухолей мозга, индуцирующее кахексию, например, когда антагонист интегрина по настоящему изобретению вводится в форме полипептида. Доза на кг массы тела может варьировать от 1 до 20 мг, при введении один или более раз в день, в течение одного или нескольких дней, или в течение неопределенного периода времени. Когда антагонист интегрина по настоящему изобретению вводят в форме моноклонального антитела, доза может варьироваться от 1 до 20 мг/кг, при введении один-два раза в неделю в течение неопределенного периода времени.
Полипептид или моноклональные антитела по настоящему изобретению можно вводить парентерально путем инъекции или постепенной инфузии в течение некоторого периода времени. Несмотря на то, что ткань, подлежащую лечению, наиболее часто лечат интраперитонеальным или подкожным (антитело) введением, антагонисты по настоящему изобретению можно вводить также интраокулярно, внутривенно, внутримышечно, внутриполостным введением, чрескожно, и использовать при этом перистальтические технические средства.
Композиции вводят таким способом, который является совместимым с данной лекарственной формой и в терапевтически эффективном количестве. Количество для введения, а также время введения зависят от субъекта, подвергаемого лечению, способности организма субъекта утилизировать активный ингредиент и степени желательного терапевтического эффекта. Точные количества активного ингредиента, которые требуются для введения, зависят от оценки практикующего врача и являются индивидуальными для каждого субъекта. Однако подходящие пределы доз для системного введения описываются в настоящем документе и зависят от пути введения. Подходящие схемы введения также разнообразны, однако типизируются первоначальным введением, с последующими повторными дозами с интервалами один или более часов инъекцией или другим способом введения.
В соответствии с одним вариантом осуществления настоящего изобретения, настоящее изобретение относится также к фармацевтической композиции, пригодной для осуществления на практике терапевтических способов, описанных в настоящем документе. Композиции содержат антагонист по настоящему изобретению в комбинации с фармацевтически приемлемым носителем. Используемые в настоящем документе термины “фармацевтически приемлемый” “физиологически переносимый” и их грамматические варианты, которые относятся к композициям, носителям, разбавителям и реагентам, используются взаимозаменяемым образом и означают, что указанные материалы можно вводить млекопитающему без нежелательных физиологических эффектов.
Препараты для парентерального введения пептида или антитела по настоящему изобретению включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и пригодные для инъекций органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, включая солевые и буферные среды. Парентеральные носители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, раствор Рингера с лактатом или жирные масла. Внутривенные носители включают жидкостные и питательные восполнители, электролитные восполнители (такие как восполнители на основе декстрозы Рингера) и т.п. Консерванты и другие добавки также могут иметь место, такие как, например, антимикробные, антиоксидантные, хелатирующие агенты, а также инертные газы и т.п.
Другой особенностью настоящего изобретения является способ ингибирования ангиогенеза в опухолевой ткани, расположенной в головном мозге хозяина. Указанный способ включает введение хозяину композиции, включающей ингибирующее ангиогенез количество антагониста интегрина.
Как обсуждалось в разделе “Предпосылки к созданию изобретения” ангиогенез представляет собой образование неоваскулярной сети из уже существующих сосудов хозяина и требуется для роста опухоли свыше 1-2 мм3. Для цели настоящего изобретения ангиогенез подавлен, если ангиогенез и симптомы заболевания, опосредованного ангиогенезом, уменьшаются.
В одном варианте осуществления настоящего изобретения опухолевая ткань находится интрацеребрально, в головном мозге хозяина. Хозяином может быть любое млекопитающее. Примеры хозяина включают, без ограничения, мышь, крысу и человека.
Диапазоны доз для введения антагониста зависят от формы антагониста и его эффективности в отношении конкретного интегрина. Специалист может подобрать подходящую дозу для конкретного антагониста с учетом описания настоящего изобретения без излишнего экспериментирования. Доза должна быть достаточно велика, чтобы оказывать желаемое действие, благодаря которому ангиогенез и симптомы заболевания, опосредованного ангиогенезом, уменьшаются. Доза не должна быть настолько большой, чтобы вызывать появление побочных эффектов, таких как отек мозга из-за быстрого лизиса опухоли с высвобождением цитокинов или кровотечением.
В одном варианте осуществления настоящего изобретения антагонист интегрина может представлять собой антагонист интегрина αVβ3 или интегрина αVβ5. Предпочтительными антагонистами интегрина могут быть моноклональное антитело или пептид. В одном варианте осуществления настоящего изобретения антагонист представляет собой полипептидный антагонист αV, а именно, полипептидный антагонист αVβ3 и αVβ5. Предпочтительно, полипептид представляет собой полипептид, содержащий Arg-Gly-Asp (RGD). В одном варианте осуществления полипептидный антагонист представляет собой RGD циклический пентапептидный антагонист αV.
В соответствии с другим вариантом осуществления настоящего изобретения, антагонистом может быть антитело против αVβ3 и комбинация антител, соответственно, против αVβ3 и αVβ5.
Терапевтически эффективное количество представляет собой количество антагониста, достаточное для обеспечения поддающегося измерению ингибирования ангиогенеза в ткани, подвергаемой лечению, т.е. количество, ингибирующее ангиогенез. Ингибирование ангиогенеза можно измерить in situ методами иммуногистохимии, как описано в настоящем документе, или с помощью других методик, известных специалистам.
В соответствии с одним вариантом осуществления настоящего изобретения, настоящее изобретение относится также к фармацевтической композиции, пригодной для осуществления на практике терапевтических способов, описанных в настоящем документе. Композиции содержат антагонист по настоящему изобретению в комбинации с фармацевтически приемлемым носителем.
Еще одной особенностью настоящего изобретения является способ ингибирования ЕСМ-зависимой клеточной адгезии клеток опухоли головного мозга, которые растут в головном мозге хозяина, который включает введение хозяину терапевтически эффективного количества антагониста интегринов αVβ3 или αVβ5.
Для цели настоящего изобретения ЕСМ-зависимая клеточная адгезия включает любую клеточную адгезию, которая зависит от ЕСМ и которая опосредована αV-интегринами. Примеры указанной адгезии включают, без ограничения, витронектин-зависимую клеточную адгезию и тенасцин-зависимую клеточную адгезию. Именно настоящее изобретение открыло то, что опухоли головного мозга человека могут вырабатывать витронектин и тенасцин, а ЕСМ играет важную роль в адгезии опухолевых клеток и миграции посредством взаимодействия с интегринами. Для цели настоящего изобретения ингибирование достигается, если адгезия опухолевых клеток к ЕСМ уменьшается.
Фраза “терапевтически эффективное количество”, используемая в настоящем документе, означает количество антагониста, которое достаточно для уменьшения ЕСМ-опосредованной адгезии опухолевых клеток. Клеточную адгезию можно измерить с помощью способов, описанных в настоящем документе, а также способов, хорошо известных специалистам.
В соответствии с одним вариантом осуществления настоящего изобретения антагонист может представлять собой полипептидный антагонист αV или комбинацию антител, соответственно против αVβ3 и αVβ5. Например, антагонист может представлять собой RGD циклический пентапептидный антагонист αV или комбинацию моноклональных антител, обозначаемых как LM-609 и P1-F6.
Другой особенностью настоящего изобретения является способ ингибирования витронектин-зависимой клеточной миграции клеток опухоли головного мозга, растущей в головном мозге хозяина, который включает введение хозяину терапевтически эффективного количества антагониста αVβ3.
Для цели настоящего изобретения ингибирование достигается, если миграция опухолевых клеток уменьшается.
Фраза “терапевтически эффективное количество”, используемая в настоящем документе, означает количество антагониста, которое достаточно для уменьшения витронектин-зависимой миграции опухолевых клеток. Миграцию клеток можно измерить с помощью способов, описанных в настоящем документе, а также способов, хорошо известных специалистам.
В соответствии с одним вариантом осуществления настоящего изобретения антагонист может представлять собой полипептидный антагонист αV или моноклональное антитело, иммунореактивное в отношении αVβ3. Например, антагонист может представлять собой RGD циклический пентапептидный антагонист αV или моноклональное антитело, обозначаемое как LM-609.
Настоящее изобретение относится также к способу индуцирования апоптоза клеток опухоли головного мозга, растущей в головном мозге хозяина. Указанный способ включает введение хозяину терапевтически эффективного количества антагониста интегрина.
Для цели настоящего изобретения апоптоз клеток опухоли головного мозга индуцируется, если после введения антагониста наблюдается увеличение количества апоптоза опухолевых клеток головного мозга. Терапевтически эффективное количество представляет собой количество антагониста, достаточное для получения поддающегося измерению апоптоза опухолевых клеток в головном мозге хозяина, подвергаемого лечению. Апоптоз опухолевых клеток в головном мозге можно измерить с помощью способов, описанных в настоящем документе, а также способов, хорошо известных специалистам.
В соответствии с одним вариантом осуществления настоящего изобретения, интегрин может представлять собой αV, αVβ3 или αVβ5. Антагонист может представлять собой полипептидный антагонист αV.
ПРИМЕРЫ
Материалы и методы
Материалы: Активный циклический RGD пентапептид EMD 121974, цикло(Arg-Gly-Asp-D-Phe-[N-Me]-Val) и неактивный контрольный пептид cRAD (EMD 135981) были предоставлены А. Jonczyk, Ph.D., Merck KgaA, Darmstadt, Germany. Моноклональные антитела LM-609 и P1-F6 описаны (13). Клеточные линии опухоли головного мозга DAOY и U87MG были приобретены в АТСС, Rockville, MD. Первичные культуры эндотелиальных клеток капилляров головного мозга человека были предоставлены M.Stins, Ph.D., Children’s Hospital, Los Angeles (49). Человеческий витронектин был приобретен у компании Promega, Madison, WI.
Анализ FACS: использовался цитометр FACS (Becton-Dickinson, San Jose). Условия описаны ранее (43). Первичные антитела представляли собой LM-609 и P1-F6 при 1:100, а вторичные Аb представляли собой меченные FITC антимышиные IgG козы при 1:250. Определение апоптоза производилось согласно инструкциям производителя (Clontech, Palo Alto, CA, набор для определения апоптоза Аро Alert Annexin V-FITC).
Адгезия: Условия анализа были описаны ранее (15). Лунки, обработанные нетканевой культурой, инкубировали в течение ночи при 4° С с витронектином (1-10 мкг/мл PBS), промывали и блокировали в течение 30 мин денатурированным нагреванием 1% BSA в PBS, после чего промывали PBS. Контрольные и тест-клетки, предварительно инкубированные при 37° С с испытуемым веществом (20 мкг/мл) в адгезионном буфере в течение 30 мин, засевали в лунки (5× 104 клеток на лунку) и инкубировали в течение 1 ч при 37° С. После осторожного промывания лунок адгезионным буфером прикрепившиеся клетки фиксировали и окрашивали кристаллическим фиолетовым, краской, растворенной в метаноле и определяли оптическую плотность (ОП) при 600° А.
Миграция: Межлуночные поликарбонатные фильтры (размер пор 8 мкм) инкубировали в течение 30 мин при 37° С с витронектином в PBS (1 мкг/мл на верхней стороне и 10 мкг на стороне дна), блокировали в течение 30 мин денатурированным нагреванием 1% BSA в PBS и промывали PBS. Тест-клетки (5× 104 клеток на лунку) добавляли в адгезионный буфер, содержавший указанные испытуемые вещества (20 мкг/мл), и инкубировали в течение 4 ч при 37° С; при этом нижняя камера содержала адгезионный буфер. Клетки из верхней камеры удаляли марлевой салфеткой, а клетки из донной части фильтра фиксировали и окрашивали кристаллическим фиолетовым, а количество мигрировавших клеток определяли путем подсчета.
Апоптоз: Условия адгезии описаны выше, за исключением того, что 12-ячеечные чашки покрывали витронектином, а 5× 105 клеток на лунку засевали в адгезионный буфер. После 30 мин инкубации при 37° С адгезионный буфер заменяли буфером, содержавшим 20 мкг/мл активного cRGD или неактивного cRAD пептида, и инкубировали в течение еще 4 ч. Прикрепившиеся клетки трипсинизировали и объединяли с открепившимися клетками в надосадочной жидкости, а затем исследовали на предмет апоптоза клеток с использованием набора для определения апоптоза Аро Alert Annexin V-FITC (Clontech).
Анализ САМ: Получение и подготовка яиц к эксперименту описаны ранее (23). Опухолевые клетки засевали в 50 мкл PBS в количестве 4× 106 клеток на яйцо для DAOY и в количестве 3,5× 106 клеток на яйцо для U87MG. Клетки выращивали до опухолей в течение 7 дней, затем собирали в стерильных условиях, обрезали до одинаковых размеров и повторяли процедуру на САМ 10-дневных эмбрионов. На следующий день в вену САМ инъецировали активный или неактивный пептид (100 мкг на яйцо). Опухоли фотографировали in situ через 7 дней роста, затем собирали, взвешивали и фиксировали в 4% формалине с буфером и заливали парафином. После получения серийных срезов, препараты окрашивали гематоксилином и эозином.
Модель опухоли головного мозга: Детально модель описана заявителями (31). Опухолевые клетки (106/10 мкл PBS) инъецировали интрацеребрально в указанных участках. Интраперитонеальное лечение активным cRGD или неактивным cRAD пептидом (100 мкг/ 50 мкл/мышь) начинали на 3 день после имплантации для клеток U87MG и на 10 день для клеток DAOY и повторяли ежедневно до тех пор, пока не появлялось состояние кахескии и/или агонии. Животных затем умерщвляли с использованием анестезии СO2, головной мозг удаляли и быстро замораживали или фиксировали в формалине с буфером, заливали в парафин и полученные срезы окрашивали гематоксилин-эозином.
Подкожный рост опухоли: Для подкожного роста опухоли клетки (106 на мышь) инъецировали п/к под правую переднюю лапу немедленно после интрацеребральной инъекции.
Исследования на животных: Исследования на животных проводили согласно руководству NIH и с разрешения местного комитета защиты животных.
Эксперименты
Ангиогенез на САМ
Для оценки влияния антагонизма в отношении αV на ангиогенез, связанный с опухолью головного мозга, клетки опухоли головного мозга человека DAOY и U87MG выращивали на хориоаллантоисной мембране (САМ) цыплят. Опухолям позволяли расти в течение 7 дней, после чего их удаляли и реимплантировали на свежие САМ. Через 24 часа после переноса 100 мкг активного пептида cRGD или контрольного пептида (cRAD) инъецировали в вену САМ. Опухоли выращивали еще 6 дней, а затем взвешивали и анализировали на предмет васкуляризации. При изучении под стереоскопическим микроскопом опухоли, получавшие контрольный пептид, демонстрировали распространенный ангиогенез, в то время как опухоли, получавшие антагонист αV, демонстрировали достоверное подавление ангиогенеза (фиг.1a).
Рост опухолей также ингибировался антагонистом αV. В противоположность контрольным опухолям, вес которых увеличился на 80%, вес опухолей, леченных антагонистом αV, уменьшался на 30% (фиг.1b). Эти данные предполагают, что ингибирование опухолевого роста антагонизмом в отношении αV приводят к нарушению ангиогенеза, связанного с опухолью.
Фиг.1а и 1b показывают ингибирование ангиогенеза (а) и опухолевого роста на САМ (b) антагонистом αV. Опухоли головного мозга, выращенные на САМ, собирали и нарезали на кусочки одинаковых размеров и помещали на свежие САМ яиц с 10-дневными эмбрионами. На следующий день в вены цыплят инъецировали 100 мкг активного ингибитора αV или контрольного пептида и выращивали еще в течение 6 дней. В яйцах, которые получали контрольный пептид, наблюдался достоверный ангиогенез (а) (DAOY=A и U87MG=C), в то время как в яйцах, получавших активный пептид, наблюдалось достоверное подавление неоваскуляризации (DAOY=B и U87MG=D). Опухоли, помещенные на САМ, взвешивали в начале и в конце эксперимента (b). Вес опухолей, обработанных контрольным пептидом, увеличивался на 80%