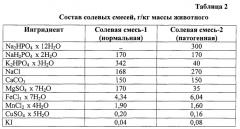
Способ моделирования электролитной нефропатии у крыс
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальной нефрологии, и может быть использовано для изучения механизмов формирования, развития и коррекции заболеваний почек. Предлагается способ моделирования электролитной нефропатии у крыс, основанный на использовании специальной полусинтетической диеты, нагруженной солями двузамещенного фосфорнокислого водного натрия при дефиците калия и магния, ежедневных внутримышечных введений суспензии гидрокортизона ацетата с одновременной заменой питьевой воды 1%-ным раствором хлорида натрия. Данный способ позволяет получить новую экспериментальную модель, наиболее точно отражающую электролитные, липидные и морфологические изменения в почках крыс, в основе которой лежит электролитная нефропатия. Предложенная модель проста в исполнении, отличается хорошей воспроизводимостью, отсутствием летального исхода экспериментальных животных и небольшим периодом развития нефрологической патологии. 4 табл., 4 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной нефрологии, и может быть использовано для изучения механизмов формирования, развития и ремиссии заболеваний почек.
При изучении механизмов физиологического и лечебного действия физических факторов, выяснении роли органов и систем, и особенно их взаимоотношений при влиянии физических факторов на организм, исключительно важен экспериментальный подход. Верное суждение о некоторых реакциях организма и его отдельных систем на внешнее воздействие можно иметь, только проверив их экспериментально. Экспериментальный метод позволяет моделировать патологические состояния и изучать особенности механизма действия физических факторов на органном, тканевом, клеточном уровнях с применением методов анализа, невозможных при клинических наблюдениях.
Вопросы изучения формирования и коррекции заболеваний почек обычно проводятся с использованием экспериментальных моделей пиелонефрита, гломерулонефрита, мочекаменной болезни, почечной недостаточности [1, 3]. У человека изменения такого характера вызывают полиорганное поражение органов и систем, функционирование которых определяется состоянием данного вида обменов. Каждая экспериментальная модель отражает развившуюся конкретную нефрологическую нозологию. Сегодня не существует модели нефропатии, отражающей основные нарушения водного, электролитного, азотистого, липидного обмена и патофизиологические механизмы, приводящие к развитию нефрологической патологии и характерные для многих заболеваний почек.
Методы моделирования патологических процессов в почках могут осуществляться путем введения животным некоторых неорганических и органических веществ (сулемовый некроз, отравления препаратами мышьяка, урана, ртути, хрома, свинца и т.д.). Однако данные патологические состояния вызывают избирательное поражение того или иного отдела нефрона [6]. Например, при использовании урана, ртути, кантаридина имеет место преимущественно поражение дистального отдела извитых канальцев первого порядка, в то время как соли хрома вызывают в первую очередь дистрофию их проксимальных отрезков. Действие одних препаратов сопровождается преимущественным поражением канальцев коркового слоя, других - мозгового.
Из существующих моделей обменного генеза (нефрокальциноза), вызываемых паратгормоном, тахистином-дигидротахистероном, этиленгликолем, витамином D2, Юрьева Э.А. (1979) выделила модель дизметаболической кальцификации почек, вызванную токсическими дозами эргокальциферола, так как она в большей степени отражает определенные морфологические и биохимические изменения в почках, характерные для таких заболеваний почек как дизметаболический нефрит и нефролитиаз. Особенностью механизма повреждающего действия витамина D2 при создании модели нефрокальциноза является кальцифицирующий мембранолиз - одна из причин вторичной гипероксалурии [5, 8]. Недостатком данной экспериментальной модели является высокая смертность животных вследствие быстрого развития почечной недостаточности вплоть до анурии, высокой степени гиперкальций- и гиперфосфатемии, множественное отложение кальцификатов в почечной ткани.
Следует ожидать, что повреждение почечной ткани должно быть более выражено при воздействии комбинации различных патогенных факторов. Например, недостаток витамина А в пищевом рационе вызывает развитие почечнокаменной болезни в основном за счет формирования фосфатных камней. Когда же в диете уменьшалось и содержание витамина Р, камни в основном состояли из карбонатов, так как увеличивалась кислотность мочи [6]. Известны способы оперативного развития стероидных нефропатий путем кастрации животных, одно- и двусторонней нефрэктомии. Однако данные методы воспроизведения заболеваний почек вызывают в организме животного значительные нейро-гуморальные сдвиги, среди которых изменение размера почек является лишь маленькой частью [2, 10]. Трудно в данном случае приписывать какое-либо “ренотропное” действие изучаемым препаратам только на основании того, что его введение кастрированному животному или в случае нефрэктомии вызывает увеличение размера почек. Данные модели технически сложны в исполнении, сопровождаются летальностью животных во время оперативного вмешательства, что проводит к удорожанию экспериментальных исследований.
В патогенезе обменных и воспалительных механизмов при заболеваниях почек ведущее значение отводится нарушениям электролитного, азотистого, липидного обмена. Дисэлектролитемическая нефропатия у больных характеризуется нарушением функций отдельных частей нефрона, вызываемая в основном дефицитом калия, магния. Данные метаболические нарушения часто обусловлены вторичными нефропатиями, когда основное заболевание влечет за собой развитие электролитного дисбаланса, сопровождающегося поражением почек. При дефиците калия наблюдаются дегенерация клеток эпителия восходящих отделов петель Генле, выраженные изменения состояния кислых мукополисахаридов в интерстициальной ткани [11]. Недостаток магния вызывает тяжелое поражение почечной ткани с отложением солей кальция, нарушение транспорта калия и натрия внутрь клетки [9, 12].
В эксперименте показано, что высокожировая диета вызывает лишь умеренные изменения в клубочках, а ее применение на фоне исходного поражения почек при экспериментальном нефрите, электролитном дисбалансе приводит к быстрому развитию гломерулосклероза [3, 14]. Известно, что скорость прогрессирования почечной недостаточности определяется как самой нефрологической патологией, так и нарушением липидного обмена, являющегося одним из индукторов прогрессирования склеротических процессов. Существующая полиорганнность поражения, сопутствующие нарушения липидного обмена, усугубляющие склерозирование почечной ткани, определяют научный интерес к моделированию патологического состояния в мочевыделительной системе, обусловленного несколькими патогенными факторами и отражающего основные патофизиологические нарушения, являющиеся основой развития заболеваний почек. В литературе существует техническая модель “Способ моделирования инфарктоидной кардиовазопатии у крыс” (Патент 21092048 RU, МПК 7 G 09 В 23/28) Т.П.Новгородцевой (2000 г.), представляющая способ моделирования инфарктподобного состояния у крыс, в основе которого положен электролитный и стероидный дисбаланс, сопровождающийся некрозами сердца [4]. Моделирование кардивазопатии включало несколько патогенных факторов, запускающих нарушения разного генеза. Пусковым механизмом развития данного патологического состояния сердечно-сосудистой системы являлась односторонняя нефрэктомия, приводящая к грубому нарушению электролитного обмена, функции почек и усугубляемая используемым дисбалансом электролитов с пищей за счет избытка солей натрия и кальция на фоне дефицита калия и магния и разрешающим агентом было воздействие холодового стресса [7, 10]. Недостатком моделирования кардивазопатии является смертность животных в послеоперационном периоде в 2% случаев, обусловленная почечной недостаточностью, значительным электролитным дисбалансом, миокардиодистрофией и некрозом сердечной мышцы.
Конкретных рекомендаций по моделированию полигенных нарушений в почечной ткани крыс посредством влияния описанных патогенных факторов или их сочетаний в литературе нет.
Для решения научных и прикладных задач, довольно часто требуется создание экспериментальной модели с метаболическими изменениями как в биологических средах организма, так и в почках животных, но с минимальной их смертностью. Такие модели практически отсутствуют.
Задача изобретения - создание экспериментальной модели, наиболее точно отражающей электролитные, липидные и морфологические изменения в почках крыс при наименьшей смертности животных, для изучения механизмов формирования, развития и коррекции нефрологической патологии.
Для решения поставленной задачи использовались белые крысы линии Вистар, выведенных в питомнике РАМН “Столбовая” (ветеринарное свидетельство №17 от 12.09.96). Для воспроизведения экспериментальных моделей использованы половозрелые особи мужского пола, средней массой 180,5±10,6 г.
Способ моделирования электролитной нефропатии осуществляют следующим образом. Животные в течение 12 дней находятся на специальной полусинтетической диете с добавлением солевой смеси, нагруженной солями двузамещенного фосфорнокислого водного натрия (Na2HPO4×12H2O) на фоне значительного дефицита калия и магния (табл.1, 2). В период содержания на полусинтетической диете питьевую воду у животных заменяют на 1%-ный раствор хлорида натрия, проводят ежедневное однократное внутримышечное введение суспензии гидрокартизона ацетата (из расчета 100 мкг/д). Доказательством развития модели у животных служат характерные морфологические изменения в почках. Отсева животных при развитии модели нефропатии не отмечено.
Сенсибилизация почечной ткани крыс вызывалась назначением животным специального питания, представляющего собой полусинтетическую нефровазопатогенную диету, насыщенную электролитами натрия при резком дефиците калия и магния. Обуславливающим фактором служили внутримышечные инъекции гидрокартизона ацетата, усугубляющего используемые нагрузки натрия. Дефицит калия, возникающий при избытке гормонов в крови, вызывает нарушение концентрационной способности почек, снижает чувствительность дистальных канальцев к АДГ, нарушает функции клеточных насосов, вследствие чего уменьшаются реабсорбция натрия и содержание его в мозговом веществе почки [11]. Время экспозиции патогенных факторов и характер развития патологического процесса определялись результатами морфологических исследований почек крыс, выводимых из эксперимента для проверки модели. Исключение из диеты патогенных факторов способствовало улучшению течения патологического процесса и снижению смертности животных. Из стандартной полусинтетической диеты был исключен холестерин, как один из факторов активизирующих липидные нарушения, процессы склерозирования сосудов и влияющий на смертность животных [13]. Среди патогенетически ориентированных факторов наиболее значимой была солевая нагрузка. Электролитный дисбаланс вызывался резким дефицитом солей калия и магния в суточном рационе (менее 50 г/кг) и избытком солей натрия, значительную роль при этом играло патологическое соотношение K/Na (1:18 в сравнении с нормальным 1:0,9). Таким образом удалось получить модель нефропатии, характеризующейся дисэлектролитемией, дислипидемией, нефрокальцинозом, но с максимальной выживаемостью подопытных животных. Состав полусинтетической диеты и солевой смеси, используемых при моделировании нефропатии, представлены в таблицах 1, 2.
Развитие модели сопровождается нарушениями электролитного, азотистого и липидного обмена (табл.3, 4). При моделировании нефропатии отмечалось снижение в сыворотке крови концентрации ионов калия на 10,1% и магния - на 63,3% (р<0.01), увеличение концентрации кальция на 8% в сравнении с таковыми показателями в контрольной группе. В моче экспериментальных животных отмечалось увеличение концентрации ионов натрия на 13,9% и снижение концентрации калия - на 15,7%, кальция - на 41,3%, магния - на 12,7%. Экспериментальная модель нефропатии характеризовалась снижением у животных суточного диуреза на 28,9%, повышением в сыворотке крови концентрации продуктов азотистого обмена на 60,7% (р<0.01) и снижением таковых в моче на 12,8% (р<0.02), сопряженных со снижением канальцевой реабсорбции, почечного клиренса и суточной экскреции данных метаболитов на 36,1% (р<0.02).
Моделируемое патологическое состояние характеризовалось увеличением общего холестерина (ХС) на 24% (р<0,05), содержание холестерина липопротеидов низкой плотности (ХС ЛПНП) увеличивалось на 64% (р<0,05). Наблюдалась тенденция к снижению холестерина липопротеидов высокой плотности (ХС ЛПВП). Индекс атерогенности (ИА) увеличился на 87,9%.
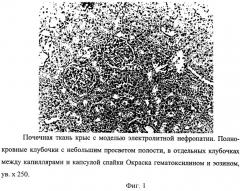
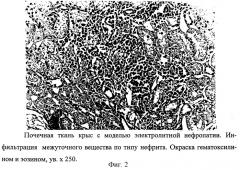
Развитие модели сопровождается появлением морфологических нарушений в почечной ткани крыс, подтвержденных данными гистологического исследования. Почки животных с экспериментальной нефропатией характеризовались увеличением размеров в среднем в 1,2 раза за счет коркового и мозгового слоев. В отличие от почек интактных животных они были светлее, на поверхности определялись вкрапления серого цвета, в некоторых клубочках между капиллярами и капсулой спайки (фиг.1). При гистологическом исследовании между корковым и мозговым веществом, в эпителии и базальных мембранах извитых канальцев обнаружена пролиферативная инфильтрация. Выявлялись дистрофические изменения почечных канальцев на всем протяжении, продуктивная реакция в строме по типу межуточного нефрита мозгового вещества (фиг.2). В просвете извитых канальцев выявлено формирование микролитов в сочетании с некрозом эпителия (фиг.3), часть канальцев выстлана кубическим эпителием, в тонком отделе канальцев и в собирательных трубочках вакуолизация цитоплазмы клеток (фиг.4).
Предлагаемый способ моделирования электролитной нефропатии несложен в техническом воспроизведении и наиболее полно отражает патологические изменения в почках при нефрологических заболеваниях. Экономически развитие данной модели является выгодным. Во-первых, для создания модели могут быть использованы крысы - наиболее доступный биологический вид; во-вторых, отсутствует отсев животных; в-третьих, животные с моделью электролитной нефропатии могут в течение 2-х месяцев использоваться для последующих экспериментальных исследований, что является важным и соответствует поставленной цели.
Таким образом, проведенные исследования позволили получить новую экспериментальную модель дисэлектролитемической, дислипидемической патологии почек у крыс, в основе которой лежит электролитная нефропатия. Предложенная модель проста в исполнении, отличается хорошей воспроизводимостью, отсутствием летального исхода экспериментальных животных и небольшим периодом развития нефрологической патологии.
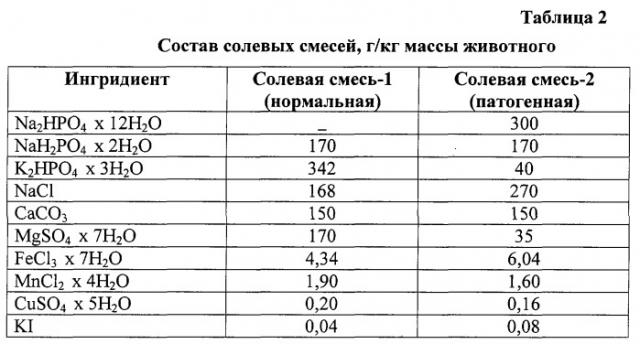
| Таблица 1Состав полусинтетической диеты для крыс, г/кг животного | ||
| Ингредиенты | Нормальная диета | Патогенная диета |
| Казеин | 180 | 300 |
| Рыбий жир | 10 | 10 |
| Маргарин | 90 | 45 |
| Сало | - | 45 |
| Сухие дрожжи | 30 | 20 |
| Солевая смесь-1 | 40 | - |
| Крахмал | 650 | 510 |
| Витамин Д2, мг | - | 15 |
| Солевая смесь-2 | - | 50 |
| Сухая желчь | - | 10 |
| Таблица 3Показатели электролитного обмена у животных с моделью электролитной нефропатии | ||||
| Показатели | Концентрация | Суточная экскреция (ммоль/сут) | Почечный клиренс (мл/мин) | |
| в крови (ммоль/л) | в моче (ммоль/л) | |||
| Натрий | ||||
| Калий | ||||
| Кальций | ||||
| Магний | ||||
| Неорг. фосфор | ||||
| Оксалаты | - | - | ||
| Фосфолипиды, % | - | - | ||
| Примечание: в числителе лабораторные значения экспериментальных животных с моделью нефропатии, в знаменателе - интактных животных. |
| Таблица 4Биохимические показатели в сыворотке крови крыс | ||
| Показатели, ммоль/л | Интактные, n=8 | Модель, n=10 |
| Креатинин | 60,2±6,91 | 96,8±1,18** |
| ХС | 1,90±0,06 | *2,50±0,21 |
| ТГ | 1,б5±0,13 | 1,76±0,12 |
| ЛПВП | 1,55±0,06 | 1,11±0,29 |
| ЛПНП | 0,40±0,12 | **1,12±0,17 |
| ЛПОНП | 0,75±0,06 | 0,80±0,06 |
| ИАДиурез, мл/сут | 0,23±0,083,2±0,02 | 1,90±0,92 |
| 4,5±0,04 | ||
| Примечание: - значения достоверны относительно контрольной группы, * - р<0,05; ** - р<0,01. |
Литература
1. Барабанова В.В., Береснева О.Н., Мирошниченко Е.Л. Функциональная активность воротной вены как отражение метаболических изменений при экспериментальной ХПН// Физиол. журн. - 1993. – Т. 79, №1. - С.64-72.
2. Гавришева Н.А., Ягмуров О.Д., Ботина А.В., Эммануэль В.Л. Экспериментальная модель хронической почечной недостаточности// Нефрология. - 2001. - Т.5, №2. - С.86-96.
3. Игнатенко Г.А., Мухин И.В. Морфологические и биохимические изменения при первичном и подагрическом гломерулонефритах в эксперименте// Нефрология. - 2001. – Т. 5, №4. - С.77-80.
4. Патент 21092048 RU, МПК 7 G 09 В 23/28. Способ моделирования инфарктоидной кардиовазопатии у крыс/ Т.П.Новгородцева, О.Г.Вострикова, И.В.Добрынченко// Опубл. 27.10.2002, Бюл. №30.
5. Патент 20825А (Украина). Способ моделирования нефропатии/ Л.И.Власик, А.Л.Кухарчук, В.Н.Магаляс, А.А.Михеев, Н.Г.Проданчук, Ю.Е.Роговой// Опубл. 27.02.98, Бюл. №1. - 4 с.
6. Саркисов Д.С., Ремизов П.И. Воспроизведение болезней человека в эксперименте. - Москва. - 1960. - 780 с.
7. Селье Г. Профилактика некрозов сердца химическими средствами М.: Медгиз, 1961. - 208 с.
8. Титова В.А., Павленко И.Н., Балакина А.Ю. Исследование морфометрических параметров ножковых отростков подоцитов при нарушении кальциевого обмена// Бюл. экспер. биол. - 1999. - Т.127, №3. - С.347-350.
9. Шилов А.М., Святов И.С., Чубаров М.И., Санодзе И.Д. Результаты применения магнийсодержащих препаратов для лечения и профилактики гипер- и дислипидемии// Клиническая медицина. - 1998. -№4. - С.35-37.
10. Шош Й., Гати Т., Чалаи Л., Деши И. Патогенез болезней цивилизации. - Будапешт: Академия наук Венгрии, 1976. - 154 с.
11. Donnell М.Е., Owen N.Е. Reduced Na+, K+, Сl- cotransport in vascular smooth muscle cells from spontaneously hypertensive rats// Amer. J. Physiol. - 1988. - Vol.255. - P.169-180.
12. Britton J., Pavord I., Richards K., et al. Dietary magnesium, lung function, wheezing, and airway hyperreactivity in a random adult population sampl// Lancet. - 1994. - Vol.344. - P.357-362.
13. Raissiguier Y. Magnesium, lipides and vascular disease: Experimental evidence in animal models// Magnesium. - 1986. - Vol.5. - P.182-190.
14. Moorhead J.E. Lipids and the pathogenesis of kidney disease// Am. J.Kid. Dis. - 1991. - Vol.27, Suppl. d. - P.65-70.
Способ моделирования электролитной нефропатии у крыс, включающий специальную полусинтетическую диету, ежедневные введения суспензии гидрокортизона ацетата с одновременной заменой питьевой воды 1%-ным раствором хлорида натрия, отличающийся тем, что в течение 12 дней животные получают нефрогенную диету, нагруженную солями двузамещенного фосфорнокислого водного натрия при дефиците калия и магния, причем двузамещенный фосфорнокислый водный натрий используют в количестве 290-320 г/кг.