Натриевая соль поли(парадигидрокси- парафенилен)тиосульфокислоты в качестве регулятора метаболизма клеток и антигипоксанта, фармацевтическая композиция на ее основе
Иллюстрации
Показать всеИзобретение относится к фармакологии и медицине, а также может быть использовано в косметологии и пищевой промышленности, и касается препаратов, регулирующих метаболизм отдельно взятых клеток и их сообщества в биологических тканях.Предложена натриевая соль поли (пара-дигидрокси-пара-фенилен) тиосульфокислоты общей формулы
где n = 2-6,
в качестве регулятора метаболизма клеток и антигипоксанта. Также предложена фармацевтическая композиция на основе указанного соединения. Использование соединения обеспечивает выраженный антигипоксический эффект. 2 н. и 2 з.п. ф-лы, 10 табл., 4 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к фармакологии и медицине, а также может быть использовано в косметологии и пищевой промышленности, и касается препаратов, регулирующих метаболизм отдельно взятых клеток и их сообщества в биологических тканях.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Исследования последних трех десятилетий показали, что в регулировании клеточного гомеостаза особо важное значение имеет поддержание баланса между энергопродуцирующими и энергопотребляющими функциями клеток. Особенно остро данная проблема возникает в случае возникновения в тканях или в организме в целом состояния гипоксии, связанного с недостаточным поступлением кислорода или нарушением механизмов его утилизации. Показано, что гипоксия вызывает сильнейший клеточный стресс и приводит к появлению обратимых или необратимых клеточных повреждений в зависимости от продолжительности и силы воздействия стрессового фактора (Deguchi J., Negoro S., Kishimoto S. // Biochem. & Biophys. Communs., 1987, Vol.149, No.3, p.1093-1098, [1]). Восстановление снабжения кислородом тканей после гипоксии (реоксигенация) сопровождается дополнительным повреждением элементов клеточных структур.
Для защиты тканей от повреждающего воздействия гипоксии или реоксигенации предложено использовать антигипоксанты. В настоящее время выделяют 5 типов подобных препаратов (Смирнов А.В., Криворучко Б.И. Сб.: Применение инфузионных антигипоскантов и искусственных переносчиков кислорода в хирургии, - СПб.: 1999, с.53-62, [2]).
К первой группе относят препараты типа гутимина и амтизола, которые усиливают гликолиз и повышают синтез аденозинтрифосфата (АТФ) в результате процесса анаэробного окисления субстрата.
Вторую группу антигипоксантов составляют вещества макроэргической природы (креатинфосфат, АТФ).
Остальные три группы антигипоксантов составляют препараты, регулирующие активность главной энергопродуцирующей системы клеток - митохондриальной дыхательной цепи. В частности, в третью группу включены препараты, поддерживающие высокую активность одного из двух субстратных участков дыхательной цепи - сукцинатоксидазного. К этой группе относится янтарная кислота, оксибутират натрия, препараты мексидол и муфасол.
К четвертой группе антигипоксантов относят синтетические препараты с электроноакцепторными свойствами, представляющие собой производные хинонов.
В пятую группу антигипоксантов включены цитохром С и убихинон Q10 (коэнзим Q10), являющиеся естественными компонентами митохондриальной дыхательной цепи.
Среди перечисленных антигипоксантов особый интерес представляет убихинон Q10, поскольку в митохондриальной цепи он играет ключевую роль в переносе электронов от субстратных участков (никотинамидадениндинуклеотид оксидазы (НАДН-оксидазы) или сукцинатоксидазы) на цитохромную цепь.
Дефицит убихинона Q10 блокирует перенос электронов по дыхательной цепи и ведет к прекращению синтеза АТФ.
При изучении соотношения между убихиноном и остальными партнерами по дыхательной цепи было обнаружено преобладание на порядок первого над остальными компонентами. Кажущаяся “расточительность” природы, использовавшей при конструировании дыхательной цепи большой избыток одного из элементов конструкции по сравнению с остальными, удалось понять, изучив более детально механизм функционирования коэнзима Q10. Оказалось, что реальным партнером, непосредственно участвующим во взаимодействии с субстратными участками дыхательной цепи, является не убихинон Q10, а его полувосстановленная свободнорадикальная форма - убисемихинон (Nohl H. Free Rad. Res. Communs, 1990, Vol.8, No.4-6, р.307-315, [3]). Поскольку пордолжительность жизни убисемихинона крайне мала, и он диспропорционирует на убихинон Q10 и убихинол Q10 (восстановленную форму убихинона), избыток коэнзима необходим для поддержания оптимальной концентрации убисемихинона.
Учитывая важную роль молекул, содержащих неспаренный электрон, в работе митохондриальной дыхательной цепи, одной из задач исследования было получение продукта, способного более продолжительное время по сравнению с убисемихиноном находиться в свободнорадикальном состоянии, и оценка эффективности его антигипоксической активности.
Наиболее близким структурным аналогом предложенного соединения является натриевая соль [поли-(2,5-дигидрокси-фенилен)]-4-тиосульфокислоты (мета НПФ), состоящей из последовательно соединенных между собой в мета-положении гидрохиноидных звеньев, имеющих в крайнем звене заместитель в виде натриевой соли тиосульфокислоты. Продукт получают взаимодействием пара-бензохинона с тиосульфатом натрия в водно-спиртовой среде при температуре выше 65°С. Показано, что продукт влияет на метаболизм клеток (Патент РФ №2105000, МПК6: С 07 С 381/02, C 08 G 61/10, А 61 К 31/05, [4]).
В современной фармакологии известны почти две тысячи различных регуляторов клеточного метаболизма, из которых только около ста являются препаратами фенольного типа (Машковский М.Д. Лекарственные средства. Изд. 13-е в двух томах. - Харьков: Торсинг, 1997, [5]).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является расширение спектра препаратов, регулирующих метаболическую активность клеток, в том числе проявляющих антигипоксическую активность.
В результате проведенных исследований было показано, что желаемой активностью - способностью регулировать метаболизм клеток, в том числе регулировать их энергетический обмен - обладает натриевая соль поли(пара-дигидроски-пара-фенилен)тиосульфокислоты (далее также для краткости называемая “пара-НПФ”), имеющая следующую структурную формулу:
где n=2-6.
Брутто-формула продукта: C6nH4n+1O2n+3S2Na.
Продукт был получен в результате реакции пара-бензохинона с тиосульфатом натрия в водной среде при нагревании от 50 до 100°С. Образующийся в результате реакции продукт отделяют от растворителя, очищают от низкомолекулярных примесей с помощью диэтилового эфира и сушат от экстрагента под вакуумом при температуре 50°С. Более подробно условия синтеза продукта и его свойства описаны в нижеследующих примерах.
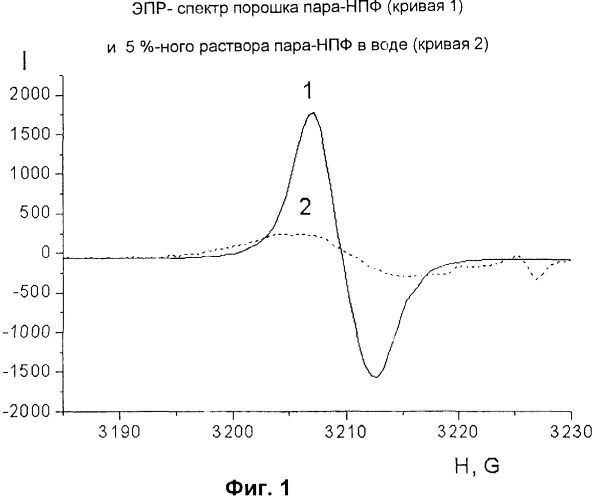
Принципиальное отличие предложенного соединения от его аналога заключается в том, что известное соединение состоит из звеньев гидрохинона, соединенных между собой в мета-положении, тогда как в предложенном соединении эти звенья расположены в пара-положении. Как известно, изменение химической структуры вещества неизбежно связано с изменением его свойств. Из химии ароматических соединений известно, что заместители, расположенные в мета-положении ароматического ядра, оказывают слабое взаимное влияние друг на друга, тогда как заместители, расположенные в пара-положении, сильно влияют друг на друга и на молекулу в целом. Наиболее ярким проявлением особых свойств продукта, предложенного в соответствии с настоящим изобретением, по сравнению с аналогом является проявление характерного сигнала, регистрируемого с помощью метода спектроскопии электронного парамагнитного резонанса (ЭПР-спектроскопии), свидетельствующего о наличии в образцах пара-НПФ неспаренных электронов, которые не были зафиксированы в образцах аналога (Фиг.1). Важно отметить также, что в отличие от малостабильного убисемихинона, для регистрации спектра которого применяют замораживание, ЭПР-спектры образцов пара-НПФ сохраняют устойчивость месяцами в условиях комнатной температуры. Наличие стабильного сигнала ЭПР в образцах пара-НПФ связано с проявлением сильного взаимодействия между всеми фенильными ядрами, соединенными друг с другом в пара-положении, при этом образуется достаточно протяженная система сопряжения, обеспечивающая эффективную стабилизацию неспаренного электрона в пределах молекулы. Спектр ЭПР наблюдается как для твердого пара-НПФ (кривая 1 на Фиг.1), так и для его водного раствора (кривая 2 на Фиг.1).
Проверка возможного влияния пара-НПФ на аэробный энергетический метаболизм проводилась на изолированных митохондриях скелетных мышц. Оценивалось влияние препарата на скорости эндогенного дыхания митохондрий (V0), дыхания митохондрий в метаболических состояниях 3 (V3) и 4 (V4) по Чансу, а также скорость разобщенного дыхания в присутствии разобщителя - 2,4-динитрофенола (VДНФ). Рассчитывался коэффициент дыхательного контроля по Чансу-Вильямсу (ДКч-в) и коэффициент фосфорилирования (АДФ/О) (Краковский М.Э., Аширметов А.X., Иноятова Ф.X. Вопр. мед. химии, 1986, т.32, №6, с.66-70, [6]). Результаты представлены в Таблице 1.
| Таблица 1Влияние препарата пара-НПФ на дыхание и фосфорилирование изолированных митохондрий скелетных мышц крыс | ||||
| Показатели | Контроль | Конц пара-НПФ (мкМ/л) | ||
| 1,2 | 2,4 | 6,0 | ||
| V0 | 15,0 | 16,1 | 17,9 | 22,6 |
| V3 | 113,0 | 85,7 | 83,9 | 60,4 |
| V4 | 46,3 | 26,0 | 22,3 | 21,7 |
| VДНФ | 82,4 | 62,5 | 54,5 | 52,8 |
| ДКЧ-В | 2,4 | 3,3 | 3,8 | 2,8 |
| АДФ/О | 1,75 | 1,94 | 2,63 | 1,85 |
Из Таблицы 1 следует, что пара-НПФ активно влияет на аэробный энергетический метаболизм, при этом достигаемый эффект зависит от дозы препарата. Значения дыхательного контроля (ДКЧ-В) и коэффициента сопряженности окислительного фосфорилирования и дыхания (АДФ/О) по мере увеличения концентрации пара-НПФ вначале растут, что соответствует более эффективной энергопродуцирующей функции митохондрий, а затем падают (разобщающий эффект).
При внесении пара-НПФ в состав глюкозо-минеральной питательной среды, содержащей (г/л) глюкозу - 4, Na2HPО4 - 7, КН2РО4 - 3, NH4Cl - 1, NaCl - 0,5, MgSO4 - 0,2, СаСl2 - 0,02, никотиновую кислоту - 0,005, пара-НПФ - 0,02, при культивировании факультативных аэробов Escherichia coli штамм М-17 время генерации микробной популяции на стадии логарифмического роста культуры сокращалось на 24±12% по сравнению с контролем (эффект стимуляции роста). Внесение 50 мг/л пара-НПФ в культуральную жидкость замедляет развитие микробных клеток (эффект ингибирования роста).
Представленные результаты показывают, что пара-НПФ участвует в регуляции метаболических процессов как в случае прокариотических, так и эукариотических клеток. Возможность повышения сопряженности процессов фосфорилирования и дыхания, подтвержденная на модели изолированных митохондрий скелетных мышц, позволяет рассматривать пара-НПФ в качестве активного антигипоксанта прямого действия.
Предложенная в соответствии с настоящим изобретением натриевая соль поли(пара-дигидрокси-пара-фенилен)тиосульфокислоты может быть применена в качестве антигипоксического препарата в составе фармацевтической композиции в любой подходящей фармацевтической форме, известной специалистам в данной области, например в форме таблетки, капсулы или раствора. Фармацевтическая композиция также может включать известные фармацевтически приемлемые наполнители, разбавители, связующие вещества и носители. Доза фармацевтической композиции должна содержать, в зависимости от назначения, по меньшей мере, терапевтически или профилактически эффективное количество активного соединения - натриевой соли поли(пара-дигидрокси-пара-фенилен)тиосульфокислоты.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 изображен спектр электронного парамагнитного резонанса (ЭПР-спектр) молекулы натриевой соли поли(пара-дигидроски-пара-фенилен)тиосульфокислоты (пара-НПФ). Кривая 1 представляет собой ЭПР-спектр порошка пара-НПФ, а кривая 2 - ЭПР-спектр, полученный при 20-кратном разбавлении пара-НПФ водой (ЭПР-спектр 5%-ного водного раствора пара-НПФ).
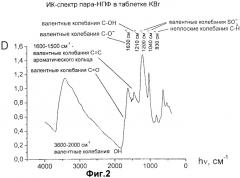
На Фиг.2 представлен ИК-спектр пара-НПФ в таблетке КВг.
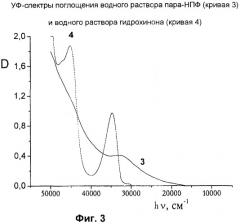
На Фиг.3 изображены УФ-спектры поглощения водного раствора пара-НПФ (кривая 3) и водного раствора гидрохинона (кривая 4).
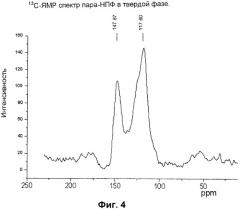
На Фиг.4 изображен 13С-ЯМР спектр пара-НПФ в твердой фазе.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Для лучшего понимания сути изобретения приведены следующие примеры.
Пример 1.
В аппарат емкостью 2 л, снабженный мешалкой и рубашкой, помещают 76,6 г (0,31 М) тиосульфата натрия в 1 л дистиллированной воды. Раствор нагревают до температуры 50°С и при интенсивном перемешивании вводят 100 г (0,93 М) пара-бензохинона. Через 2,5 часа процесс прекращают и образовавшийся продукт сушат на распылительной сушилке. Сухой порошкообразный продукт помещают в аппарат Сокслетта и удаляют примеси с помощью диэтилового эфира в качестве экстрагента. Время экстракции - 24 часа. Затем продукт сушат под вакуумом при температуре 50°С. Выход целевого продукта 102,7 г. Молекулярная масса, определенная криоскопическим методом, равна 440. Содержание серы по данным элементного анализа составляет 16,2%.
На Фиг.2 представлен ИК-спектр образца в таблетке КВг. На нем видна широкая полоса поглощения в области 3600-2000 см-1, относящаяся к валентным колебаниям НО-групп; полосы при 1200 и 1040 см-1 относятся к валентным колебаниям SО3-групп. Набор полос в области 1600-1500 см-1 относится к валентным колебаниям связей С=С в ароматическом кольце, а полоса при 830 см-1 связана с неплоскими деформационными колебаниями связи С-Н в тетразамещенном бензольном кольце.
На Фиг.3 представлены УФ-спектры растворов пара-НПФ (кривая 3) и гидрохинона (кривая 4) в воде. Гидрохинон можно рассматривать в качестве модельного соединения для элементарного звена пара-НПФ. Два слабо выраженных пика в области 45000 и 33000 см-1, наблюдаемые в спектре пара-НПФ, смещены в более низкочастотную область по сравнению с характерными полосами поглощения гидрохинона 45200 и 32780 см-1. Подобное смещение, а также непрерывное поглощение образца от ультрафиолетовой (УФ-) до видимой области спектра свидетельствует об эффективном сопряжении в синтезированном продукте.
Пример 2.
В аппарат, описанный в примере 1, помещают 23 г (0,093 М) тиосульфата натрия в 1 л дистиллированной воды, раствор нагревают до 90°С и вводят при интенсивном перемешивании 100 г (0,93 М) пара-бензохинона. Через 1,5 часа реакцию прекращают и содержимое сушат на распылительной сушилке. Выделенный сухой продукт экстрагируют диэтиловым эфиром в течение 24 часов, затем сушат под вакуумом при температуре 50°С. Выход целевого продукта 80,2 г. По данным элементного анализа содержание серы составляет 10,8%, молекулярная масса полученного продукта равна 750.
Присоединение гидрохиноидных звеньев в синтезированном образце в пара-положении друг относительно друга подтверждается данными спектроскопии ядерного магнитного резонанса 13С-ЯМР по наличию полосы поглощения при 147,87 м.д., характерной для Саром.-Саром. связи между бензольными кольцами (Фиг.4).
Пример 3. Оценка влияния пара-НПФ на метаболизм клеток
Для оценки влияния пара-НПФ, полученного в примере 1, на метаболическую активность клеток была использована культура гриба Aspergillus oryzae, являющегося продуцентом амилолитических ферментов. Данный гриб относится к строгим аэробам и выращивается на плотных питательных средах. Из-за ограничений с диффузией кислорода воздуха внутрь “коржа” эффективность продуцирования амилолитических ферментов прогрессивно снижается по мере увеличения толщины слоя плотной питательной среды. В таблице 2 приведены данные по амилолитической активности гриба из проб, взятых из образцов с толщиной “коржа” 1, 3 и 4 см.
| Таблица 2Влияние пара-НПФ на амилолитическую активность гриба Aspergillus oryzae | |||||||||
| Толщина “коржа”, см | Концентрация пара-НПФ, мг/л | ||||||||
| 25 | 50 | 100 | |||||||
| Контроль | Опыт | Эффект, % | Контроль | Опыт | Эффект, % | Контроль | Опыт | Эффект, % | |
| 1 | 394 | 362 | -8 | 394 | 397 | -1 | 327 | 370 | 15 |
| 3 | 233 | 299 | 28 | 233 | 286 | 23 | 210 | 226 | 8 |
| 4 | 168 | 156 | -7 | 168 | 246 | 46 | 141 | 172 | 22 |
Из таблицы 2 видно, что вблизи поверхности плотной питательной среды, где условия аэрации максимально благоприятны для развития культуры, добавка пара-НПФ мало сказывается на амилолитической активности гриба. Однако по мере увеличения толщины “коржа” с ростом ограничений по диффузии кислорода амилолитическая активность гриба снижается. В этих условиях добавление пара-НПФ в питательную среду заметно повышает амилолитическую активность гриба Aspergillus oryzae.
Пример 4. Оценка антигипоксической активности пара-НПФ
В аппарат, описанный в примере 1, помещают 38,3 г (0,15 М) тиосульфата натрия в 1 л дистиллированной воды, раствор нагревают до 70°С и при интенсивном перемешивании вводят 100 г (0,93 М) пара-бензохинона. Через 2 часа реакцию прекращают и содержимое сушат на распылительной сушилке. Полученный продукт экстрагируют в течение суток диэтиловым эфиром и сушат от экстрагента под вакуумом при 50°С. Выход целевого продукта - 95,7 г. По данным элементного анализа содержание серы составляет 11,7%. Молекулярная масса полученного образца равна 650.
Оценку антигипоксического действия пара-НПФ проводили на модели гипоксической гипоксии при моделировании в барокамере подъема на высоту 12000 м над уровнем моря. В качестве подопытных животных использовались крысы. Использовалась барокамера с приточно-вытяжной вентиляцией, исключающей накопление углекислого газа. Был использован следующий режим “подъема” животных: первые 5000 м - за 3 минуты, каждые последующие 1000 м - за 1 минуту. На высоте 12000 м производили экспозицию крыс в течение 45 минут. Эффективность препарата оценивалась по следующим показателям: выживаемость животных (в %), продолжительность жизни на высоте (мин), коэффициент эффективности антигипоксического воздействия препарата (δ), определяемый по отношению продолжительности жизни на высоте животных, получивших препарат, к продолжительности жизни животных в контрольной группе контролю. В качестве эталонного препарата был использован убихинон Qio. Результаты опыта представлены в Таблице 3.
| Таблица 3Сравнительная антигипоксическая активность пара-НПФ и убихинона Q10 в оптимальных дозах на модели гипоксической гипоксии (крысы) | ||||||
| Условия опыта | Число крыс | Доза препарата, мг/кг | Время введения препарата до подъема | Выживаемость, % | Продолжительность жизни крыс, мин | δ |
| Контроль | 20 | 0 | 45 | 0 | 12±1,7 | 3,5±0,3 |
| Пара-НПФ | 20 | 10 | 45 | 80 | 41,5±2,2 | |
| Контроль | 20 | о | 80 | 0 | 9,6±1,7 | 2,3±0,4 |
| Убихинон Q10 | 20 | 200 | 80 | 0 | 22,8±0,6 |
На модели гипоксической гипоксии преимущество пара-НПФ по сравнению с убихиноном Q10 проявилось как в увеличении продолжительности жизни животных при экспозиции “на высоте” 12000 м, так и в выживаемости 80% крыс, тогда как все контрольные животные и животные, получившие убихинон Q10, погибли.
В таблице 4 представлены результаты сравнительной эффективности пара-НПФ и убихинона Q10 на модели гистотоксической гипоксии. В эксперименте использовали мышей, которым вначале вводили внутрибрюшинно антигипоксанты, а через 45 минут - летальную дозу цианида калия, составляющую 15 мг/кг массы.
| Таблица 4Сравнительная антигипоксическая активность пара-НПФ и убихинона Q10 на модели гистотоксической гипоксии (доза цианида калия 15 мг/кг, внутрибрюшинно) | |||||
| Условия опыта | Число животных | Доза препарата, мг/кг | Число выживших животных | Продолжительность жизни животных, мин | δ |
| Контроль | 68 | 0 | 0 | 2,53±0,18 | - |
| Пара-НПФ | 14 | 15 | 0 | 3,81±0,26 | 1,5 |
| 10 | 35 | 1 | 5,08±0,51 | 2,0 | |
| 45 | 70 | 18 | 5,38±0,48 | 2,1 | |
| Убихинон Q10 | 12 | 100 | 0 | 2,55±0,14 | 1,0 |
| 16 | 200 | 0 | 3,43±0,20 | 1,4 |
Таким образом, защитный эффект пара-НПФ при введении летальной дозы цианистого калия оказался более высоким по сравнению с убихиноном Q10.
В Таблице 5 представлены результаты сравнительной эффективности пара-НПФ и убихинона Q10 на модели циркуляционной гипоксии, вызванной кровопотерей. Опыты поставлены на крысах, у которых из общей сонной артерии отбирали кровь в объеме 3 мл крови на 100 г массы животного. Препараты вводили внутрибрюшинно за 45 мин до кровопотери. Отслеживали количество выживших животных через 6, 12 и 24 часа после кровопотери.
| Таблица 5Сравнительная антигипоксическая активность пара-НПФ и убихинона Q10 на модели циркуляционной гипоксии, вызванной кровопотерей | ||||
| Условия опыта | Число крыс | Выживаемость крыс после кровопотери, % | ||
| 6 час | 12 час | 24 час | ||
| Контроль | 30 | 0 | 0 | 0 |
| пара-НПФ | 30 | 70 | 60 | 60 |
| Убихинон Q10 | 30 | 20 | 0 | 0 |
Нетрудно видеть, что на модели циркуляционной гипоксии, вызванной кровопотерей, антигипоксический эффект пара-НПФ существенно превосходит аналогичный эффект убихинона Q10.
Пример 5. Оценка острой и хронической токсичности пара-НПФ
Острую токсичность препарата определяли на мышах-самцах массой 20-25 г при внутрибрюшинном введении 7%-ного водного раствора пара-НПФ. Летальную дозу ЛД50 рассчитывали по методу Беренса. Оказалось, что летальная доза зависит от молекулярной массы препарата. Для образца пара-НПФ, описанного в примере 1 (молекулярная масса М=440), летальная доза ЛД50 составляет 520 мг/кг, для образца пара-НПФ, описанного в примере 2 (М=750), летальная доза ЛД50 составляет 920 мг/кг, а для образца пара-НПФ, описанного в примере 4 (М=650), летальная доза ЛД50 составляет 810 мг/кг.
Хроническую токсичность препарата определяли на крысах-самцах. При введении образца пара-НПФ, описанного в примере 4 (М=650), в дозе 20 мг/кг ежедневно в течение 1 года видимых изменений в поведении животных не выявлено. Проведенные гистологический исследования образцов легких, сердца, печени, почек, селезенки, щитовидной железы, скелетной мышцы не выявили патологических изменений по сравнению с контролем.
Пример 6. Сравнение биологической активности пара-НПФ и мета-НПФ
Задачей исследования было сравнение биологической активности соединения согласно изобретению (пара-НПФ) и его ближайшего структурного аналога - мета-НПФ, описанного в упомянутом выше патенте РФ №2105000. Биологическая активность мета-НПФ описана также в патенте РФ № 2124888. В качестве экстремального фактора была выбрана острая гипоксическая гипоксия.
Методика
Исследование выполнено на беспородных белых крысах-самцах массой 180-200 г в условиях хронического эксперимента. Предварительно у крыс исследовали индивидуальную устойчивость к острой гипоксической гипоксии. Для этого изучали время выживания их "на высоте" 12000 м, скорость "подъема" на высоту составляла 75 м/с. Согласно методике В.А.Березовского, определяли время устойчивости от момента достижения высоты 12000 м и до появления атонального дыхания или приступа судорог. Животные, имеющие низкую устойчивость к гипоксии, из эксперимента исключались. За неделю до основного эксперимента ежедневно внутрибрюшинно крысам I (контрольной) группы вводили 1 мл 0,9% раствора хлорида натрия (15 животных), II группы - мета-НПФ 1 мл 4% раствора (14 животных), III группы - пара-НПФ 1 мл 4% раствора (16 животных). Для всех трех препаратов доза составила 40 мг/кг. Доза мета-НПФ и пара-НПФ была предварительно подобрана в тесте физической работоспособности. Через три дня после теста с гипоксической гипоксией у животных изучали в крови маркеры неспецифической резистентности.
В нижеследующих таблицах количество животных в группе обозначено “п”.
Результаты
Приведенные в Таблице 6 результаты исследования показали, что пара-НПФ проявляет большую эффективность в отношении устойчивости к гипоксической гипоксии.
| Таблица 6 | ||||||
| Группы | Количество животных | Время устойчивости к гипоксии (с) | ||||
| Минимальное | Максимальное | Среднее | Ошибка среднего | Процент от контроля | ||
| I (контроль) | 15 | 31 | 144 | 77,3 | 19,05 | 100 |
| II (мета-НПФ) | 14 | 44 | 217 | 114,2 | 23,44 | 147 |
| III (пара-НПФ) | 16 | 48 | 219 | 128 | 23,7 | 166 |
Результаты исследования показателей нейроэндокринной регуляции представлены в Таблице 7, белков сыворотки крови - в Таблице 8, углеводного обмена - в Таблице 9, процессов пероксидации и состояния антиоксидантной системы - в Таблице 10.
| Таблица 7Показатели нейроэндокринной регуляции (X±х) | |||
| Показатели | Группы животных | ||
| I (контроль)п=15 | II (мета-НПФ)п=14 | III (пара-НПФ)п=16 | |
| Катехоламины (мкг/л) | 2,13±0,14 | 2,67±0,06* | 1,72±0,13* |
| Адреналин (мкг/л) | 1,1+0,08 | 0,92±0,05 | 1,06±0,13 |
| Норадреналин (мкг/л) | 1,83±0,07 | 1,05±0,05 | 1,56±0,07* |
| Норадреналин (усл. ед.) Адреналин | 1,86±0,08 | 2,0±0,16 | 1,59±0,2 |
| Ацетилхолин (мкг/л) | 2,14±0,06 | 2,11±0,04 | 1,90±0,05 |
| Катехоламины (усл. ед.) Ацетилхолин | 1,67±0,08 | 0,80±0,03* | 1,47±0,06* |
| Ацетилхолин (усл. ед.) Норадреналин | 1,43±0,05 | 2,01±0,08* | 1,14±0,09* |
| Примечание: * - различия достоверны |
| Таблица 8Содержание белков в сыворотке крови (Х±х) | |||
| Показатели | Группы животных | ||
| I (контроль)п=15 | II (мета-НПФ)п=14 | III (пара-НПФ)п=16 | |
| Общий белок (г/л) | 68,7±1,4 | 73,2±1,8* | 79,8±1,5* |
| Альбумин (г/л) | 32,8±1,0 | 40,8±1,8* | 36,3±1,7* |
| α1 - глобулины (%) | 4,3±0,4 | 4,5±0,5 | 5,3±0,2 |
| α2 - глобулины (%) | 12,2±0,8 | 12,1±0,9 | 11,6±0,3 |
| β - глобулины (%) | 12,3±0,6 | 12,5±0,7 | 12,1±0,4 |
| γ - глобулины (%) | 20,3±0,5 | 19,5±0,6 | 22,8±0,6 |
| α1 - глобулины (%) | 4,3±0,4 | 4,5±0,5 | 5,3±0,2 |
| α2 - глобулины (%) | 12,2±0,8 | 12,1±0,9 | 11,6±0,3 |
| β - глобулины (%) | 12,3±0,6 | 12,5±0,7 | 12,1±0,4 |
| γ - глобулины (%) | 20,3±0,5 | 19,5±0,6 | 22,8±0,6 |
| Примечание: * - различия достоверны | |||
| Таблица 9Показатели углеводного обмена (Х±х) | |||
| Показатели | Группы животных | ||
| I (контроль)п=15 | II (мета-НПФ)п=14 | III (пара-НПФ)п=16 | |
| Глюкоза (ммоль/л) | 2,7±0,07 | 4,51±0,09* | 4,28±0,08* |
| Лакт (ммоль/л) | 183±18,5 | 185,0±20,0 | 151,0±17,0* |
| Пируват (ммоль/л) | 9,7±1,89 | 10,31±0,81 | 13,3±1,6* |
| Гликоген (отн. ед.) | 0,28±0,09 | 0,15±0,01 | 0,19±0,01* |
| Г-6*ФДГ(отн. ед.) | 53,2±3,9 | 54,0±6,0 | 43,5±3,8 |
| ЩФ (отн. ед.) | 121±6,5 | 121,0±2,0 | 105,0±6,08* |
| Примечание: * - различия достоверны |
| Таблица 10Показатели процессов пероксидации и состояния антиоксидантной системы(Х±х) | |||
| Показатели | Группы животных | ||
| I (контроль)п=15 | II (мета-НПФ)п=14 | III (пара-НПФ)п=16 | |
| Малоновый диальдегид (мкмол/л) | 3,3±0,13 | 3,6±0,15 | 6,1±0,36* |
| Супероксиддисмутаза (уел. ед.) | 1,83±0,06 | 2,09±0,24 | 2,1±0,19 |
| Витамин “Е” (мкмоль/л) | 3,7±0,16 | 5,31±0,51* | 7,6±0,35* |
| Дегидроаскорбиновая кислота (мкмоль/л) | 4,2±0,17 | 7,6±0,62* | 6,8±0,34* |
| Аскорбиновая кислота (мкмоль/л) | 3,9±0,14 | 17,7±1,31* | 17,66±0,78 |
| Общая аскорбиновая кислота (мкмоль/л) | 18,6±1,2 | 29,3±1,25* | 24,6±1,62* |
| Аскорбиновая / Дегидроаскорбиновая кислота (усл.ед.) | 2,1±0,12 | 3,12±0,38 | 3,21±0,24* |
| Бета-каротин (мкг/дл) | 12,3±0,9 | 17,9±4,15* | 21,3±0,59* |
| Ретинол (мкг/дл) | 8,7±0,7 | 7,7±1,29 | 12,5±3,1* |
| Восстановленный глутатион (мкмоль/л) | 1,0±0,06 | 1,1±0,03 | 1,39±0,07 |
| Окисленный глутатион (мкмоль/л) | 3,1±0,5 | 2,6±0,02 | 1,7±0,06* |
| Общий глутатион (мкмоль/л) | 12,5±0,5 | 13,4±0,04 | 18,6±0,07* |
| Примечание: * - различия достоверны |
ВЫВОДЫ
1. Пара-НПФ обеспечивает более выраженный антигипоксический эффект, чем мета-НПФ.
2. Действие экстремального фактора после введения в организм мета-НПФ или пара-НПФ приводит к увеличению неспецифической резистентности, при этом повышение неспецифической резистентности более выражено при использовании пара-НПФ, что свидетельствует о том, что пара-НПФ обладает более выраженным стресспротективным действием.
3. Механизм действия пара-НПФ при действии экстремальных факторов заключается в оптимизации нейроэндокринной регуляции, усилении белкового синтеза, анаэробного окисления.
4. Пара-НПФ обладает более выраженным защитным противоокислительным действием, чем мета-НПФ.
1. Натриевая соль поли(парадигидрокси-парафенилен)тиосульфокислоты общей формулы
где n = 2 ÷ 6,
в качестве регулятора метаболизма клеток.
2. Натриевая соль поли(парадигидрокси-парафенилен)тиосульфокислоты по п. 1 в качестве антигипоксанта.
3. Фармацевтическая композиция, содержащая в качестве активного начала терапевтически или профилактически эффективное количество антигипоксанта, отличающаяся тем, что в качестве антигипоксанта используют натриевую соль поли(пара-дигидрокси-парафенилен)тиосульфокислоты, как она определена в п.1 или 2.
4. Фармацевтическая композиция по п. 3, отличающаяся тем, что дополнительно содержит фармацевтически приемлемый носитель, разбавитель, связующее вещество или инертный наполнитель.