Фармацевтическая композиция, обладающая гепатозащитным действием, и лекарственное средство
Иллюстрации
Показать всеИзобретение относится к области фармацевтики и касается фармацевтической композиции, обладающей гепатозащитным действием, Изобретение заключается в том, что в качестве действующего вещества в основу фармацевтических композиций положены аддукты оротовой кислоты с аминокислотами или аминами. Композиции содержат эффективное количество действующего вещества и целевые добавки, при этом соотношение активного вещества и целевых добавок составляет, мас.%: активное вещество 0,05-40,0, целевые добавки 60,0-99,95. В качестве целевых добавок используют крахмал, смесь витаминов, лактозу, аэросил, тальк, соли стеариновой кислоты, поливинилпирролидон, твердый кондитерский жир, твин-80, полиэтиленгликоль, глицерин, кислоту лимонную, кислоту бензойную, натрия бензоат, коррегирующие вещества красители, при этом композиции выполнены в виде таблеток, капсул, драже, суппозиториев, сиропов. Также предложено лекарственное средство, включающее вышеназванную фармацевтическую композицию. Изобретение обеспечивает высокий фармако-терапевтический эффект, срок годности не менее 2-х лет. 2 н. и 7 з.п. ф-лы, 6 табл.
Реферат
Изобретение относится к области медицины, в частности к лекарственным средствам, которые могут быть использованы для профилактики и лечения острых и хронических гепатитов, жировой инфильтрации и цирроза печени, при острых и хронических отравлениях печени.
Известны различные составы, обладающие гепатозащитным действием. Основными активными компонентами известных лекарственных средств являются различные аминокислоты, оротовая кислота и ее производные, эссенциальные фосфолипиды, выделяемые из бобов сои, препараты на основе травы расторопши пятнистой, некоторые витамины /1, 2/.
В настоящее время в РФ в медицинской практике в качестве гепатозащитных средств применяют эссенциале, силибор, калия оротат, легалон, гептрал, т.е. арсенал препаратов гепатопротекторного, истинно этиотропного действия очень ограничен. Некоторые средства имеют побочные эффекты, иногда малоэффективны и, в основном, зарубежного производства /2, 3/.
Недавно нами был выявлен ряд новых потенциальных гепатопретекторов /4/ в ряду аддуктов оротовой кислоты с аминокислотами или аминами, обладающих высоким гепатозащитным эффектом. Углубленное фармакологическое и токсикологическое изучение указанных соединений подтвердило их высокий гепатозащитный эффект, превосходящий отдельные из применяемых в медицинской практике гепатопротекторы, низкую токсичность, практическое отсутствие побочного действия. Все это делает целесообразным разработку различных лекарственных форм на основе аддуктов оротовой кислоты с аминокислотами или аминами и создание лекарственных средств - гепатопротекторов с улучшенными свойствами.
Как известно, лекарственные формы обычно состоят из активного начала и вспомогательных фармацевтически приемлемых веществ, которые существенно влияют на скорость и полноту всасывания лекарственной формы, обеспечивают точность дозирования препарата, придают ему оптимальную массу и объем, не только обеспечивают биологическую доступность препарата, но и способствуют успешному проведению технологического процесса изготовления лекформы. Применение в составе конкретного препарата вспомогательных веществ в качестве целевых добавок требует предварительных биофармацевтических экспериментальных исследований.
Целью изобретения является расширение арсенала эффективных гепатозащитных препаратов, способных надежно защищать печень, - основной орган человека и животных, обеспечивающий дезинтоксикацию организма и функционирование ряда систем.
В основу заявляемого изобретения положена задача путем сочетания аддуктов оротовой кислоты с аминокислотами или аминами с целевыми добавками создать различные лекарственные формы новых гепатопротекторов, отвечающих требованиям Госфармакепеи РФ XI издания, обеспечивающие высокий фармакотерапевтический эффект, имеющие срок годности не менее 2-х лет.
Эта задача решается созданием фармацевтических композиций, содержащих в качестве активного начала эффективные количества аддуктов оротовой кислоты с аминокислотами или аминами общей формулы I
X-CH-(CH2)n-Z, где X=H, COOH, COOAlk;
Z=H, COOH, NH2, CONH2, n=0-5
и целевые добавки.
При этом соотношение активного начала и целевых добавок составляет, мас.%:
активное начало 0,05-40,0
целевые добавки 60,0-99,95
В качестве целевых добавок используют крахмал, смесь витаминов, лактозу, аэросил, тальк, соли стеариновой кислоты, поливинилпирролидон, твердый кондитерский жир, твин-80, полиэтиленгликоль, глицерин, кислоту лимонную, кислоту бензойную, натрия бензоат, коррегирующие вещества, краситель, при следующем соотношении компонентов, мас.%:
крахмал 0-46
смесь витаминов 0-23
лактоза 0-40
аэросил 0-10
тальк 0-3,0
соль стеариновой кислоты 0-1,0
поливинилпирролидон 0-4,5
твердый кондитерский жир 0-99,94
твин-80 0-0,01
полиэтиленгликоль 0-99,95
пропиленгликоль 0-40,0
кислота лимонная 0-0,3
кислота бензойная или натрия
бензоат 0-0,15
коррегирующие вещества 0-40
краситель 0-0,002
Присутствие в твердых лекарственных формах указанных количеств крахмала и аэросила обеспечивает повышение скорости высвобождения и полноту всасывания активного начала, увеличивает распадаемость и растворение лекформы, а также создает условия для проникновения воды и пищеварительных соков в таблетку или драже. Крахмал предпочтительно использовать картофельный или кукурузный. Присутствие солей стеариновой кислоты обеспечивает эффект скольжения, необходимый на стадии прессования таблеток. В качестве солей целесообразно применять стеарат магния или кальция.
Смесь витаминов в качестве целевых добавок к активному началу способствует интенсификации процессов клеточного метаболизма и обмена веществ, окислительно-восстановительных процессов, регенерации клеток, липидного обмена, что должно положительно влиять на ход лечения заболеваний печени различной этиологии. Из витаминов, предпочтительно, использовать тиамина хлорид или бромид, рибофлавин, пиридоксина гидрохлорид, цианокобалмин, фолиевую кислоту, никотинамид, токоферола ацетат, аскорбиновую кислоту, рутин.
В качестве суппозиторной основы при изготовлении ректальных свечей, как было нами установлено, предпочтительно, использовать твердый кондитерский жир с добавкой 1% твин-80 или полиэтиленгликоль, которые обеспечивают максимальное высвобождение активного начала из свечей. При приготовлении сиропов в качестве коррегирующих веществ целесообразно использовать сорбит, ксилит, лактозу, глюкозу, сахарин, аспартам, ароматизирующие фруктовые эссенции либо готовые фруктовые сиропы.
Фармацевтические композиции мoгут быть выполнены в виде порошка (в капсулах), таблеток, драже, таблеток в пленочной оболочке, суппозиториев (ректальных свечей), сиропов.
Заявляемые соотношения компонентов найдены экспериментальным путем, являются оптимальными и позволяют получить технический результат, соответствующий поставленной задаче: все фармацевтические композиции отвечают требованиям Госфармакопеи XI издания, имеют срок годности не менее 2-х лет и обеспечивают высокий фармакотерапевтический эффект активного начала.
Одним из способов получения твердых лекарственных форм является изготовление таблеток путем влажного гранулирования, включающее следующие этапы: смешение порошков, увлажнение, смешение, гранулирование, сушка, опудривание, прессование /5/. Суппозитории (ректальные свечи) готовили по общепринятой технологии методом выливания, а контроль качества свечей проводился согласно требованиям Госфармакопеи XI изд. Выбор оптимальной липофильной суппозиторной основы осуществлялся по результатам высвобождения активного начала из суппозирориев методом равновесного диализа через полупроницаемую мембрану. Драже и порошок в капсулах заявленной фармакологической композиции были получены по известным в этой области технологиям.
Гепатозащитные свойства предлагаемых лекарственных средств установлены впервые.
Оценку гепатозащитной активности предлагаемых лекарственных форм проводили на моделях острого и хронического активного гепатита у крыс в диапазоне доз 5-25 мг/кг соединения формулы I при внутрижелудочном введении испытуемых образцов и препаратов сравнения.
Использовались следующие методы и модели и получены следующие результаты изучения гепатозащитного эффекта заявляемых лекарственных форм соединений I, которые приведены ниже.
Функциональное состояние печени оценивали, используя биохимические методы исследования сыворотки крови и печени, а также морфометрические методы исследования ткани печени.
Изучение гепатозащитного эффекта препаратов проводили на моделях аминазинового гепатита у крыс (аналог внутригепатоцитарного холестаза), на модели гепатита у крыс, вызванного отравлением тетрахлорметаном (аналог химически индуцированного токсического гепатита), на модели хронического этанолового гепатита (аналог алкогольного отравления печени), на модели парацетамолового гепатита (аналог межгепатоцеллюлярного холестаза) и на других моделях. Ниже приведены результаты изучения препаратов, проведенных на первых двух из указанных моделей.
1. Биохимические методы исследования сыворотки крови и печени.
Активность аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) в сыворотке крови определяли методом Rеitman, Frankel, щелочной фосфатазы (ЩФ) - методом Bessey, Brock, содержание общего белка - по Lowry /6/. Содержание холестерина (ХС) в сыворотке крови определяли методом Илька /6/, холестерин липопротеидов высокой плотности (ХС ЛПВП) оценивали в супернатанте после гепарин-марганцевой преципитации липопротеидов низкой (ЛПНП) и очень низкой (ЛПОНП) плотности /7/. Липидный состав печени: триглицериды (ТГ), свободный холестерин (СХ), неэстерифицированные жирные кислоты (НЭЖК), фосфолипиды (ФД), эфиры холестерина (ЭХ) определяли методом тонкослойной хроматографии /8, 9/ после экстракции суммарных липидов по методу Фолча в модификации /10/. Результаты представлены в виде процентного распределения фракций.
Определение общего холестерина в ткани печени проводили по методу /11/.
2. Морфометрические методы исследования ткани и печени.
Полученные при аутопсии образцы ткани печени фиксировали в 10% растворе нейтрального формалина, заливали в парафин по стандартным методикам, готовили срезы толщиной 7 микрон, срезы окрашивали гематоксилином и эозином /12, 13/. Гистопрепараты оценивали визуально, а также проводили морфометрию, определяя общее число гепатоцитов (Г); поврежденных гепатоцитов (ПГ); синусоидов; центральных вен; триад; клеток ретикуло-эндотальной системы (РЭС) в % от общего числа гистоэлементов на фиксированной площади среза. На гистологических препаратах оценивали в баллах от 0 до 2 у.е. степень альтерации ткани печени /14/. Основное внимание обращали на степень жировой и белковой дистрофии гепатоцитов, степень нарушения балочной структуры, состояние микроциркулярного русла печени, активность воспалительного процесса паренхимы (степень инфильтрации лимфоидным элементами).
3. Модель аминазинового гепатита у крыс.
Аминазин вводили внутрижелудочно (в/ж) ежедневно однократно в течение 4 суток в дозе 50 мг/кг в растворе крахмальной слизи. Содержимое капсул 1а в дозах 5 и 15 мг/кг и капсул эссенциале в дозе 100 мг/кг вводили в/ж в растворе крахмальной слизи ежедневно в течение 8 суток. Соединение 1a - оротат лизина, 1б - β-аланина.
4. Moдeль oстрoгo тетраxлоpмeтaнoвoгo гепатита у крыс.
Четыреххлористый углерод вводили животным подкожно однократно ежедневно в течение 4 дней в дозе 0,4 мл 50% раствора на вазелиновом масле на 100 г массы тела животного /15/. Таблетки 1б в дозе 5 и 25 мг/кг и эссенциале в дозе 160 мг/кг вводили в/ж в растворе крахмальной слизи ежедневно в течение 20 дней.
5. Результаты изучения гепатозащитного эффекта капсул 1а на модели аминазинового гепатита у крыс.
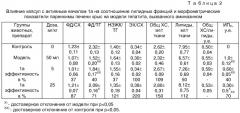
Биохимическое исследование сыворотки крови экспериментальных животных на модели аминазинового гепатита показало, что уровень трансаминаз возрос в среднем в 2 раза и снизился коэффициент де Ритиса в 1,4 раза, повысился на 17% уровень общего холестерина сыворотки, незначительно снизилась доля холестерина ЛПВП (на 6%) и на 57% повысился коэффициент атерогенности (КАТ) (см. табл.1).
Изучение липидного состава печени на модели аминазинового гепатита по сравнению с контрольными животными показало снижение общего холестерина в печени на 32%, а общих липидов на 39%, что свидетельствовало о явлениях внутрипеченочного холестаза с нарушениями синтеза холестерина. Увеличение соотношений ФЛ/ТГ (на 52%) и НЭЖ/тг (на 113%) подтверждало факт уменьшения количества ТГ. Соотношение ЭХ/СХ осталось без изменения. О снижении относительного содержания ФЛ в печени свидетельствовало снижение отношения ФЛ/СХ (на 19%), однако это снижение не было достоверным.
По данным гистологического анализа токсическая доза аминазина вызывала нарушение балочной структуры на периферии печеночных долек. Мелкозернистая белковая дистрофия гепатоцитов центральных отделов печеночных долек нарастала к периферии, переходя в баллонную. Жировая дистрофия отсутствовала. Синусоиды чаще были сужены, эндотелий центральных вен был поврежден, отмечалось значительное сужение сосудов триад, особенно портальных вен, эндотелий периферических сосудов был утолщен и триады часто выглядели разросшимися, встречались кариолизисы и некрозы гепатоцитов вблизи портальных полей, лимфоидная инфильтрация была увеличена вблизи триад. Эндотелий желчных капилляров был нарушен. Индекс поражения печени (ИПП) был равен 1,0±0,12 у.е. (табл.2).
Капсулы 1а применялись в двух дозах: 5 и 25 мг/кг. Применение 1а в дозе 5 мг/кг положительно влияло на биохимические показатели сыворотки крови: снизился уровень трансаминаз (АлАТ в 1,7 paза, АсАТ в 1,4 раза). Однако уровень общего холестерина и холестерин ЛПВП сыворотки крови препарат изменил незначительно, уменьшив его лишь на 7% по сравнению с моделью для первого показателя и увеличив на 8% для второго. Однако эти незначительные изменения показателей привели к позитивному изменению КАТ, снизив его на 26% по сравнению с моделью.
Увеличение дозы 1а до 25 мг/кг усиливало положительное гепатозащитное влияние препарата: уровень АлАТ и АсАТ снизился в 2 и 1,6 раза, соответственно, коэффициент де Ритиса увеличился на 24%. Уровень ХС ЛПВП увеличился на 10%, общий ХС уменьшился на 11%. Показатели КАТ приближались к соответствующим значениям контрольной группы. Введение 1а оказывало позитивное влияние на липидный обмен и гистоструктуру печени. 1а как в дозе 5, так и 25 мг/кг увеличивал сниженные аминазином значения общего холестерина и липидов ткани печени в среднем на 15-20%. Соотношение ФЛ/ТГ увеличилось на 21 и 37%, соответственно, а НЭЖК/ТГ уменьшилось на 5 и 18%. 1a снижал гидролиз ЭХ, благодаря чему соотношение ЭХ/СХ восстанавливалось до нормы. 1а, кроме того, при применении в дозе 25 мг/кг повышалсоотношение ФЛ/СХ.
Морфометрические исследования показали, что при применении 1а в дозе 5 мг/кг балочная структура сохранена только в центре печеночных долек, на периферии нарушена, гепатоциты в центре долек не имеют повреждений, на периферии наблюдалась довольно значительная мелкозернистая белковая дистрофия, жировая дистрофия отсутствовала. Синусоиды в пределах нормы, сосуды в основном расширены, особенно центральные вены. Незначительно была увеличена инфильтрация. ИПП был равен 0,60±0,05 у.е., что свидетельствовало о позитивном действии препарата.
При введении 1а в дозе 25 мг/кг наблюдалась четкая балочная структура как в центре, так и на периферии. Гепатоциты равномерно окрашены, не имели повреждений, сосуды и синусоиды были в пределах нормы, отмечались лишь следы мелкозернистой белковой дистрофии на периферии долек, жировой дистрофии не было. Инфильтрация незначительна. ИПП был равен 0,30±0,05 у.е.
Таким образом, по данным биохимических и морфологических исследований на модели аминазинового гепатита наблюдался высокий дозозависимый гепатозащитный эффект соединения 1а. С увеличением дозы 1а эффект нарастал. Наибольший эффект наблюдается у капсул 1а в дозе 25 мг/кг.
6. Результаты изучения гепатозащитного эффекта соединения 1б на модели тетрахлорметанового гепатита у крыс.
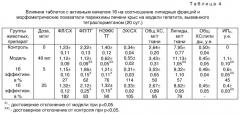
Результаты исследований показали, что после 4-кратного введения крысам ССI4 на 20 сутки в сыворотке крови экспериментальных животных повысился уровень АлАТ в 2,3 раза, АcАТ - в 1,8 раза и на 22% уровень общего холестерина, незначительно (на 7%) понизился холестерин ЛПВП по сравнению с контрольной группой животных (см. табл.3). Коэффициент де Ритиса снизился на 25%, а КАТ повысился на 72%. Поражение печени тетрахлорметаном сопровождалось увеличением содержания в ткани печени общего холестерина и общих липидов в среднем в 1,4 раза, относительной доли ТГ и снижением ФЛ, СХ и ЭХ, что проявилось уменьшением соотношений ФЛ/ТГ (в 2,1 раза), НЭЖК/ТГ (в 2,3 раза), ФЛ/CX (на 9%) и ЭХ/СХ (на 26%).
Морфометрические исследования показали, что ССI4 вызывал в печени крыс нарушения балочной структуры как в центре, так и на периферии печеночных долек. Гепатоциты в центре долек поражены крупнокапельной жировой дистрофией, на периферии долек наблюдалась значительная белковая дистрофия. Синусоиды несколько сужены, центральные вены в отдельных участках расширены. Периферические сосуды в основном в пределах нормы, в них наблюдался застой крови. Инфильтрация незначительная. Морфометрический индекс поражения печени ИПП был равен 1,1±0,1 у.e. (табл.4).
Введение таблеток 1б в дозе 5 мг/кг сопровождалось снижением в сыворотке крови уровня АлАТ и АсАТ в 1,4 раза, коэффициент де Ритиса остался без изменений. Содержание общего холестерина снизилось на 13%, а холестерин ЛПВП незначительно увеличился (на 3%), в связи с чем КАТ снизился на 29%. В печени животных под воздействием 1б снизилось содержание общих липидов и общего холестерина в среднем на 12%. Соотношения ФЛ/ТГ и НЭЖК/ТГ, бывшие в модели значительно сниженными по сравнению с контрольными животными, при применении 1б увеличились в 1,7 раза и 1,9 раза, соответственно, что свидетельствует о преобладании процессов липолиза над процессами липосинтеза.
Патоморфологические наблюдения свидетельствовали о восстановлении балочной структуры в центре долек, о значительном снижении жировой дистрофии. Синусоиды были в норме, центральные вены в отдельных участках расширены. Периферические сосуды в основном в пределах нормы. Инфильтрация лимфоидными элементами незначительная. При этом морфометрический индекс ИПП снизился по сравнению с моделью на 45% и был равен 0,6±0,05 у.e.
Введение таблеток 1б в дозе 25 мг/кг сопровождалось значительным снижением в сыворотке крови уровня АлАТ (в 1,8 раза) и АсАТ (в 1,6 раза), коэффициент де Ритиса увеличился на 9%. Содержание общего холестерина снизилось на 14%, а холестерин ЛПВП незначительно увеличился (на 4%), что привело к снижению КАТ на 32%.
В печени животных 1б по сравнению с моделью снизил содержание общего холестерина и общих липидов в среднем на 22%. Значительно сниженные в модели соотношения ФЛ/ТГ и НЭЖК/ТГ при применении 1б увеличились в 1,9 и 2,1 раза, соответственно, соотношения ФЛ/ХС и ЭХ/СХ - на 18 и 32%. Таким образом, значения показателей липидного обмена в опытной группе животных, получавших таблетки 1б в дозе 25 мг/кг, приблизились к таковым животных контрольной группы.
Патоморфологические исследования печени свидетельствовали о восстановлении балочной структуры в центре долек, о значительном снижении жировой и белковой дистрофии. Синусоиды, центральные вены и периферические сосуды были в основном в пределах нормы. Лимфоидная инфильтрация незначительная. ИПП был равен 0,4±0,03 у.e.
Таким образом, по данным биохимических и морфологических исследований лекарственной формы 1б в виде таблеток в дозе 5 и 25 мг/кг оказывала высокий дозозависимый гепатозащитный эффект на модели токсического гепатита у крыс, вызванного тетрахлорметаном.
Нами были проведены фармакологические исследования и иных предлагаемых лекарственных форм соединений, имеющих структуру I. При этом существенных (достоверных) отличий в эффективности разных лекформ этих соединений на различных моделях поражения печени не было установлено.
Состав и способы изготовления заявляемых фармацевтических композиций приведены в следующих примерах.
Пример 1 (фармацевтическая композиция в виде порошка в капсулах).
К 60 г порошка соединения 1а прибавляют 60 г смеси витаминов (например, 1 г тиамина бромида либо хлорида, 1 г рибофлавина, 1 г пиридоксина гидрохлорида, 0,01 г цианокобалмина, 0,3 г фолиевой кислоты, 5 г токоферола ацетата, 20 г никотинамида и 31,8 г аскорбиновой кислоты), тщательно перемешивают в смесителе и прибавляют 138 г крахмала картофельного или кукурузного, 30 г аэросила, 9 г талька и 3 г стеарата кальция или магния. Массу тщательно гомогенизируют и полученный порошок рассыпают по капсулам. Получают 1 тыс. капсул по 0,3 г, имеющих следующий состав порошка (мас.ч.):
активное начало 1a - 20,0
смесь витаминов - 20,0
крахмал - 46,0
аэросил - 10,0
тальк - 3,0
стеарат кальция или магния - 1,0
Пример 2 (фармацевтическая композиция в виде драже).
К 60 г аддукта оротовой кислоты и гамма-аминомасляной кислоты (1в) прибавляют 26,5 г смеси витаминов (например, 2 г тиамина хлорида или бромида, 2 г рибофлавина, 0,5 г фолиевой кислоты, 2 г пиридоксина гидрохлорида, 3 г токоферола ацетата, 17 г никотинамида) и тщательно перемешивают. Затем загружают 185 г лактозы, 218,5 г сухого крахмала, 5 г талька и 5 г стеарата кальция или магния. Смесь гомогенизируют и дражируют в дражираторе до получения неслипающихся драже. Получают 1 тыс. драже со следующим содержанием ингредиентов в одном драже (мас.ч.):
активное начало 1в - 12,0
смесь витаминов - 5,3
лактоза - 38,0
крахмал - 43,7
тальк - 1,0
стеарат магния - 1,0
Пример 3 (фармацевтическая композиция в виде таблеток).
Изготовление таблеток осуществляют путем операций приготовления (перемешивания компонентов), увлажнения, влажного гарнулирования, сушки, сухого гранулирования, размола и опудривания гранул, таблетирования, обеспыливания и отбраковки таблеток.
В смеситель загружают 62,65 г порошка 1б, 58,06 г крахмала картофельного, 27,88 г лактозы и 3,13 г аэросила. После перемешивания смеси порошков загружают 66,83 г 5ти-пpoцeнтного крахмального клейстера (из 3,41 г крахмала) и перемешивают до равномерного распределения влаги. Полученную массу тщательно перемешивают и пропускают через гранулятор с диаметром отверстий 2 мм. Влажный гранулят сушат до остаточной влаги 1,5-2,5%, высушенные гранулы пропускают через гранулятор с диаметром отверстий 1 мм. Полученную массу опудривают 1,53 г стеарата магния и таблетируют на таблеточной машине. Получают 150 таблеток со следующим содержанием ингредиентов в одной таблетке (мас.ч.):
активное начало 1б - 40,0
крахмал - 39,2
магния стеарат - 1,0
лактоза - 17,8
аэросил - 2,0
Полученные таблетки имеют срок годности более 2-х лет, хорошие структурно-механические характеристики, отвечают всем общим требованиям Госфармакопеи XI издания (см. табл.5).
Пример 4 (фармацевтическая композиция в виде таблеток в пленочной оболочке).
В смеситель загружают просеянные порошки аддукта оротовой кислоты и лизина (1 г) - 120 г, смесь витаминов 75,7 г, крахмала картофельного 100 г и аэросила 2 г. Перемешивают смесь в течение 15 минут, увлажняют раствором поливинилпирролидона (ПВП), содержащего 13,6 г ПВП. Увлажненную массу перемешивают и гранулируют, гранулы высушивают до содержания влаги не более 4%. Затем сухие гранулы размалывают, опудривают стеаратом магния или кальция (2 г) и таблетируют в таблеточной машине. Получают ядра-таблеток, имеющих следующий состав ингредиентов (мас.ч.):
активное начало (1 г) - 40,0
смесь витаминов - 23,3
крахмал - 30,8
поливинилпирролидон - 4,5
аэросил - 0,7
стеарат магния (кальция) - 0,7
Далее на ядра-таблетки наносят пленочное покрытие, приготовленное из раствора ацетилфталилцеллюлозы (АФЦ) в смеси ацетона с 96%-ным этиловым спиртом (содержащего 15 г АФЦ), 4 г титана диоксида, 2,9 г касторового масла и 3,1 г вазелинового масла. Масса покрытия должна составлять 3-3,5% от общей массы таблетки.
Получают 1 тыс. таблеток в оболочке с массой 0,325 г, которые отвечают всем требованиям Госфармакопеи XI изд. и имеют срок годности более 2-х лет (см. табл.5).
Пример 5 (ректальные свечи массой 0,5 г).
Суппозитории (ректальные свечи) готовят по общепринятой технологии методом выливания массы в формы при следующем соотношении ингредиентов (мас.ч.):
оротат Д-(-)-трео-п-нитро-
фенил-2-аминопропандиол-1,3 (1д) - 0,06
твердый кондитерский жир (ТКЖ) - 99,94
Из 47 г липофильной суппозиторной основы ТКЖ и 3 г активного начала 1д получают 100 свечей со средней массой 0,5 г, содержащих по 60 мг 1д в каждой свече, отвечающих требованиям Госфармакопеи XI изд. к ректальным свечам (см. табл.5).
Пример 6 (свечи массой 1 г).
Ректальные свечи готовят методом выливания, аналогично описанному в примере 5, при следующем соотношении ингредиентов (мас.ч.):
активное начало 1в - 0,06
ТКЖ - 99,93
твин-80 - 0,01
Из 6 г активного начала 1в, 93 г суппозиторной основы ТКЖ и 1 г твина-80 получают 100 свечей с массой по 1 г, содержащих по 60 мг 1в, соответствующих требованиям Госфармакопеи XI изд.
Пример 7 (свечи массой 4 г).
Ректальные свечи готовят методом выливания при следующем соотношении ингредиентов (мас.ч.):
активное начало 1а - 0,05
полиэтиленгликоль (95% ПЭГ с М.м.=1500+
+5% ПЭГ с М.м.=400) - 99,95
Из 20 г активного начала 1а и 380 г ПЭГ методом выливания получают 100 свечей с массой по 4 г, содержащих по 50 мг 1a, соответствующих требованиям Госфармакопеи XI изд.
Пример 8 (сироп во флаконах).
К нагретому до 50°С раствору 220 г пропиленгликоля прибавляют 12 г оротата гуанидина (1е), 1 г бензоата натрия и 2,4 г лимонной кислоты (раствор № 1). В другом смесителе растворяют 0,2 г ментола и 1 г ванилина или других ароматизаторов в 80 мл пропиленгликоля (раствор №2). В 3-ем смесителе готовят при нагревании водный раствор 350 г сорбита или другого подсластителя (раствор № 3). Затем к охлажденному раствору № 1 приливают раствор № 3 и к полученной смеси добавляют 0,001 г пищевого красителя, например тропеолина 0, и раствор 1 г сахарина в 200 мл воды (раствор № 4). Далее к смеси приливают раствор № 2, прибавляют 4 г ароматизирующей пищевой эссенции, например эссенции "лимон", и доводят общий объем очищенной водой до 1 л. После перемешивания и фильтрации от механических примесей сироп расфасовывают в стеклянные флаконы по 100 мл. Получают 10 флаконов сиропа.
Срок годности всех разработанных лекарственных форм, приведенных в примерах 1-8, не менее 2-х лет.
Все заявляемые фармацевтические композиции обладают высоким гепатозащитным эффектом и по терапевтическому индексу в 2-5 раз превосходят ряд известных гепатопротекторов.
Таким образом, положительный эффект и промышленная применимость изобретения заключается в возможности получения доступными методами новых высокоэффективных гепатозащитных препаратов для лечения заболеваний печени, превосходящих по эффективности и терапевтической широте некоторые известные в клинической практике препараты того же назначения.
Источники информации
1. Радбиль О.С. Фармакотерапия в гастроэнтерологии (справочник), М., "Медицина", 1991.
2. Машковский М.Д. Лекарственные средства, М., "Медицина", изд.12ое, ч.1, 2, 1993.
3. Видаль-2002 (справочник). Лекарственные препараты в России, изд. "АстраФармСервис", с.Б-733.
4. Пат. РФ № 2047606.
5. Технология лекарственных форм, т.2 (под ред. Л.А.Ивановой) М., "Медицина", 1991, с.142.
6. Биохимические методы исследования в клинике (под ред. А.А.Покровского) М., 1969, с.300-303.
7. Титов В.Н. и др. Лаб. дело, 1979, № 1, с.36-41.
8. Величко Л.Н. и др. Вопр. мед. химии, 1980, № 2, с.275-277.
9. Кейтс М. Техника липидологии (пер. с англ.). М., "Мир", 1975, с.74.
10. Грибанов Г.А., Сергеев С.А. Вопр. мед. химии, 1975, т.21, с.652.
11. Watson D. Clin. Chim. Acta, 1960, № 5, р.637.
12. Волкова О.B., Eлeцкий Ю.К. Оcнoвы гистологии и гистологической техники. М., 1982, 304 с.
13. Елисеев В.Г. и др. Основы гистологии и гистологической техники. М., 1967, 267 с.
14. Автандилов Г.Г. Введение в количественную патологическую морфологию. М., 1980, 216 с.
15. Фишер А. Физиология и экспериментальная патология печени. Будапешт, 1961, 216 с.
1. Фармацевтическая композиция, обладающая гепатозащитным действием, включающая в качестве активного начала производные оротовой кислоты и целевые добавки, отличающаяся тем, что в качестве производных оротовой кислоты она содержит аддукты оротовой кислоты с аминокислотами или аминами общей формулы I
X-CH-(CH2)n-Z, где Х=Н, СООН, СООАlk;
Z=H, СООН, NH2, CONH2; n=0-5
при следующем соотношении компонентов, мас.%:
Активное начало 0,05-40,0
Целевые добавки 60,0-99,95
2. Фармацевтическая композиция по п.1, отличающаяся тем, что в качестве целевых добавок она содержит компоненты, выбранные из группы: крахмал, смесь витаминов, лактоза, аэросил, тальк, соль стеариновой кислоты, поливинилпирролидон, твердый кондитерский жир, твин-80, полиэтиленгликоль, пропиленгликоль, кислота лимонная, кислота бензойная или натрия бензоат, коррегирующие вещества, краситель.
3. Композиция по п.1, отличающаяся тем, что в качестве крахмала она содержит картофельный и/или кукурузный крахмал.
4. Композиция по п.1, отличающаяся тем, что в качестве соли стеариновой кислоты используют кальциевую или магниевую соль этой кислоты.
5. Композиция по п.1, отличающаяся тем, что в качестве смеси витаминов используют тиамина хлорид или бромид, рибофлавин, пиридоксина гидрохлорид, цианокобалмин, фолиевую кислоту, никотинамид, токоферола ацетат, аскорбиновую кислоту, рутин.
6. Композиция по п.2, отличающаяся тем, что в качестве коррегирующих веществ используют сорбит, ксилит, лактозу, глюкозу, сахарозу, аспартам либо готовый фруктовый сироп и ароматизирующие эссенции.
7. Композиция по п.1, отличающаяся тем, что она представляет собой порошок, таблетки, драже, капсулы, суппозитории, сиропы.
8. Лекарственное средство, обладающее гепатозащитным действием, включающее фармацевтическую композицию по п.1.
9. Лекарственное средство по п.8, отличающееся тем, что аддукт оротовой кислоты с аминокислотами или аминами содержит в качестве аминокислотной компоненты или амина L-глутаминовую кислоту, гамма-аминомасляную кислоту, лизин, бета-аланин, гуанидин или Д-(-)-трео-п-нитрофенил-2-аминопропандиол-1,3.