Комплексы органокобальта с тридентатными основаниями шиффа в качестве инициаторов эмульсионной полимеризации и сополимеризации диеновых и виниловых мономеров
Иллюстрации
Показать всеИзобретение относится к областям химии металлоорганических соединений и полимеров, а именно к комплексам алкилкобальта(III) с тридентатными основаниями Шиффа, в которых алкильный лиганд содержит функциональную, а именно гидроксильную, карбоксильную или аминогруппу, формулы I, где W - мостиковая двухзвенная ненасыщенная углеводородная группа, а именно -С(Н)=С(СН3)- (пропен-1,2-диил), или о-С6Н4 (о-фенилен); Х (функциональная группа)=ОН, NH2 или COONa; Y - однозарядный анион, а именно Cl-, Br-, I-, NO3 - или ClO4 -, и Z - насыщенная углеводородная мостиковая, а именно полиметиленовая, (CH2)n, группа, где число звеньев n=3-11, если Х=ОН или NH2, и n=2-11, если Х=COONa;
Полученные комплексы используют в качестве инициаторов эмульсионной полимеризации и сополимеризации диеновых и виниловых мономеров для получения реакционноспособных бифункциональных олигомеров и полимеров с такими концевыми группами. Технический результат данного изобретения состоит в получении новых высокоэффективных низкотемпературных инициаторов эмульсионной полимеризации, содержащих в инициирующем радикале гидроксильную, карбоксильную или аминогруппу, которые подходят для последующей конъюгации получаемых полимеров с соответствующими реагентами. 3 табл.
Реферат
Изобретение относится к областям химии металлоорганических соединений и полимеров, а именно к комплексам алкилкобальта(III) с тридентатными основаниями Шиффа, в которых алкильный лиганд содержит функциональную, а именно гидроксильную, карбоксильную или аминогруппу, и использованию этих комплексов в качестве инициаторов эмульсионной полимеризации и сополимеризации диеновых и виниловых мономеров для получения реакционноспособных бифункциональных олигомеров и полимеров с такими концевыми группами.
Введение в полимер функциональных групп может быть использовано для иммобилизации биологически активных соединений, например получения иммунодиагностикумов и прививки катализаторов (Хартли Ф. Закрепленные металлокомплексы - новое поколение катализаторов. М.: Мир, 1989), а также для модификации свойств самого полимера. Полученные аналогичным образом бифункциональные олигомеры могут послужить исходными веществами (компонентами) для получения поликонденсационных (со)полимеров.
До сих пор при использовании для этой цели метода эмульсионной полимеризации в качестве инициаторов применяли соответствующим образом функционализованные перекисные и азосоединения (Иванчев С.С. Успехи химии, 1991, 60, 1368-1390). Однако в этом случае процесс приходится проводить при повышенных (>60° С) температурах и относительно высоких концентрациях инициатора. Последнее приводит к тому, что количество функциональных групп на поверхности полимерной частицы намного превышает оптимальное. В результате происходит лиофилизация поверхности и, как следствие, понижается устойчивость этих частиц в физиологическом растворе при использовании таких суспензий в качестве носителей биолигандов. Напротив, в случае использования предлагаемых инициаторов имеется возможность регулирования количества функциональных групп на поверхности частицы путем варьирования концентрации инициатора.
Известно использование комплексов алкилкобальта(III) с тридентатным основанием Шиффа - алкил{2-[(2-аминоэтил)имино]-3-алкил-пент-3-ен-4-олят}-(1,2-этандиамин)кобальт(III) бромидов (I, где XZ - простая, т.е. функционально не замещенная алкильная группа CnH2n+1, и Y=Br) - в качестве инициаторов эмульсионной полимеризации (патент РФ №2070202, 1991). Эти соединения являются высокоэффективными инициаторами эмульсионной полимеризации, работающими при комнатных и даже более низких температурах; однако они не вносят в состав полимера функциональных групп.
Задачей данного изобретения было получение новых высокоэффективных низкотемпературных инициаторов эмульсионной полимеризации, содержащих в инициирующем радикале гидроксильную, карбоксильную или аминогруппу, которые подходят для последующей конъюгации получаемых полимеров с соответствующими реагентами.
Эта задача решается новой структурой комплексов (функционально замещенного алкил)кобальта с тридентатными основаниями Шиффа общей формулы I
где W - мостиковая двухзвенная ненасыщенная углеводородная группа, а именно -С(Н)=С(СН3)- (пропен-1,2-диил, А), или о-С6H4 (о-фенилен, В), Х=ОН, NH2 или COONa, Z - насыщенная углеводородная мостиковая, а именно полиметиленовая ((СН2)n) группа, и Y - однозарядный анион, а именно Сl-, Вr-, I-, NO3 - или ClO4 -. До сих пор комплексы алкилкобальта с тридентатными основаниями Шиффа, содержащие в алкильном лиганде функциональные группы, не были известны.
Сопоставительный анализ с аналогами позволяет сделать вывод о том, что предлагаются соединения новой структуры. Таким образом, заявленное техническое решение соответствует критерию “новизна”.
Указанные комплексы - (ω -гидрокси-н-алкил)-, (ω -амино-н-алкил)- и [ω -(натрия карбоксилато)-н-алкил]{2-[(2-аминоэтил)имино]пент-3-ен-4-олято}- и -(2-{ 1-[(2-амино-этил)имино]этил}фенолято)(1,2-этандиамин)кобальт(III) бромиды *, хлориды, иодиды, нитраты и перхлораты (символические формулы [Х(СН2)nСо(асасеn)(еn)]Y (IA) и [X(CH2)nCo(7-Me-salen)(en)]Y (IВ), соответственно) впервые получены авторами, как описано ниже.
Комплексы I с бромидным противоионом (Y=Вr) и Х=ОН, COONa, Вr** синтезировали темплатным методом, в основном по аналогии с опубликованными методиками получения соответствующих комплексов с простыми, т.е. функционально незамещенными алкильными лигандами CnH2n+1, а именно комплексов рядов [RCo(acacen)(en)]Br (патент РФ 2070202, 1991) и [RCo(7-Me-salen)(en)]Br (I.Ya. Levitin et al., Inorg. Synth. (S. Kirschner, ed.), Wiley, New York, 1985, v.23, pp.163-171), в анаэробных условиях и при постоянном перемешивании. Комплексы с другими противоионами (Y=Cl, I, NO3, ClO4) получали, исходя из соответствующих бромидов реакциями ионного обмена в растворах, также по аналогии с комплексами с простыми алкильными лигандами (I. Ya. Levitin et al., Inorg. Chim. Acta, 1985, 100, 65-77). Комплексы по возможности защищали от света при всех операциях и хранили в темноте. Упаривание растворов проводили в вакууме при температуре бани не выше 30° С.
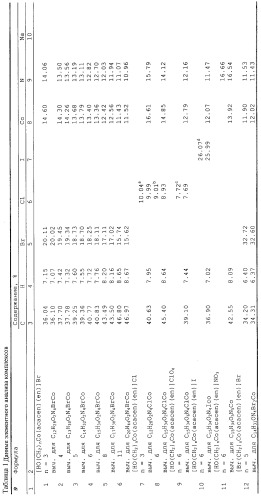
Комплексы идентифицированы и охарактеризованы с помощью элементного анализа (таблица 1 *), ПМР-, ИК- и электронной спектроскопии, а также ТСХ и капиллярного электрофореза. Их выходы и хроматографические характеристики приведены в таблице 2.
* а также (ω -бром-н-алкил){2-[(2-аминоэтил)имино]пент-3-ен-4-олято}- и -(2-{1-[(2-аминоэтил)-имино]этил}-фенолято)(1,2-этандиамин)кобальт(III) бромиды ([Br(CH2)nCo(acacen)(en)]Br и [Br(CH2)nCo(7-Me-salen)(en)]Br), которые являются промежуточными продуктами в синтезе соответствующих ω -аминозамещенных комплексов
** см. предыдущее примечание
* там же дана нумерация комплексов
Вариант (I): Получение 6-гидроксигексил{2-[(2-аминоэтил)имино]пент-3-ен-4-олят}(1,2-этандиамин)-кобальт(III) бромида ([НО(СН2)6Со(асасеп)(еn)]Вr, №4).
Раствор ацетилацетона - 3.08 мл (30 ммол) и этилендиамина - 2.01 мл (30 ммол) в метаноле (110 мл) выдерживали до тех пор, пока он не окрасился в желтый цвет. Затем добавили СоСl2·6Н2О - 3.6 г (15 ммол). К полученному коричневому раствору при охлаждении водой постепенно присыпали едкий натр - 3.7 г (80 ммол); при этом раствор превратился в морковно-красную суспензию. После растворения едкого натра водяную баню нагрели до 25° С. Затем добавили 2%-ный раствор PdCl2 в 1 М водном растворе КСl - 0.3 мл и 2,94 мл (22,5 ммол) 6-бромгексанола. После этого реакционную колбу защищали от света. Затем добавили l/10 часть раствора 0.8 г (20 ммол) NaBH4 в растворе 0.4 г (≈ 10 ммол) NaOH в 5 мл метанола. Оставшийся раствор добавляли постепенно в течение 5 час. После этого продолжали перемешивать реакционную смесь в анаэробных условиях еще час. Затем ее охлаждали в течение нескольких часов при 0° С. Отфильтровали выпавший осадок и промывали его на фильтре метанолом до тех пор, пока промывная жидкость не перестала окрашиваться. Промывную жидкость соединили с маточником. Полученный раствор сконцентрировали в вакууме до 30 мл и оставили кристаллизоваться при 0° С. Образовавшийся осадок темно-красного цвета отделили фильтрованием и сушили отсасыванием на фильтре. Затем промывали его СН2Сl2 до тех пор, пока промывная жидкость не перестала окрашиваться в зеленый цвет. Оставшийся на фильтре продукт красного цвета сушили отсасыванием на фильтре и окончательно - в вакууме над хлористым кальцием. Продукт-сырец был очищен перекристаллизацией из метанола. Выделенный таким образом комплекс представляет собой красный кристаллический порошок.
Аналогичным образом получили другие комплексы ряда [HO(CH2)nCo(acacen)(en)]Br (№1-3, 5, 6). Выходы от 80% (n=3) до 55% (n=11) - см. табл. 2.
Вариант (2): Получение 5-аминоамил{2-[(2-аминоэтил)имино]пент-3-ен-4-олят}-(1,2-этандиамин)кобальт(III) бромида ([НО(СН2)5Со(асасеn)(еn)]Вr, №13).
а - Синтез соответствующего ω -бромалкилкобальтового комплекса ([Br(CH2)5Co(acacen)(en)]Br, №12).- Синтез проводили по аналогии с синтезом 1, с той разницей, что в качестве алкилирующего средства вместо 6-бромгексанола использовали 1,5-дибромпентан (6.13 мл - 45 ммол). Полученный (промежуточный) продукт представляет собой красный кристаллический порошок.
б - Аминирование полученного ω -бромалкилкобальтового комплекса.-[Br(CH2)5Co(acacen)(en)]Br (0.5 г) растворили в концентрированном водном растворе аммиака (70 мл). Полученный раствор оставили стоять при комнатной температуре; ход реакции, которая окончилась через 3 часа, контролировали с помощью ТСХ в условиях, указанных в табл. 2. После добавления Na2CO3 (0,5 г) полученный раствор концентрировали в вакууме, а затем экстрагировали дихлорметаном. Экстракт сушили над Na2SO4 и концентрировали в вакууме. Продукт высадили эфиром, отфильтровали и высушили на фильтре. Получили красный кристаллический порошок.
Варианты (3,4): Получение 2-(натрий карбоксилато)этил- и 5-(натрий карбоксилато)амил{2-[(2-аминоэтил)-имино]пент-3-ен-4-олят}(1,2-этандиамин)-кобальт(III) бромидов ([NaOCO(CH2)nCo(acacen)(en)]Br, n=2, 5; №15 и 16).
Синтезы проводили по аналогии с синтезом 1, с той разницей, что в качестве алкилирующего средства вместо 6-бромгексанола использовали метанольные растворы 3-бромпропионата и 6-бромкапроата натрия соответственно. Они были приготовлены добавлением к охлаждаемым и перемешиваемым растворам 3-бромпропионовой и 6-бромкапроновой кислот (22.5 ммол - 3.44 и 4.39 г соответственно) Na2CO3 до прекращения газовыделения; избыток реагента удаляли декантацией. Продукты представляют собой красные кристаллические порошки.
Вариант (5): Получение 11-гидроксиундецил(2-{1-[(2-аминоэтил)имино]-этил}фенолято)(1,2-этандиамин)кобальт(III) бромида ([HO(CH2)11Co(7-Me-salen)(en)]Br, №19).
Синтез проводили по аналогии с синтезом 1, с той разницей, что в качестве кетоенола и алкилирующего средства вместо ацетилацетона и 6-бромгексанола использовали о-гидроксиацетофенон (3.61 мл - 30 ммол) и 11-бромундеканол (5.65 г - 22.5 ммол) соответственно. Продукт представляет собой красный кристаллический порошок.
Вариант (6) Получение 11-(натрий карбоксилато)ундецил(2-{1-[(2-аминоэтил)имино]этил}фенолято)-(1,2-этандиамин)-кобальт(III) бромида ([HO(CH2)11Co(7-Me-salen)(en)]Br. №22),-
Синтез проводили по аналогии с синтезом 5, с той разницей, что в качестве алкилирующего средства вместо 11-бромундеканола использовали метанольный раствор 11-бромундеканоата натрия, приготовленный добавлением к охлаждаемому и перемешиваемому раствору 11-бромундекановой кислоты (5.97 г - 22.5 ммол) Na2CO3 до прекращения газовыделения; избыток реагента удаляли декантацией. Продукт представляет собой красный кристаллический порошок.
Вариант (7): Получение 6-гидроксигексил{2-[(2-аминоэтил)имино]пент-3-ен-4-олят}(1,2-этандиамин)кобальт(III) хлорида ([НО(СН2)6Со(асасеn)(еn)]Сl, №8).
К почти насыщенному раствору [НО(СН2)6Со(асасеn)(еn)]Вr (1.10т - 2.5 ммол) в метаноле добавили по каплям насыщенный водный раствор РbСl2 (0.35 г - 1.25 ммол). После отделения декантацией образовавшегося осадка (РbВr2) к полученному раствору добавили двукратный объем холодной воды и упарили его в вакууме до начала кристаллизации. Окончательно кристаллизовали при 0° С. Выпавший продукт отделили фильтрованием, промыли небольшим количеством ледяной воды и высушили на фильтре. Получили красный кристаллический порошок, выход 82%.
Аналогичным образом, исходя из соответствующих комплексов I, Y=Вr, получили и другие комплексы с хлоридным противоионом I, Y=Сl (№7, 17, 20).
Вариант (8): Получение 6-гидроксигексил{2-[(2-аминоэтил)имино]пент-3-ен-4-олят}(1,2-этандиамин)-кобальт(III) иодида ([НО(СН2)6Со(асасеn)(еn)]I, №10).
Почти насыщенный раствор [HO(CH2)6Co(acacen)(en)]Br (1 г) в метаноле прилили к насыщенному водному раствору (5 мл) NaI. Выпавший продукт отделили фильтрованием, промыли небольшим количеством ледяной воды и высушили на фильтре. Получили темно-красные кристаллы, выход 85%.
Аналогичным образом, исходя из соответствующих комплексов I, Y=Вr и соответственно NaClO4 или NaNO3 (вместо NaI), получили комплексы с перхлоратным и нитратным противоионами I, Y=СlO4 и NO3 (№9 и 11, 18, 21).
Примеры синтеза полимеров в присутствии комплексов I приведены ниже. Инициаторы приведены под номерами, данными в табл. 1.
Пример 1 (по изобретению)
В реакторе с мешалкой смешивают 100 маc. ч. стирола, очищенного двойной переконденсацией под вакуумом, с водной фазой, включающей 4 мас. ч. алкилсульфоната натрия (Е-30) с длиной алкильного заместителя C15, инициатор №9, и 200 маc. ч. воды. Процесс проводят при перемешивании в атмосфере азота при температуре 40° С и рН среды, равной 7, в течение 5 часов до конверсии 97%. Полимер содержит 0,01 вес.% групп ОН-.
Примеры 2-7.
Выполняют аналогично примеру 1, с изменением типа мономеров, инициаторов, эмульгаторов, температуры, рН среды и концентрации ингредиентов.
Пример 8 (сравнительный)
В реакторе с мешалкой смешивают 100 маc. ч. стирола, очищенного двойной переконденсацией под вакуумом, с водной фазой, включающей 4 мас. ч. алкилсульфоната натрия (Е-30) с длиной алкильного заместителя С15, инициатор, состоящий из 0,11 маc. ч. комплекса с октильным заместителем и 200 маc. ч. воды. Процесс проводят при перемешивании в атмосфере азота при температуре 20° С и рН=7 в течение 5,0 часов до конверсии 94%. Полимер не содержит функциональных групп.
Рецептура и результаты использования комплексов I в качестве инициаторов эмульсионной полимеризации приведены в таблице 3.
Наличие в полистироле, полученном при инициировании полимеризации комплексами I, X=ОН или NH2, Z=(CH2)5 и Y=Вr, функциональных групп, содержащих подвижный атом водорода, было доказано путем люминесцентного анализа, при использовании в качестве метки флуоросцеинизотиоцианата.
Для увеличения содержания функциональных групп в полимере можно вводить в реакционную смесь регулятор молекулярной массы. рН эмульсионной системы поддерживают посредством известных буферных систем.
Комплексы органокобальта с тридентатными основаниями Шиффа общей формулы I
где W - мостиковая двухзвенная ненасыщенная углеводородная группа, а именно -С(Н)=С(СН3)-(пропен-1,2-диил) или о-С6Н4 (о-фенилен);
Х (функциональная группа) - ОН, NH2 или COONa;
Y - однозарядный анион, а именно Сl-, Вr-, I-, NO3 - или ClO4 -,
Z - насыщенная углеводородная мостиковая, а именно полиметиленовая, (CH2)n, группа, где число звеньев n=3-11, если Х=ОН или NH2, и n=2-11, если Х=COONa;
в качестве инициаторов эмульсионной полимеризации и сополимеризации виниловых и диеновых мономеров.