Производные фузидовой кислоты, стереоизомер, фармацевтические композиции, соединения
Иллюстрации
Показать всеПредставлены новые производные 17,20-дигидрофузидовой кислоты (Iа), где Q1 и Q2 одинаковые или различные -СО-, -СНОН- или -CHOR-, где R-C1-С4алкил, Q3-СН2-, Y-H, А-O- или -S-, R1-С1-C4алкил, олефин С2-С4, С1-С6ацил, С3-С7-циклоалкилкарбонил, бензоил, применяемые в фармацевтических композициях для лечения инфекционных заболеваний, в частности, в композициях для местного применения для лечения инфекционных заболеваний кожи или глаз. 6 н. и 16 з.п.ф-лы, 7 табл.
Реферат
Настоящее изобретение относится к новому ряду производных 17,20-дигидрофузидовой кислоты, к их солям и легко гидролизуемым эфирам, к получению указанных соединений, к фармацевтическим композициям, содержащим такие соединения, и к применению таких соединений в медицине. В частности, указанные соединения обнаруживают антимикробную активность, и, таким образом, они полезны для лечения инфекционных заболеваний. Соединения настоящего изобретения можно использовать как при системном лечении инфекционных заболеваний, так и при местном лечении инфекций, поражающих кожу и глаза.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Антибактериальные свойства фузидовой кислоты хорошо известны. Также известно, что структурные изменения могут вызвать существенную или полную потерю такой активности (ср. Godtfredsen et al., J. Med. Chem., Vol.9, p.15-22, 1966). До сих пор вообще считалось, что двойная связь между углеродами С-17 и С-20, присоединяющими боковую цепь к тетрациклической кольцевой системе, обязательна для проявления любой антибактериальной активности. Восстановление двойной связи между С-24 и С-25 фузидовой кислоты до простой связи оказывает несущественное влияние на антибактериальную активность молекулы в то время, как дополнительное восстановление двойной связи между С-17 и С-20, приводящее к тетрагидрофузидовой кислоте, вызывает почти полную потерю активности. Ранее путем каталитического гидрирования фузидовой кислоты или ее изомера люмифузидовой кислоты получены два эпимера в ряду тетрагидрофузидовых кислот, имеющих конфигурацию 17(R), 20(S) и 17(R), 20(R), соответственно (ср. von Daehne et al., Adv. Appl. Microbiol., 25, p.95-146, 1979, и указанные в работе ссылки).
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью изобретения являются полусинтетические аналоги фузидовой кислоты, обладающие антимикробной активностью. Указанной цели достигают с помощью соединений настоящего изобретения, принадлежащих к ряду дигидро- и тетрагидрофузидовых кислот, имеющих обязательную конфигурацию 17(S), 20(S), показывающих in vitro высокую антимикробную активность и благоприятную устойчивость и фармакокинетические свойства, благодаря чему соединения изобретения можно использовать при лечении инфекционных заболеваний у людей и животных.
Настоящее изобретение относится к соединениям общей формулы Iа:
где
Q1, Q2 и Q3 являются одинаковыми или различными и представляют, независимо, группу -(СО)-; группу -(СНОН)-; группу -(CHOR)-; группу -(CHSH)-; группу -(NH)-; группу -(CHNH2)- или группу -(CHNHR)-, где R представляет алкильный радикал с 1-4 атомами углерода или ацильный радикал с 1-4 атомами углерода; и где Q2 и О3 также могут представлять, независимо, группу -(СН2)-;
Y представляет водород, гидрокси, алкильный радикал с 1-4 атомами углерода или ацильный радикал с 1-4 атомами углерода; А представляет атом кислорода или серы;
R1 представляет алкильный радикал с 1-4 атомами углерода, олефиновую группу с 2-4 атомами углерода, (C1-C6)-ацильную группу, (С2-С7)-циклоалкилкарбонильную группу или бензоильную группу, причем R1, необязательно, замещен одним или более атомами галогена и/или гидрокси-, алкокси- или азидогруппами;
и к их фармацевтически приемлемым солям и легко гидролизуемым эфирам.
В формуле Iа и последующих формулах, приведенных в описании, пунктирные линии между С-1 и С-2 и/или С-24 и С-25 показывают, что указанные атомы соединены или двойной связью, или простой связью.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предпочтительными соединениями изобретения являются соединения формулы I
где
Q1 и Q2 являются одинаковыми или различными и оба представляют группу -(СНОН)-, группу -(СО)- или группу -(CHSH)-;
А представляет атом кислорода или серы;
R1 представляет алкильный радикал с 1-4 атомами углерода, олефиновую группу с 2-4 атомами углерода, (C1-C6)-ацильную группу, (С3-С7)-циклоалкилкарбонильную группу или бензоильную группу, причем R1, необязательно, замещен одним или более атомами галогена и/или гидрокси-, алкокси- или азидогруппами;
и
их фармацевтически приемлемые соли и легко гидролизуемые эфиры.
Предпочтительно, Q1 и Q2 выбраны из группы, состоящей из -(СО)- и -(СНОН)-.
Более предпочтительными соединениями изобретения являются соединения формулы I, где Q1 и Q2 - оба представляют группу или один из Q1 и Q2 представляет -(СО)-; А представляет кислород; R1 представляет (С1-С4)-алкильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из азидо, гидрокси и галогена, выбранного из фтора, хлора и брома, или R1 представляет ацильную группу с 1-4 атомами углерода или бензоильную группу, обе необязательно замещенные одним или более атомами галогена, предпочтительно, выбранными из группы, состоящей из фтора и хлора. R1, предпочтительно, выбран из группы, состоящей из этила, 2,2,2-трифторэтила, 2,2,2-трихлорэтила, 2-азидоэтила, 2-гидроксиэтила, пропила и изопропила, 1,3-дифторизопропила, ацетила, пропионила, хлорацетила и трифторацетила, или R1 выбран из предпочтительной группы, состоящей из этила, 2,2,2-трихлорэтила, 2-азидоэтила, изопропила, трет-бутила и ацетила. Также предпочтительными являются соединения формулы I и формулы Iа, где связь между С-24 и С-25 является двойной связью.
Примерами соединений изобретения, которые можно получить способами, описанными ниже, являются:
17(S),20(S)-дигидрофузидовая кислота,
17(S),20(S), 24,25-тетрагидрофузидовая кислота,
11-дегидро-17(S),20(S)-дигидрофузидовая кислота,
3-дегидро-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-пропионилокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(3'-хлорпропионилокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(2'-метилпропионилокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-циклопропилкарбонилокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-хлорацетокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-бромацетокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-бензоилокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(4'-фторбензоилокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-циклогексилкарбонилокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-акрилоилокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-изопропилтио-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-этилтио-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(2',2',2'-трихлорэтилтио)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-трет-бутилтио-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-метоксиметилтио-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-изопропилтио-17(S),20(S),24,25-тетрагидрофузидовая кислота,
16-деацетокси-16β-ацетилтио-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-бензоилтио-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-этокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(2',2',2'-трифторэтокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-пропокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-изопропокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(1',3'-дифторизопропокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-метоксиметокси-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(2',2',2'-трихлорэтокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(2'-азидоэтокси)-17(S),20(S)-дигидрофузидовая кислота,
16-деацетокси-16β-(2'-гидpoкcиэтoкcи)-17(S),20(S)-дигидрофузидовая кислота,
и их фармацевтически приемлемые соли и легко гидролизуемые эфиры.
В отличие от природной фузидовой кислоты (1), где С-17 и С-20 соединены двойной связью, все описанные здесь соединения формулы I и формулы Iа имеют простую связь между С-17 и С-20. Конфигурация двух рассматриваемых асимметричных атомов углерода является 17(S) и 20(S). Такой эпимер является одним из четырех возможных эпимеров, различающихся только конфигурацией С-17 и С-20; и биологические испытания показывают, что это единственный эпимер, обнаруживающий сильную активность.
Соединения изобретения можно использовать как таковые или в форме солей или легко гидролизуемых эфиров (как описано далее). Соли соединений являются, в частности, фармацевтически приемлемыми солями, такими как соли щелочных металлов и соли щелочноземельных металлов, например, натриевые, калиевые, магниевые или кальциевые соли, а также соли серебра и соли оснований, таких как аммиак или подходящие нетоксичные амины, такие как низшие алкиламины, например, триэтиламин, низшие гидроксиалкиламины, например, 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, циклоалкиламины, например, дициклогексиламин, или бензиламины, например, N,N'-дибензилэтилендиамин и дибензиламин. Соли серебра соединений особенно полезны для местного лечения.
Выражение "легко гидролизуемые эфиры" в данном описании используется для обозначения алканоилоксиалкиловых, аралканоилоксиалкиловых, ароилоксиалкиловых эфиров, например, ацетоксиметиловых, пивалоилоксиметиловых, бензоилоксиметиловых эфиров, и соответствующих 1'-oкcиэтилпpoизвoдныx, или алкоксикарбонилоксиалкиловых эфиров, например, метоксикарбонилоксиметиловых эфиров и этоксикарбонилоксиметиловых эфиров, и соответствующих 1'-оксиэтилпроизводных, или лактониловых эфиров, например, фталидиловых эфиров, или диалкиламиноалкиловых эфиров, например, диэтиламиноэтиловых эфиров. Выражение "легко гидролизуемые эфиры" включает эфиры соединений изобретения, гидролизуемые in vivo. Такие эфиры можно получить с использованием способов, известных специалистам в данной области техники, ср. патент GB №1490852, включенный в настоящее описание в качестве ссылки.
Используемые в описании перечисленные далее термины, если нет иных указаний, имеют значения, указанные далее, ср. также рекомендации ИЮПАК, 1994, http://www.chem.qmw.ас.uk/iupac/class/.
"Алкил" обозначает любую одновалентную группу, образованную от алкана путем удаления атома водорода от любого атома углерода, и включает подклассы нормальных алкильных (н-алкил) и первичных, вторичных и третичных алкильных групп, соответственно, с определенным числом атомов углеродов, в том числе, например, (C1-C4)-алкил, (C1-С3)-алкил, (С1-С2)-алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Aлканом называется ациклический разветвленный или неразветвленный углеводород общей формулы CnH2n+2, где n представляет целое число, и, следовательно, полностью состоящий из атомов водорода и насыщенных атомов углерода.
Термин "олефиновая группа" относится к линейному или разветвленному ациклическому углеводороду с одной или несколькими углерод-углеродными двойными связями Е- или Z-стереохимии, где это приемлемо, с определенным числом атомов углерода. Термин включает, например, (С2-С4)-олефиновую группу, предпочтительно, (С2-С4)-алкенил; (С2-С3)-олефиновую группу, предпочтительно, (С2-С3)-алкенил; винил; аллил; 1-бутенил; 2-бутенил и 2-метил-2-пропенил. Кроме того, термин "олефиновая группа" относится к линейной или разветвленной алкинильной группе, содержащей, по меньшей мере, одну тройную связь. Такой термин будет включать, например, кротил и пропаргил. Олефиновые группы, содержащие только одну углерод-углеродную двойную связь, называемые здесь алкенилами, являются предпочтительными.
Термин "арил" относится к группам, образованным от моноциклических и полициклических ароматических углеводородов посредством удаления атома водорода от атома углерода кольца, например, о-толилу, фенилу, нафтилу. Число атомов углерода в арильной группе, как правило, составляет 6, 7, 8, 9 или 10.
Термин "ацил" в широком смысле относится к радикалу формулы R-CO-, где R представляет собой алкил, имеющий указанные выше значения, например, (C1-C6)-ацилу.
Термин "алкокси" в широком смысле относится к радикалу формулы -OR, где R представляет собой алкил, имеющий указанные выше значения, например, (С1-С5)-алкокси, (C1-С3)-алкокси, метокси, н-пропокси, трет-бутокси и т.п.
"Галоген" означает одинаковые или различные фтор, хлор, бром и йод; причем в соединениях настоящего изобретения более полезны фтор, хлор и бром.
Термин "алканоил" в широком смысле относится к радикалу формулы -R-CO-, где R представляет алкил, имеющий указанные выше значения, например, (С1-С8)-алканоил, ацетил, пропионил, изопропионил, бутирил. Термин "аралканоил" в широком смысле относится к радикалу формулы -R(CH2)n-CO-, где R представляет собой арил, имеющий указанные выше значения, и n представляет целое число, выбранное, предпочтительно, из 1, 2, 3 и 4. Термин "ароил" в широком смысле относится к радикалу формулы R-CO-, где R представляет арильную группу, имеющую указанные выше значения.
Термин "алканоилоксиалкил" или "ароилоксиалкил" в широком смысле относится к радикалу формулы -CH2-O-CO-R, где R представляет (C1-C6)-алкильную группу или (С6-С8)-арильную группу. Арил и алкил имеют значения, указанные выше.
Термины "алкоксикарбонил-" и "арилоксикарбонил-" относятся к группе -CO-OR, или "ацилокси-" относится к группе R-CO-O-, где R представляет алкил или арил, имеющие значения, указанные выше.
В соединениях по изобретению существует несколько хиральных центров из-за присутствия асимметричных атомов углерода. Наличие нескольких асимметричных атомов углерода приводит к ряду стереоизомеров R- или S-конфигурации при каждом хиральном центре. Общие формулы I и Iа и (если нет иных указаний) все другие формулы в данном описании следует понимать как охватывающие все такие стереоизомеры в чистых формах и в виде смесей (например, смеси стереоизомеров), за исключением тех случаев, когда конфигурация указана специально.
В соединениях формул I и Iа предпочтительная стереохимическая конфигурация, как правило, следующая: когда Q1 и Q2 относятся к группе , конфигурация при С-3 и С-11 в соединениях формулы I и Iа является 3α и 11α, соответственно. Атом С-16, к которому присоединена группа А, имеет (S)-конфигурацию, далее обозначаемую 16β. В формулах в описании простые линии обозначают связи приблизительно в плоскости рисунка; связи с атомами выше плоскости показаны жирной клиновидной линией, узкий конец которой исходит отатома в плоскости рисунка; и связи с атомами ниже плоскости показаны короткими параллельными (в виде клина) линиями. Заместители выше плоскости обозначаются β, и на них указывает жирная клиновидная линия, заместители ниже плоскости обозначаются α, и на них указывает линия из коротких параллельных линий (в виде клина).
Биологическая активность
Исследования in vitro свидетельствуют о высокой эффективности соединений изобретения против некоторых бактерий, в том числе, стафилококков, стрептококков, коринбактерий и микобактерий. Биологические испытания показывают, что антибактериальная активность 17(S),20(S)-дигидрофузидовой кислоты (10) (соединение 101) сравнима с активностью фузидовой кислоты (1), как можно видеть из таблицы 1, показывающей величины MIC двух указанных соединений в отношении ряда бактерий. Биологические испытания проводят на титрационных микропланшетах с использованием жидкой среды, содержащей бульон.
| Таблица 1 | |||
| Название бактерий/штамма | Пояснение | Величины MIC (концентрации в мкг/мл, требуемые для 90%-ного ингибирования) | |
| Соединение 101 | Фузидовая кислота (1) | ||
| S. aureus/l Aus-pe | FusS. MRSA | 1 | 1 |
| S. aureus/АТСС 29213 | FusS, MSSA | 1 | 1 |
| S. aureus/22 DK | FusS. MSSA | I | 0,5 |
| S.aureus/54USA-br | FusR, MSSA | 8 | 8 |
| E.faecalis/V583 P. Cour. | VanR | 16 | 16 |
| C. diphteria/62001 | 0,063 | 0,063 | |
| Streptococcus – gr. A/67011 | 64 | 16 | |
| Streptococcus – gr. B/61 | >64 | 32 | |
| Streptococcus - gr. C/68 | 4 | 2 | |
| Streptococcus - gr. G/59 | 8 | 4 | |
| Staphylococcus/291-2* | FusS | 1 | 1 |
| Staphylococcus/379-2* | FusR | 64 | 64 |
| P. acnes/1060 | 0,5 | 0,125 | |
| N. gonorrhoea/C1 | 4 | 1 | |
| N. meningitidis/K1 | 1 | 0,25 | |
| M. tuberculosis/R 498 | 16 | >16 |
FusS = чувствительный к фузидовой кислоте; FusR = устойчивый к фузидовой кислоте; MRSA = метициллинустойчивый Staphylococcus aureus; MSSA = метициллинчувствите-льный Staphylococcus aureus; VanR = ванкомицинустойчивый. * Коагулазоотрицательные.
Другие соединения изобретения также обнаруживают высокую in vitro активность против некоторых бактерий. Антибактериальная активность некоторых таких соединений относительно фузидовой кислоты видна из таблицы 2, показывающей величины MIC соединений изобретения.
Используемый способ рекомендован Europan Pharmacopoeia, 3rd Ed. (1977), для испытания эффективности антибиотиков. Он представляет собой метод диффузии в агаре, где в углубления в агаре добавляют одинаковые объемы испытываемого раствора. Зоны ингибирования являются функцией концентрации используемого аналога фузидовой кислоты. Все анализы проводят с фузидовой кислотой (1) в качестве стандартного вещества. Результаты в таблице 2 отличаются от результатов в таблице 1 из-за использования различных экспериментальных методов.
| Таблица 2 | |||||||
| Величины MIC (концентрации в мкг/мл, требуемые для 90%-ного ингибирования) | |||||||
| Штамм | Фузидовая кислота (1) | 101 | 102 | 105 | 113 | 123 | 128 |
| S-aureus | 0,013 | 0,002 | 0,016 | 0,22 | 16 | 0,02 | 0,26 |
| АТСС6538Р | |||||||
| S. aureus* | 0,012 | 0,003 | 0,12 | 0,24 | 16 | 0,005 | >64 |
| Leo id. CJ232 | |||||||
| S. aureus** | 0,01 | 0,001 | 0,009 | 0,063 | 16 | 0,007 | >64 |
| LeoidCJ234(R) | |||||||
| S. aureus | 0,01 | 0,001 | 0,02 | 0,19 | 16 | 0,02 | 0,19 |
| ATCC2977 | |||||||
| Strep. epidermis | 0,01 | 0,001 | 0,015 | 008 | >64 | 0,5 | 0,5 |
| A. ATCC12228 | |||||||
| Strep. faccalis | 4,9 | 3,7 | MIC>64 | >64 | >64 | 16 | 16 |
| ATCC10541 | |||||||
| Strep. faecium*** | 2,7 | 1,2 | 3,9 | 3,9 | >64 | 16 | 16 |
| Leo id.E119(P) | |||||||
| Strep. sp. Gr.B | 4,9 | 3,5 | 3,4 | >64 | 4 | 16 | 16 |
| Leo id.EF6 | |||||||
| *MRSA, **MRSA и рифампицинустойчивый, ***Пенициллинустойчивый |
Кроме того, соединения изобретения обладают некоторыми преимуществами, по сравнению с соответствующими соединениями, содержащими двойную связь 17, 20, такими как фузидовая кислота.
- Соединения формул I и Ia химически более устойчивы, вероятно, из-за меньшей активности насыщенной связи 17, 20 и отсутствия сопряжения карбоновой кислоты с углерод-углеродной двойной связью.
- Соединения формул I и Iа менее легко разлагаются под действием солнечного света.
- Соединения формул I и Iа более устойчивы в растворе. Раствор соединения формулы 10, приведенной ниже, в этаноле, хранившийся при 0°С в течение 1 месяца, сохраняет >80% начальной активности в то время, как соответствующий раствор фузидовой кислоты сохраняет только 70% начальной активности.
- Соединения формул I и Iа более липофильны и, таким образом, более подходят для препаратов для местного применения.
- Будучи полусинтетическими, соединения формул I и Iа можно получить из относительно неочищенной исходной фузидовой кислоты, которая в таком случае не подходит для целей медицины.
В данном описании используются приведенные далее общепринятые сокращения.
АсОН = уксусная кислота
Аc2O = уксусный ангидрид
Ас = ацетил
Вu = н-бутил
tВu, tBu = трет-бутил
Et = этил
Эфир = диэтиловый эфир
Me = метил
MOM = метоксиметил
МОМО = метоксиметил-O
Ph = фенил
TBAF = фторид тетра-н-бутиламмония
TBS = трет-бутилдиметилсилил
TBSCl = трет-бутилдиметилсилилхлорид
ТГФ = тетрагидрофуран
ТСХ = тонкослойная хроматография
TMS = триметилсилил
Получение соединений изобретения
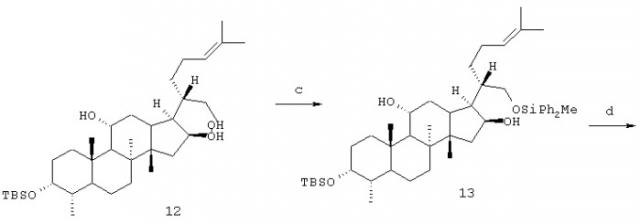
17S,20S-дигидрофузидовую кислоту (10) можно получить, исходя из встречающейся в природе фузидовой кислоты, последовательно по схеме 1, описанной ниже. Сначала фузидовую кислоту (1) превращают в лактон (2) путем деацетилирования с последующим подкислением. Двойную связь между С-17 и С-20 в (2) восстанавливают NaBH4 в водном метаноле с цис-атакой с α-стороны молекулы с образованием лактона (3). Инверсию по С-20 получают с количественным выходом посредством нагревания лактона (3) в присутствии 28% водного раствора гидроксида натрия. Затем последовательно защищают гидроксигруппы при С-3 и С-11 в лактоне (4) как простые метоксиметиловые (MOM) эфиры. Восстановление содержащего защитные группы лактона (5) LiAlH4 дает диол (6), который сначала селективно защищают попервичной гидроксигруппе при С-21 дифенилметилсилильной группой, а затем ацетилируют гидроксигруппу при С-16. После десилилирования (7) с использованием фторида тетрабутиламмония (TBA+F), забуференного уксусной кислотой, свободную гидроксильную группу в (8) можно окислить сначала до альдегида периодинаном (periodinane) Десс-Мартина, а затем до карбоновой кислоты (9) хлоритом натрия. Соединение (10) получают на конечной стадии путем отщепления МОМ-групп в (9) обработкой триметилсилилбромидом (TMSBr) в безводном дихлорметане.
Соединение формулы 10 представляет собой соединение изобретения (соединение 101) и также общее исходное соединение для аналогов, соответствующих формуле I, как описано далее.
Схема 1
а) водн. р-р NaOH, в EtOH, кипячение с обратным холодильником; АсОН b) водн. р-р NaBH4, в МеОН; АсОН; с) водн. р-р NaOH (28%), в EtOH, кипячение с обратным холодильником; d) диизопропилэтиламин, MOMCl, СН2Сl2, кипячение с обратным холодильником; е) LiAlH4, ТГФ, кипячение с обратным холодильником; f) (i) Ph2MeSiCl, Et3N, CH2Cl2, 0°C;
(ii) Ас2О/пиридин; g) TBA+F-, АсОН, ТГФ, кипячение с обратные холодильником; h) (i) периодинан Десс-Мартина, СН2Сl2/пиридин;
(ii) NaClO2, трет-BuOH; i) TMSBr, CH2Cl2.
Соединение 101 можно получить другим способом с использованием TBS-защитной группы для маскирования функциональной 3-гидроксигруппы в соединении 4, оставляя 11-гидроксигруппу незащищенной. Затем соединение 11 с TBS-защитной группой (схема 2) соответствующим способом реагирует, как показано на схеме 1. Конечного отщепления TBS-группы достигают обработкой соединения 16 разбавленной фтористоводородной кислотой с образованием соединения формулы 10 (соединение 101).
Схема 2
а) имидаэол, TBSCl, CH2Cl2; b) LiAlH4, ТГФ, кипячение с обратным холодильником; с) Ph2MeSiCl, Et3N, CH2Cl2, 0°C; d) Ac2O/пиридин; е) TBA+F-, AcOH, ТГФ, кипячение с обратным холодильником; f) (i) периодинан Десс-Мартина, СН2Сl2/пиридин; (ii) NaClO2, трет-BuOH; g) водн. HF, ацетонитрил/ТГФ.
Соединения общей формулы I можно получить способом, включающим первую стадию, на которой соединения общей формулы II превращают в 16-бромсоединения формулы III, как описано ниже.
В приведенных формулах Q'1 и Q'2 представляют группу –(CO)-,
группу или группу ,
причем R3 представляет обычную защитную группу, такую как алканоил, аралканоил, алканоилоксиалкил или ароил, или тризамещенный силильный радикал, замещенный алкильной, оксиалкильной, арильной или оксиарильной группами; R2 представляет линейный или разветвленный алкильный радикал с 1-6 атомами углерода, например, метил, этил, трет-бутил, незамещенный или замещенный аралкильный радикал, например, бензил, нитробензил, алканоилметильный или ароилметильный радикал, например, ацетонил или фенацил, алканоилоксиалкильный или ароилоксиалкильный радикал, например, ацетоксиметил, пивалоилоксиметил или бензоил-оксиметил, алкоксиметильный радикал или цианометильный радикал, силильный радикал, замещенный группами из числа алкила, алкенила, оксиалкила, оксиалкенила, арила или оксиарила, например, триэтилсилил, триизопропилсилил, дифенилметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трет-бутоксидифенилсилил; пунктирные линии между С-24 и С-25 имеют значение, указанное выше.
Превращение осуществляют взаимодействием соединения формулы II с тетрабромметаном/трифенилфосфином или с N,N-диметилформамидатбромидом в инертном растворителе, например, эфире, тетрагидрофуране или диметилформамиде, и при комнатной или более низкой температуре (ср. von Daehne, W., and Rasmussen, P., 1975, патент Великобритании №1523803).
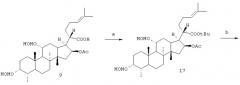
Соединения формулы II получают, исходя из соединений, указанных на схеме 1, способами, известными из литературы (ср. патент Великобритании №1490852 и патент Великобритании №1523803), или аналогичными способами. Например, исходные соединения формулы III можно получить из соединения формулы 10 или, удобнее, из соединения формулы 9, как показано на схеме 3.
Схема 3
а) N,N-диметилформамид-бис-трет-бутилацетат, бензол, кипячение с обратным холодильником; b) 2 н. водный раствор NaOH, EtOH; кипячение с обратным холодильником; с) CBr4, PPh3, CH2Cl2.
На следующей стадии промежуточные соединения формулы III вводят в реакцию с соединениями формулы IV с образованием, с инверсией конфигурации при С-16, соединений формулы V:
где в приведенных формулах Q1', Q2', A, R1, R2 и пунктирная линия между С-24 и С-25 имеют значения, указанные выше. Превращения осуществляют в соответствии с методиками, известными из литературы (ср. von Daehne, W., and Rasmussen, P., 1975, патент Великобритании №1523803). Когда А в формуле V представляет кислород, и R1 отличается от ацила, взаимодействующие соединения формулы IV используют, предпочтительно, в качестве растворителей, и реакцию осуществляют в присутствии соли серебра или ртути, например, карбоната серебра, трифторацетата серебра или ацетата ртути, или основания, например, карбоната калия, бикарбоната натрия или (C1-C5)-алкоголята натрия, предпочтительно, метилата натрия или этилата натрия, и при комнатной или несколько более высокой температуре. Если А в формуле V представляет серу, и R1 отличается от ацила, реакцию осуществляют в инертном органическом растворителе, предпочтительно, этаноле или диметилформамиде, в присутствии основания, например, гидроксида калия или гидрида натрия, и при комнатной или несколько более высокой температуре.
Когда А в формуле V представляет кислород, и R1 представляет ацил, реакцию проводят в присутствии соответствующих солей серебра соединений формулы IV в инертном растворителе, например, бензоле, и при комнатной или несколько более высокой температуре. Когда А в формуле V представляет серу, и R1 представляет ацил, взаимодействующие соединения формулы IV используют, предпочтительно, в виде их калиевых или натриевых солей, и реакцию осуществляют в инертном растворителе, например, диметилформамиде, и при комнатной температуре.
Соединения формулы V, где А представляет кислород, и R1 представляет (С1-С6)-ацильную группу или бензоильную группу, можно получить из соединений формулы II реакцией с реакционноспособным производным карбоновой кислоты формулы IV, например, хлорангидридом или ангидридом. Реакцию осуществляют в присутствии основания, предпочтительно, пиридина, в инертном растворителе, например, диметилформамиде или пиридине, и при температуре ниже комнатной.
На конечной стадии соединения формулы V можно превратить в соединения формулы I гидролизом либо в присутствии основания, такого как гидроксид или карбонат натрия или калия, в водном метаноле или этаноле, либо в присутствии кислоты, такой как соляная кислота или п-толуолсульфоновая кислота, в водном тетрагидрофуране, в зависимости от природы Q1', Q2', R1 и R2.
Соединения формулы V, где Q1' и Q2' представляют группу
или -(СО)-, и R2 представляет радикал легко гидролизуемого эфира, являются соединениями изобретения без дальнейшего превращения.
Соединения формулы V, где Q1' и/или Q2' представляют группу
или -(СО)-, и R3 представляет алканоильный, алкоксиалкильный, аралканоильный или ароильный радикал, можно превратить в соединения изобретения гидролизом в водном метаноле, этаноле или ТГФ в присутствии кислоты, такой как соляная кислота, уксусная кислота и п-толуолсульфоновая кислота, или в безводных апротонных органических растворителях, например, дихлорметане, в присутствии кислоты Льюиса, например, триметилсилилбромида. Если R3 представляет радикал алкокси или арилокси, соединения формулы V можно превратить в соединения изобретения гидролизом в водном метаноле или этаноле и в присутствии основания, такого как гидроксид или карбонат натрия или калия.
Соединения формулы V, где каждый из Q1' и Q2' представляют группу
или -(СО)-, и R2 представляет незамещенный или замещенный бензильный радикал, цианометил, алканоилметил или ароилметил, также можно превратить в соединения формулы I восстановлением. В случае, если R2 представляет бензильный или цианометильный радикал, то предпочтительно каталитическое гидрирование, в то время как если R2 представляет ацетонильный, фенацильный или трихлорэтильный радикал, то можно использовать восстановление цинком в уксусной кислоте. Когда R2 представляет замещенный силильный радикал, можно использовать кислотный гидролиз с использованием разбавленных кислот, таких как соляная кислота, уксусная кислота или толуолсульфоновая кислота, или отщепление с помощью фторида, например, фтороводорода в ацетонитриле или фторида тетрабутиламмония в ТГФ.
Соединения общей формулы I, где А представляет кислород, можно получить альтернативным способом, включающим первую стадию, на которой соединения общей формулы VI превращают в 16-ацилокси- или 16-O-алкилсоединения формулы VII, как описано ниже.
где в формулах Q1', Q2', R1 и пунктирная линия между С-24 и С-25 имеют значения, указанные выше; и R4 представляет обычную защитную группу, такую как алканоил, аралканоил, алканоилоксиалкил или ароил, или тризамещенный силильный радикал, замещенный алкильными, оксиалкильными, арильными или оксиарильными группами.
R4, предпочтительно, представляет силильную защитную группу, такую как дифенилметилсилил или трет-бутоксидифенилсилил, или ацильную защитную группу, такую как ацетил или пивалоил.
В случае соединений формулы VII, где R1 представляет алкильный радикал, как указано выше, превращение осуществляют взаимодействием соединения формулы VI с алкилгалогенидом или алкилтрифлатом, согласно общим способам получения простых эфиров, известным специалистам в данной области техники.
В случае соединений формулы VII, где R1 представляет ацильную группу, превращение осуществляют взаимодействием соединения формулы VI с хлорангидридом или соответствующими ангидридами в присутствии слабого основания, согласно общим способам ацилирования, известным специалистам в данной области техники. Соединения формулы VII можно превратить в соединения формулы I, удаляя сначала защитную группу R4 известными способами и затем осуществляя взаимодействия по тем же реакционным стадиям f и g, описанным на схеме 2, или родственными способами.
Соединения формулы I, где Q1 и/или Q2 представляет -(СО)-, также можно получить из соответствующих соединений формулы I, где Q1 и Q2 оба представляют группу
методами окисления, известными специалистам в данной области техники.
Изобретение также относится к способу получения соединения формулы I, в котором нагреванием лактона указанной формулы 3 в присутствии концентрированного раствора гидроксида натрия достигают количественной инверсии С-20.
Легко гидролизуемые эфиры соединений формул I и Iа можно получить способами, известными из литературы.
Соединения изобретения, где С-24 и С-25 соединены простой связью, можно получить из соответствующих ненасыщенных аналогов восстановлением, например, каталитическим гидрированием с использованием катализаторов, таких как палладий или платина. Соединения, такие как гельволевая кислота и цефалоспорин P1, можно использовать в качестве исходных веществ при получении других соединений общей формулы Iа.
Соединения формулы II получают, исходя из соединений, указанных на схеме 1, способами, известными из литературы (ср. патент Великобритании №1490852 и патент Великобритании №1523803), или аналогичными способами. Исходные соединения формулы III можно получить, например, из соединения формулы 10 или, удобнее, из соединения формулы 9, как показано на схеме 3.
Другой целью настоящего изобретения являются фармацевтические композиции, полезные при лечении инфекционных заболеваний у людей и в ветеринарной практике.
С учетом указанной цели композиция изобретения содержит в качестве активного компонента, по меньшей мере, одно соединение, выбранное из группы, состоящей из соединений формулы I и формулы Iа (называемых далее активным ингредиентом), включая их приемлемые соли и легко гидролизуемые эфиры, вместе с фармацевтически приемлемыми носителями и/или разбавителями.
В указанной композиции доля терапевтически активного вещества и вещества-носителя может изменяться до 0,5 до 95% мас. Композиции можно получить в различных фармацевтических формах, таких как грануляты, таблетки, пилюли, драже, суппозитории, капсулы, таблетки с замедленным высвобождением, суспензии, инъекции, и ими можно наполнять флаконы или тюбики или подходящие емкости. Для получения композиций, содержащих соединения настоящего изобретения, можно использовать фармацевтические органические или неорганические твердые или жидкие носители и/или разбавители, подходящие для перорального, энтерального, парентерального или местного введения, такие как вода, желатин, лактоза, крахмал, стеарат магния, тальк, растительные и животные масла и жиры, бензиловый спирт, камедь, полиалкиленгликоль, вазелин, масло какао, ланолин и другие эмульгаторы, в качестве вспомогательных веществ можно использовать соли для изменения осмотического давления или буферные вещества для обеспечения подходящей величины рН композиции.
Кроме того, композиция может содержать другие терапевтически активные компоненты, которые, соответственно, можно вводить вместе с соединениями изобретения при лечении инфекционных заболеваний, такие как другие подходящие антибиотики, в частности, такие антибиотики, которые мо