Штамм rhodococcus erythropolis для разложения нефти и нефтепродуктов
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к очистке объектов окружающей среды от загрязнения нефтью и нефтепродуктами при помощи микроорганизмов. Штамм депонирован как Rhodococcus erythropolis ВКПМ Ac-1667. Штамм выделен из образца загрязненной нефтью почвы Республики Башкортостан, растет на многих натуральных и синтетических средах. Предлагаемый штамм Rhodococcus erythropolis обладает высокой скоростью утилизации нефти и нефтепродуктов. 3 табл.
Реферат
Изобретение относится к микробиологической промышленности и касается новой культуры микроорганизмов, разрушающих нефть и нефтепродукты, и которая может быть использована, например, для очистки загрязненных поверхностей.
Известна смесь специально селекционированных штаммов бактерий Rhodococcus erythropolis ВКПМ В-3078 (36а-1), Rhodococcus luteus ВКПМ В-3077(25) и Micrococcus flavus ВКПМ В-3079 (53) (ав. св. СССР №1493666, С 02 F 3/34, 1989), используемых для деструкции нефти и нефтепродуктов.
Использование указанных культур микроорганизмов возможно только в аэротенках. Выращивание смеси культур возможно при больших материальных и энергозатратах.
Известен штамм бактерий Rhodococcus erythropolis BKM Ас-1339Д, используемый для разложения нефти и нефтепродуктов, который применяется для очистки воды и почвы от указанных продуктов. Недостатками известного штамма являются недостаточная скорость утилизации нефти и неспособность осуществлять утилизацию нефти и нефтепродуктов при высоком содержании их к объему загрязненного объекта.
Наиболее близким аналогом является консорциум микроорганизмов “Деворойл”, активно окисляющий нефтепродукты как в зоне контакта с водой, так и непосредственно в нефтяной пленке. В состав консорциума входят бактериальные и дрожжевые клетки. Композиция выделена из пластовых вод нефтяного месторождения (пат. РФ 2023686).
Целью данного изобретения является получение нового штамма, характеризующегося высокой скоростью утилизации нефти и нефтепродуктов, которые являются единственными источниками углерода и энергии.
Для достижения поставленной цели предложен штамм Rhodococcus erythropolis 51 ВКПМ Ac-1667, выделенный из нефтезагрязненных почв республики Башкортостан.
Выделение штамма осуществлялось путем рассева исходного образца загрязненной нефтью воды на мясопептонный агар с 0,5% нефти и предварительным пассированием исходного образца через жидкую среду Раймонда с 0,5% нефти.
Идентификация штамма была осуществлена на основании изучения его культурально-морфологических и физиолого-биохимических характеристик в соответствии с описанием, данным в определении бактерий Bergey (Bergey Smanual of Systematic Bacteriology vol.1. 1984 р.). А также на основании изучения последовательности генов 16S рРНК по Edwards U. Et all.
Хранится штамм на агаризованных питательных средах при температуре 6-8°С в течение месяца. Более длительное хранение штамма осуществляется в герметично запаянных ампулах в лиофильно-высушенном состоянии. Составы среды для хранения штамма:
Мясопептонный агар, г/л:
Мясная вода 100,0
Агар 20,0
NaCl 5,0
Пептон 10,0
Глюкоза 7,0
Вода водопроводная - до 1 литра
Агаризованая среда Раймонда с нефтью, г/л:
Nа2СО3 0,1
CaCl2 0,01
MnSO4 0,02
FeSO4 0,01
MgSO4 0,2
NH4Cl 0,2
NaCl 3,0
Na2HPO4 1,5
КН2РO4 1,0
Агар 20,0
Мясопептонный бульон 500
Нефть 0,5 об.%
Вода дистиллированная до 1 литра
Данный штамм характеризуется следующими морфолого-культуральными признаками.
Культура представляет собой подвижные, грамвариабельные короткие палочковидные мелкие клетки и клетки округлой формы, расположенные парами или по нескольку в строчку, а также поодиночке. Культура полиморфна. Встречаются цепочки и парочки, расположенные под углом друг к другу, а также отдельные кокковидные клетки. Клетки подвижные, спор не образуют. Размер клеток в пределах (0,5-1,0)×(1,5-4,0) мкм. Аэроб.
Штамм растет на многих натуральных и синтетических средах. На МПА через 2 суток роста при 30°С культура образует круглые колонии, не очень крупные, чуть выпуклые, с матовой поверхностью и ровными краями с розово-бежевым пигментом. R-формы. Как правило, при выращивании на плотных средах на 2-3 сутки обнаруживается сплошной рост по штриху в виде выпуклых образований розового цвета.
Желатину не разжижает. Культура не лизогенна, после хранения на плотных питательных средах в течение 2-3 недель негативных пятен не обнаружено (при Т=30-35°С).
На мясопептонном бульоне при 30°С через 3-е суток наблюдается помутнение среды, беловатый осадок, заметно образование тонкого пристеночного кольца, небольшое количество агломератов клеток в толще среды в виде хлопьев, слабая пленка на поверхности среды. Оптимум роста 28-30°С, рН 6,8-7,2.
На минеральной среде Раймонда с глюкозой образует беловатый осадок, слегка опалесцирующую муть в толще среды и тонкое пристеночное кольцо.
На минеральной среде Раймонда с нефтью в качестве единственного источника углерода наблюдается слегка опалесцирующая муть в толще среды. Визуально нефть значительно деградирована - при встряхивании образуется взвесь в виде мелкодисперсной фазы коричневого цвета, что совершенно не характерно для нативной нефти.
Размножение культуры осуществляли путем пересева на мясопептонном агаре или агаризованной среде Раймонда, состав которых представлен выше.
Условия культивирования на ферментационной питательной среде: температура 28-30°С, рН 6,8-7,2, продолжительность культивирования 22 часа. Состав ферментационной питательной среды, вес.%:
Кормовые дрожжи БВК 2
Кукурузный экстракт 1
Вода водопроводная до 100
У штамма обнаружен высокий уровень сходства последовательностей 16S рРНК (99,3-99,6) с видом Rhodococcus gingeri.
Активность (продуктивность) штамма, а также другие производственные показатели: на производственной питательной среде продуктивность культуры по биомассе составляет (4,5±0,7)×109 клеток/мл, активность на среде Раймонда - на 5 сутки биодеградации нефти (при содержании нефти 10%) отмечается в разведении 10-1-10-8, степень нефтепотребления составляет 75%. Степень нефтепотребления при содержании в почве 10% нефти на 10 сутки составляет 56%.
Активность определяли на среде Раймонда с нефтью визуально по степени деградации нефти, а также гравиметрическим методом и методом газожидкостной хроматографии.
Результаты проведенных исследований заявляемого штамма показывают, что средневирулентная доза штамма при однократном внутрибрюшинном введении белым мышам составила более 109 клеток на животное.
Штамм не обладает способностью к транслокации и диссеминации во внутренние органы и кровь животных после 30-дневного наблюдения.
Штамм не обладает токсичными и токсигенными свойствами.
Наблюдение за животными в течение 30-ти суток не выявило каких-либо клинических признаков заболевания, а изучение внутренних органов не выявило патологических изменений, регистрируемых морфологически.
Изучаемые микроорганизмы не обладают раздражающим действием на слизистую оболочку глаза, не проникают через естественные барьеры верхних дыхательных путей, не диссемилируют во внутренние органы при интраназальном поступлении в организм.
Примеры конкретного использования.
Применение на практике данного штамма обусловливается его физиолого-биохимическими особенностями. Штамм предназначен для ликвидации последствий загрязнения воды и почвы нефтью и нефтепродуктами. Продукт, синтезируемый штаммом, - ферментный комплекс, обеспечивающий разложение сырой нефти и нефтепродуктов.
Пример 1.
Культуру выращивали в колбах объемом 250 мл с рабочим объемом заполнения питательной средой 30 мл на качалке при 350 об/мин, что обеспечивает коэффициент массопередачи по кислороду K1a=90 час-1. Продолжительность культивирования составляет 22-24 часа, конечная концентрация клеток в культуральной жидкости составляет в среднем 3×109 кл/мл.
Пример 2
Экспериментальная оценка способности штамма микроорганизмов биодеградировать нефть проводилась в лабораторных условиях, в пилотных и полевых экспериментах комплексно по следующим показателям: убыли суммы углеводородов, изменению фракционного состава нефти в процессе биодеструкции, изменению площади остаточной нефти по отношению к общей площади загрязненной поверхности.
Культуральная жидкость после выращивания штамма бактерий-деструкторов нефти сгущали сепарированием до концентрации клеток 1×109-1010 кл/мл.
Для биообработки водных поверхностей культуральную жидкость заявляемого штамма разводили до конечной концентрации клеток 1×106 кл/мл в пресной воде, добавляли 0,2% нитроаммофоски. Наносили готовый раствор из расчета 10 л/м2 поверхности почвы. Через 10-15 дней проводили повторную биообработку загрязненной поверхности. При необходимости, в случае высокого уровня загрязнения, проводили третью биообработку через 10-15 дней после второй. На почвах при пересыхании обрабатываемой поверхности проводили полив и рыхление, если это было возможно. Обработку почвы и воды в пилотных испытаниях осуществляли из садовых леек, в полевых - с помощью поливальной или пожарной машины вместимостью 5-10 м3.
В лабораторных условиях обработку почвы, искусственно загрязненной нефтью, осуществляли в лабораторной посуде объемом 0,25-0,50 л.
Лабораторные эксперименты проводили при комнатной температуре.
Пилотные испытания проводили на поверхности водоемов площадью 1-2 м2 и более или на аварийно-загрязненных почвах, где предварительно определяли уровень загрязнения.
Полевые испытания проводили на природных объектах после аварийных разливов нефти на них. И пилотные, и полевые испытания проводили в летне-осенний период.
Пробы для анализов изначально и в динамике отбирали по пятиточечной схеме стандартным пробоотборником.
Массовый анализ исходного уровня загрязнения и дальнейший мониториг процесса очистки почвенных объектов и воды от нефтяных загрязнений проводили гравиметрическим методом. Качественный состав загрязняющего агента проводили методами газожидкостной хроматографии. Количественный состав нефтяных фракций определяли с помощью площади пиков, качественный - по времени удержания. В качестве контроля использовали нативную нефть, не подвергавшуюся биодеградации.
Эффективность биодеградации загрязнения оценивали по убыли углеводородов нефти в процессе проведения биообработок, принимая за 100% исходную концентрацию загрязнения.
Учет численности живых клеток микроорганизмов во всех экспериментах проводили общепринятым методом предельных разведений на элективных средах.
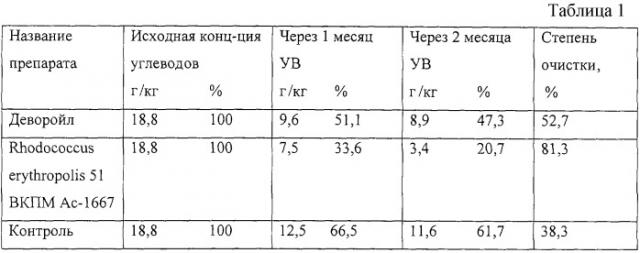
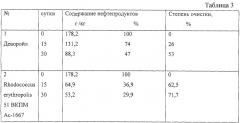
В табл.1, 2, 3 приведены результаты тестирования биодеградирующей способности штамма в лабораторных условиях, полевых и пилотных экспериментах.
В табл.1 приведены результаты сравнительного тестирования деградирующей способности штамма Rhodococcus erythropolis 51 ВКПМ Ac-1667 и препарата Деворойл на модели почвы в лабораторных условиях. В качестве модели был использован образец загрязненной почвы республики Башкортостан предприятия по обеспечению нефтепродуктами. Контролем служил загрязненный углеводородами образец почвы с того же участка без внесения каких бы то ни было дополнительных микроорганизмов.
В табл.2 представлены результаты полевых тестов биодеградирующей способности штамма Rhodococcus erythropolis 51 ВКПМ Ac-1667 на природном объекте (река Черная), загрязненном углеводородами (УВ) в результате аварийных разливов нефти.
В табл.3 представлены результаты тестирования штамма Rhodococcus erythropolis 51 ВКПМ Ac-1667 в сравнении с отечественным препаратом в пилотных экспериментах, которые были поставлены на застарелом нефтяном загрязнении.
Таким образом, полученные результаты свидетельствуют о том, что с помощью штамма Rhodococcus erythropolis 51 ВКПМ Ac-1667 может быть достигнута интенсивная деградация при высоком содержании ее в объекте загрязненного субстрата, и он может быть использован для удаления нефтяных загрязнений с поверхности почвы и водоемов.
Штамм Rhodococcus erythropolis ВКПМ Ac-1667 для разложения нефти и нефтепродуктов.