Штамм гибридных клеток с3/s-3e5 животных mus musculus l., продуцирующих моноклональные антитела к коксиеллам бернета
Иллюстрации
Показать всеИзобретение относится к гибридомной технологии и представляет собой новый штамм гибридных клеток C3/S-3E5 животных Mus musculus L., продуцирующих в клеточных культурах и брюшной полости сингенных животных моноклональные антитела (далее МКАт) к коксиеллам Бернета (штамм “Грита”). В результате слияния миеломы мыши линии Sp-2/0 и спленоцитов мышей BALB/c, иммунизированных инактивированным формалином концентрированным очищенным препаратом коксиелл Бернета (штамм “Грита”), при использовании в качестве сливающего агента полиэтиленгликоля с молекулярной массой 1000 и последующего клонирования методом предельных разведений получена гибридома C3/S-3E5, продуцирующая МКАт к данному возбудителю. Специфичность полученных МКАт: отсутствие перекрестных реакций в ИФА с антигеном риккетсий Провачека, а также с неинфицированным субстратом накопления. С помощью полученных МКАт можно проводить специфическое выявление коксиелл Бернета методом ИФА (прямой и непрямой варианты). Чувствительность ИФА на основе данных МКАт составляет 2,0· 103 ИД50·см-3 для белых крыс. Использование изобретения позволяет выявить и идентифицировать возбудителей риккетсиозной этиологии. 1 ил., 3 табл.
Реферат
Изобретение относится к области микробиологии и биотехнологии, а именно к гибридомной технологии, и представляет собой новый штамм гибридных клеток C3/S-3E5 животных Mus musculus L., продуцирующих в клеточных культурах и брюшной полости сингенных животных моноклональные антитела (далее МКАт) к коксиеллам Бернета (штамм “Грита”), который может быть использован в научных исследованиях и при изготовлении медицинских иммунобиологических препаратов.
Изобретение может быть использовано в микробиологических и иммунологических исследованиях при создании диагностикумов для выявления в пробах от людей и переносчиков коксиелл Бернета - возбудителей лихорадки Ку.
Лихорадка Ку относится к зооантропонозам с природной очаговостью и распространена во многих странах мира [1-7]. Особенности патогенеза инфекции у человека и своеобразие клинических проявлений коксиеллеза создает большие трудности в распознавании заболевания [1,8-10].
Для обнаружения специфических антигенов возбудителей различных инфекционных заболеваний вирусной и риккетсиозной этиологии в последнее время широкое применение получили иммунохимические методы, в частности иммуноферментный анализ (далее ИФА). Одним из наиболее перспективных направлений повышения эффективности ИФА является использование МКАт как антителсодержащего субстрата, применяемого в качестве диагностикума. Однако вопрос о возможности использования МКАт для выявления и идентификации возбудителей риккетсиозной этиологии остается до настоящего времени нерешенным.
Применение МКАт к коксиеллам Бернета для диагностики лихорадки Ку на ранней стадии заболевания может исключить ложноположительные реакции, нередко возникающие при использовании тест-систем на основе поликлональных иммунных сывороток. Необходимо также отметить, что использование МКАт позволит создавать стандартизованные тест-системы за счет возможности применения антител постоянной авидности и специфичности.
При разработке на основе МКАт диагностикумов, предназначенных для выявления возбудителей опасных и особо опасных инфекционных заболеваний вирусной и риккетсиозной этиологии, актуальным является вопрос получения достаточной биомассы последних. С этой целью проводят культивирование клеток гибридом различными методами in vitro или in vivo.
Перспективным направлением исследований является выбор и обоснование условий метода культивирования гибридом in vitro, позволяющих получать биомассу МКАт, количественно сопоставимую с таковой при выращивании клеток гибридом in vivo.
Целью настоящего изобретения является получение гибридомы, продуцирующей МКАт к коксиеллам Бернета, которые используют в качестве антителсодержащего субстрата в серологических тестах при выявлении и идентификации данного возбудителя.
Сущность изобретения состоит в том, что в результате слияния миеломы мыши линии Sp-2/О и спленоцитов мышей BALB/c, иммунизированных инактивированным очищенным концентрированным антигеном коксиелл Бернета, при использовании в качестве сливающего агента полиэтиленгликоля (далее ПЭГ) с молекулярной массой 1000 и последующего клонирования методом предельных разведений получена гибридома C3/S-3E5, продуцирующая МКАт к коксиеллам Бернета. Данные МКАт позволяют проводить специфическое выявление коксиелл Бернета методом ИФА (прямой и непрямой варианты). Чувствительность ИФА на основе МКАт составляет 2,0· 103 ИД50·cм-3.
Пример выполнения
Полученный штамм гибридных клеток C3/S-3E5 животных Mus musculus L., продуцирующих моноклональные антитела к коксиеллам Бернета, обладает следующими характеристиками:
1. Родословная гибридомы представлена на чертеже.
2. Число пассажей к моменту паспортизации составляет 14 раз.
3. Стандартные условия выращивания in vitro:
- посевная концентрация при выращивании in vitro 2,0· 105 кл· см-3;
- среда культивирования - среда Игла в модификации Дюльбекко (DMEM) с добавлением 10% фетальной телячьей сыворотки (далее ФТС);
- температура культивирования (37±0,5)° С;
- содержание СО2 в атмосфере культивирования 5%.
4. Культуральные свойства штамма
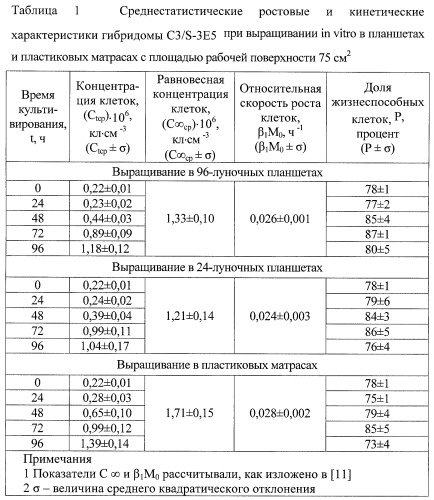
Штамм является монослойно-суспензионным: около 30% клеток находятся в суспензии, не прикрепляясь к поверхности культурального сосуда. Частота пассирования при посевной дозе 2,0· 105 кл· см-3 составляет от 3 до 4 суток. Индекс пролиферации при выращивании in vitro равен 7,2.
5. Ростовые (кинетические) характеристики гибридомы представлены таблице 1.
6. Характеристика культивирования в организме животного
При внутрибрюшинном введении мышам BALB/c от 2,0· 106 до 5,0· 106 клеток гибридомы на 9-21 сутки формируются серозные опухоли. От одной мыши получают от 2,0 до 3,0 см3 иммунной асцитической жидкости (далее ИАЖ). Концентрация клеток гибридомы в ИАЖ составляет от 30· 106 до 50· 106 кл· см-3.
7. Цитогенетическая (кариологическая) характеристика:
- модальный класс от 88 до 96 хромосом;
- доля клеток в модальном классе - 54%;
- модальный класс для родительской миеломной линии Sp-2/O - от 57 до 59 хромосом.
8. Цитоморфологическая характеристика
Клон гибридомы представлен крупными округлыми клетками с размерами от 20 до 25 мкм, близкими по морфологии клеткам исходной миеломы линии Sp-2/O.
9. Видовая принадлежность Mus musculus.
10. Онкогенность
Гибридома при внутрибрюшинном введении вызывает серозные (в 70% случаев) и солидные опухоли.
11. Маркерные характеристики
Клон продуцирует МКАт к коксиеллам Бернета.
12. Контроль контаминации
Грибковая и бактериальная микрофлора в культуре штамма гибридомы отсутствует.
13. Биотехнологическая характеристика
Штамм продуцирует МКАт к коксиеллам Бернета:
- титр МКАт при выращивании in vitro - 1:2560 (в ИФА);
- титр МКАт при выращивании in vivo - 1:163840 (в ИФА).
Характеристика продуцируемых МКАт к коксиеллам Бернета:
- белок-мишень - антиген I фазы коксиелл Бернета, структурный белок с молекулярной массой (ММ) 62 кДа;
- изотип продуцируемых иммуноглобулинов - IgG;
- количество изученных пассажей: in vitro - 14; in vivo - 5.
Секреторные характеристики гибридомы C3/S-3E5 представлены в таблице 2.
14. Способ криоконсервации
Осадок клеток, полученный после низкоскоростного центрифугирования, ресуспендируют в среде, содержащей 90% ФТС и 10% диметилсульфоксида (DMSO), доводят до конечной концентрации 3,0· 106 кл· см-3 и разливают в пластиковые ампулы по 0,5 см3. Ампулы охлаждают до температуры минус 70° С в установке для программного замораживания при скорости замораживания от 1 до 2° С в минуту и затем помещают в сосуд Дьюара с жидким азотом.
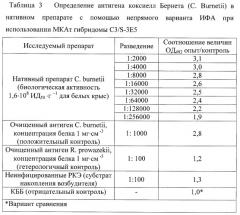
Клетки гибридомы C3/S-3E5, выращенные in vitro в 24-луночных планшетах до конечной концентрации от 1,0· 106 до 1,5· 106 кл· см-3, осаждают с помощью низкоскоростного центрифугирования и вводят внутрибрюшинно мышам линии BALB/c, предварительно (за 7 суток) обработанным адъювантом Пристана, в количестве от 2,0· 106 до 5,0· 10 клеток в объеме 0,5 см3. На 9-21 сутки после введения гибридомы примерно у 70% животных формируются асцитные опухоли. Клетки гибридомы осаждают из ИАЖ с помощью низкоскоростного центрифугирования (1500 об· мин -1 в течение 10 минут) и используют для последующего пассажа in vivo. Супернатант, содержащий МКАт в высоких титрах, используют в качестве полуфабриката для выделения иммуноглобулина, который используют для получения диагностикума. Данные по чувствительности и специфичности ИФА на основе МКАт C3/S-3E5 представлены в таблице 3.
Как показывает анализ данных, представленных в таблице 3, чувствительность непрямого варианта ИФА на основе МКАт при определении коксиелл Бернета (С. Bumetii) в составе нативного препарата составляет 1,2· 103 ИД50·г-1. Специфичность непрямого варианта ИФА на основе МКАт подтверждена отсутствием положительной реакции с антигеном риккетсий Провачека (R. Prowazekii) [12].
Источники информации
1. Koprowski H., Gerhard W., Crok С.V. Production of antibodies against influence virus by somatic cell hybrids between mouse myeloma and primed spleen cells // PNAS USA - 1977. - Vol.74. - P.2985-2988.
2. Lefrancois L. Protection against lethal virus infection by neutralizing and nonneutralizing antibodies: distinct mechanisms of action in vivo //J.Virol. - 1984. - Vol.51. - P.208-214.
3. McCullogh K.C. Monoclonal antibodies: implication for virology. Brief review //Arch. Virol - 1986. - Vol.87. - P.1-36.
4. Лашкевич В.А. Использование моноклональных антител в вирусологии // Вопр. вирусол. - №6. - 1983. - С.648-654.
5. Остерхауз А., Уитдехаат Р. Лимфоцитные гибридомы: получение и применение моноклональных антител // Биотехнология клеток животных. - М.: Агропромиздат, 1989. - С.61-85.
6. М.В.Шпилевая, А.А.Кущ, И.А.Разумов и др. Эпитопная специфичность и протективная активность моноклональных антител к вирусу ВЭЛ // Вопр. вирусол. - 1995. - №2. - С.82-85.
7. Dimmock N.J. Mechanism of neutralization of animal viruses // J. Gen. Virol. - 1984. - Vol.65. - P.1015-1022.
8. Roehrig J.Т., Day J.W., Kinney R.M. Antigenic analysis of the surface glycoproteins of VEE virus (TC-83) using monoclonal antibodies // Virology. - 1982. - Vol.118. - P.269-271.
9. Roehrig J.T., Hunt A.R., Kinney R.N., Mathews J.H. In vitro mechanisms of monoclonal antibody neutralization of alphaviruses // Virology. - 1988. - Vol.165. - P.66-73.
10. Roehrig J.T., Mathews J.H. The neutralization site of VEE (TC-83) virus is composed of multiple conformationally stable epitopes // Virology. - 1985. - Vol.142. - P.347-356.
11. Васильев Н.Н., Амбросов В.А., Складнев А.А. Моделирование процессов микробиологического синтеза. - М.: Лесная промышленность, 1975.
12. Погодина В.В., Токаревич Н.К., Горюнова Л.Б., Малыгин А.М. Изучение динамики цитоксической активности спленоцитов мышей СЗНА, иммунизированных возбудителем Ку-лихорадки и его антигенными субстанциями // Цитология. - 1991. - №9. - С.95-98.
Штамм гибридных клеток C3/S-3E5 животных Mus musculus L., продуцирующих в течение 14 изученных пассажей in vitro моноклональные антитела к коксиеллам Бернета (штамм “Грита”), относящиеся к изотипу IgG, пригодные для приготовления на их основе диагностикумов для специфического выявления коксиелл Бернета (1-й фазы) с помощью иммуноферментного анализа.