Устройство и способ диагностики и фотодинамической терапии заболеваний глаз
Иллюстрации
Показать всеНастоящее изобретение относится к медицинской технике, а более конкретно к аппаратуре и способу, предназначенным для диагностики и фотодинамической терапии заболеваний глаз. Предложенное устройство содержит осветитель, микроскоп, снабженный видеоканалом, включающим видеокамеру формирования цветного изображения исследуемого участка глаза и систему оптического переноса изображения исследуемого участка глаза на эту видеокамеру, видеокамеру формирования флуоресцентного изображения исследуемого участка глаза и систему оптического переноса изображения исследуемого участка глаза на эту видеокамеру, систему отображения видеоинформации, один из входов которой соединен с выходом видеокамеры формирования цветного изображения исследуемого участка глаза, а другой - с выходом видеокамеры формирования флуоресцентного изображения исследуемого участка глаза, лазер и адаптер, фокусирующий излучение лазера на исследуемый участок глаза, причем длина волны излучения лазера лежит в пределах спектральной полосы поглощения вводимого объекту исследования фотосенсибилизатора, система оптического переноса изображения исследуемого участка глаза на видеокамеру формирования флуоресцентного изображения исследуемого участка глаза содержит фильтр, не пропускающий оптическое излучение с длинами волн, равными и меньшими длины волны излучения лазера и пропускающий оптическое излучение с длинами волн, превышающими длину волны излучения лазера. При этом осветитель и система оптического переноса изображения исследуемого участка глаза на видеокамеру формирования цветного изображения исследуемого участка глаза содержат фильтры с соотношением между значениями коэффициентов пропускания в спектральном диапазоне 400-640 нм и значениями коэффициентов пропускания на длинах волн, равных и превышающих длину волны излучения лазера не менее 103, фильтр системы оптического переноса изображения исследуемого участка глаза на видеокамеру формирования флуоресцентного изображения исследуемого участка глаза имеет соотношение между значениями коэффициентов пропускания в спектральном диапазоне флуоресценции фотосенсибилизатора и значениями коэффициентов пропускания в спектральном диапазоне с длинами волн, превышающими значения длин волн спектрального диапазона флуоресценции фотосенсибилизатора не менее 103, на выходе адаптера установлен гомогенизирующий элемент-расширитель пучка с возможностью его установки на оси выходящего из адаптера пучка и смещения перпендикулярно оси пучка. Сущность способа диагностики и фотодинамической терапии заболеваний глаз заключается в введении в организм фотосенсибилизатора, проведения диагностического обследования посредством облучения исследуемого участка возбуждающим излучением и контроля распределения по исследуемому участку интенсивности флуоресценции, и терапевтического облучения участка с повышенной интенсивностью флуоресценции, в котором для проведения диагностики и фотодинамической терапии используют предлагаемое устройство. В качестве фотосенсибилизатора используют композицию на основе ди-, три-, и тетра-сульфофталоцианинов оксиалюминия. Длину волны лазера выбирают в спектральном диапазоне 667-672 нм. Диагностику осуществляют по картине распределения интенсивности флуоресценции в спектральном диапазоне 690-730 нм при облучении лазерным излучением устройства, а затем проводят терапевтическое облучение участка с повышенной интенсивностью флуоресценции лазерным излучением устройства. Предлагаемое устройство и способ диагностики и фотодинамической терапии заболеваний глаз обеспечивают возможность проведения флуоресцентной диагностики и фотодинамической терапии в рамках одной лечебной процедуры, что повышает эффективность и удобство лечения и снижает вероятность повреждения здоровых тканей глаза. 2 н. 8 з.п. ф-лы, 6 ил., 1 табл.
Реферат
Настоящее изобретение относится к медицинской технике, а более конкретно к аппаратуре и способу, предназначенным для диагностики и фотодинамической терапии заболеваний глаз.
Заболевания сетчатки и сосудистого тракта глаз являются одной из основных причин слабовидения или слепоты. Например, появление субретинальной неоваскулярной мембраны (СНМ) в центральной зоне глазного дна вследствие врастания новообразованных сосудов из хориокапиллярного слоя под пигментный эпителий или сетчатку осложняет течение различных воспалительных и дистрофических процессов, приводя к стойкому снижению остроты зрения.
Значительную офтальмологическую проблему представляет также глаукома - большая группа заболеваний глаза, характеризующихся постоянным или периодическим повышением внутриглазного давления (ВГД), вызванным нарушением оттока водянистой влаги из глаза, продуцируемой цилиарным телом. Следствием повышения ВГД является постепенное развитие характерных для глаукомы нарушений зрительных функций и атрофии зрительного нерва. На сегодняшний день единственным методом лечения далеко зашедшей глаукомы является подавление функций цилиарного тела.
При нарушении строения стромы роговицы, связанном с несовершенной регенерацией собственного вещества, в роговичную ткань проникает обычная соединительная ткань, а в более тяжелых случаях - кровеносные сосуды. Эти изменения являются осложнением кератитов и дистрофий роговицы или травм роговицы различного генеза. Для лечения неоваскуляризации роговицы применяют различные виды кератопластик, однако в ряде случаев (от 10 до 30%) после операции происходит врастание новообразованных сосудов в роговичный трансплантат с последующим его помутнением.
Для лечения субретинальной неоваскулярной мембраны используют лазерную коагуляцию или хирургическое вмешательство. Однако данные методы не всегда эффективны и сопряжены с опасностью развития осложнений при их проведении. В связи с этим в последнее время изучается новый метод терапии субретинальной неоваскулярной мембраны, основанный на фотодинамическом эффекте. В его основе лежит фотодинамическая окклюзия новообразованных сосудов с сохранением окружающих тканей. Данный метод позволяет воздействовать с определенной избирательностью только на патологические участки, не влияя на окружающую их здоровую ткань, что повышает эффективность лечения, и значительно улучшает прогноз для зрительных функций /J.W.Miller, W.G.Stinson, W.A.Gregory, H.E.El-Koumi, C.A.Poliafito. "Phthalocyanine Photodynamic Therapy of Experimental his Neovascularization". Ophthalmology, 1991, Vol. 98, No 11, pp.1711-1719/.
Фотодинамическую терапию (ФДТ) используют также при лечении далеко зашедшей глаукомы. Фотодинамическое воздействие на сосуды цилиарного тела уменьшает его кровоснабжение и как следствие подавляет продукцию внутриглазной жидкости /М.К.Tsilimbaris, I.I.Naoumidi, L.P.Naoumidis, E.Papageorgiou, I.G.Pallikaris. "Transscleral Ciliary Body Photodynamic Therapy Using Phthalocyanine and Diode Laser: Functional and Morphologic Implications in Albino Rabbits". Ophtalmic Surgery and Lasers, 1997, Vol. 28, No 6, рр.483-494/.
ФДТ была применена также для лечения неоваскуляризации роговичного трансплантата /В.Г.Копаева, Ю.В.Андреев, Г.В.Пономарев, E.Ф.Странадко. "Первый опыт лечения неоваскуляризации роговичного трансплантата методом фотохимической деструкции сосудов". Актуальные проблемы офтальмологии. Сборник научных трудов, Уфа, 1996 г., с.40-43/, где путем фотодинамического воздействия удалось достигнуть полного запустевания неоваскулярной сети в трансплантате.
До настоящего времени диагностика сосудистых заболеваний глаз, в частности СНМ, осуществлялась посредством флуоресцентной ангиографии с флуоресцеином натрия, либо телевизионно-оптической ангиографии глазного дна с индоцианином зеленым. Известно устройство для флуоресцентной ангиографии глазного дна с флуоресцеином натрия и телевизионно-оптической ангиографии глазного дна с индоцианином зеленым /рекламный проспект "VISUPAC 120" фирмы "Kari Zeiss. Ophthalmic Instruments". Публикация №000000-1124-196, опубл. 1 июня 2000 г./. Предлагаемое устройство включает щелевую лампу (или фундус-камеру), содержащую осветитель и микроскоп, снабженный видеоканалом, включающим видеокамеру, систему оптического переноса изображения глазного дна на видеокамеру и систему отображения видеоинформации, вход которой соединен с выходом видеокамеры. Для реализации способа диагностики патологических изменений глаз, в частности СНМ, пациенту вводят флуоресцеин натрия (при флуоресцентной ангиографии) или индоцианин зеленый (при телевизионно-оптической ангиографии), облучают излучением осветителя в спектральном диапазоне соответственно 455-490 нм (при флуоресцентнной ангиографии) либо 805 нм (при телевизионно-оптической ангиографии), и, наблюдая изображение исследуемого объекта, полученное видеокамерой видеоканала в спектральном диапазоне 520-530 нм (при флуоресцентной ангиографии) или 835 нм (при телевизионно-оптической ангиографии), делают вывод о наличии и распространении патологических изменений.
Известно устройство для фотодинамической терапии патологий сетчатки глазного дна /рекламный проспект "Innovative Photodynamic Therapy. VISULAS 690s" фирмы "Karl Zeiss. Ophthalmic Instruments". Публикация №000000-1134-917, опубл. в ноябре 2001 г./, включающее щелевую лампу (или фундус-камеру), содержащую осветитель и микроскоп, лазер и адаптер, фокусирующий излучение лазера на сетчатке, причем длина волны излучения лазера лежит в пределах спектральной полосы поглощения фотосенсибилизатора.
Используя эти два устройства, врач вынужден проводить процедуры диагностики и фотодинамической терапии в два разнесенных во времени этапа, а саму терапевтическую процедуру он вынужден осуществлять, ориентируясь только по внешним визуальным признакам патологических изменений (их виду), используя только микроскоп и цветную видеокамеру. Невозможность проведения диагностики и фотодинамической терапии одновременно (в рамках одной процедуры) усложняет метод, затрудняя точное наведение на нужный участок, что может привести к повреждению здоровых тканей и отсутствию воздействия на патологические очаги. Все эти недостатки приводят к уменьшению эффекта ФДТ и лечения в целом.
Эти недостатки частично устранены в устройстве для флуоресцентной диагностики и фотодинамической терапии патологических изменений глаз /Akira Obana, Yuko Gobto, Kenji Keneda, Susumu Nakajima, Tokubiko Miki. "PDT to Monkey CNV with ATX-S10(Na): Inapproppriateness of Early Laser Irradiation for Selective Occlusion". Ophthalmology & Visual Science, 2001, Vol. 42, No11, pp.2639-2645/ /1/, включающем офтальмологический прибор (в частности, фундус-камеру), содержащий осветитель, лазер, адаптер, фокусирующий излучение лазера на патологических изменениях глаза, микроскоп, снабженный видеоканалом, включающим цветную видеокамеру и систему оптического переноса изображения исследуемого участка глаза на эту видеокамеру, высокочувствительную видеокамеру и систему оптического переноса изображения исследуемого участка глаза на эту видеокамеру, систему отображения видеоинформации, один из входов которой соединен с выходом цветной видеокамеры, а другой - с выходом высокочувствительной видеокамеры, система оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру содержит фильтр, не пропускающий оптическое излучение с длинами волн, равными и меньшими длины волны излучения лазера, и пропускающий только оптическое излучение с длинами волн, превышающими длину волны излучения лазера. Для фотодинамической терапии выбран флуоресцирующий фотосенсибилизатор, флуоресценция которого может быть использована для контроля и диагностики новообразованных сосудов. Длина волны излучения лазера лежит в пределах спектральной полосы поглощения фотосенсибилизатора и совпадает со спектральным максимумом этой полосы поглощения.
Однако это устройство также обладает рядом существенных недостатков, приводящих к невозможности одновременной (в рамках одной процедуры) диагностики и фотодинамической терапии заболеваний глаз. Прежде всего это связано с "засветкой" высокочувствительной видеокамеры длинноволновой компонентой светового излучения от осветителя и системы освещения офтальмологического кабинета. Эта компонента, близкая по интенсивности к интенсивности флуоресценции фотосенсибилизатора в патологических участках глаза, существенно снижает контраст флуоресцентной картины и затрудняет как диагностику, так и выработку терапевтической тактики. Кроме того, рассеянное от поверхностей глаза лазерное излучение с высокой пространственной и спектральной плотностью, попадая на цветную видеокамеру видеоканала устройства, приводит к сильнейшим искажениям изображения по яркости и цветопередаче (так называемое ослепление или заллывание камеры). В свою очередь вышеперечисленные недостатки устройства /1/ привели к недостаткам способа диагностики и фотодинамической терапии заболеваний глаз, который осуществляется в рамках двух процедур с использованием двух устройств (ангиография - на одном устройстве, а фотодинамическая терапия - на другом).
Проблемы, связанные с вышеперечисленными недостатками известного устройства для диагностики и фотодинамической терапии заболеваний глаз, приводят к аналогичным недостаткам способа диагностики и фотодинамической терапии неоваскудяризации сетчатки или глаукомы, так как невозможно в рамках одной процедуры четко и достоверно определить границы патологического участка и провести его фотодинамическую терапию. Это снижает эффективность лечения заболеваний глаз и повышает вероятность побочных эффектов.
В изобретении решается задача повышения эффективности лечения заболеваний глаз и снижения вероятности побочных эффектов за счет обеспечения возможности одновременной (в рамках одной процедуры) диагностики и фотодинамической терапии заболеваний глаз, повышения достоверности флуоресцентной диагностики, упрощения работы с устройством для флуоресцентной диагностики и фотодинамической терапии заболеваний глаз и повышения точности управления.
Указанная задача решается тем, что в устройстве для диагностики и фотодинамической терапии глазных заболеваний, включающем офтальмологический прибор (фундус-камеру или щелевую лампу, или операционный микроскоп), содержащий осветитель, микроскоп, снабженный видеоканалом, включающим цветную видеокамеру и систему оптического переноса изображения исследуемого участка глаза на эту видеокамеру, высокочувствительную видеокамеру и систему оптического переноса изображения исследуемого участка глаза на эту видеокамеру, систему отображения видеоинформации, один из входов которой соединен с выходом цветной видеокамеры, а другой - с выходом высокочувствительной видеокамеры, лазер и адаптер, фокусирующий излучение лазера на патологически измененный участок глаза, длина волны излучения лазера лежит в пределах спектральной полосы поглощения фотосенсибилизатора, система оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру содержит фильтр, не пропускающий оптическое излучение с длинами волн, равными и меньшими длины волны излучения лазера и пропускающий оптическое излучение с длинами волн, превышающими длину волны излучения лазера, осветитель и система оптического переноса изображения исследуемого участка глаза на цветную видеокамеру содержат фильтры с соотношением между значениями коэффициентов пропускания в спектральном диапазоне 400-640 нм и значениями коэффициентов пропускания на длинах волн, равных и превышающих длину волны излучения лазера не менее 103, фильтр системы оптического переноса изображения на высокочувствительную видеокамеру имеет соотношение между значениями коэффициентов пропускания в спектральном диапазоне флуоресценции фотосенсибилизатора и значениями коэффициентов пропускания в спектральном диапазоне с длинами волн, превышающими значения длин волн спектрального диапазона флуоресценции фотосенсибилизатора не менее 103, на выходе адаптера дополнительно содержится гомогенизирующий элемент-расширитель пучка с возможностью его установки на оси выходящего из адаптера пучка и смещения перпендикулярно оси пучка.
Указанная задача решается также тем, что устройство дополнительно содержит систему управления, включающую интерфейс управления и выбора режима работы устройства, блок управления оптическим увеличением адаптера, блок управления лазером, блок коррекции, вход которого соединен с выходом блока управления оптическим увеличением адаптера, а выход - со входом блока управления лазером.
Указанная задача решается также тем, что устройство дополнительно содержит электропривод гомогенизирующего элемента-расширителя пучка, вход управления которым соединен с выходом интерфейса управления и выбора режима работы устройства.
Указанная задача решается также тем, что устройство дополнительно содержит систему шумоподавления, вход которой соединен с выходом высокочувствительной видеокамеры, а выход - с дополнительным входом системы отображения видеоинформации.
Указанная задача решается также тем, что в качестве системы шумоподавления устройство содержит систему многокадрового накопления.
Указанная задача решается также тем, что система многокадрового накопления содержит вход, входной буфер, первый блок умножения, второй блок умножения, двухвходовой сумматор, выходной буфер, выход и ключ, соединяющий вход и выход системы, входной буфер, первый блок умножения, двухвходовой сумматор и выходной буфер соединены последовательно между входом и выходом системы, второй блок умножения включен между выходом и вторым входом двухвходового сумматора, причем сумма коэффициентов умножения первого и второго блоков умножения равна единице.
Указанная задача решается также тем, что в качестве гомогенизирующего элемента-расширителя использована рассеивающая линза с оптической силой 3-4 м-1.
Указанная задача решается также тем, что в качестве гомогенизирующего элемента-расширителя использована световодная пластина толщиной 2-20 мм.
Указанная задача решается тем, что в способе диагностики и фотодинамической терапии заболеваний глаз путем введения в организм фотосенсибилизатора, проведения диагностического обследования посредством облучения исследуемого участка возбуждающим излучением и контроля распределения по исследуемому участку интенсивности флуоресценции, и терапевтического облучения участка с повышенной интенсивностью флуоресценции, для проведения диагностики и фотодинамической терапии используют устройство по п.1, в качестве фотосенсибилизатора используют композицию на основе ди-, три-, и тетра-сульфофталоцианинов оксиалюминия, длину волны лазера выбирают в спектральном диапазоне 667-672 нм, диагностику осуществляют по картине распределения интенсивности флуоресценции в спектральном диапазоне 690-730 нм при облучении лазерным излучением устройства, а затем проводят терапевтическое облучение участка с повышенной интенсивностью флуоресценции лазерным излучением устройства.
Указанная задача решается также тем, что контроль результатов ФДТ осуществляют по остаточной флуоресценции патологического участка и при необходимости осуществляют повторную ФДТ участка с остаточной флуоресценцией.
Сущность изобретения поясняется фиг.1-4.
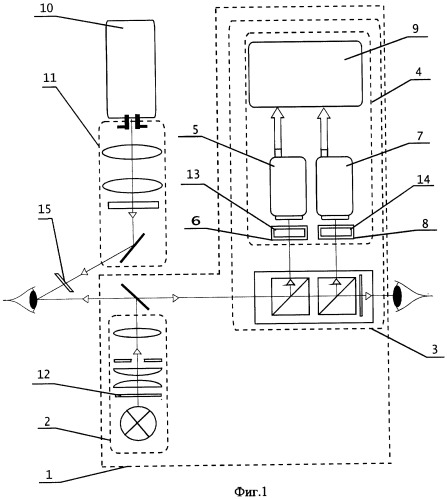
На фиг.1 приведена блок-схема предлагаемого устройства для флуоресцентной диагностики и фотодинамической терапии заболеваний глаз, где:
1 - офтальмологический прибор;
2 - осветитель;
3 - микроскоп;
4 - видеоканал;
5 - цветная видеокамера;
6 - система оптического переноса изображения исследуемого участка глаза на цветную видеокамеру;
7 - высокочувствительная видеокамера;
8 - система оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру;
9 - система отображения видеоинформации;
10 - лазер;
11 - адаптер;
12 - фильтр осветителя;
13 - фильтр системы оптического переноса изображения исследуемого участка глаза на цветную видеокамеру;
14 - фильтр системы оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру;
15 - гомогенизирующий элемент-расширитель пучка.
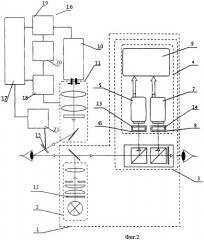
На фиг.2 приведена блок-схема предлагаемого устройства для флуоресцентной диагностики и фотодинамической терапии заболеваний глаз с системой управления, где:
1 - офтальмологический прибор;
2 - осветитель;
3 - микроскоп;
4 - видеоканал;
5 - цветная видеокамера;
6 - система оптического переноса изображения исследуемого участка глаза на цветную видеокамеру;
7 - высокочувствительная видеокамера;
8 - система оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру;
9 - система отображения видеоинформации;
10 - лазер;
11 - адаптер;
12 - фильтр осветителя;
13 - фильтр системы оптического переноса изображения исследуемого участка глаза на цветную видеокамеру;
14 - фильтр системы оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру;
15 - гомогенизирующий элемент-расширитель пучка;
16 - система управления;
17 - интерфейс управления и выбора режима работы устройства;
18 - блок управления оптическим увеличением адаптера;
19 - блок управления лазером;
20 - блок коррекции;
21 - электропривод гомогенизирующего элемента-расширителя пучка.
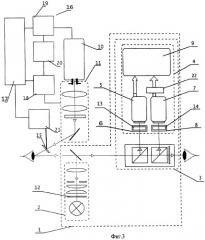
На фиг.3 приведена блок-схема предлагаемого устройства для флуоресцентной диагностики и фотодинамической терапии заболеваний глаз с системами управления и шумоподавления, где:
1 - офтальмологический прибор;
2 - осветитель;
3 - микроскоп;
4 - видеоканал;
5 - цветная видеокамера;
6 - система оптического переноса изображения исследуемого участка глаза на цветную видеокамеру;
7 - высокочувствительная видеокамера;
8 - система оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру;
9 - система отображения видеоинформации;
10 - лазер;
11 - адаптер;
12 - фильтр осветителя;
13 - фильтр системы оптического переноса изображения исследуемого участка глаза на цветную видеокамеру;
14 - фильтр системы оптического переноса изображения исследуемого участка глаза на высокочувствительную видеокамеру;
15 - гомогенизирующий элемент-расширитель пучка;
16 - система управления;
17 - интерфейс управления и выбора режима работы устройства;
18 - блок управления оптическим увеличением адаптера;
19 - блок управления лазером;
20 - блок коррекции;
21 - электропривод гомогенизирующего элемента-расширителя пучка;
22 - система шумоподавления.
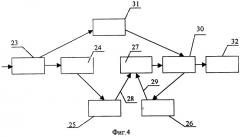
На фиг.4 приведена блок-схема предлагаемой системы многокадрового накопления, где:
23 - вход системы;
24 - входной буфер;
25 - первый блок умножения;
26 - второй блок умножения;
27 - двухвходовой сумматор;
28 - первый вход двухвходового сумматора;
29 - второй вход двухвходового сумматора;
30 - выходной буфер;
31 - ключ;
32 - выход системы.
Устройство для флуоресцентной диагностики и фотодинамической терапии заболеваний глаз (фиг.1) включает офтальмологический прибор 1, содержащий осветитель 2, микроскоп 3, снабженный видеоканалом 4, включающим цветную видеокамеру 5 с системой 6 оптического переноса изображения исследуемого участка глаза на эту видеокамеру, высокочувствительную видеокамеру 7 с системой 8 оптического переноса изображения исследуемого участка глаза на эту видеокамеру, систему 9 отображения видеоинформации, лазер 10 и адаптер 11. Осветитель 2 и система 6 оптического переноса изображения исследуемого участка глаза на цветную видеокамеру содержат фильтры соответственно 12 и 13. Система 8 оптического переноса изображения на высокочувствительную видеокамеру содержит фильтр 14. На выходе адаптера 11 дополнительно содержится гомогенизирующий элемент-расширитель пучка 15 с возможностью его установки на оси выходящего из адаптера пучка и смещения перпендикулярно оси пучка.
Предлагаемое устройство может дополнительно содержать систему управления 16, включающую интерфейс 17 управления и выбора режима работы устройства, блок 18 управления оптическим увеличением адаптера, блок 19 управления лазером, блок 20 коррекции, вход которого соединен с выходом блока управления увеличением адаптера 18, а выход - со вторым входом блока управления лазером, а также электропривод 21 гомогенизирующего элемента-расширителя пучка. Выходы интерфейса 17 управления и выбора режима работы устройства соединены с первьм входом блока 19 управления лазером и электроприводом 21 гомогенизирующего элемента-расширителя пучка.
Для повышения чувствительности устройства и как следствие улучшения качества диагностики предлагаемое устройство дополнительно содержит систему шумоподавления 22 (фиг.3), вход которой соединен с выходом высокочувствительной видеокамеры 7, а выход - со вторым входом системы отображения видеоинформации. Система шумоподавления 22 может быть выполнена в виде системы многокадрового накопления, которая может, в частности, содержать (фиг.4) вход 23, входной буфер 24, первый блок умножения 25, второй блок умножения 26, двухвходовой сумматор 27 с первым входом 28 и вторым входом 29, выходной буфер 30, ключ 31 и выход 32. Ключ 31 соединяет вход 23 и выходной буфер 30 системы. Входной буфер 24, первый блок умножения 25, двухвходовой сумматор 27 и выходной буфер 30 соединены последовательно между входом 23 и выходом 32 системы, второй блок умножения 26 включен между выходом 32 и вторым входом 29 двухвходового сумматора 27, причем сумма коэффициентов умножения первого и второго блоков умножения равна единице.
Предлагаемое устройство работает следующим образом. В диагностическом режиме осветитель 2 офтальмологического прибора 1 облучает глаз пациента, цветная видеокамера 5 регистрирует рассеянное от нее излучение, сигнал с цветной видеокамеры поступает в систему отображения видеоинформации 9, где и наблюдается цветное изображение исследуемого участка глаза пациента. При этом излучение осветителя офтальмологического прибора благодаря наличию в нем фильтра 12 не содержит компоненты с длиной волны, превышающей 640 нм, однако эта длинноволновая компонента излучения и не участвует в формировании цветного излучения цветной видеокамеры. Одновременно выходящее из лазера 10 излучение проходит адаптер 11, затем гомогенизирующий элемент-расширитель пучка 15 и облучает широким однородным пучком глаз пациента, вызывая флуоресценцию фотосенсибилизатора. Излучение флуоресценции через микроскоп 3 попадает в видеоканал 4 и через систему 8 оптического переноса изображения, содержащую фильтр 14, поступает на высокочувствительную видеокамеру 7. Через этот фильтр проходит и поступает на высокочувствительную видеокамеру 7 только излучение флуоресценции. Ни рассеянное от глаза лазерное излучение, ни излучение посторонней засветки (включая излучение осветителя 2 офтальмологического прибора 1) через фильтр 14 практически не поступает (тем более что благодаря наличию в осветителе 2 фильтра 12 излучение осветителя практически не содержит компоненты, лежащей в спектральном диапазоне флуоресценции фотосенсибилизатора). В то же время благодаря наличию в системе 6 оптического переноса изображения исследуемого участка глаза на цветную видеокамеру 5 фильтра 13 с параметрами согласно предлагаемому изобретению рассеянное от глаза лазерное излучение широкого однородного лазерного пучка оказывается практически незаметным в цветной видеокамере 5 (не влияя ни на яркость, ни на цвет изображения исследуемого участка глаза пациента). Благодаря этому цветная видеокамера формирует в видеоканале цветное изображение исследуемого участка глаза пациента, а высокочувствительная видеокамера - флуоресцентное изображение данного участка, распределение яркости в котором соответствует распределению фотосенсибилизатора в тканях и сосудах глаза. Сопоставляя эти два изображения на экране системы 9 отображения видеоинформации, офтальмолог делает вывод о наличии патологических изменений на исследуемом участке глаза, их топографии, размерах, и в соответствии с ним перемещает манипулятором офтальмологический прибор для выбора места фокусировки лазерного излучения в терапевтическом режиме и регулирует параметры адаптера.
В терапевтическом режиме гомогенизирующий элемент-расширитель пучка 15 убирается с его оси, и выбранный патологический участок глаза облучается сфокусированным пучком лазерного излучения. При этом благодаря наличию фильтра 14 высокочувствительная видеокамера 7 контролирует только интенсивность флуоресценции фотосенсибилизатора в облучаемом месте, поскольку рассеянное лазерное излучение на нее не проходит. Контроль изменения флуоресценции при терапевтическом облучении позволяет судить об интенсивности проходящих фотохимических реакций. При этом цветная видеокамера 5 в терапевтическом режиме регистрирует цветное изображение исследуемого участка глаз и ослабленное по яркости не менее чем в 103 раз, благодаря наличию фильтра 13 изображение сфокусированного на патологическом участке лазерного пучка (вследствие чего эта яркость оказывается сопоставимой с яркостью цветного изображения). Поэтому изображение лазерного пучка не мешает работе цветной видеокамеры и служит для офтальмолога маркером (индикатором) положения и геометрических размеров оказываемого воздействия.
При использовании в предлагаемом устройстве системы управления 16 интерфейс 17 управления и выбора режима работы устройства служит для переключения режимов флуоресцентной диагностики и ФДТ. В режиме флуоресцентной диагностики команда с интерфейса 17 на электропривод 21 гомогенизирующего элемента-расширителя пучка 15 приводит к установке гомогенизирующего элемента-расширителя пучка на оси лазерного пучка, а команда на блок 19 управления лазером задает мощность этого пучка. В терапевтическом режиме интерфейс 17 управления и выбора режима работы устройства дает команду на электропривод гомогенизирующего элемента-расширителя пучка для его удаления с оси пучка, команду на блок 18 управления оптическим увеличением адаптера, задающего необходимый размер области терапевтического воздействия в соответствии с размерами флуоресцентного изображения подлежащего ФДТ патологического участка, и команду на первый вход блока 19 управления лазером, задающую уровень мощности терапевтического излучения. Блок 20 коррекции, вход которого соединен с выходом блока управления оптическим увеличением адаптера, вырабатывает команду коррекции с учетом изменения пропускания оптической системы адаптера в зависимости от его оптического увеличения, и подает ее на второй вход блока управления лазером, обеспечивая надлежащее изменение мощности лазера для компенсации этого изменения пропускания.
Поскольку в диагностическом режиме целесообразно использовать минимальные значения плотности мощности лазерного излучения (во избежание фотодинамического повреждения здоровых сосудов и тканей глаза), плотность мощности возбуждающего флуоресценцию лазерного излучения выбирается невысокой. Поэтому для обеспечения надлежащего качества флуоресцентного изображения патологических участков при низком уровне сигнала необходимо подавить шумы телевизионной системы, неизбежно проявляющиеся при ее работе в режиме максимальной чувствительности. Это обеспечивается использованием системы 22 шумоподавления, которая может быть выполнена, в частности, в виде системы многокадрового накопления, усредняющей в каждый конкретный момент времени для каждой конкретной точки изображения сигналы интенсивности флуоресценции из нескольких ближайших кадров изображения. Это позволяет улучшить отношение "сигнал-шум" и, следовательно, качество видеоизображения. В качестве оптимального варианта системы многокадрового накопления, позволяющего минимизировать необходимые для шумоподавления ресурсы персонального компьютера, предложена система, содержащая вход 23, входной буфер 24, первый блок умножения 25, второй блок умножения 26, двухвходовой сумматор 27 с первым входом 28 и вторым входом 29, выходной буфер 30, ключ 31 и выход 32. В предлагаемой системе каждый поступающий кадр (ПК) видеопотока не замещает собой предыдущий кадр, а изменяет текущее изображение (ТИ), прибавляясь к нему с некоторым коэффициентом (под прибавлением понимается получение нового изображения путем попиксельного сложения ПК и ТИ), при этом коэффициенты при ТИ и ПК подбираются так, что их сумма равна единице. К примеру, если выбраны коэффициент 0,4 при ТИ и 0,6 при ПК, то интенсивность пиксела (а, б) результирующего изображения будет суммой интенсивностей пиксела (а, б) ПК, умноженного на 0,6, и пиксела (а, б) ТИ, умноженного на 0,4. Полученное таким образом изображение (результирующее изображение) отображается на мониторе и является ТИ для следующего ПК и т.д.
Исполнительный цикл системы состоит из четырех шагов:
1) ПК поступает через вход 23 и сохраняется во входном буфере 24; в том случае, если ПК является первым кадром потока, ключ 31 передает его в выходной буфер 30, тем самым инициализируя схему для первого цикла;
2) содержимое входного буфера 24 поступает на блок умножения 25 на коэффициент У1; содержимое выходного буфера 30 поступает на блок умножения 26 на коэффициент У2. Блоки 25 и 26 выполняют умножение каждого пиксела полученного кадра на соответствующий коэффициент;
3) информация с выходов блоков 25 и 26 поступает на соответствующие входы 28 и 29 сумматора 27, где осуществляется попиксельное сложение умноженных на У1 и У2 кадров;
4) с выхода сумматора 27 информация передается в выходной буфер 30, который напрямую соединен с выходом 32.
Такая система позволяет подавлять "белый шум" (случайную низкоинтенсивную высокочастотную составляющую) видеопотока в режиме реального времени.
Предлагаемый способ реализуют следующим образом. Объекту исследования (пациенту или экспериментальному животному, например кролику) с заболеванием глаза вводят фотосенсибилизатор - композицию на основе ди-, три- и тетра-сульфофталоцианинов оксиалюминия. После анестезии объект исследований располагают перед щелевой лампой так, чтобы патологически измененный участок глаза был в рабочей зоне щелевой лампы. Для проведения процедуры щелевая лампа под контролем видеоканала цветной камеры с помощью манипулятора наводится на исследуемый участок глаза (для наведения на патологические участки глазного дна и угол передней камеры в области проекции цилиарного тела необходимо дополнительно использовать 3-зеркальную линзу Гольдмана). С помощью электропривода, управляемого с интерфейса, вводят гомогенизирующий элемент-расширитель пучка, обеспечивающий облучение исследуемого участка глаза широким равномерным пучком лазерного излучения. Наблюдают картину флуоресценции в спектральном диапазоне 690-730 нм, и, обнаружив зону с повышенной интенсивностью флуоресценции и сопоставив ее с цветным изображением, делают вывод о наличии, расположении и размерах патологически измененного участка, например СНМ. После этого, установив необходимый диаметр пучка лазерного излучения и обеспечив его точное наведение на патологический участок, убирают гомогенизирующий элемент-расширитель пучка и проводят терапевтическое облучение. Ниже приведены конкретные примеры реализации предлагаемого способа диагностики и фотодинамической терапии заболеваний глаз.
Пример 1
На кроликах породы шиншилла была получена модель субретинальной неоваскулярной мембраны (СНМ). Для создания модели под общей анестезией проводилась лазерная коагуляция центральной области глазного дна (диаметр коагулята 0,2 мм, мощность аргонового лазера 550-850 мВт, время экспозиции 0,15 сек, количество коагулятов - 5). На фиг.5А показано глазное дно кролика сразу после проведения лазерной коагуляции. Стрелками отмечены свежие лазерные коагуляты с перифокальным отеком. На месте трех коагулятов в течение 5 дней формировалась локальная отслойка пигментного эпителия с последующим образованием фиброваскулярной ткани (подтверждено офтальмоскопически и результатами флуоресцентной ангиографии с флуоресцеином натрия). В ушную вену кролика ввели 0,3 мг/кг фотосенсибилизатора на основе композиции производных ди-, три- и тетра-сульфофталоцианинов оксиалюминия с массовьм соотношением 20:60:20. На третьи сутки после введения препарата проведено флуоресцентное исследование глазного дна в спектральном диапазоне 690-730 нм с использованием предлагаемого устройства с плотностью мощности лазерного излучения 50 мВт/см2 и длиной волны 669 нм. Отмечается высокий уровень флуоресценции в области лазерных коагулятов, а именно в зонах перифокального отека и локальных отслоек пигментного эпителия (фиг.5Б). В диске зрительного нерва флуоресценция сосудов не отмечена. ФДТ субретинальной неоваскулярной мембраны осуществлялась посредством воздействия лазерного излучения с длиной волны 669 нм при плотности мощности 500 мВт/см2 в течение 100 сек. Через 3 суток после ФДТ наблюдается (фиг.5Г) гипофлуоресценция патологического очага, свидетельствующая о запустевании СНМ. Спустя 3 недели на этом месте образуется атрофический очаг (рубец), что указывает на эффективность ФДТ в лечении СНМ.
Пример 2
Проведен сравнительный анализ влияния фотодинамической терапии и трансклеральной коагуляции диодным лазером цилиарного тела на уровень внутриглазного давления. Исследование проводилось на кроликах породы шиншилла, которые были разделены на 2 группы. В первой группе проводилась ФДТ с использованием предлагаемого устройства и фотосенсибилизатора на основе композиции производных ди-, три- и тетра-сульфофталоцианинов оксиалюминия. Фотосенсибилизатор в дозе 0,3 мг/кг веса кролика вводился болюсно, в ушную вену, После этого на расстоянии 2 мм от лимба в области проекции цилиарного тела было проведено облучение лазером с длиной волны 669 нм и мощностью 200 мВт при диаметре светового пятна 200 мкм (количество коагулятов - 10). Во второй группе была проведена лазерная коагуляция с длиной волны 669 нм, мощностью 200 мВт, диаметром светового пятна 200 мкм, количество коагулятов 10 без введения фотосенсибилизатора. Измерение внутриглазного давления у всех животных проводилось до облучения и через 5 минут, 3 часа, 7 часов, 24 часа, 48 часов, 60 часов, 72 часа, 96 часов после облучения.
Результаты проведенного эксперимента приведены в таблице 1.
| Таблица 1Изменение внутриглазного давления при фотодинамической терапии и трансклеральной коагуляции диодным лазером цилиарного тела. | |||||||||
| Значение ВГД (по аклакову)мм рт.ст. | До облучения | Через 5 минут | Через 3 часа | Через 7 часов | Через24 часа | Через 48 часов | Через 60 часов | Через 72 часа | Через 96 часов |
| 1 группа | 20 | 40 | 40 | 20 | 15 | 13 | 10 | 12 | 10- |
| 2 группа | 22 | 38 | 35 | 28 | 18 | 16 | 17 | 17 | 15 |
В обеих группах в течение первых семи часов отмечено реактивное повышение внутриглазного давления. Затем внутриглазное давление снижается, причем в первой группе более значительно, чем во второй. Эти результаты свидетельствует о положительном эффекте ФДТ в лечении глаукомы.
Пример 3
На кроликах породы шиншилла создана модель новообразованных сосудов роговицы путем травматического повреждения эпителия и стромы роговицы. В течение двух недель в центральной зоне роговицы кролика сформировался очаг округлой формы с нечеткими границами: диаметр 8 мм, глубиной 2/3 стромы. В очаге имеются новообразованные сосуды, питающий сосуд идет от лимба "на 10 часах". В зоне прохождения новообразованных сосудов наблюдаются помутнение стромы и дефекты эпителия (фиг.6А). В ушную вену кролика был введен раствор фотосенсибилизатора на основе композиции производных ди-, три- и тетра-сульфофталоцианинов оксиалюминия в концентрации 0,1 мг/кг. Через 2 суток после введения фотосенсибилизатора на предлагаемом устройстве было проведено исследование флуоресценции в спектральном диапазоне 690-730 нм при облучении лазерным излучением с длиной волны 669 нм и плотностью мощности 10 мВт/см2 в пятне диаметром 1000 мкм. Новообразованные сосуды роговицы интенсивно флуоресцировали (фиг.6Б). При этом флуоресценция сосудов конъюнктивы и р