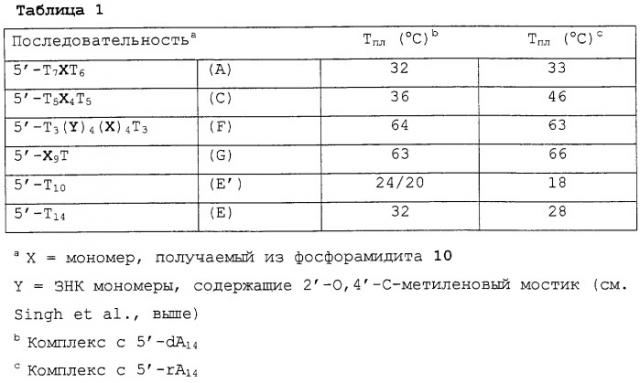
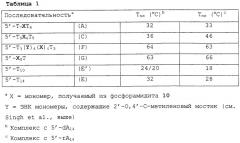
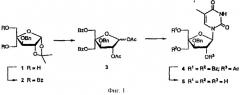
Аналоги l-рибо-знк
Иллюстрации
Показать всеИзобретение относится к олигомеру, включающему по меньшей мере один нуклеозидный аналог L-рибо ЗНК общей формулы Ia, где Х представляет собой -О-; В представляет собой нуклеотидное основание; Р обозначает положение радикала в межнуклеозидной связи с последующим мономером или 5'-концевую гидрокси группу; Р* обозначает межнуклеозидную связь с предшествующим мономером или 3'-концевую гидрокси группу; R2* и R4* вместе обозначают бирадикал -(CH2)0-1-O-(CH2)1-3-, -(CH2)0-1-S-(CH2)1-3- или -(CH2)0-1-NR-(CH2)1-3-, где R обозначает водород, алкил или ацил; R1*, R2, R3*, R5, R5* обозначают водород. Также предлагаются нуклеозидные аналоги для получения олигомеров по изобретению. Предложенные олигомеры обладают повышенной аффинностью к комплементарным нуклеиновым кислотам и могут использоваться в качестве инструмента для молекулярно-биологических исследований, а также в качестве антисмысловых, антигенных или активирующих ген средств. 2 н. и 13 з.п. ф-лы, 3 табл., 4 ил.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к области аналогов бициклических нуклеозидов в L-рибо-конфигурации и к синтезу таких нуклеозидных аналогов, которые используют при получении синтетических олигонуклеотидов, способных к образованию специфических дуплексов нуклеотидных оснований с комплементарными одноцепочечными и двухцепочечными нуклеиновыми кислотами. Изобретение также относится к области аналогов бициклических нуклеозидов в L-рибо-конфигурации, которые могут использоваться в качестве лекарственных средств и которые могут быть включены в состав олигонуклеотидов.
Предпосылки создания изобретения
Синтетические олигонуклеотиды представляют собой соединения, широко используемые в различных областях, таких как молекулярная биология, а также диагностика и лечение с применением препаратов на основе ДНК.
Общее описание
Для использования в широком перечне различных приложений, указанных выше, олигонуклеотиды должны удовлетворять множеству различных требований. Так, например, для использования в качестве лекарственных средств олигонуклеотид должен быть в состоянии проникать через клеточную мембрану, характеризоваться хорошей устойчивостью к вне- и внутриклеточным нуклеазам и предпочтительно обладать способностью мобилизовать эндогенные ферменты, такие как PHKseH. В диагностике на основе ДНК и в молекулярной биологии важны также другие свойства, такие как, например, способность олигонуклеотидов действовать в качестве эффективных субстратов для широкого перечня различных ферментов, оказывающих воздействие на природные нуклеиновые кислоты, таких как полимеразы, киназы, лигазы и фосфатазы. Однако фундаментальным свойством олигонуклеотидов, которое лежит в основе всех вариантов их использования, является их способность распознавать и гибридизоваться на специфичном участке последовательности с комплементарными одноцепочечными нуклеиновыми кислотами с помощью либо водородных связей Уотсона-Крика (А-Т и G-C), либо других вариантов водородных связей, таких как описаны в модели Хугстина (Hoogsteen). Для характеристики способности данного олигонуклеотида к гибридизации обычно используют два важных параметра: аффинность и специфичность. Аффинность представляет собой меру силы связывания олигонуклеотида с комплементарной целевой последовательностью (выражаемую в виде термостабильности (Тm) дуплекса). Каждая нуклеотидная пара в дуплексе вносит свой вклад в термостабильность и, таким образом, аффинность возрастает с увеличением размеров (числа нуклеотидных оснований) олигонуклеотида. Специфичность является мерой способности олигонуклеотида различать полную комплементарность и ошибочную целевую последовательность. Иными словами, специфичность является мерой потери аффинности, связанной с наличием ошибочных пар нуклеотидных оснований в молекуле-мишени.
При постоянстве размеров олигонуклеотида специфичность возрастает с увеличением числа ошибочных спариваний между олигонуклеотидом и его целевыми последовательностями (т.е. процент ошибок повышается). И наоборот, специфичность снижается, когда размер олигонуклеотида увеличивается при постоянном числе ошибок (т.е. процент ошибочных спариваний снижается). Говоря иными словами, повышение аффинности олигонуклеотида происходит за счет потери специфичности и наоборот.
Ввиду недостатков, свойственных естественным олигонуклеотидам, очень желательно разработать новые подходы для повышения специфичности и аффинности лекарственных средств на основе ДНК, методов диагностики и в целом методов молекулярной биологии, использующих ДНК.
Конформационно-ограниченные нуклеозиды
Известно, что олигонуклеотиды подвергаются конформационным переходам в ходе гибридизации с целевой последовательностью из относительно случайно свернутой структуры одноцепочечного состояния в упорядоченную структуру дуплекса.
Так, в последние годы в поиске аналогов олигонуклеотидов с улучшенными гибридизационными свойствами в сравнении с немодифицированными (2'-дезокси)олигонуклеотидами применялся метод конформационного ограничения. К их числу относятся, например, бицикло[3.3.0]нуклеозиды с дополнительным С-3',С-5'-этано-мостиком (М. Tarköy, M. Bolli, В. Schweizer and С. Leumann, Helv. Chem. Acta, 1993, 76, 481; Tarköy and С. Leumann, Angew. Chem., Int. Ed. Engl., 1993, 32, 1432; M. Egli, P. Lubini, M. Dobler and C. Leumann, J. Am. Chem. Soc., 1993, 115, 5855; M. Tarköy, M. Bolli and C. Leumann, Helv. Chem. Acta, 1994, 77, 716; M. Bolli and C. Leumann, Angew. Chem., Int. Ed. Engl., 1995, 34, 694; M. Bolli, P. Lubini and C. Leumann, Helv. Chem. Acta, 1995, 78, 2077; J.C. Litten, C. Epple and C. Leumann, Bioorg. Med. Chem. Lett., 1995, 5, 1231; J.C. Litten and C. Leumann, Helv. Chem. Acta, 1996, 79, 1129; M. Bolli, J.C. Litten, R. Schultz and C. Leumann, Chem. Biol., 1996. 3, 197; M. Bolli, H.U. Trafelet and C. Leumann, Nucleic Acids Res., 1996, 24, 4660), бикарбоцикло [3.1.0]нуклеозиды с дополнительным С-1',С-6' или С-6',С-4'-метано-мостиком (К.-Н. Altmann, R. Kesselring, E. Francotte and G. Rihs, Tetrahedron Lett., 1994, 35, 2331; K.-H. Altmann, R. Imwinkelried, R. Kesselring and G. Rihs, Tetrahedron Lett., 1994, 35, 7625; V.E. Marquez, M.A. Siddiqui, A. Ezzitouni, P. Russ, J. Wang, R.W. Wagner and M.D. Matteucci, J. Med. Chem., 1996, 39, 3739; A. Ezzitouni and V.E. Marquez, J. Chem. Soc., Perkin Trans. 1, 1997. 1073), бицикло[3.3.0]- и [4.3.0]нуклеозиды, содержащие дополнительное С-2',С-3'-диоксалановое кольцо, синтезированные в виде димера с немодифицированным нуклеозидом, в котором дополнительное кольцо представляет собой часть межнуклеозидной связи, замещающей естественную фосфодиэфирную связь (R.J. Jones, S. Swaminathan, J.F. Millagan, S. Wadwani, B.S. Froehler and M. Matteucci, J. Am. Chem. Soc., 1993, 115, 9816; J. Wang and M.D. Matteucci, Bioorg. Med. Chem. Lett., 1997, 7, 229), димеры, содержащие бицикло[3.1.0]нуклеозид с С-2',С-3'-метано-мостиком как составную часть межнуклеозидных связей амидного и сульфонамидного типа (C.G.Yannopoulus, W.Q.Zhou, P. Nower, D. Peoch, Y.S. Sanghvi and G. Just, Synlett., 1997, 378), аналог нуклеозида, производного от бицикло[3.3.0]глюкозы, включенный в середину тримера через формацетальные межнуклеозидные связи (C.G. Yannopoulus, W.Q. Zhou, P. Nower, D. Peoch, Y.S. Sanghvi and G. Just, Synlett., 1997, 378) и бициклические[4.3.0]- и [3.3.0]нуклеозиды с дополнительным С-2',С-3'-связанным шести- и пятичленным кольцом (Р. Nielsen, Н.М. Pfundheller, J. Wengel, Chem. Commun., 1997, 826; Р. Nielsen, H.M. Pfundheller, J. Wengel, XII International Roundtable: Nucleosides, Nucleotides and Their Biological Applications; La Jolla, California, September 15-19, 1996; Poster PPI 43), которые были синтезированы и включены в состав олигодезоксинуклеотидов. К сожалению, олигонуклеотиды, включающие указанные аналоги, в большинстве случаев образуют менее стабильные дуплексы с комплементарными нуклеиновыми кислотами в сравнении с немодифицированными олигонуклеотидами. В том случае, когда отмечается умеренное повышение стабильности дуплекса, такое повышение связано только с ДНК или РНК мишенью, или имеет отношение к полностью, а не частично модифицированным олигонуклеотидам, или наоборот.
Оценка большинства из указанных аналогов осложнена также недостаточностью данных по аналогам с Г, А и Ц нуклеотидными основаниями, а также данных по специфичности и способу гибридизации. Во многих случаях синтез указанных мономерных аналогов представляет собой очень сложный процесс, причем в ряде случаев синтез полностью модифицированных олигонуклеотидов несовместим с широко используемыми стандартными методами фосфорамидитной химии.
В последнее время появились сообщения об олигомерах, включающих замкнутые нуклеиновые кислоты (ЗНК, Locked Nucleic Acids, LNA) (Nielsen, P., Pfundheller, H.M., Olsen, C.E. and Wengel, J., J. Chem. Soc., Perkin Trans. 1, 1997, 3423; Nielsen, P., Pfundheller, H.M., Wengel, J., Chem. Commun., 1997, 9, 825; Christensen, N.K., Petersen M., Nielsen, P., Jacobsen, J.P. and Wengel, J., J. Am. Chem. Soc., 1998, 220, 5458; Koshkin, A.A. and Wengel, J., J. Orq. Chem., 1998, 63, 2778; Obika, S., Morio, K.-I., Hari, Y. and Imanishi, Т., Bioorg. Med. Chem. Lett., 1999, 515). Оказалось, что включение ЗНК мономеров, содержащих 2'-O,4'-С-метиленовый мостик, в олигонуклеотидную последовательность ведет к беспрецедентному улучшению гибридизационных свойств такого модифицированного олигонуклеотида (Singh, S.K., Nielsen, P., Koshkin, A.A., Olsen, C.E. and Wengel, J., Chem. Commun., 1998, 455; Koshkin, А.К., Singh, S.K., Nielsen, P., Rajwanshi, V.K., Kumar, R., Meldgaard, M., Olsen, S.E. and Wengel, J., Tetrahedron, 1998, 54, 3607; Koshkin, A.A., Rajwanshi, V.K. and Wengel, J., Tetrahedron Lett., 1998, 39, 4381; Singh, Sanjay К. and Wengel, J., Chem. Commun., 1998, 1247; Kumar, R., Singh, S. K., Koshkin, A.A., Rajwanshi, V.K., Meldgaard, M., and Wengel, J., Bioorg. Med. Chem. Lett., 1998, 8, 2219; Obika, S. et al. Tetrahedron Lett., 1997, 38, 8735; Obika, S. et al. Tetrahedron Lett., 1998, 39, 5401; Singh, S.K., Kumar, R. and Wengel, J., J. Org. Chem., 1998, 63, 6078; Koshkin, А.А., Nielsen, P., Meldgaard, M., Rajwanshi, V.K., Singh, S.K. and Wengel, J., J. Am. Chem. Soc., 1998, 120, 13252; Singh, S.K., Kumar, R. and Wengei, J., J. Org. Chem., 1998, 63, 10035). Олигонуклеотиды, включающие указанные ЗНК мономеры и соответствующий 2'-тио-ЗНК аналог, образуют дуплексы с комплементарными ДНК и РНК со значениями термической стабильности, которые ранее не наблюдались для би- и трициклических нуклеозидов в модифицированных олигонуклеотидах (ΔТпл/модификация = от +3 до +11°С), а также демонстрируют улучшенную селективность.
В ряде работ Сеела с соавт. (Seela et al.) изучали ксило-ДНК (фиг.1, основание = аденин-9-ил, цитозин-1-ил, гуанин-9-ил или тимин-1-ил), включающую один или более 2'-дезокси-β-D-ксилофуранозильных нуклеотидных мономеров (Rosemeyer, Н.; Seela, F. Helv. Chem. Acta, 1991, 74, 748; Rosemeyer, H.; Krecmerova, M.; Seela, F. Helv. Chem. Acta, 1991, 74, 2054; Seela, F.; Wörner, Rosemeyer, H. Helv. Chem. Acta, 1994, 77, 883; Seela, F.; Heckel, M.; Rosemeyer, H. Helv. Chem. Acta, 1996, 79, 1451; Rosemeyer, H.; Seela, F. Nucleosides Nucleotides, 1995, 14, 1041; Schoeppe, A., Hinz, H.-J., Rosemeyer, H., Seela, F. Eur. J. Biochem. 1996, 239, 33). В сравнении с соответствующими природными 2'-дезокси-β-D-рибофуранозильными олигонуклеотидами, ксило-ДНК в основном характеризуется зеркальной вторичной структурой, энтропически благоприятствующей образованию дуплекса, повышению стабильности в отношении экзонуклеаз и, в случае олигонуклеотидов, включающих небольшое число 2'-дезокси-β-D-ксилофуранозильных мономеров, снижению термической аффинности в отношении комплементарной ДНК (Rosemeyer, H.; Seela, F. Helv. Chem. Acta, 1991, 74, 748; Rosemeyer, H.; Krecmerova, M.; Seela, F. Helv. Chem. Acta, 1991, 74, 2054; Seela, F.; Wörner, Rosemeyer, H. Helv. Chem. Acta, 1994, 77, 883; Seela, F.; Heckel, M.; Rosemeyer, H. Helv. Chem. Acta, 1996, 79, 1451).
Краткое описание сущности изобретения
В свете вышесказанного и на основании известных свойств ЗНК мономеров с 2'-О,4'-С-метиленовым мостиком, было принято решение синтезировать олигонуклеотиды, включающие один или более 2'-О,4'-С-метилен-α-L-рибофуранозильных нуклеотидных мономера(ов). Компьютерное моделирование на мономерах α-L-рибо-ЗНК указывало на конформацию фуранозного кольца S-типа. В этой связи целью настоящей работы является синтез 2'-O,4'-С-метилен-α-L-рибофуранозильного нуклеотидного мономера и изучение термической стабильности олигонуклеотидов, включающих указанный мономер. Результаты показывают, что модифицированный L-рибо-ЗНК может использоваться для высокоаффинного распознавания комплементарных нуклеиновых кислот. Если принимать во внимание инвертную стереохимию молекулы на С-3'-конце и С-4'-конце, этот факт является весьма удивительным.
Таким образом, авторы настоящего изобретения предложили новые аналоги ЗНК нуклеозидов (L-рибо-ЗНК) и олигонуклеотиды, в которые включены аналоги L-рибо-ЗНК нуклеозидов. Были синтезированы новые аналоги L-рибо-ЗНК нуклеозидов, включающие тимин в качестве нуклеинового основания, однако они могут быть легко синтезированы также с четырьмя другими нуклеотидными основаниями с образованием полного набора нуклеозидных аналогов для включения в олигонуклеотиды.
Настоящее изобретение относится к олигомерам, включающим по меньшей мере один нуклеозидный аналог (называемый далее "L-рибо-ЗНК") общей формулы I
где Х выбирают из -О-, -S-, -N(RN*)-, -C(R6R6*)-;
В выбирают из водорода, гидрокси, необязательно замещенного C1-4-алкокси, необязательно замещенного C1-4-алкила, необязательно замещенного C1-4-ацилокси, нуклеотидных оснований, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов;
Р обозначает положение радикала в межнуклеозидной связи относительно последующего мономера или 5'-концевую группу, причем такая межнуклеозидная связь или 5'-концевая группа необязательно включает заместитель R5 или равноприемлемый заместитель R5*;
Р* обозначает межнуклеозидную связь с предшествующим мономером или 3'-концевую группу;
R2* и R4* обозначают бирадикалы, состоящие из 1-4 групп/атомов, выбираемые из -С(RaRb)-, -С(Ra)=C(Ra)-, -C(Ra)=N-, -О-, -Si(Ra)2-, -S-, -SO2-, -N(Ra)- и >C=Z, где Z выбирают из -О-, -S- и -N(Ra)-, и R3 и R13, каждый, независимо, выбирают из водорода, необязательно замещенного C1-12-алкила, необязательно замещенного С2-12-алкенила, необязательно замещенного C2-12-алкинила, гидрокси, C1-12-алкокси, С2-12-алкенилокси, карбокси, C1-12-алкоксикарбонила, C1-12-алкилкарбонила, формила, арила, арилоксикарбонила, арилокси, арилкарбонила, гетероарила, гетероарилоксикарбонила, гетероарилокси, гетероарилкарбонила, амино, моно- и ди(С1-6-алкил) амино, карбамоила, моно- и ди(С1-6-алкил)аминокарбонила, амино-С1-6-алкиламинокарбонила, моно- и ди(C1-6-алкил)амино-С1-6-алкиламинокарбонила, C1-6-алкилкарбонил-амино, карбамидо, C1-6-алканоилокси, сульфоно, C1-6-алкилсульфонилокси, нитро, азидо, сульфанила, C1-6-алкилтио, галогена, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов, где арил и гетероарил могут быть необязательно замещены и где два геминальных заместителя Ra и Rb вместе могут обозначать необязательно замещенный метиленолефин (=СН2);
каждый из присутствующих заместителей R1*, R2, R3*, R5, R5*, R6 и R6* независимо выбирают из водорода, необязательно замещенного C1-12-алкила, необязательно замещенного С2-12-алкенила, необязательно замещенного С2-12-алкинила, гидрокси, C1-12-алкокси, С2-12-алкенилокси, карбокси, C1-12-алкоксикарбонила, C1-12 -алкилкарбонила, формила, арила, арилоксикарбонила, арилокси, арилкарбонила, гетероарила, гетероарилоксикарбонила, гетероарилокси, гетероарилкарбонила, амино, моно- и ди(С1-6-алкил)амино, карбамоила, моно- и ди(С1-6-алкил)аминокарбонила, амино-С1-6-алкиламинокарбонила, моно- и ди(С1-6-алкил)амино-С1-6-алкиламинокарбонила, C1-6-алкилкарбонил-амино, карбамидо, C1-6-алканоилокси, сульфоно, C1-6-алкилсульфонилокси, нитро, азидо, сульфанила, C1-6-алкилтио, галогена, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов, где арил и гетероарил могут быть необязательно замещены и где два геминальных заместителя вместе могут обозначать оксо, тиоксо, имино или необязательно замещенный метилен, или вместе они могут образовывать спиро-бирадикал, состоящий из алкиленовой цепи, включающей 1-5 атомов углерода, которая необязательно содержит внутри и/или на конце один/одну или более гетероатомов/групп, выбранных из -О-, -S- или -(NRN)-, где RN выбирают из водорода и C1-4-алкила и где два соседних (негеминальных) заместителя могут обозначать дополнительную связь, приводящую к образованию двойной связи; и RN*, в случае его наличия, выбирают из водорода и С1-4-алкила;
и к их основным солям и кислым аддитивным солям.
Настоящее изобретение также относится к нуклеозидным аналогам (L-рибо-ЗНК) общей формулы II
где заместитель В выбирают из нуклеотидных оснований, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов;
Х выбирают из -О-, -S-, -N(RN*)- и -C(R6R6*)-;
каждый из Q и Q* независимо выбирают из водорода, азидо, галогена, циано, нитро, гидрокси, Prot-O-, Act-O-, меркапто, Prot-S-, Act-S-, C1-6-алкилтио, амино, Prot-N(RH)-, Act-N(RH)-, моно- или ди (С1-6-алкил)амино, необязательно замещенного С1-6-алкокси, необязательно замещенного С1-6-алкила, необязательно замещенного С2-6-алкенила, необязательно замещенного C2-6-алкенилокси, необязательно замещенного С2-6-алкинила, необязательно замещенного С2-6-алкинилокси, монофосфата, дифосфата, трифосфата, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп, лигандов, карбокси, сульфоно, гидроксиметила, Prot-O-CH2-, Act-O-CH2-, аминометила, Prot-N(RH)-CH2-, Act-N(RH) -CH2-, карбоксиметила, сульфонометила, где Prot обозначает защитную группу для -ОН, -SH и -NH(RH)-, соответственно, Act обозначает активирующую группу для -ОН, -SH и -NH(RH), соответственно, и RH выбирают из водорода и C1-6-алкила; и R2* и R4* вместе обозначают бирадикал, выбираемый из -О-, -(CR*R*)r+s+l-, -(CR*R*)r-O-(CR*R*)s-, - (CR*R*)r-S-(CR*R*)s-, -(CR*R*)r-N(R*)-(CR*R*)s-, -O- (CR*R*)r+s-O-, -S- (CR*R*)r+s-O-, -O-(CR*R*)r+s-S-, -N-(R*)-(CR*R*)r+s-O-, -O-(CR*R*)r+s-N (R*)-, -S-(CR*R*)r+s-S-, -N(R*)-(CR*R*)r+s-N(R*)-, -N (R*) - (CR*R)r+s-S- и -S-(CR*R*)r+s-N(R*)-;
где каждый R* выбирают независимо из водорода, галогена, азидо, циано, нитро, гидрокси, меркапто, амино, моно- или ди (C1-6-алкил) амино, необязательно замещенного C1-6-алкокси, необязательно замещенного C1-6-алкила, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов, и/или два соседних (негеминальных) R* могут вместе обозначать двойную связь и каждый r и s обозначает 0-3, при условии, что сумма r+s равна 1-4;
каждый из присутствующих заместителей R1*, R2, R3*, R5, R5*, R6 и R6* независимо выбирают из водорода, необязательно замещенного C1-12-алкила, необязательно замещенного C2-12-алкенила, необязательно замещенного С2-12-алкинила, гидрокси, C1-12-алкокси, C2-12-алкенилокси, карбокси, C1-12-алкоксикарбонила, C1-12-алкилкарбонила, формила, арила, арилоксикарбонила, арилокси, арилкарбонила, гетероарила, гетероарилоксикарбонила, гетероарилокси, гетероарилкарбонила, амино, моно- и ди(C1-6-алкил)амино, карбамоила, моно- и ди(С1-6-алкил)аминокарбонила, амино-С1-6-алкиламинокарбонила, моно- и ди(C1-6-алкил)амино-С1-6-алкиламинокарбонила, C1-6-алкилкарбонил-амино, карбамидо, C1-6-алканоилокси, сульфоно, C1-6-алкилсульфонилокси, нитро, азидо, сульфанила, C1-6-алкилтио, галогена, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов, где арил и гетероарил могут быть необязательно замещены и где два геминальных заместителя вместе могут обозначать оксо, тиоксо, имино или необязательно замещенный метилен, или вместе они могут образовывать спиро-бирадикал, состоящий из алкиленовой цепи, включающей 1-5 атомов углерода, которая необязательно содержит внутри и/или на конце один/одну или более гетероатомов/групп, выбираемых из -О-, -S- и -(NRH)-, где RH выбирают из водорода и C1-4-алкила и где два соседних (негеминальных) заместителя могут обозначать дополнительную связь, приводящую к образованию двойной связи;
и RH*, если он имеется и не включен в бирадикал, выбирают из водорода и C1-4-алкила;
и к их основным солям и кислым аддитивным солям;
при условии, что любая химическая группа (включающая любое нуклеотидное основание), которая является реакционноспособной в условиях, преобладающих при синтезе олигонуклеотидов, представляет собой необязательно защищенную функциональную группу.
Настоящее изобретение также относится к использованию нуклеозидных аналогов (L-рибо-ЗНК) для получения олигомеров и к использованию олигомеров, а также нуклеозидных аналогов (L-рибо-ЗНК) в диагностике, молекулярно-биологических исследованиях и в терапии.
Подробное описание изобретения
В контексте настоящего описания термин «L-рибо-ЗНК» (закрытые нуклеозидные аналоги в L-рибо-конфигурации) относится к бициклическим нуклеозидным аналогам в L-рибо-конфигурации, которые либо включены в олигомер согласно настоящему изобретению (основная формула I), либо представляют собой отдельный химический вид (общая формула II). Термин «мономерный L-рибо-ЗНК» конкретно относится к последнему случаю.
Олигомеры и нуклеозидные аналоги
Как указывалось выше, настоящее изобретение относится, в числе других объектов, к новым олигомерам (олигонуклеотидам), включающим один или более бициклических нуклеозидных аналогов в L-рибо-конфигурации (далее в описании называемых «L-рибо-ЗНК»).
Каждый из возможных L-рибо-ЗНК, включенных в олигомер (олигонуклеотид), имеет общую формулу I:
где Х выбирают из -О- (L-рибофуранозный мотив), -S-, -М(RN*)-, -C(R6R6*)-, где R6, R6* и RN* определены ниже. Таким образом, L-рибо-ЗНК, включенные в олигомер, содержат 5-членное кольцо в качестве обязательной части бициклической структуры.
Среди возможных 5-членных колец очень интересной является ситуация, когда Х обозначает -О-, -S- и -N(RN*), а ситуация, когда Х обозначает -О-, представляется особенно интересной.
Заместитель В может обозначать группу, которая, в том случае когда олигомер образует комплекс с ДНК или РНК, способна взаимодействовать (например, с помощью водородных связей, или ковалентных связей, или посредством электронного взаимодействия) с ДНК или РНК, в особенности с нуклеотидными основаниями ДНК или РНК. Альтернативно, заместитель В может обозначать группу, которая действует как метка или репортер, или заместитель В может обозначать группу (например, водород), которая, как ожидается, будет в незначительной мере взаимодействовать с ДНК или РНК, или взаимодействие вообще не будет иметь места. Так, заместитель В предпочтительно выбирают из водорода, гидрокси, необязательно замещенного С1-4-алкокси, необязательно замещенного C1-4-алкила, необязательно замещенного C1-4-ацилокси, нуклеотидных оснований, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов.
В контексте настоящего описания термин «нуклеотидное основание» охватывает как природные нуклеотидные основания, так и неприродные нуклеотидные основания. Каждому специалисту со средним уровнем знаний в данной области очевидно, что различные нуклеотидные основания, которые ранее рассматривались как неприродные, впоследствии были найдены в природе. Таким образом, термин «нуклеотидные основания» включает не только известные пуриновые и пиримидиновые гетероциклы, но также аналоги гетероциклических соединений и их таутомеры. Репрезентативные примеры нуклеотидных оснований включают аденин, гуанин, тимин, цитозин, урацил, пурин, ксантин, диаминопурин, 8-оксо-N6-метиладенин, 7-деазаксантин, 7-деазагуанин, N4,N4-этаноцитозин, N6,N6-этано-2,6-диаминопурин, 5-метилцитозин, 5-(С3-С6)-алкинилцитозин, 5-фторурацил, 5-бромурацил, псевдоизоцитозин, 2-гидрокси-5-метил-4-триазолопиридин, изоцитозин, изогуанин, инозин и «неприродные» нуклеотидные основания, описанные в патенте США No. 5432272 (Benner et al.). Термин «нуклеотидное основание» охватывает все приведенные примеры, а также их аналоги и таутомеры. Особенно интересными нуклеотидными основаниями являются аденин, гуанин, тимин, цитозин и урацил, которые рассматриваются как природные нуклеотидные основания в контексте их терапевтического и диагностического использования у людей.
В контексте настоящего описания термин «интеркалятор ДНК» означает группу, которая может интеркалироваться в спираль, дуплекс или триплекс ДНК или РНК. Примеры функциональных частей интеркаляторов ДНК включают акридины, антрацены, хиноны, такие как антрахинон, индол, хинолин, изохинолин, дигидрохиноны, антрациклины, тетрациклины, метиленовый синий, антрациклинон, псоралены, кумарины, этидий-галогениды, динемицин, комплексы металлов, такие как 1,10-фенантролин-медь, трис(4,7-дифенил-1,10-фенантролин)рутений-кобальт-энедиины, такие как калхеамицин, порфирины, дистамицин, нетропцин, виологен, дауномицин. Особенно интересными примерами являются акридины, хиноны, такие как антрахинон, метиленовый синий, псоралены, кумарины и этидий-галогениды.
В контексте настоящего описания термин «фотохимически активные группы» охватывает соединения, способные подвергаться химическим реакциям при облучении светом. Наглядными примерами функциональных групп таких соединений являются хиноны, особенно 6-метил-1,4-нафтохинон, антрахинон, нафтохинон и 1,4-диметил-антрахинон, диазирины, ароматические азиды, бензофеноны, псоралены, диазосоединения и диазириносоединения.
В контексте настоящего описания термин «термохимически реактивная группа» означает функциональную группу, которая при термохимической индукции способна образовывать ковалентную связь с другими группами. Наглядными примерами функциональных частей термохимически активных групп являются карбоновые кислоты, сложные эфиры карбоновых кислот, такие как активированные сложные эфиры, галоидангидриды карбоновых кислот, такие как фторангидриды, хлорангидриды, бромангидриды и иодангидриды, а также азиды карбоновых кислот, гидразиды карбоновых кислот, сульфоновые кислоты, сложные эфиры сульфоновых кислот, галоидангидриды сульфоновых кислот, семикарбазиды, тиосемикарбазиды, альдегиды, кетоны, первичные спирты, вторичные спирты, третичные спирты, фенолы, алкилгалогениды, тиолы, дисульфиды, первичные амины, вторичные амины, третичные амины, гидразины, эпоксиды, малеимиды и производные бороновой кислоты.
В контексте настоящего описания термин «хелатирующая группа» означает молекулу, которая включает более одного сайта связывания и зачастую соединяется с другой молекулой, другим атомом или другим ионом посредством более чем одного связывающего сайта в одно и то же время. Примеры функциональных частей хелатирующих групп включают иминодиуксусную кислоту, нитрилотриуксусную кислоту, этилендиаминтетрауксусную кислоту (ЭДТА), аминофосфоновую кислоту и др.
В контексте настоящего описания термин «репортерная группа» означает группу, которая обнаруживается либо сама по себе, либо как часть обнаруживаемой серии. Примеры функциональных частей репортерных групп включают биотин, дигоксигенин, флуоресцентные группы (группы, способные абсорбировать электромагнитное излучение, например, свет или рентгеновские лучи с определенной длиной волны, с последующей повторной эмиссией поглощенной энергии в виде излучения с большей длиной волны; наглядные примеры включают дансил (5-диметиламино)-1-нафталинсульфонил), DOXYL (N-оксил-4,4-диметилоксазолидин), PROXYL (N-оксил-2,2,5,5-тетраметилпирролидин), TEMPO (N-оксил-2,2,6,6-тетраметилпиперидин), динитрофенил, акридины, кумарины, Сy3 и Сy5 (торговые марки Biological Detection Systems, Inc.), эритрозин, кумаровую кислоту, умбеллиферон, техасский красный (Texas Red), родамин, тетраметил-родамин, рокс (Rox), 7-нитробензо-2-окса-1-диазол (НБД), пирен, флуоресцеин, европий, рутений, самарий и другие редкоземельные металлы), радиоизотопные метки, хемилюминесцентные метки (метки, обнаруживаемые за счет эмиссии света во время химической реакции), спиновые метки (свободные радикалы (например, замещенные органические нитроксиды) или другие парамагнитные зонды (например, Cu2+, Mg2+), которые при связывании с биологической молекулой делают ее обнаруживаемой при использовании спектроскопии электронного парамагнитного резонанса), ферменты (такие как пероксидазы, щелочные фосфатазы, β-галактозидазы и глюкозооксидазы), антигены, антитела, гаптены (группы, способные соединяться с антителом, но которые сами по себе не вызывают иммунного ответа, такие как пептиды и стероидные гормоны), системы носителей для проникновения через клеточную мембрану, такие как остатки жирных кислот, стероидные группы (холестерин), витамин А, витамин D, витамин Е, фолиевая кислота, пептиды для специфических рецепторов, группы, опосредующие эндоцитоз, эпидермальный фактор роста (EGF), брадикинин и фактор роста тромбоцитов (PDGF). Особенно интересные примеры включают биотин, флуоресцеин, техасский красный, родамин, динитрофенил, дигоксигенин, рутений, европий, Сy5 и Сy3.
В контексте настоящего описания термин «лиганд» означает группу, которая может связываться с чем-либо. Лиганды могут включать функциональные группы, такие как ароматические группы (такие как бензол, пиридин, нафталин, антрацен и фенантрен), гетероароматические группы (такие как тиофен, фуран, тетрагидрофуран, пиридин, диоксан и пиримидин), карбоновые кислоты, сложные эфиры карбоновых кислот, галогениды карбоновых кислот, азиды карбоновых кислот, гидразиды карбоновых кислот, сульфоновые кислоты, сложные эфиры сульфоновых кислот, галогениды сульфоновых кислот, семикарбазиды, тиосемикарбазиды, альдегиды, кетоны, первичные спирты, вторичные спирты, третичные спирты, фенолы, алкилгалогениды, тиолы, дисульфиды, первичные амины, вторичные амины, третичные амины, гидразины, эпоксиды, малеинимиды, C1-C20-алкильные группы, необязательно включающие внутри группы или на ее конце один или более гетероатомов, таких как атомы кислорода, атомы азота и/или атомы серы, необязательно включающие ароматические или моно/полиненасыщенные углеводороды, полиоксиэтилен, такой как полиэтиленгликоль, олиго/полиамиды, такие как поли-β-аланин, полиглицин, полилизин, пептиды, олиго/полисахариды, олиго/полифосфаты, токсины, антибиотики, клеточные яды и стероиды, а также «аффинные лиганды», т.е. функциональные группы или биомолекулы, которые обладают специфической аффинностью в отношении сайтов на определенных белках, антителах, поли- и олигосахаридах и других биомолекулах.
Для любого специалиста в данной области очевидно, что указанные выше конкретные примеры интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов соответствуют «активной/функциональной» части рассматриваемых групп. Для специалистов в данной области также ясно, что интеркаляторы ДНК, фотохимически активные группы, термохимически активные группы, хелатирующие группы, репортерные группы и лиганды в типичном случае находятся в М-К-форме, где М обозначает «активную/функциональную» часть рассматриваемой группы, а К обозначает спейсер, через который указанная «активная/ функциональная» часть присоединяется к 5-членному кольцу. Таким образом, следует понимать, что группа В в том случае, когда В выбирают из интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных групп и лигандов, имеет форму М-К-, где М обозначает «активную/функциональную» часть интеркалятора ДНК, фотохимически активной группы, термохимически активной группы, хелатирующей группы, репортерной группы и лиганда, соответственно, и где К обозначает необязательный спейсер, включающий 1-50 атомов, предпочтительно 1-30 атомов, в частности 1-15 атомов, между 5-членным кольцом и «активной/функциональной» частью молекулы.
В контексте настоящего описания термин «спейсер» означает фотохимически и термохимически неактивную группу, которая выполняет функцию пространственного дистанцирования при соединении двух или более различных групп указанного выше типа. Спейсеры выбирают с учетом множества характеристик, включая гидрофобность, гидрофильность, гибкость их молекул и длину (см., в частности, Hermanson et al., «Immobilized Affinity Ligand Techniques», Academic Press, San Diego, California (1992), p.137-ff). В основном длина спейсера составляет менее чем примерно 400 , в случае некоторых применений предпочтительно, чтобы длина была меньше 100 . Таким образом, спейсер включает цепь углеродных атомов, необязательно содержащую внутри или на конце один или более гетероатомов, таких как атомы кислорода, атомы азота и/или атомы серы. Таким образом, спейсер К может включать одну или более амидных, сложноэфирных, амино, эфирных и/или тиоэфирных функциональных групп и необязательно ароматические или моно/полиненасыщенные углеводороды, полиоксиэтилен, такой как полиэтиленгликоль, олиго/полиамиды, такие как поли-р-аланин, полиглицин, полилизин, и пептиды в целом, олигосахариды, олиго/полифосфаты. Кроме того, спейсер может состоять из объединенных единиц. Длина спейсера может варьировать, в зависимости от его желательного или необходимого положения и пространственной ориентации «активной/функциональной» части рассматриваемой группы относительно 5-членного кольца. В особенно интересных вариантах реализации настоящего изобретения спейсер включает химически расщепляемую группу. Примеры таких химически расщепляемых групп включают дисульфидные группы, расщепляемые в восстановительных условиях, пептидные фрагменты, расщепляемые пептидазами, и др.
В одном варианте реализации настоящего изобретения К обозначает одинарную связь, так что «активная/функциональная» часть рассматриваемой группы присоединяется непосредственно к 5-членному кольцу.
В предпочтительном варианте реализации настоящего изобретения заместитель В в основных формулах I и II предпочтительно выбирают из нуклеотидных оснований, в частности из аденина, гуанина, тимина, цитозина и урацила.
В олигомерах согласно настоящему изобретению (формула I) Р обозначает положение радикала в межнуклеозидной связи с последующим мономером или 5'-концевую группу. Первый вариант имеет место в том случае, когда рассматриваемый L-рибо-ЗНК не является 5'-концевым «мономером», тогда как последний вариант применим в том случае, когда рассматриваемый L-рибо-ЗНК представляет собой 5'-концевой «мономер». Следует понимать (что также очевидно из приведенного ниже определения межнуклеозидной связи и 5'-концевой группы), что такая межнуклеозидная связь или 5'-концевая группа могут включать заместитель R5 (или равноприемлемый заместитель R5*), образуя таким образом двойную связь с группой Р. (5'-конец относится к положению, соответствующему 5'-атому углерода в рибозной группе нуклеозида).
С другой стороны Р* обозначает положение радикала в межнуклеозидной связи с предшествующим мономером или 3'-концевую группу. Аналогично, первый вариант относится к тому случаю, когда рассматриваемый L-рибо-ЗНК не является 3'-концевым «мономером», тогда как последний вариант имеет место в том случае, когда рассматриваемый L-рибо-ЗНК представляет собой 3'-концевой «мономер» (3'-конец относится к положению, соответствующему 3'-атому углерода в рибозной группе в нуклеозиде).
В контексте настоящего описания термин «мономер» относится к природным нуклеозидам, неприродным нуклеозидам, ПНК, ЗНК, а также к L-рибо-ЗНК. Таким образом, термин «последующий мономер» относится к соседнему мономеру в направлении 5'-конца, и термин «предшествующий мономер» относится к соседнему мономеру в направлении 3'-конца. Такие последующий и предшествующий мономеры с точки зрения положения L-рибо-ЗНК мономера могут быть представлены природными нуклеозидами или неприродными нуклеозидами или даже L-рибо-ЗНК мономерами.
Следовательно, в контексте настоящего описания (как можно видеть из приведенных выше определений) термин «олигомер» означает олигонуклеотид, модифицированный за счет включения одного или более L-рибо-ЗНК.
Важнейшей частью настоящего изобретения является L-рибо-конфигурация комбинированного 5-членного кольца, при условии, что R2* и R4* вместе обозначают бирадикал, образующий слитое кольцо на 5-членном кольце.
В группах, составляющих бирадикал(ы), Z выбирают из -О-, -S- и -N(Ra)-, и Ra и Rb, каждый, независимо, выбирают из водорода, необязательно замещенного C1-12-алкила, необязательно замещенного С2-12-алкенила, необязательно замещенного С2-12-алкинила, гидрокси, C1-12-алкокси, С2-12-алкенилокси, карбокси, C1-12-алкоксикарбонила, C1-12-алкилкарбонила, формила, арила, арилоксикарбонила, арилокси, арилкарбонила, гетероарила, гетероарилоксикарбонила, гетероарилокси, гетероарилкарбонила, амино, моно- и ди(С1-6-алкил)амино, карбамоила, моно- и ди(С1-6-алкил)аминокарбонила, амино-С1-6-алкиламинокарбонила, моно- и ди (C1-6-алкил) амино-С1-6-алкиламинокарбонила, C1-6-алкилкарбонил-амино, карбамидо, C1-6-алканоилокси, сульфоно, C1-6-алкилсульфонилокси, нитро, азидо, сульфанила, C1-6-алкилтио, галогена, интеркаляторов ДНК, фотохимически активных групп, термохимически активных групп, хелатирующих групп, репортерных