Новый цитокин zalpha11-лиганд
Иллюстрации
Показать всеИзобретение относится к биотехнологии и может быть использовано для получения Zalpha11 лиганда и антител к нему. Zalpha11 лиганд выделяют из библиотеки кДНК, генерированной из активированных клеток периферической крови человека (hPBCs), которые были отобраны на CD3. Zalpha11 лигандом инокулируют животное и получают антитела, которые специфически связываются с эпитопами, пептидами или полипептидами Zalpha11 лиганда. Изобретение позволяет эффективно регулировать пролиферацию и/или развитие гемопоэтических клеток in vitro и in vivo, 11 н. и 7 з.п. ф-лы, 1 ил., 6 табл.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Пролиферация и дифференцировка клеток многоклеточных организмов регулируются гормонами и полипептидными факторами роста. Эти диффундируемые молекулы позволяют клеткам осуществлять коммуникацию друг с другом и действовать совместно для образования клеток, тканей и органов и репарации поврежденной ткани. Примеры гормонов и факторов роста включают в себя стероидные гормоны (например, эстроген, тестостерон), паратиреоидный гормон, фолликулостимулирующий гормон, интерлейкины, тромбоцитарный фактор роста (PDGF), эпидермальный фактор роста (EGF), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), эритропоэтин (ЕРО) и кальцитонин.
Гормоны и факторы роста влияют на клеточный метаболизм путем связывания с рецепторами. Рецепторы могут быть интегральными мембранными белками, которые связаны с путями передачи сигналов в клетке, такими как системы вторичных мессенджеров. Другие классы рецепторов являются растворимыми молекулами, такими как факторы транскрипции.
Цитокины обычно стимулируют пролиферацию и/или дифференцировку клеток гемопоэтической линии дифференцировки или участвуют в механизмах иммунных и воспалительных реакций организма. Примерами цитокинов, которые влияют на гемопоэз, являются эритропоэтин (ЕРО), который стимулирует развитие эритроцитов; тромбопоэтин (ТРО), который стимулирует развитие клеток мегакариоцитарной линии дифференцировки; и гранулоцитарный колониестимулирующий фактор (G-CSF), который стимулирует развитие нейтрофилов. Эти цитокины применимы в восстановлении нормальных уровней клеток крови в пациентах, страдающих от анемии, тромбоцитопении и нейтропении или получающих химиотерапию по поводу рака.
Интерлейкины представляют собой семейство цитокинов, которые опосредуют иммунологические реакции, в том числе воспаление. Интерлейкины опосредуют различные воспалительные патологии. Центральной для иммунной реакции является Т-клетка, которая продуцирует многие цитокины и искусственный (приобретенный) иммунитет к антигенам. Цитокины, продуцируемые Т-клеткой, были классифицированы как цитокины типа 1 и типа 2 (Kelso, A. Immun. Cell Biol. 76:300-317, 1998). Цитокины типа 1 включают в себя IL-2, IFN-γ, LT-α, и участвуют в воспалительных реакциях, противовирусном иммунитете, иммунитете против внутриклеточных паразитов и отторжении трансплантата. Цитокины типа 2 включают в себя IL-4, IL-5, IL-6, IL-10 и IL-13 и участвуют в гуморальных ответах, противогельминтном иммунитете и аллергических реакциях. Общие цитокины между типом 1 и типом 2 включают в себя IL-3, GM-CSF и TNF-α. Существуют доказательства в пользу предположения, что популяции Т-клеток, продуцирующие цитокины типа 1 и типа 2, преимущественно мигрируют в различные типы воспаленной ткани.
Зрелые Т-клетки могут быть активированы, а именно антигеном или другим стимулом, для продуцирования, например, цитокинов, молекул биохимической передачи сигналов или рецепторов, которые дополнительно влияют на судьбу популяции Т-клеток.
В-клетки могут быть активированы через рецепторы на их клеточной поверхности, в том числе рецептор В-клеток, и другие вспомогательные молекулы для выполнения вспомогательных клеточных функций, таких как продуцирование цитокинов.
Природные клетки-киллеры (МК-клетки) имеют общую клетку-предшественник с Т-клетами и В-клетками и играют роль в иммунологическом контроле. NK-клетки, которые содержат до 15% лимфоцитов крови, не экспрессируют рецепторы антигенов и, следовательно, не используют МНС-узнавание в качестве требования для связывания с клеткой-мишенью. NK-клетки участвуют в узнавании и убивании некоторых опухолевых клеток и инфицированных вирусом клеток. Считается что, in vivo МК-клетки требуют активации, однако было показано, что in vitro МК-клетки убивают некоторые типы опухолевых клеток без активации.
Продемонстрированные in vivo активности семейства цитокинов иллюстрируют огромный клинический потенциал и потребность в отношении других цитокинов, агонистов цитокинов и антагонистов цитокинов. Данное изобретение направлено на удовлетворение этих потребностей путем обеспечения нового цитокина, который стимулирует клетки гемопоэтической линии дифференцировки, а также относящихся к нему композиций и способов.
Данное изобретение обеспечивает такие полипептиды для этих и других применений, которые должны быть очевидны лицам с обычной квалификацией в данной области из приведенных здесь описаний.
Чертеж является иллюстрацией множественного сопоставления IL-2 человека, IL-15 человека, zalpha11-лиганда (SEQ ID NO:2), IL-4 человека, IL-4-мыши, GM-CSF человека и GM-CSF мыши.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Перед подробным изложением данного изобретения может быть полезным для его понимания определение следующих терминов:
Термин "аффинная метка" используется здесь для обозначения полипептидного сегмента, который может быть присоединен ко второму полипептиду для обеспечения очистки или детектирования второго полипептида или обеспечения сайтов для присоединения второго полипептида к субстрату. В принципе, любой пептид или белок, для которого доступны антитело или другой агент специфического связывания, может быть использован в качестве аффинной метки. Афинные метки включают в себя полигистидиновый участок (тракт), белок А (Nilsson et al., EMBO J. 4:1075, 1985; Nilsson et al., Methods Enzvmol. 198:3, 1991), глутатион S-трансферазу (Smith and Johnson, Gene 67:31, 1988), аффинную метку Glu-Glu (Grussenmeyer et al., Proc. Natl. Acad. Sci. USA 82:7952-4, 1985), вещество Р, пептид Flag™ (Hopp et al., Biotechnology 6:1204-10, 1988), стрептавидинсвязывающий пептид или другой антигенный эпитоп или связывающий домен. См., в общем, Ford et al., Protein Expression and Purification 2:95-107, 1991. ДНК, кодирующие аффинные метки, доступны от коммерческих поставщиков (например, Pharmacia Biotech, Piscataway, NJ).
Термин "аллельный вариант" используется здесь для обозначения любой из двух или нескольких альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельная вариация возникает природно через мутацию и может приводить к фенотипическому полиморфизму в популяциях. Мутации генов могут быть молчащими (без изменения в кодируемом полипептиде) или могут кодировать полипептиды, имеющие измененную аминокислотную последовательность. Термин аллельный вариант используется здесь также для обозначения белка, кодируемого аллельным вариантом гена.
Термины "амино-концевой" и "карбоксил-концевой" используются здесь для обозначения положений внутри полипептидов. Там, где позволяет контекст, эти термины используются со ссылкой на конкретную последовательность или часть полипептида для обозначения близости или относительного положения. Например, некоторая последовательность, расположенная карбоксил-терминально относительно ссылочной последовательности в полипептиде, расположена проксимально относительно карбоксил-конца ссылочной последовательности, но не обязательно находится при карбоксил-конце полного полипептида.
Термин "пара комплемент/антикомплемент" обозначает неидентичные части молекулы, которые образуют нековалентно связанную, стабильную пару при подходящих условиях. Например, биотин и авидин (или стрептавидин) являются членами-прототипами пары комплемент/антикомплемент. Другие примеры пар комплемент/антикомплемент включают в себя пары рецептор/лиганд, пары антитело/антиген (или гаптен, или зпитоп), пары смысловой/антисмысловой полинуклеотид и т.п. В случае, когда желательна последующая диссоциация пары комплемент/антикомплемент, пара комплемент/антикомплемент предпочтительно имеет аффинность связывания <109 М-1.
Термин "комплементы полинуклеотидной молекулы" обозначает полинуклеотидную молекулу, имеющую комплементарную последовательность оснований и обращенную ориентацию в сравнении со ссылочной последовательностью. Например, последовательность 5'-ATGCACGGG-3' комплементарна 5'-CCCGTGCAT-3'.
Термин "вырожденная нуклеотидная последовательность" обозначает последовательность нуклеотидов, которая включает в себя один или более вырожденных кодонов (в сравнении со ссылочной полинуклеотидной молекулой, которая кодирует полипептид). Вырожденные кодоны содержат различные триплеты нуклеотидов, но кодируют один и тот же аминокислотный остаток (т.е. триплеты GAU и GAC, каждый, кодируют Asp).
Термин "экспрессирующий вектор" используется для обозначения молекулы ДНК, линейной или кольцевой, которая содержит сегмент, кодирующий представляющий интерес полипептид, функционально связанный с дополнительными сегментами, которые обеспечивают его транскрипцию. Такие дополнительные элементы включают в себя промоторную и терминаторную последовательности и могут также включать в себя одну или несколько точек начала репликации, один или несколько селектируемых маркеров, энхансер, сигнал полиаденилирования и т.д. Экспрессирующие векторы обычно произведены из плазмидной или вирусной ДНК или могут содержать элементы обеих.
Термин "выделенный" в применении к полинуклеотиду обозначает, что этот полинуклеотид был удален из его природной генетической среды и, следовательно, не содержит других посторонних или нежелательных кодирующих последовательностей и находится в форме, подходящей для применения в генетически сконструированных системах продуцирования белков. Такие выделенные молекулы являются молекулами, которые выделены из их природного окружения и включают в себя кДНК-клоны и геномные клоны. Выделенные молекулы ДНК данного изобретения не содержат других генов, с которыми они обычно связаны, но могут включать в себя природно встречающиеся 5'- и 3'-нетранслируемые районы, такие как промоторы и терминаторы. Идентификация связанных районов будет очевидной лицу с обычной квалификацией в данной области (см., например, Dynan and Tijan, Nature 316:774-78, 1985).
"Выделенным" полипептидом или белком является полипептид или белок, который обнаруживается в условиях, иных, чем его природное окружение, например, отдельно от крови и ткани животного. В предпочтительной форме выделенный полипептид является по существу не содержащим других полипептидов, в частности других полипептидов животного происхождения. Предпочтительно обеспечение полипептидов в высокоочищенной форме, т.е. имеющих чистоту более 95%, более предпочтительно чистоту более 99%. При использовании в этом контексте термин "выделенный" не исключает присутствия того же самого полипептида в альтернативных физических формах, таких как димеры или альтернативно гликозилированные или дериватизованные формы.
Термин "неопластический" при применении к клеткам указывает клетки, подвергающиеся новой и отклоняющейся от нормы пролиферации, в частности, в ткани, где эта пролиферация является неконтролируемой и прогрессирующей, приводящей к неоплазме (новообразованию, т.е. опухоли). Неопластические (относящиеся к опухоли) клетки могут быть либо злокачественными, т.е. инвазивными и метастатическими, либо доброкачественными.
Термин "функционально (операбельно) связанные", при ссылке на ДНК-сегменты, указывает, что эти сегменты расположены таким образом, что они функционируют совместно для их предполагаемых целей, например, транскрипция инициируется в промоторе и протекает через кодирующий сегмент до терминатора.
Термин "ортолог" обозначает полипептид или белок, полученный из одного вида, который является функциональной копией полипептида или белка из другого вида. Различия последовательностей среди ортологов являются результатом видообразования.
"Паралоги" являются отличающимися, но структурно родственными белками, производимыми организмом. Считается, что паралоги возникают в результате дупликации генов. Например, α-глобин, β-глобин и миоглобин являются паралогами друг друга.
Термин "полинуклеотид" обозначает одно- или двухцепочечный полимер дезоксирибонуклеотидных или рибонуклеотидных оснований, считываемых от 5'-конца к 3'-концу. Полинуклеотиды включают в себя РНК и ДНК и могут быть изолированы из природных источников, синтезированы in vitro или получены из комбинации природных и синтетических молекул. Размеры полинуклеотидов выражаются как пары нуклеотидов (сокращенно "п.н."), нуклеотиды ("нт") или тысячи пар нуклеотидов ("т.п.н."). Там, где позволяет контекст, два последние термина могут описывать полинуклеотиды, которые являются одноцепочечными или двухцепочечными. При применении этого термина к двухцепочечным молекулам его используют для обозначения общей длины, и должно быть понятно, что он является эквивалентным термину "пары нуклеотидов". Специалистам в данной области будет понятно, что две цепи двухцепочечного полинуклеотида могут слегка отличаться по длине и что их концы могут быть расположены зигзагами в результате ферментативного расщепления; таким образом, не все нуклеотиды в двухцепочечной полинуклеотидной молекуле могут быть спаренными.
"Полипептид" является полимером аминокислотных остатков, соединенных пептидными связями, получен ли он природным путем или синтетическим путем. Полипептиды, имеющие менее приблизительно 10 аминокислотных остатков, обычно называют "пептидами".
Термин "промотор" используется здесь в его признанном в данной области значении для обозначения части гена, содержащей последовательности ДНК, которые обеспечивают связывание РНК-полимеразы и инициацию транскрипции. Промоторные последовательности обнаруживаются обычно, но не всегда, в 5'-некодирующих районах генов.
"Белок" обозначает макромолекулу, содержащую одну или несколько полипептидных цепей. Белок может включать в себя также непептидные компоненты, такие как углеводные группы. Углеводы и другие непептидные компоненты могут быть присоединены к белку клеткой, в которой продуцируется данный белок, и будут варьироваться в зависимости от типа клетки. Белки определены здесь в терминах их аминокислотных каркасных структур; заместители, такие как углеводные группы, обычно не указаны, но тем не менее они могут присутствовать.
Термин "рецептор" используется здесь для обозначения связанного клеткой белка, который связывается с биоактивной молекулой ("лигандом") и медиирует действие этого лиганда на клетку. Мембраносвязанные рецепторы характеризуются мультипептидной структурой, содержащей внеклеточный лиганд связывающий домен и внутриклеточный домен, который обычно участвует в передаче сигнала. Связывание лиганда с рецептором приводит к конформационному изменению в рецепторе, которое вызывает взаимодействия между эффекторным доменом (доменами) и другой молекулой (молекулами) в клетке. Эти взаимодействия, в свою очередь, приводят к изменениям в метаболизме клетки. Метаболические события, связанные с взаимодействиями рецептор-лиганд, включают в себя транскрипцию генов, фосфорилирование, дефосфорилирование, увеличения продуцирования циклического АМФ, мобилизацию клеточного кальция, мобилизацию мембранных липидов, клеточную адгезию, гидролиз инозитлипидов и гидролиз фосфолипидов. Обычно рецепторы могут быть мембраносвязанными, цитозольными или ядерными; мономерными (например, рецептор тиреоидстимулирующего гормона, рецептор β-адренергического гормона) или мультимерными (например, PDGF-рецептор, рецептор гормона роста, IL-3-рецептор, GM-CSF-рецептор, G-CSF-рецептор, рецептор эритропоэтина и IL-6-рецептор).
Термин "секреторная сигнальная последовательность" обозначает здесь последовательность ДНК, которая кодирует полипептид ("секреторный полипептид"), который как компонент большего полипептида направляет этот больший полипептид через секреторный путь клетки, в которой он синтезируется. Этот больший полипептид обычно расщепляется с удалением секреторного пептида во время прохождения через этот секреторный путь.
Термин "сплайсинговый вариант" используется здесь для обозначения альтернативных форм РНК, транскрибированных из гена. Сплайсинговая вариация возникает природно посредством использования альтернативных сайтов сплайсинга в транскрибируемой молекуле РНК или менее обычно между раздельно транскрибируемыми молекулами РНК и может приводить к нескольким мРНК, транскрибируемым из одного и того же гена. Сплайсинговые варианты могут кодировать полипептиды, имеющие измененную аминокислотную последовательность. Термин сплайсинговый вариант используют здесь также для обозначения белка, кодируемого сплайсинговым вариантом мРНК, транскрибируемым из гена.
Должно быть понятно, что молекулярные массы и длины полимеров, определяемые неточными аналитическими методами (например, гель-электрофорезом), являются приблизительными величинами. Когда такая величина выражается как "около" Х или "приблизительно" X, указанная величина Х должна пониматься как величина, определенная в точностью до ±10%.
Все цитируемые здесь ссылки включены в качестве ссылки в полном виде.
Данное изобретение основано частично на открытии новой последовательности ДНК, которая кодирует белок, имеющий структуру имеющего четырехспиральный пучок цитокина. Посредством способов клонирования, анализов пролиферации и исследований связывания, описанных подробно здесь, была идентифицирована полинуклеотидная последовательность, кодирующая новый лигандный полипептид, т.е. лиганд с высокой специфичностью в отношении ранее описанного orphan ("сирота")-рецептора zalpha11. Этот полипептидный лиганд, названный zalpha11-лигандом, был выделен из библиотеки кДНК, генерированной из активированных клеток периферической крови человека (hPBCs), которые были отобраны на CD3. CD3 является маркером клеточной поверхности, уникальным для клеток лимфоидного происхождения, в частности, Т-клеток.
В приведенных ниже примерах, линию клеток, которая является зависимой от связанного с orphan-рецептором zalpha11 пути для выживания и роста клеток в отсутствие других факторов роста, использовали для скрининга на источник кДНК, кодирующей zalpha11-лиганд. Предпочтительной зависимой от факторов роста клеточной линией, которую использовали для трансфекции и экспрессии рецептора zalpha11, была линия BaF3 (Palados and Steinmetz, Cell 41:727-734, 1985; Mathey-Prevot et al., Mol. Cell. Biol. 6:4133-4135, 1986). Однако другие зависимые от факторов роста клеточные линии, такие как FDC-P1 (Hapel et al., Blood 64:786-790, 1984) и M07e (Kiss et al., Leukemia 7:235-240. 1993), являются пригодными для этой цели.
Аминокислотная последовательность для zalpha11-рецептора показала, что этот кодируемый рецептор принадлежит к подсемейству рецепторов цитокинов Класса I, которое включает в себя, но не ограничивайся ими, рецепторы для IL-2, IL-4, IL-7, IL-15, ЕРО, ТРО, GM-CSF и G-CSF (Обзор см. в Cosman, "The Hematopoietin Receptor Superfamily" in Cytokine 5(2):95-106, 1993). Zalpha11-рецептор полно описан в патентной заявке РСТ совместного владения с номером US99/22149. Анализ тканевого распределения мРНК zalpha11-рецептора показал экспрессию в лимфатическом узле, лейкоцитах периферической крови (PBL), селезенке, костном мозгу и вилочковой железе (тимусе). Кроме того, эта мРНК была обильной в линии клеток Raji (ATCC No. CCL-86), полученной из лимфомы Беркитта. Тканевое распределение этого рецептора предполагает, что мишенью для предсказанного zalpha11-лиганда являются клетки гемопоэтического происхождения, в частности лимфоидные клетки-предшественники и лимфоидные клетки. Другие имеющие структуру четырехспирального пучка цитокины, которые действуют на лимфоидные клетки, включают в себя IL-2, IL-4, IL-7 и IL-15. В отношении обзора имеющих структуру четырехспирального пучка цитокинов см. Nicola et al., Advances in Protein Chemistry 52:1-65, 1999 и Kelso, A., Immunol. Cell BjoL76:300-317, 1998.
Кондиционированные среды (КС) отобранных на CD3+, ФМА/Иономицин-стимулированных клеток периферической крови человека поддерживали рост клеток BaF3, которые экспрессировали zalpha11-рецептор и были в ином случае зависимыми от IL-3. Кондиционированные среды из клеток, которые не были 1) ФМА/Иономицин-стимулированными; или не были 2) CD3 отобранными (с ФМА/Иономицин-стимуляцией или без нее), не поддерживали рост клеток BaF3/zalpha11-рецептор. Контрольные эксперименты показали, что эта пролиферативная активность не была связана с другими известными факторами роста и что способность таких кондиционированных сред стимулировать пролиферацию экспрессирующих zalpha11-рецептор клеток могла быть нейтрализована растворимой формой этого рецептора.
Пролиферацию zalpha11-рецептор-экспрессирующих клеток BaF3, подвергнутых воздействию КС (кондиционированной среды) от CD3+ отобранных ФМА/Иономицин-стимулированных клеток периферической крови человека, идентифицировали визуальным обследованием культур и/или анализом пролиферации. Многочисленные подходящие анализы пролиферации известны в данной области и они включают в себя анализы на уменьшение красителя, такого как alamarBlue™ (AccuMed International, Inc. Westlake, Ohio), 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид (Mosman, J. Immunol. Meth. 65:55-63. 1983); 3- (4,5-диметилтиазол-2-ил)-5-3-карбоксиметоксифенил-2Н-тетразолий; 2,3-бис(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)карбонил]-2Н-тетразолийгидроксид и цианодитолилтетразолийхлорид (которые являются коммерчески доступными из Polysciences, Inc., Warrington, PA); анализы митогенеза, такие как, например, измерение включения 3H-тимидина; анализы вытеснения красителя, использующие, например, красители нафталиновый черный или трипановый синий; поглощение красителя с использованием диацетилфлуоресцеина; и высвобождение хрома. См. в общем, Freshney, Culture of Animal Cells: A Manual of Basic Technique. 3rd ed., Wiley-Liss, 1994, включ. здесь в качестве ссылки.
Библиотеку кДНК получали из CD3+ отобранных ФМА/Иономицин-стимулированных клеток периферической крови человека. Библиотеку кДНК CD3+ отобранных ФМА/Иономицин-стимулированных клеток периферической крови человека делили на пулы, содержащие множественные молекулы кДНК, и трансфицировали в линию клеток-хозяев, например, в клетки ВНК 570 (АТСС accession no. 10314). Трансфицированные клетки-хозяева культивировали в среде, которая не содержала экзогенных факторов роста, и кондиционированную среду собирали. Кондиционированные среды анализировали на способность стимулировать пролиферацию клеток BaF3, трансфицированных zalpha11-рецептором. Были идентифицированы пулы кДНК, продуцирующие кондиционированную среду, которая стимулировала клетки BaF3/zalpha11-рецептор. Эту объединенную плазмидную кДНК электропорировали в Е.coli. кДНК выделяли из одиночных колоний и трансфицировали индивидуально в клетки ВНК 570. Положительные клоны идентифицировали по положительному результату в анализе пролиферации клеток ВаР3/zаlрhа11-рецептор и специфичность испытывали нейтрализацией пролиферации с использованием растворимого zalpha11-рецептора.
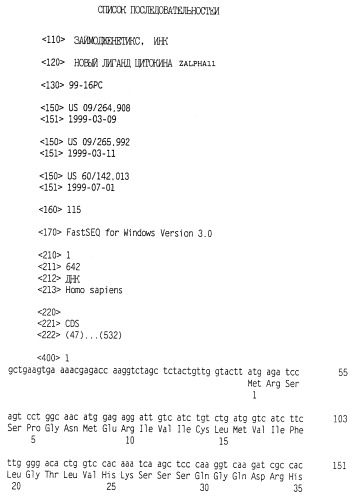
Положительные клоны выделяли, и анализ секвенирования выявил, что полинуклеотидная последовательность, содержащаяся в этой плазмидной ДНК, была новой. Секреторная сигнальная последовательность состоит из аминокислотных остатков 1 (Met) - 31 (Gly), а зрелый полипептид состоит из аминокислотных остатков 32 (Gln) - 162 (Ser) (как показано в SEQ ID NO:2).
Обычно прогнозируется, что цитокины имеют структуру, состоящую из четырех альфа-спиралей, причем спирали А, С и D являются наиболее важными во взаимодействиях лиганд-рецептор и являются более высококонсервативными среди членов этого семейства. Со ссылкой на аминокислотную последовательность zalpha11-лиганда человека, показанную в SEQ ID NO:2, сопоставление аминокислотных последовательностей zalpha11-лиганда человека, IL-15 человека, IL-4 человека и GM-CSF человека, прогнозируется, что спираль А zalpha11-лиганда определяется аминокислотными остатками 41-56; спираль В аминокислотными остатками 69-84; спираль С аминокислотными остатками 92-105 и спираль D аминокислотными остатками 135-148; показанными в SEQ ID NO:2. Структурный анализ предполагает, что А/В-петля является длинной, В/С-петля является короткой и C/D-петля является параллельно длинной. Эта структура петель приводит к спиральной организации вверх-вверх-вниз-вниз. Остатки цистеина являются абсолютно консервативными между zalpha11-лигандом и IL-15, как показано на чертеже. Остатки цистеина, которые являются консервативными между IL-15 и zalpha11-лигандом, соответствуют аминокислотным остаткам 71, 78, 122 и 125 SEQ ID NO:2. Сохранение некоторых остатков цистеина обнаружено также в IL-2, IL-4, GM-CSF и zalpha11-лиганде, соответствующих аминокислотным остаткам 78-125 SEQ ID NO:2, как показано на чертеже. Совпадающее расположение цистеинов является дополнительным подтверждением структуры четырехспирального пучка. Также высококонсервативной в этом семействе, содержащем IL-15, IL-2, IL-4, GM-CSF и zalpha11-лиганд, является последовательность Glu-Phe-Leu, показанная в SEQ ID NO:2 в остатках 136-138 на чертеже.
Последующий анализ zalpha11-лиганда на основе множественных сопоставлений (показанных на чертеже) прогнозирует, что аминокислотные остатки 44, 47 и 135 (показанные в SEQ ID NO:2) играют важную роль в связывании zalpha11-лиганда с его родственным рецептором. Кроме того, предсказанная аминокислотная последовательность мышиного zalpha11-лиганда обнаруживает 57% идентичность с предсказанным белком человека. На основе сравнения последовательностей zalpha11-лиганда человека и мыши хорошо сохраненные остатки были обнаружены в районах, предсказанных для кодирования альфа-спиралей А и D. Соответствующие полинуклеотиды, кодирующие районы, домены, мотивы, остатки и последовательности zalpha11-лиганда, описанные здесь, показаны в SEQ ID NO:1.
Подробный мутационный анализ проводили для IL-4 и IL-2, оба из которых являются высокородственными zalpha11-лиганду. Анализ мышиного IL-2 (Zurawski et al., EMBO J. 12:5113-5119, 1993) показывает, что остатки в спиралях А и С являются важными для связывания с IL-2Rβ; критическими остатками являются Asp34, Asn99 и Asn103. Многочисленные остатки в петле А/В мышиного IL-2 и спираль В являются важными для связывания IL-2Rα, тогда как только единственный остаток, Gln141 в спирали D, является очень важным для связывания с IL-2Rα. Подобным образом, спирали А и С являются сайтами взаимодействия между IL-4 и IL-4Rα (структурно сходным с IL-2Rα), а остатки в спирали D являются существенными для взаимодействия IL-2Rα (Wang et al., Proc. Natl. Acad. Sci. USA 94:1657-1662, 1997; Kruse et al., EMBQ.J. 11:3237-3244, 1992). В частности, мутация Tyr124 в Asp в IL-4 человека создает антагонист, который связывается с IL-4Rα, но не с IL-2Rα и, следовательно, не может передавать сигнал (Kruse et al. ibid. 1992).
В то время как спираль А является относительно хорошо сохраненной между человеческим и мышиным zalpha11-лигандом, спираль С является более расходящейся. Хотя оба вида имеют преобладающие кислые аминокислоты в этом районе, эти различия могут быть ответственными за видовую специфичность взаимодействия между zalpha11-лигандом и его рецептором "β"-типа, zalpha11. Петля А/В и спираль В zalpha11-лиганда являются вполне консервативными между видами; хотя субъединица рецептора, соответствующая IL-2Rα, еще не была идентифицирована, консервативность в этом районе предполагает, что она является функционально значимой. D-спирали человеческого и мышиного zalpha11-лиганда являются также высококонсервативными. Антагонисты zalpha11-рецептора могут быть сконструированы через мутации в спирали D zalpha11-лиганда. Они могут включать в себя укорочение этого белка от остатка Gln145 (SEQ ID NO:2) или мутации Gln145 или lle148 (SEQ ID NO:2; соответствующего Tyr124 в IL-4 человека) в остатки, такие как Ala или Asp. Любая мутация, которая разрушает спиральную структуру zalpha11-лиганда, может устранять связывание его рецептора и, следовательно, ингибировать передачу сигнала.
Цитокины со структурой четырехспирального пучка группируют также по длине их компонентов-спиралей. Цитокины "длинноспиральной" формы обычно состоят из спиралей из 24-30 остатков и включают в себя IL-6, цилиарный нейротрофический фактор (CNTF), ингибирующий лейкоз фактор (LIF) и гормон роста человека (hGH). Цитокины "короткоспиральной" формы обычно состоят из спиралей из 18-21 остатков и включают в себя IL-2, IL-4 и GM-CSF. Авторы считают, что zalpha11-лиганд является новым членом группы цитокинов короткоспиральной формы. Исследования с использованием CNTF и IL-6 показали, что спираль CNTF может заменять эквивалентную спираль в IL-6, придавая этой химере свойства связывания CNTF. Таким образом, функциональные домены четырехспиральных цитокинов, по-видимому, определяются на основе структурной гомологии независимо от идентичности последовательности и могут сохранять функциональную целостность в химере (Kallen et al., J. Biol. Chem. 274:11859-11867, 1999). Таким образом, спиральные домены zalpha11-лиганда будут применимы для получения химерных слитых молекул, в частности, с другими цитокинами короткоспиральной формы, для определения и модулирования специфичности связывания рецептора. Особый интерес представляют слитые (гибридные) белки, сконструированные со спиралью А и/или спиралью D, или слитые белки, которые объединяют спиральный и петлевой домены из других цитокинов короткоспиральной формы, таких как IL-2, IL-4, IL-15 и GM-CSF. Аминокислотные остатки, составляющие спирали А, В, С и D и петли А/В, В/С и C/D, для zalpha11-лиганда, IL-2, IL-4, IL-15 и GM-CSF показаны в таблице 1.
| Таблица 1 | ||||||||
| Спираль | Петля | Спираль | Петля | Спираль | Петля | Спираль | D | |
| А | А/В | В | В/С | С | C/D | |||
| Остатки zalpha11-лиганда | 41-56 | 57-68 | 69-84 | 85-91 | 92-105 | 106-134 | 135-148 | SEQ ID №:2 |
| Остатки IL-2 | 36-46 | 47-52 | 53-75 | 76-86 | 87-99 | 100-102 | 103-121 | SEQ ID №:111 |
| Остатки IL-4 | 29-43 | 44-64 | 65-83 | 84-94 | 95-118 | 119-133 | 134-151 | SEQ ID №112 |
| Остатки IL-15 | 45-68 | 69-83 | 84-101 | 102-106 | 107-119 | 120-133 | 134-160 | SEQ ID №113 |
| Остатки GM-CSF | 30-44 | 45-71 | 72-81 | 82-90 | 91-102 | 103-119 | 120-131 | SEQ ID №114 |
Данное изобретение обеспечивает полинуклеотидные молекулы, в том числе молекулы ДНК и РНК, которые кодируют описанные здесь полипептиды zalpha11-лиганда. Специалистам в данной области будет понятно, что в связи с вырожденностью генетического кода возможна значительная вариация среди этих полинуклеотидных молекул. SEQ ID NO:3 является вырожденной последовательностью ДНК, которая включает в себя все ДНК, которые кодируют полипептид zalpha11-лиганда SEQ ID NO:2. Специалистам в данной области будет понятно, что вырожденная последовательность SEQ ID NO:3 обеспечивает также все последовательности РНК, кодирующие SEQ ID NO:2, путем замены U (урацилом) Т (тимина). Таким образом, кодирующие полипептид zalpha11-лиганда полинуклеотиды, содержащие район от нуклеотида 1 или 97 до нуклеотида 486 SEQ ID NO:3, и их РНК-эквиваленты рассматриваются данным изобретением. Таблица 2 дает однобуквенные коды, используемые в SEQ ID NO:3 для обозначения положений вырожденных нуклеотидов. "Разрешения" представляют собой нуклеотиды, обозначенные кодовой буквой. "Комплемент" указывает код для комплементарного нуклеотида (комплементарных нуклеотидов). Например, код Y обозначает либо С, либо Т, а его комплемент R обозначает А или G, причем А является комплементарным Т, а G является комплементарным С.
| ТАБЛИЦА 2 | |||
| Нуклеотид | Разрешение | Комплемент | Разрешение |
| А | А | Т | Т |
| С | С | G | G |
| G | G | С | С |
| Т | Т | А | А |
| R | A|G | Y | С|Т |
| Y | С|Т | R | A|G |
| М | А|С | К | G|T |
| К | G|T | М | А|С |
| S | C|G | S | C|G |
| W | А|Т | W | А|Т |
| Н | А|С|Т | D | A|G|T |
| В | C|G|T | V | A|C|G |
| V | A|C|G | В | C|G|T |
| D | A|G|T | Н | A|C|T |
| N | A|C|G|T | N | A|C|G|T |
Вырожденные кодоны, используемые в SEQ ID NO:3, включающие в себя все возможные кодоны для конкретной аминокислоты, представлены в таблице 3.
| ТАБЛИЦА 3 | |||
| Аминокислота | Однобуквенный код | Кодоны кодон | Вырожденный |
| Cys | С | TGC TGT | TGY |
| Ser | S | AGC AGT ТСА ТСС TCG ТСТ | WSN |
| Thr | Т | АСА АСС ACG ACT | ACN |
| Pro | Р | ССА ССС CCG ССТ | CCN |
| Ala | А | GCA GCC GCG GCT | GCN |
| Gly | G | GGA GGC GGG GGT | GGN |
| Asn | N | ААС ААТ | AAY |
| Asp | D | GAC GAT | GAY |
| Glu | Е | GAA GAG | GAR |
| Gln | Q | САА CAG | CAR |
| Hls | Н | САС CAT | CAY |
| Arg | R | AGA AGG CGA CGC CGG CGT | MGN |
| Lys | К | AAA AAG | AAR |
| Met | М | ATG | ATG |
| Ile | I | ATA ATC ATT | ATH |
| Leu | L | СТА CTC CTG CTT TTA TTG | YTN |
| Val | V | GTA GTC GTG GTT | GTN |
| Phe | F | TTC TTT | TTY |
| Туг | Y | TAC TAT | TAY |
| Trp | W | TGG | TGG |
| Ter | . | TAA TAG TGA | TRR |
| Asn|Asp | В | RAY | |
| Glu|Gln | Z | SAR | |
| Any | Х | NNN |
Специалисту с обычной квалификацией в данной области будет понятно, что некоторая двусмысленность вводится в определение вырожденного кодона, представляющего все возможные кодоны, кодирующие каждую аминокислоту. Например, вырожденный кодон для серина (WSN) может в некоторых обстоятельствах кодировать аргинин (AGR), а вырожденный кодон для аргинина (MGN) может в некоторых обстоятельствах кодировать серин (AGY). Сходная взаимосвязь существует между кодонами, кодирующими фенилаланин и лейцин. Таким образом, некоторые полинуклеотиды, охватываемые вырожденной последовательностью, могут кодировать вариантные аминокислотные последовательности, но специалист с обычной квалификацией в данной области может легко идентифицировать такие вариантные последовательности сравнением с аминокислотной последовательностью SEQ ID NO:2. Вариантные последовательности могут быть легко тестированы на функциональность, как описано здесь. Так, предложена полинуклеотидная молекула, где указанные нуклеотиды являются такими, как показано в SEQ ID NO:3 от нуклеотида 121 до нуклеотида 444 или от нуклеотида 94 до нуклеотида 486.
Специалисту с обычной квалификацией в данной области будет также понятно, что различные виды могут проявлять "предпочтительное (преферентивное) использование кодонов". В общем, см., Grantham, et al., Nuc. Acids Res. 8:1893-912, 1980; Haas, et al., Curr. Biol. 6:315-24, 1996; Wain-Hobson, et al., Gene 13: 355-64, 1981; Grosjean and Fiers, Gene 18:199-209, 1982; Holm. Nuc. Adds Res. 14:3075-87, 1986; Ikemura, J. Mol. Biol. 158:573-97, 1982. В применении здесь термин "предпочтительное (преферентивное) использование кодонов" или "предпочтительные (преферентивные) кодоны" является термином данной области, относящимся к кодонам трансляции белка, которые наиболее часто используются в клетках определенных видов, отдавая, следовательно, предпочтение одному или немногим представителям возможных кодонов, кодирующих каждую аминокислоту (См. таблицу 3). Например, аминокислота треонин (Thr) может кодироваться АСА, АСС, ACG или ACT, но в клетках млекопитающих наиболее обычно используемым кодоном является АСС; в других видах, например, в клетках насекомых, дрожжей, вирусов или бактерий, могут быть предпочтительными другие кодоны Thr. Предпочтительные кодоны для конкретных видов могут быть введены в полинуклеотиды данного изобретения различными способами, известными в данной области. Введение предпочтительных последовательностей кодонов в рекомбинантную ДНК может, например, усиливать продуцирование этого белка, делая трансляцию белка более эффективной в конкретном типе клеток или виде. Таким образом, вырожденная последовательность кодонов, описанная в SEQ ID NO:3, служит в качестве матрицы для оптимизации экспрессии полинуклеотидов в различных типах клеток и видах, обычно используемых в данной области и описанных здесь. Последовательности, содержащие предпочтительные кодоны, могут быть тестированы и оптимизированы для экспрессии в различных видах и тестированы на функциональность, как описано здесь.
Как отмечалось ранее, выделенные полинуклеотиды данного изобретения включают в себя ДНК и РНК. Способы выделения ДНК и РНК хорошо известны в данной области. Обычно РНК выделяют из ткани или клетки, которая продуцирует большие количества РНК zalpha11-лиганда. Такие ткани и клетки идентифицируют Нозерн-блоттингом (Thomas, Proc. Natl. Acad. Sci. USA 77:5201, 1980) или скринингом кондиционированной среды от различных типов клеток на активность на клетках- или тканях-мишенях. Как только эта активность или продуцирующая РНК клетка или ткань идентифицирована, тотальная РНК может быть получена с использованием экстракции изотиоцианатом гуанидиния с последующим выделением центрифугированием в градиенте CsCl (Chirgwin et al., Biochemistry 18:52-94, 1979). Поли(А)+ РНК получают из тотальной РНК с использованием способа Aviv and Leder, Proc. Natl. Acad. Sci. USA 69:1408-1412 (1972). Комплементарную ДНК (кДНК) получают из пол(А)+ РНК при помощи известных способов. Альтернативно, может быт