Способ прогнозирования тяжести абдоминального сепсиса
Иллюстрации
Показать всеИзобретение относится к медицине и предназначено для прогнозирования тяжести абдоминального сепсиса. Регистрируют омега-потенциал. При его значениях от -14 до +20 мВ определяют возможность развития септического шока с последующей полиорганной недостаточностью. При значениях омега-потенциала от -26 и ниже - определяют риск развития сепсиса или тяжелого сепсиса с умеренной органной дисфункцией. При показателях омега-потенциала от -15 до -26 мВ определяют средне-тяжелое клиническое течение - синдром системного воспалительного ответа. Способ позволяет повысить эффективность прогнозирования тяжести абдоминального сепсиса. 2 табл., 4 ил.
Реферат
Изобретение относится к медицине, а именно к анестезиологии-реаниматологии и хирургии, и может быть использовано для прогнозирования тяжести течения септического процесса.
Сепсис, в связи с тенденцией к росту в последние годы, рассматривается как самостоятельная проблема. Сегодня причины сепсиса отнюдь нельзя свести к санитарно-эпидемиологическим недоработкам в хирургическом стационаре. Напротив, проблема наиболее остро стоит в ведущих современных клиниках Европы, США и Японии, поскольку именно там концентрируются пациенты группы высокого риска и выполняются оперативные вмешательства при таких заболеваниях, которые совсем недавно считались неоперабельными.
Определение сепсиса (С), тяжелого сепсиса (ТС), септического шока (СШ) и системной воспалительной реакции (СВО), предложенные R.C.Bone, были приняты на Согласительной конференции по сепсису в 1992 году [Bone R.C., 1992.] и продолжают использоваться по сей день [Mitchell M.L., et al., 2003].
Источники тяжелого сепсиса можно разделить на "первичные", при этом на первом месте оказалась пневмония - 44-53%, смертность при которой составляет 56%, на втором месте - нагноительные процессы брюшной полости (9-11%) [Alberti С. et al., 2003]. Источником "вторичного" сепсиса также преимущественно служит пневмония (58,3%) на фоне длительной ИВЛ [Angus D.C, Wax R.S., 2001]. Септический шок - одна из частых причин летальных исходов в отделениях интенсивной терапии и реанимации хирургических стационаров [Alberti С. et al., 2003]. Так, по данным статистики США, из всей клинической мозаики сепсиса, ежегодно диагностируется 46-82% септического шока и 16-56% тяжелого сепсиса, при этом летальность составляет 16-50% [Salvo I. et al., 1995; Rangel-Frausto M.S. et al., 1995; Alberti C. et al., 2003]. При этом большинство авторов считают, что если СШ является самым угрожающим для жизни состоянием при сепсисе, то самым неблагоприятным исходом шока является синдром полиорганной недостаточности (СПОН) [Белобородова Н.В., Бачинская Е.Н., 2000].
Причины изменения и перехода СШ в СПОН лежат на клеточном уровне и обусловлены дефицитом кровоснабжения и нарушениями циркуляции в самих органах. Это ведет к нарушению транспортной функции клеточных мембран, повышению их проницаемости и возрастанию энергетических потребностей клетки. Описанные изменения могут быть обратимыми, если применение интенсивных мероприятий позволяет своевременно разорвать порочный круг. В связи с этим главная цель проводимой терапии направлена на быструю стабилизацию органных функций за счет оптимизации доставки и потребления кислорода и энергетических потребностей, обеспечение адекватного венозного и лимфатического оттока [Takala A. et al., 1999].
Несмотря на значительный прогресс в интенсивной медицине, множественные органные повреждения остаются основной причиной неблагоприятных исходов у больных, перенесших критические состояния [Poeze M, Ramsay G, 1997]. При этом до последнего десятилетия отмечалась лишь тенденция к уменьшению летальности у таких пациентов [Fry D.E., 1992; Mitchell M.L. et al., 2003]. Неудовлетворительные результаты реализации современных программ комплексного лечения расстройств обусловлены целым рядом причин не только технического, но и стратегического плана. В этой связи, очевидно, что поиск критериев, позволяющих не столько мониторировать, как прогнозировать возможность развития таких осложнений, является крайне востребованным.
Аналог 1.
Известен способ диагностики и прогнозирования сепсиса, основанный на определении биомаркеров [Taniguchi Т. et al., 1999; Ueda S. et al., 1999; Stoiser В. et al., 1998; Takala A. et al., 1999]. Действительно, попытка связать сепсис или его стадию с конкретным маркером, определяемым лабораторным путем, до сих пор остается заманчивой. Требования к такому маркеру достаточно серьезные: он должен воспроизводить воспаление и интоксикацию в эксперименте, оценивая их количественно и качественно. Вышеупомянутые исследования показали повышение уровня циркулирующего интерлейкина (I1-6), адреномедулина, растворимых CD 14, ELAM-1, MIP-1α, внеклеточной фосфолипазы А2 и С - реактивного белка у пациентов, попадающих под критерии ССВО. Однако огромное разнообразие индикаторных веществ и их сочетаний затрудняют выделение таких маркеров, а стоимость проведения этих анализов достаточно высока. Кроме того, до сегодняшнего дня, ни одно из представленных исследований не имело необходимой доказательной базы [Mitchell M.L., et al., 2003].
Аналог 2.
В 1992 г. Конференция согласия ACCP/SCCM под руководством Roger С. Bone определила критерии ССВО (SIRS), сепсиса (ССВО плюс инфекция), тяжелого сепсиса (сепсис, связанный с дисфункцией органов, гипоперфузией или гипотонией) и септического шока (сепсис с артериальной гипотонией, развивающейся несмотря на адекватное восполнение ОЦК). В силу того, что вышеуказанная классификация и диагностические критерии, опубликованные более десяти лет назад, неоднократно публиковались и хорошо известны широкому кругу специалистов, мы не приводим их здесь. Не отрицая ее колоссального значения и доминирующего положения, на сегодняшний день, в методологии постановки диагноза, следует признать, что она так же не лишена определенных недостатков. Так, результаты недавних исследований [Marshall J.C., 2000; Vincent J.-L., 1997] показали необходимость пересмотреть и изменить определения 1992 г., чтобы лучше отразить существующее понимание патофизиологии этих синдромов.
Европейское Общество Интенсивной Медицины (ESICM/SCCM), проведя обзор, касающийся определения сепсиса, отметило, что 71% респондентов не процитировали никакого общего определения сепсиса [Ramsay G. et al., 2003]. Из недостатков также можно отметить, что система допускает наслаивание пациентов с риском неблагоприятного исхода с больными у которых компенсаторные возможности организма еще состоятельны [Mitchell M. et al., 2003]. Как и любая другая система классификации тяжести состояния, она констатирует факт развившегося осложнения, а не прогноз его развития.
Прототип.
Оценка потребления тканями кислорода и их потребность в нем могут использоваться для прогноза тяжести патологического процесса. Известно, что кроме общепринятых критериев кислородного баланса: sO2 и pO2 артериальной и смешанной венозной крови, необходимо динамическое исследование концентрации лактата, быстро увеличивающейся в условиях дефицита кислорода. Лактат является ценным показателем в качестве: раннего признака недостаточности поступления кислорода к тканям, метода мониторинга и оценки проводимой терапии, диагностики степени гипоксии, прогностического показателя исхода лечения.
Динамическое исследование лактата весьма актуально у больных в критическом состоянии: если на фоне интенсивной терапии отмечается снижение лактата менее 3,5 ммоль/л, то выживает 90% больных, до 5,5 ммоль/л - 63%, до 7,7 ммоль/л - 43% и в случае, когда, несмотря на терапию, лактат остается более 9,0 ммоль/л - выживает лишь 7% больных [Корячкин В.А. и соавт., 2001; Дементьева И.И., 2002].
Говоря о недостатках метода, уместно сослаться на заключение международной согласительной конференции по сепсису SCCM/ESICM/ACCP/ATS/SIS, постановившей в 2001 году, что использование биомаркеров для диагностики сепсиса является перспективным направлением, но преждевременным для использования в настоящее время.
Задачами способа являются:
- Прогнозирование вероятности развития ССВО, сепсиса, тяжелого сепсиса или септического шока в послеоперационном периоде у больных с гнойно-деструктивными процессами брюшной полости
- Контроль эффективности лечебных мероприятий
- Снижение летальности
Сущностью изобретения является определение величины омега-потенциала (ОП). При его значениях от -14 до +20 мВ, прогнозируют риск развития септического шока с признаками выраженной органно-системной дисфункции в виде острой почечно-печеночной недостаточности (ОПГТН), синдрома диссеминированного внутрисосудистого свертывания (ДВС), синдрома острого повреждения легких (СОПЛ), энцефалопатии (Э); при ОП от -26 мВ и ниже прогнозируют развитие сепсиса или тяжелого сепсиса с органной дисфункцией, а при ОП от -15 до -25 мВ прогнозируют течение болезни на уровне СВО без развития сепсиса.
Способ апробирован в клинических условиях Российского центра функциональной хирургической гастроэнтерологии (г. Краснодар) у 54 больных с гнойно-деструктивными осложнениями в брюшной полости. Средний возраст больных составлял 48,5±8,2 лет, преобладали мужчины (66,7%). Тяжесть состояния по шкале АРАСНЕ III варьировала от 78 до 87 баллов. Летальность - 22,2%.
У всех больных производили регистрацию сверхмедленных физиологических процессов (СМФП) методом омегаметрии с использованием неполяризующихся жидкостных хлорсеребряных электродов типа ЭВЛ-1 МЗ и усилителя постоянного тока с большим входным сопротивлением по постоянному току не менее 20 МОм.
Сущность омегаметрии состоит в дискретной регистрации омега-потенциала (частотная полоса от 0 до 0,05 Гц) и сверхмедленных колебательных процессов в частотной полосе от 0,05 до 0,5 Гц. Регистрация проводится в течение 10 мин в состоянии покоя. Отведениями для наложения электродов служат область лба и тенар кисти доминирующей руки.
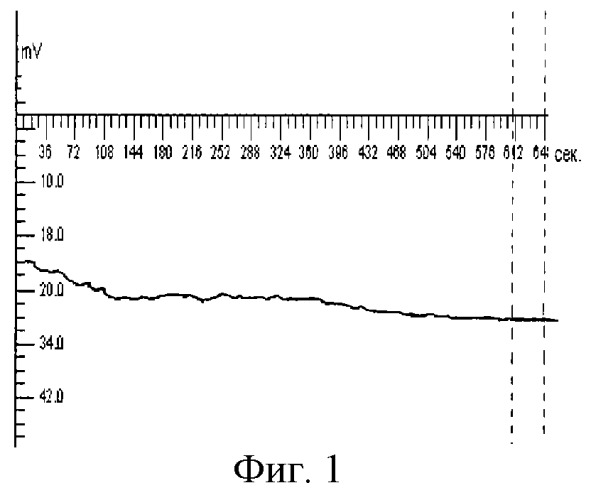
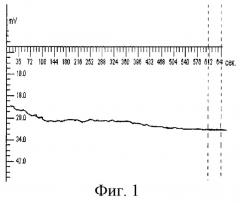
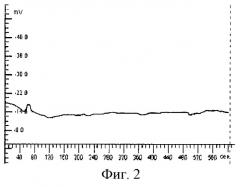
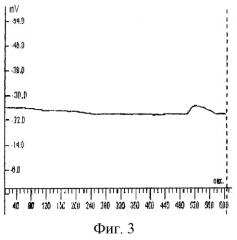
Способ осуществляют следующим образом. Активный электрод устанавливают в области лба по средней линии на расстоянии 2 см от надбровных дуг. Референтный электрод располагают в области тенара правой кисти для правшей и левой - для левшей. Во время исследования обеспечивают постоянное освещение и низкий уровень шума. Запись омега-потенциала проводят каждые 5 с на протяжении 10 мин. Графическое изображение омегаграмм осуществляют с помощью стандартного пакета программ. При этом по оси абсцисс откладывают время в секундах, а по оси ординат - значения омега-потенциала в мВ (см. фиг.1-4).
Результаты исследований показывают распределение септических состояний в зависимости от величины омега-потенциала (ОП) (табл.1).
| Таблица 1. | ||||||||||
| Состояние органной и системной дисфункции в зависимости от величины омега-потенциала | ||||||||||
| ОП в мВ | Всего б-х | из них | ОППН | СОПЛ | ДВС | Энцефалопатия | Летальность | |||
| СВО | С | ТС | СШ | |||||||
| От -14 до +20 | 14 | - | - | - | 14 | 14(100%) | 12(85,7%) | 12(85.7%) | 14(100%) | 12 (85,7%) |
| От -15 до -25 | 25 | 22(88%) | 3(12%) | - | - | 0 | 0 | 0 | 3(12%) | 0 |
| от -26 и ниже | 15 | - | 7 (46,7%) | 8 (53,3%) | - | 8 (53,3%) | 6 (40%) | 8 (53,3%) | 13 (86,7%) | 0 |
| Всего | 54 | 22 (40,7%) | 10 (18,5%) | 8 (14,8%) | 14 (25,9%) | 22 (40,7) | 18 (33,3%) | 20 (37%) | 32(59,3%) | 12 (22,2%) |
Среди наблюдаемых больных септический шок выявлен у 14 (25,9%) человек с исходно тяжелым течением основного заболевания. При этом у всех пациентов с СШ значения ОП были в диапазоне от -14 до +20 мВ (группа 1).
Тяжесть и частота органных нарушений у пациентов этой группы были наиболее выражены. Так, почечно-печеночная и мозговая недостаточность, разной степени выраженности, встречались у всех пациентов этой группы. СОПЛ и ДВС отмечались у 12 больных (85,7%).
Следует отметить, что все летальные случаи (n=12) пришлись на пациентов этой группы, составив групповую и общую летальность 85,7% и 22,2% соответственно.
Сепсис (n=7) и тяжелый сепсис (n=8) констатировались у пациентов с ОП в частной полосе от -26 мВ и ниже, т.е. распределялись как 46,7% и 53,3% (группа 2).
Обращает внимание факт, что если органная дисфункция отмечалась и при сепсисе, и при тяжелом сепсисе, то СПОН развивалась только при тяжелом сепсисе. Наиболее частой комбинацией органной дисфункции у больных с ТС были ОППН и ДВС-синдром (в 100%), а в 75% случаев (n=6) к этим состояниям присоединялся СОПЛ.
У пациентов с сепсисом в 70% развивались явления энцефалопатии, разной степени выраженности, в то время как у больных с тяжелым сепсисом эти осложнения составляли 100%.
Самой многочисленной (n=25) была третья группа, на 88% состоящая из больных с СВО и на 12% с сепсисом. Определяемые значения ОП у пациентов этой группы колебались от -15 до -25 мВ.
У всех больных 3 группы с диагнозом - сепсис наблюдались явления энцефалопатии, в то время как у пациентов с СВО (n=22) это осложнение отсутствовало. Не отмечалось как моно- так и полиорганных повреждений.
Приведенные данные свидетельствуют, что определяемые значения ОП позволяют прогнозировать тяжесть септических осложнений, разделяя их по шкале R.C.Bone на СВО-сепсис-тяжелый сепсис-септический шок. Подобный подход к диагностике позволяет осуществлять заблаговременную, упреждающую терапию, тем самым улучшая результаты лечения.
В таблице 2 приведены значения омега-потенциала и их соотношение с некоторыми клинико-лабораторными параметрами степени выраженности СШ и полиорганной недостаточности у исследованных больных: среднего динамического давления, как показателя гипотензии, тромбоцитопении - ДВС-синдрома, содержания кислорода в артериальной и венозной крови - тканевой гипоксии, показателей мочевины и общего билирубина - острой почечно-печеночной недостаточности.
Например, у больного с синдромом полиорганной недостаточности (СШ, ДВС, СОПЛ, ОППН) со значениями ОП=0 мВ, наименьшее зарегистрированное среднее динамическое давление без инотропной поддержки равно 13,3 (АД 40/0 мм рт.ст.), уровень тромбоцитов 71,2·109/л, мочевина - 14,2 ммоль/л, общий билирубин - 346,9 ммоль/л, дыхательная недостаточность с извращением метаболизма кислорода, дисфункция ЦНС по шкале Глазго - 13 баллов. Кроме того, клинические симптомы - снижение температуры тела и мочеотделения, геморрагическая экзантема, макрогематурия, признаки гипокоагуляции и активации фибринолиза на коагулограмме, физикальные изменения в легких, рентгенологические признаки РДСВ, мраморность кожных покровов, анурия, соответствуют септическому шоку с выраженной полиорганной недостаточностью.
| Таблица 2. | |||||||||
| Соотношение клинико-лабораторных параметров СПОН с величиной омега-потенциала | |||||||||
| ОП в мВ | APACHE III | СДД | Тромбоциты1×109/л | ДВС | pO2 а/в мм рт.ст. | СОПЛ | Мочевина ммоль/л | Общий билирубин мкмоль/л | ОППН |
| -14-+20 (n=14) | 83,3±2,2 | 42,3± 1,2 | 72,1±3,5 | 12 | 60,2±5,8 31,6±4,3 | 12 | 14,2±0,8 | 146,9±19,8 | 14 |
| -15 - -25(n=25) | 80,4±3,2 | 80,8± 2,2 | 160±8,0 | 0 | 85±7,554,1±6,3 | 0 | 6,2±0,3 | 22,1±2,5 | 0 |
| -26 и ниже (n-15) | 82,7±8,3 | 64,4± 1,7 | 94,5±8,2 | 8 | 77,3±5,5 42,4±8,1 | 6 | 10,3±2,7 | 65,5±7,2 | 8 |
Из таблицы 2 следует, что суммарные значения показателей органной дисфункции имеют достоверные различия в представленных группах в зависимости от тяжести сепсиса. Так, у больных со значениями ОП от -15 до +20 мВ показатели среднего динамического давления (СДД) составляют 42,3±1,2 мм рт.ст. и соответствуют манифестирующему септическому шоку. У больных со значениями ОП от -26 мВ и ниже, показатели СДД равны 64,4±1,7 (р<0,05), что свидетельствует о факте гипотонии и органной гипоперфузии.
В группе больных с ОП от -15 до -25 мВ показатели СДД приближаются к нормальным и равны 80,8±2,2 мм рт.ст. (р<0,05)). Тромбоцитопения, как один из показателей ДВС-синдрома, достоверно более выражена у больных с ОП от -14 до +20 мВ, чем в других группах (71,2±3,5×109/л против 160,0±8,0×109/л в группе с ОП от -15 до -25 мВ (р<0,05) и против 94,5±8,2×109/л в группе с ОП от -26 мВ и ниже (р<0,05). Аналогично более значимыми являются изменения показателей печеночно-почечной недостаточности у лиц с ОП от -14 до +20 мВ. В частности, уровень общего билирубина, равный 146,9±19,8 мкмоль/л, достоверно превышает данный показатель у больных с ОП от -15 до -25 мВ, где он имеет значения 22,1±2,5 мкмоль/л (р<0,05), и с ОП от -26 мВ и ниже, где общий билирубин равен 65,5±7,2 мкмоль/л (р<0,05). Уровень мочевины также достоверно выше у больных с ОП от -14 до +20 мВ (14,2±0,8 ммоль/л против 6,2±0,3 ммоль/л у лиц с ОП от -15 до -25 мВ (р<0,05) и против 10,3±2,7 ммоль/л у пациентов с ОП от -26 мВ и менее (р<0,05).
Среднее количество баллов по шкале APACHE III у всех больных было достаточно высоким (82,13±4,5), что свидетельствовало о тяжелом состоянии пациентов всех трех групп, на момент поступления в отделение реанимации. Вместе с тем подобная однородность еще раз подтверждает низкую прогностическую ценность оценочной шкалы, поскольку уже в ближайшие часы послеоперационного периода общее состояние пациентов существенно отличалось.
Таким образом, данные таблицы подтверждают, что у больных с показателями ОП от -14 до +20 мВ, развивающийся патологический процесс соответствует септическому шоку, протекает на фоне тяжелых циркуляторных расстройств, и приводит к выраженным органным повреждениям. У больных с показателями ОП от -15 до -25 мВ чаще наблюдается средне-тяжелое клиническое течение, определяемое как синдром системного воспалительного ответа. В группе больных с ОП от -26 мВ и более отмечается развитие сепсиса или тяжелого сепсиса с умеренной органной дисфункцией.
Клинические примеры
Пример 1. Больной А., 42 года. Доставлен бригадой скорой медицинской помощи в крайне тяжелом состоянии. На основании данных анамнеза, клинических и лабораторных тестов определен диагноз: гнойный холангит, холецистопанкреатит - пакреонекроз. При омегаметрии ОП+20 мВ (фиг.1).
После лапароскопической папилотомии, санации и дренирования брюшной полости развивалась клиника септического шока, острая почечная недостаточность, тромбогеморрагический синдром. Среднее динамическое давление, без инотропной поддержки, 13.3 мм рт.ст. (40/0 мм рт.ст.). Дыхание осуществлялось аппаратом РО-6 в режиме умеренной гипервентиляции. Температура тела 38,7°С. Кожные покровы цианотичные. Анурия. Тромбоциты - 67×109/л, билирубин - 295,3 мкмоль/л, мочевина - 11,6 ммоль/л, ПТИ - 56%, выраженная гипокоагуляция и активация фибринолиза на электрокоагулограмме. В легких жесткое дыхание с обильным количеством сухих хрипов. Неврологический статус - медикаментозная седация. Тяжесть состояния по шкале АРАСНЕ III - 86 баллов. Проводилась интенсивная терапия, включающая инотропную поддержку, коррекцию нарушений гемостаза и гемореологии, борьбу с ацидозом и гипоксией, антимикробную химиотерапию, а также операции экстракорпоральной гемокоррекции. Тем не менее, состояние больного ухудшалось, прогрессировала полиорганная недостаточность, тромбоциты снизились до 60,1х109/л, мочевина достигала 14,3 ммоль/л, общий билирубин - 356,2 мкмоль/л, лактат артериальной крови - 7,0 ммоль/л, СДД на фоне инфузии допамина (15 мкг/кг/мин) - 60 мм рт.ст. Однако, несмотря на проводимые терапевтические мероприятия, наступил летальный исход.
В данном клиническом примере следует акцентировать внимание на поздние сроки поступления в стационар, объем некротического поражения железы и крайне низкие значения ОП еще до операции, что свидетельствует о полной ареактивности стресс-лимитирующих систем организма с высокой долей вероятности неблагоприятного исхода.
Пример 2. Больной А., 34 года. Поступил в отделение реанимации после санационной лапаротомии по поводу 3-суточного разлитого перитонита. Состояние расценено как тяжелый сепсис (по R.C.Bone). Больной вял, адинамичен, сознание спутанное, кожные покровы бледные холодные, температура 36°С. АД 80/40 мм рт.ст., СДД - 53,3 мм рт.ст., ЧСС 120 в минуту, ЧДД 30 в минуту. За последние сутки собрано 800 мл мочи. Тяжесть состояния по шкале АРАСНЕ III - 83 балла. При омегаметрии ОП -14 мВ (фиг.2). Билирубин - 320 мкмоль/л, мочевина - 12,4 ммоль/л, лактат - 5,0 ммоль/л, тромбоциты - 81×109/л. После проведения необходимых хирургических мероприятий: ушивание дефекта кишки, санация и дренирование брюшной полости, начата интенсивная терапия, включающая антибактериальную химиотерапию, инфузионно-трансфузионную терапию, препараты, восстанавливающие органную и тканевую перфузию, мембраностабилизаторы, этиотропные препараты. В результате лечения состояние больного стабилизировалось, длительность шока составила одни сутки с момента поступления, в течение недели нормализовались показатели тромбоцитов и красной крови, восстановился темп диуреза и тканевая перфузия.
Из данного клинического примера следует, что низкие значения ОП свидетельствовали о наличии у больного выраженных нарушений компенсаторных возможностей организма с высокой долей вероятности развития множественных осложнений болезни. Тем не менее, своевременное хирургическое вмешательство и комплекс интенсивных лечебных мероприятий позволили корригировать имеющиеся нарушения, что помогло предотвратить развитие септического шока и полиорганной недостаточности.
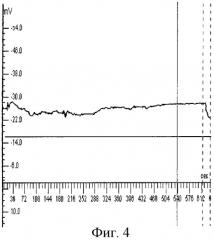
Пример 3. Больной X., 49 лет, поступил в отделение реанимации после оперативного вмешательства (санация и дренирование сальниковой сумки, вскрытие забрюшинной флегмоны) по поводу деструктивного панкреатита. Состояние при поступлении расценено как крайне тяжелое. Больной находился в состоянии медикаментозной седации. Отмечалась повышенная температура, выраженный лейкоцитоз, акроцианоз. АД - 100/60 мм рт.ст., СДД - 73,3 мм рт.ст., ЧСС - 120 в минуту. Проводилась ИВЛ в режиме умеренной гипервентиляции. Общий билирубин - 83,7 мкмоль/л, мочевина - 8,2 ммоль/л, тромбоциты - 102×109/л. Диагноз: острый деструктивный панкреатит, гнойный холангит, состояние после санации и дренирования брюшной полости. Тяжесть состояния по шкале АРАСНЕ III-83 балла. Результаты омегаметрии выявили: ОП-26 мВ (фиг.3).
Начата инфузионно-трансфузионная терапия, включающая коллоидные и кристаллоидные растворы, свежезамороженную плазму. Антибактериальная и противошоковая терапия. В дополнение к парентеральной детоксикации - малообъемная плазмофильтрация. На следующие сутки: кожные покровы бледные, температура 37°С, АД 100/50 мм рт.ст., СДД - 67,6 мм рт.ст., пульс -101 уд.мин., дыхание спонтанное (ЧДД - 24 в мин.), тромбоциты - 112×109/л, признаки нормокоагуляции и активации фибринолиза на электрокоагулограмме, по поводу чего назначен контрикал (100 тыс. ЕД/сут). Суточный диурез составил 2400 мл, улучшилась микроциркуляция и нормализовалась коагулограмма.
Данный клинический пример показывает необходимость проведения ранней активной патогенетической терапии и почасового наблюдения у больных с показателями ОП данного диапазона, так как у таких больных высока вероятность развития септического шока. Тем не менее, во время мониторирования состояние больного оценено как сепсис (по R.C.Bone).
Пример 4. Больной В., 44 года, поступил в отделение реанимации после лапароскопического дренирования внутрипеченочного абсцесса. На момент поступления в реанимационное отделение состояние пациента расценено как крайне тяжелое. Мраморность кожных покровов, температура тела 39°С, гипотензия до 80/40 мм рт.ст., ЧСС 120 в мин. Тяжесть состояния по шкале АРАСНЕ III - 80 баллов. ОП по результатам омегаметрии - 25 мВ (фиг.4). Общий билирубин - 78 мкмоль/л, мочевина - 6,8 ммоль/л, тромбоциты 113×109/л. Начата противошоковая терапия: инфузионная программа, ИВЛ, гормоны, кардиотонические препараты, экстракорпоральная гемокоррекция. На следующие сутки после операции и поступления в РО состояние больного заметно улучшилось. Исчезла мраморность кожных покровов и нормализовалась температура. Стабилизировалась гемодинамика, что позволило отказаться от применения вазопрессоров. Отсутствие видимых признаков гипоксии, достаточный мышечный тонус и ясное сознание у пациента позволили перевести его на самостоятельное дыхание с инсуфляцией кислорода. Суточный диурез составил 2000 мл. Данные биохимического исследования крови и электрокоагулография свидетельствовали о стабилизации показателей.
Данный клинический пример показывает, что несмотря на тяжесть состояния больного в момент поступления, течение болезни было благоприятным, без развития СПОН. Об этом свидетельствовали и данные ОП данного диапазона.
Медико-социальная эффективность изобретения заключается в снижении диагностических ошибок по определению степени тяжести и вероятности развития абдоминального сепсиса, назначении эффективных лечебных мероприятий, сокращении сроков пребывания больного в стационаре и уменьшении летальных исходов.
ЛИТЕРАТУРА
1. Белобородова Н.В., Бачинская Е.Н. Иммунологические аспекты послеоперационного сепсиса//Анестезиология и реаниматология. - №1. - 2000. - С.59-66.
2. Дементьева И.И. Клинические аспекты состояния и регуляции кислотно-основного гомеостаза. М. - 2002. - 80 с.
3. Корячкин В.А., Страшнов В.И., Чуфаров В.Н. Клинические функциональные и лабораторные тесты в анестезиологии и интенсивной терапии. - СПб. - 2001. - 143 с.
4. Alberti С., Brun-Buisson С., Burchardi H. Epidemiology of infection and sepsis: A Review. Advances in sepsis. Vol.3.- №2. - P.45-55. - 2003.
5. Angus D.C., Linde-Zwirbe W.T., Lidicker J. Epidemiology of severe sepsis in the USA: Analysis of incidence, outcome, and associated costs of care. Crit Care Med.- 2001; 29:1303-1310.
6. Fry D.E. Multiple System organ failure.- St. Louis, 1992. - P.15-103.
7. Marshall J.C. SIRS and MODS: What is their relevance to the science and practice of intencive care? Shock. - 2000; 14:586-589.
8. Mitchell M.L., Mitchell P.P., Marshall J.C., Abraham E., Angus D., Cook D., Cohen J., Opal S.M., Jean-Louis V., Ramsay G. 2001 SCCM/ESICM/ACCP/ATS/SIS International sepsis definition conference. - Crit Care Med. - 2003. - Vol.31. - №4. - P.1250-1256.
9. Poeze M., Ramsay G., Poeze M., Ramsay G. //Yearbook of intensive care and emergency medicine/Ed.J.-L. Vincent-Berlin, 1997. - P.161-168.
10. Ramsay G., Gerlach H., Levy M.M. An international sepsis survey: A study of doctors knowledge and percepton about sepsis.- Crit Care Med. - 2003. - 31.
11. Rangel-Frausto M.S., Pittet D., Costigan M. The natural history of the systemic inflammatory response syndrome. A prospective study. JAMA.- 1995; 273:117-123.
12. Bone R.C., Balk R.A., Cerra F.B. Definition for sepsis and organ failure and guideline for the use of innovation therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992. - 101:1644-1655.
13. Salvo I., de Cian W., Musicco M. The Italian sepsis study: Preliminary results on the incidence and evolution of SIRS, sepsis, severe sepsis and septic shock. Intensive Care Med.-1995:21:244-249.
14. Stoiser B., Knapp S., Thalhammer F. Time course of immunological marcers in patients with the systemic inflammatory response syndrome. Eur J Clin Invest. - 1998, - 28:672-678.
15. Takala A., Jousela I., Oikkola К.Т. SIRS in acutely ill patients admitted to hospital in a medical emergency. Clin Sci (Long). - 1999; 96:287-295.
16. Taniguchi Т., Koido Y., Aiboshi J. Change in the ratio of interleukin-10 predicts a poor outcome in patients with SIRS. Critical Care Medicine. - 1999; 27:1262-1264.
17. Ueda S., Nishio K., Minamino N. Increased plasma levels of adrenomedullin in patients with SIRS. Am J Respir Critical Care Medicine. - 1999; 160:132-136.
18. Vincent J.-L., Moreno R., Takala J. The SOFA score to describe organ dysfunction. - Intensive Care Med. - 1996; 22:707-710.
Способ прогнозирования тяжести абдоминального сепсиса, включающий определение клинических параметров, отличающийся тем, что регистрируют омега-потенциал и при его значениях от -14 до +20 мВ определяют возможность развития септического шока с последующей полиорганной недостаточностью, при значениях омега-потенциала от -26 и ниже определяют риск развития сепсиса или тяжелого сепсиса с умеренной органной дисфункцией, при показателях омега-потенциала от -15 до -26 мВ определяют средне-тяжелое клиническое течение - синдром системного воспалительного ответа.