Сенсибилизатор для фотодинамического разрушения клеток злокачественных новообразований и фармацевтическая композиция с его использованием
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к онкологии. Сенсибилизатор для фотодинамического разрушения клеток злокачественных новообразований представляет собой новое соединение - 18-гидроксизамещенный циклоимид хлорина р6 или 7,8-дигидроксибактериохлорина формулы I. Соединения I находят применение как средство для лечения злокачественных новообразований и расширяют ассортимент сенсибилизаторов для фотодинамической терапии. 2 н. и 4 з.п. ф-лы.
Реферат
Изобретение относится к химии биологически активных соединений в области фотодинамической терапии, в частности к сенсибилизаторам для фотодинамического разрушения злокачественных новообразований.
Метод фотодинамической терапии основан на использовании веществ - сенсибилизаторов, которые при введении в организм локализуются преимущественно в опухоли, а при световом, в частности лазерном, возбуждении с определенной длиной волны продуцируют цитотоксичные вещества, прежде всего синглетный кислород. В настоящее время известны сенсибилизаторы на основе сложных смесей производных гематопорфирина, например Fotofrin-II (E.Sternberg, D.Dolphin, C.Bruckner. Tetrahedron, 54, 4151 (1998)).
Недостаток сенсибилизаторов на основе производных гематопорфирина заключается в том, что они имеют интенсивные полосы поглощения в ультрафиолетовой и видимой (синей, зеленой) областях спектра, и в то же время в наиболее длинноволновой полосе поглощения (630+10 нм) коэффициент экстинкции относительно невысок. Вследствие этого для эффективной фотодинамической терапии оказывается необходимым введение в организм пациента значительных концентраций препарата. Кроме того, при попадании пациента под прямое солнечное излучение, имеющее значительную спектральную плотность в фиолетово-зеленой области спектра, накопленный в коже препарат проявляет значительную фототоксичность. Сильное поглощение несенсибилизированных тканей организма в спектральном диапазоне 620-640 нм приводит к значительным потерям излучения вне опухолевых тканей, обусловливает малую глубину проникновения излучения в ткани, что затрудняет лечение опухолей больших размеров. Все это приводит к необходимости использовать высокую мощность и в то же время является причиной недостаточно высокой лечебной эффективности фотодинамической терапии.
Развитие фотодинамической терапии злокачественных новообразований стимулировало поиск новых малотоксичных сенсибилизаторов, у которых оптические свойства, способность локализоваться в опухолевых клетках и эффективность действия должны быть более высокими, чем у применяемых до сих пор производных гематопорфирина. В связи с этим в качестве перспективных объектов рассматриваются соединения, принадлежащие к классу тетрапирролов с модификацией сопряженной системы и имеющие интенсивные полосы поглощения в красной и ближней ИК областях спектра: фталоцианины, нафталопорфирины, хлорины, пурпурины, бактериохлорины и другие.
Так, недостатки производных гематопорфирина частично устраняются при использовании для фотодинамической терапии в качестве сенсибилизатора алюминиевого комплекса сульфированного фталоцианина ("Фотосенса"), поглощающего в спектральном диапазоне 660-680 нм. Коэффициент экстинкции "Фотосенса" в максимуме полосы поглощения превышает 105 л·моль-1·см-1, поглощение несенсибилизированных тканей организма в этом диапазоне падает, поэтому при его использовании повышается глубина фотодинамического воздействия на ткани, что позволяет повысить лечебную эффективность фотодинамической терапии (В.В.Соколов и др., Вопросы онкологии, 41, 134 (1995)). Однако "Фотосенс" обладает все же определенными недостатками, основным из которых является весьма высокая величина используемой дозы (0,5-0,8 мг на кг веса тела), следствием чего является наличие у него побочной кожной токсичности.
В последние годы в связи с поиском новых эффективных сенсибилизаторов широкого спектра действия активно изучаются циклоимидные производные хлорина р6. Эти соединения доступны, практически полностью безвредны, обладают хорошими спектральными и фотофизическими свойствами, а также способностью к разнообразным модификациям.
Задача изобретения - разработка новых сенсибилизаторов для фотодинамической терапии на основе циклоимидных производных хлорина р6.
Для повышения эффективности фотодинамического разрушения злокачественных новообразований в качестве сенсибилизатора предлагаются новые соединения - 18-гидроксизамещенные циклоимиды хлорина р6 или 7,8-дигидроксибактериохлорина. Описывается способ их получения и фармацевтическая композиция с новым сенсибилизатором. Новые соединения - 18-гидроксизамещенные циклоимиды хлорина р6 или 7,8-дигидроксибактериохлорина предназначены для лечения злокачественных новообразований.
Согласно изобретению синтезирован ряд новых 18-гидроксизамещенных производных хлорина р6 и 7,8-дигидроксибактериохлорина с дополнительным имидным экзоциклом, сопряженным с основным хлориновым макроциклом, содержащих различные заместители при атоме азота имидного экзоцикла, предпочтительно гидрокси-, ацетокси- и 3-гидроксипропильные заместители.
18-Гидроксизамещенные циклоимиды хлорина р6 или 7,8-дигидроксибактериохлорина представляют собой соединения общей формулы I.
где R1 обозначает -Н -СН3, -(СН2)6ОН
R2 обозначает -СН=СН2, ,
R3=R4 и представляет собой -ОН или R3 и R4 вместе образуют химическую связь,
R5 обозначает -Н, -ОН, -ОСН3, , -(СН2)2ОН, -(СН2)3ОН, -(СН2)4OH, -(CH2)3NHR6, , где
R6 одинаковые или различные и обозначают -Н, .
Предпочтительны соединения формулы I, где
R1 обозначает -Н или -СН3,
R2 обозначает -СН=СН2,
R3 и R4 вместе образуют химическую связь,
R5 обозначает -ОН, , -(СН2)3ОН.
Указанные соединения являются выбранными из группы, включающей (17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина p6, 175-метил-(17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6, 175-метил-(17S, 18R)-18-гидрокси-13,15-N-гидроксициклоимид хлорина р6, 175-метил-(17S, 18R)-18-гидрокси-13,15-N-ацетоксициклоимид хлорина р6.
Наиболее предпочтительны соединения формулы I, где
R1 обозначает -Н или -СН3,
R2 обозначает -СН=СН2,
R3 и R4 вместе образуют химическую связь,
R5 обозначает -(CH2)3ОН.
Указанные соединения представляют собой (17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6 или 175-метил-(17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6.
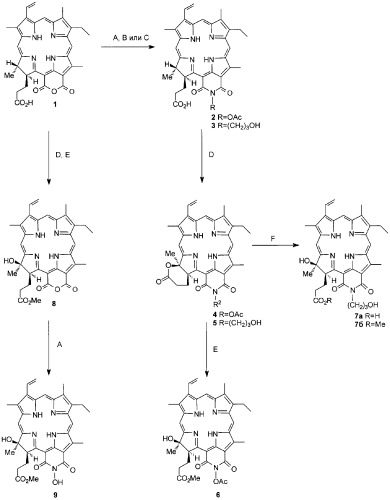
Как известно, введение гидроксильных групп в молекулу хлорина позволяет существенно изменять его амфифильность. При этом гидроксильные группы могут находиться как непосредственно в макроцикле (K.R.Adams, M.C.Berenbaum, R.Bonnett, A.N.Nizhnik, A.Salgado, M.A.Valles. J.Chem. Soc., Perkin Trans. 1, 1465-1470 (1992)), так и в составе боковых заместителей (R.Bonnett, M.F.Grahn, A.Salgado, M.Turkish, M.A.Valles, N.S.Williams. Photodynamic therapy and biomedical lasers. Amsterdam:Elsevier, 866-869 (1992)). Как показывает практика, именно амфифильные молекулы лучше накапливаются в опухолях. Большой интерес представляют соединения, в которых гидрофобные и гидрофильные заместители расположены в противоположных частях хлориновой молекулы. Такие вещества, обычно, легче проникают в клетку и затем концентрируются в ее жизненно важных компартментах. Новые 18-гидроксизамещенные циклоимиды хлорина р6 синтезированы регио- и стереонаправленным методом гидроксилирования природных хлоринов и их производных. Метод основан на внутримолекулярной циклизации остатка пропионовой кислоты под действием 2,3-дихлор-5,6-дициан-1,4-бензохинона (DDQ) в соседнее положение 18 с образованием δ-лактона и раскрытие последнего в кислой или щелочной среде с образованием 18-гидроксихлоринов. В соответствии со схемой циклоимидные производные хлорина р6 были синтезированы взаимодействием пурпурина 18 (1) с гидрохлоридом гидроксиламина и 3-аминопропанолом соответственно. Обработка N-ацетоксициклоимида хлорина р6 (2) DDQ приводит к δ-лактону соответствующего хлорина р6 (4) с выходом 54%. Аналогичным образом соединение (3) окисляется с образованием δ-лактона N-(3-гидроксипропил)циклоимида хлорина р6 (5). Масс-спектры 5-лактонов циклоимидов (4) и (5) содержат интенсивные пики молекулярных ионов с m/z 620.3 (М++Н) (4) и 619.6 (М+) (5). В электронных спектрах интенсивный максимум основной полосы поглощения Q соединений (4) и (5) находится при 707-708 нм, а полоса Соре - при 418-419 нм, что означает существенный батохромный сдвиг по сравнению с δ-лактоном пурпурина 18 (699 и 411 нм соответственно).
Структура δ-лактонов (4) и (5) была также подтверждена спектрами 1Н-ЯМР. Спектры соединений (4) и (5) аналогичны спектру δ-лактона пурпурина 18 и отличаются от последнего лишь дополнительными сигналами заместителей, расположенных у атома азота циклоимида. В отличие от исходных циклоимидов (2) и (3), в спектрах соединений (4) и (5) отсутствуют квартеты 18-Н протонов в области 4.32-4.33 м.д, а сигналы 18-СН3 сдвинуты в слабое поле с 1.70-1.72 м.д. до 2.15-2.18 м.д., и проявляются в виде синглета, а не дублета, как это имеет место у исходных соединений. Протоны 17-Н располагаются в области 5.57-5.69 м.д.
Изучение спектров 1Н-ЯМР соединения (5) с использованием метода NOESY выявило наличие сильных взаимодействий между 17-Н и 18-СН3, свидетельствующее о том, что данные заместители находятся с одной стороны от плоскости макроцикла и, следовательно, образовавшееся лактонное кольцо расположено над плоскостью хлорина. Последующий анализ спектров NOESY позволил сделать отнесение для протонов двух метиленовых групп в δ-лактонном цикле, а также заместителя при имидном азоте. Протоны N-гидроксипропильного заместителя имеют следующие значения хим. сдвигов: триплет в области 4.67 м.д. соответствует СН2-группе при атоме азота, мультиплет в области 3.81 м.д. - 134-CH2 и триплет в области 2.24 м.д. - метиленовой группе при гидроксиле. Аналогичным образом было сделано отнесение всех основных сигналов в соединении (4). Эти результаты находятся в хорошем соответствии с данными, полученными для пурпурина 18 и хлорина р6, согласно которым дополнительный δ-лактонный цикл расположен над плоскостью основного макроцикла (A.F.Mironov, A.V.Efremov, O.A.Efremova, R.Bonnett, G.Martinez. J.Chem. Soc., Perkin Trans. 1, 3601-3608 (1998), А.Ф.Миронов, А.В.Нечаев. Биоорг. хим., 27, 141-144 (2001)).
Нами показано, что 18-гидроксизамещенный N-ацетоксициклоимид (6) образуется с лучшим выходом при раскрытии δ-лактонного цикла в метаноле в присутствии трифторуксусной кислоты. И напротив, для получения соответствующего производного N-(3-гидроксипропил)циклоимида (7а) лучше использовать щелочной гидролиз. В результате обработки лактона (5) 50% водным раствором щелочи в тетрагидрофуране 18-гидроксициклоимид (7а) получен с выходом 41%. В кислых условиях δ-лактон N-(3-гидроксипропил)циклоимида (5) преимущественно претерпевает дегидратацию с образованием порфирина.
Для получения 18-гидрокси-N-гидроксициклоимида (9) удобным исходным является 18-гидроксипурпурин 18 (8). Гидроксизамещенный N-гидроксициклоимид (9) синтезирован взаимодействием 18-гидроксипурпурина 18 (8) с гидрохлоридом гидроксиламина в пиридине с выходом 58%.
В масс-спектрах соединений (6), (7а) и (9) имеются пики молекулярных ионов с m/z 652.1, 637.4 и 610.5. Обработка 18-гидроксициклоимида (7а) диазометаном приводит к соответствующему метиловому эфиру (7б). При этом группы 18-ОН и 136-OH не затрагиваются. В спектрах 1H-ЯМР 18-гидроксициклоимидов (6), (7б) и (9) метильная группа в положении 18 проявляется в виде синглета, а не дублета, характерного для природных хлоринов. Методом NOESY показано, что 18-СН3 и 17-Н расположены с одной стороны хлоринового макроцикла и, следовательно, образовавшаяся 18-ОН группа находится над плоскостью макроцикла. Электронные спектры хлоринов (6), (7а, б) и (9) практически не отличаются от спектров их циклоимидных предшественников, не содержащих в положении 18 макроцикла гидроксильную группу, и имеют максимум основной полосы поглощения в области 710-719 нм.
Нижеследующие примеры служат для иллюстрации различных аспектов настоящего изобретения.
Примеры способов синтеза.
Ниже приведены условия синтеза целевых веществ, для каждого конкретного соединения даны выходные данные и результаты анализов. Чистоту вещества контролировали тонкослойной хроматографией на пластинках HPTLC-Kieselgel 60 с концентрирующей зоной (Merck, Германия). Для препаративной тонкослойной хроматографии применялся Kieselgel 60 Н (Merck, Германия) (А) и силикагель CHEMAPOL L 5/40 (Чехия) (Б) на пластинках 20×20 см с толщиной слоя 1 мм. Электронные спектры соединений записаны на спектрофотометре "Jasco 7800" в области 400-800 нм в хлороформе. Спектры 1Н-ЯМР в дейтерохлороформе регистрировали на спектрометрах "Bruker MSL 200" и "Bruker AMX-600".
Масс-спектры записаны на приборе "Micromass Autospec" (EI, 70 eV, 200°C). Используемый в синтезах пурпурин 18 (1) приготовлен из сине-зеленых водорослей Spirulina platensis по методике (A.S.Brandis, A.N.Kozyrev, A.F.Mironov. Tetrahedron, 48, 6491 - 6499 (1992)).
(17S, 18R)-174,18-лактон 13,15-N-ацетоксициклоимида хлорина р6 (4). К раствору 10.4 мг (0.017 ммоль) 13,15-N-ацетоксициклоимида (2) в 5 мл хлороформа добавляют 6 мг (0.033 ммоль) DDQ и перемешивают 20 мин при 25°С. Реакционную массу промывают водой (5×50 мл), органический слой отделяют, сушат сульфатом натрия, растворитель отгоняют в вакууме. Остаток хроматографируют на пластине (А) в системе хлороформ : ацетон (5:1) и перекристаллизовывают из смеси хлороформ-гексан. Получено 5.7 мг (54.8%) целевого продукта. Электронный спектр, λмакс, нм (ε/103): 418 (110.0), 483 (4.6), 513 (5.6), 552 (23.7), 652 (7.5), 708 (42.1). Спектр 1Н-ЯМР (δ, м.д.): 9.68 с и 9.67 с (1Н, 10-Н), 9.49 с (1Н, 5-Н), 8.77 с и 8.76 с (1Н, 20-Н), 7.92 дд (1Н, J 18 и 12 Гц, 31-СН), 6.31 дд (1Н, J 18 и 1 Гц, 32-СН2), 6.22 дд (1Н, J 12 и 1 Гц, 32-CH2), 5.66 дд и 5.57 дд (1Н, J 7 и 5 Гц, 17-Н), 3.84 с и 3.82 с (3Н, 12-СН3), 3.67 кв (2H, J 8 Гц, 81-СН2), 3.38 с (3Н, 2-СН3), 3.20 с (3Н, 7-СН3), 2.97 м (1Н, 171-CH2), 2.65 с и 2.64 с (3Н, 135-СН3), 2.46 м (1Н, 172-СН2), 2.28 м (1Н, 171-CH2), 2.16 с и 2.15 с (3Н, 18-СН3), 1.69 т (3Н, J 8 Гц, 82-CH3), 1.63 м (1Н, 172-CH2), 0.5 с и 0.4 с (1Н, NH), 0.12 с и 0.10 с (1Н, NH). ИК-спектр, νмакс, см-1: 3431 ср, 2961 сл, 2923 сл, 2867 сл, 2847 сл, 1728 сл, 1681 сл, 1640 с, 1601 ср, 1545 ср, 1526 ср, 1383 сл, 1307 сл, 1168 сл, 1062 сл, 987 ср, 898 сл. Масс-спектр, m/z: 620.3 (М++Н).
(17S, 18R)-174,18-лактон 13,15-N-(3-гидроксипропил)циклоимида хлорина р6 (5). Аналогично δ-лактону (4) из 9.8 мг (0.016 ммоль) 13,15-N-(3-гидроксипропил) циклоимида хлорина р6 (3) в 5 мл хлороформа и 7.1 мг (0.031 ммоль) DDQ после хроматографирования на пластине (А) в системе хлороформ : ацетон (5:1) и перекристаллизации из смеси хлороформ-гексан получено 5.0 мг (51.5%) целевого продукта. Электронный спектр, λмакс, нм (ε/103): 419 (99.7), 483 (1.5), 513 (2.4), 552 (17.2), 651 (3.55), 707 (33.9). Спектр 1Н-ЯМР (δ, м.д.): 9.70 с (1Н, 10-Н), 9.52 с (1Н, 5-Н), 8.87 с (1Н, 20-Н), 7.92 дд (1Н, J 18 и 12 Гц, 31-СН), 6.28 дд (1Н, J 18 и 1 Гц, 32-СН2), 6.21 дд (1Н, J 12 и 1 Гц, 32-СН2), 5.69 дд (1Н, J 7 и 5 Гц, 17-Н), 4.67 т (2Н, J 6 Гц, 133-СН2), 3.83 с (3Н, 12-СН3), 3.81 м (2Н, 134-СН2), 3.66 кв (2Н, J 8 Гц, 81-СН2), 3.40 с (3Н, 2-СН3), 3.19 с (3Н, 7-СН3), 2.97 м (1Н, 171-CH2), 2.48 м (1Н, 172-CH2), 2.29 м (1Н, 171-CH2), 2.24 т (2Н, J 6 Гц, 135-CH2), 2.18 с (3Н, 18-СН3), 1.66 т (3Н, J 8 Гц, 82-CH3), 1.64 м (1Н, 172-CH2), -0.18 с, -0.33 с (2Н, NH). ИК-спектр, νмакс, см-1: 3380 сл, 3331 сл, 2956 ср, 2919 с, 2851 ср, 1758 ср, 1738 ср, 1683 с, 1644 с, 1603 сл, 1586 сл, 1545 с, 1526 с, 1454 сл, 1431 сл, 1397 ср, 1384 ср, 1349 сл, 1331 сл, 1313 сл, 1168 ср, 1084 сл, 988 с, 962 сл, 910 ср, 802 ср, 789 с, 702 с, 674 с. Масс-спектр, m/z: 619.6 (М+).
Метиловый эфир (17S, 18R)-18-гидрокси-13,15-N-ацетоксициклоимида хлорина р6 (6). Раствор 17.0 мг (0.026 ммоль) циклоимида (4) в смеси 1 мл ТФК и 10 мл МеОН перемешивают в течение 2 ч под аргоном при 25°С, реакционную массу разбавляют 40 мл хлороформа и промывают водой (5×150 мл). Органический слой отделяют, сушат Na2SO4 и упаривают в вакууме. Остаток хроматографируют на пластине в системе хлороформ:МеОН (10:0.75). После перекристаллизации из смеси хлороформ-гексан получен продукт (4) с выходом 6.9 мг (40%). Электронный спектр, λмакс, нм (ε/103): 425 (47.1), 517 (3.9), 559 (13.6), 663 (5.2), 719 (19.5). Спектр 1Н-ЯМР (5, м.д.): 9.60 с (1Н, 10-Н), 9.34 с (1Н, 5-Н), 8.79 с (1Н, 20-Н), 7.86 дд (1Н, J 18 и 12 Гц, 31-СН), 6.28 дд (1Н, J 18 и 1 Гц, 32-CH2), 6.16 дд (1Н, J 12 и 1 Гц, 32-CH2), 5.44 и 5.36 дд (1Н, J 7 Гц, 17-Н), 3.79 с (3Н, СН3), 3.64 кв (2Н, J 8 Гц, 81-CH2), 3.34 с (3Н, 2-СН3), 3.23 с и 3.20 с (3Н, 175-СН3), 3.16 с (3Н, 7-СН3), 2.62 с и 2.60 с (135-СН3), 2.57 м (1Н, 171-СН2), 2.45 м (1Н, 172-CH2), 2.34 м (1Н, 171-CH2), 2.15 и 2.12 м (1Н, 172-СН2), 1.54 с (3Н, 18-СН3), 1.62 т (3Н, J 8 Гц, 82-СН3), 0.30 с и 0.12 с (2Н, NH). Масс-спектр, m/z: 652.1 (M+).
(17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6 (7а). К раствору 27.0 мг (0.044 ммоль) циклоимида (5) в 5 мл тетрагидрофурана добавляют 5 мл 50% водного раствора гидроксида натрия и перемешивают в течение 4 ч при 25°С. Реакционную массу разбавляют 30 мл воды и нейтрализуют уксусной кислотой. Продукт экстрагируют хлороформом (3×50 мл), органический слой промывают водой (3×100 мл), сушат сульфатом натрия и упаривают в вакууме. Остаток хроматографируют на пластине (А) в системе хлороформ : метанол (10:2). После перекристаллизации из смеси хлороформ-гексан получен продукт (7а) с выходом 11.3 мг (41%). Электронный спектр, λмакс, нм (ε/103): 420 (78.0), 484 (4.4), 514 (4.9), 554 (16.9), 654 (6.1), 711 (29.6). Масс-спектр, m/z: 637.4 (М+).
Метиловый эфир (17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимида хлорина р6 (7б). К раствору 11.3 мг (0.018 ммоль) хлорина (7а) в 5 мл хлороформа добавляют избыток эфирного раствора диазометана, перемешивают 5 мин при 25°С и упаривают в вакууме. Остаток хроматографируют на пластине (А) в системе хлороформ : метанол (10:0.5). Выделенное вещество перекристаллизовывают из смеси хлороформ-гексан. Выход 10.5 мг (91%). Электронный спектр, λмакс, нм (относительная интенсивность): 420, 484, 514, 554, 654, 711 (2.64:0.15:0.17:0.57:0.21:1.00). Спектр 1Н-ЯМР (δ, м.д.): 9.63 с (1Н, 10-Н), 9.36 с (1Н, 5-Н), 8.80 с (1Н, 20-Н), 7.84 дд (1Н, J 18 и 12 Гц, 31-СН), 6.25 дд (1Н, J 18 и 1 Гц, 32-СН2), 6.14 дд (1Н, J 12 и 1 Гц, 32-СН2), 5.45 д (1Н, J 7 Гц, 17-Н), 4.64 т (2Н, J 6 Гц, 133-CH2), 3.81 с (3Н, 12-СН3), 3.78 м (2H, 134-CH2), 3.64 кв (2H, J 8 Гц, 81-CH2), 3.47 с (3Н, 175-СН3), 3.24 с (3Н, 7-СН3), 3.16 с (3Н, 2-СН3), 2.22 м (2H, 171-CH2) и (2H, 172-CH2), 2.04 м (2Н, 135-CH2), 1.54 с (3Н, 18-СН3), 1.66 т (3Н, J 8 Гц, 82-СН3), -0.07 с и -0.06 с (2Н, NH).
Метиловый эфир (17S, 18R)-18-гидрокси-13,15-N-гидроксициклоимида хлорина р6 (9). Смесь 8.0 мг (0.014 ммоль) пурпурина 18 (8) [4] в 3 мл Ру и 9.4 мг (0.14 ммоль) гидрохлорида гидроксиламина перемешивают в течение 12 ч при 25°С. Реакционную массу разбавляют хлороформом, промывают 0.1 N раствором HCl (3×50 мл) и затем водой. Органический слой отделяют, сушат Na2SO4 и растворитель упаривают в вакууме. Остаток хроматографируют на пластине в системе хлороформ : МеОН (80:5). После перекристаллизации из смеси хлороформ-гексан получено 4.7 мг (58%) продукта (9). Электронный спектр, λмакс, нм. (ε/103): 419 (82.8), 483 (5.4), 513 (5.8), 553 (19.0), 596 (3.0), 653 (6.8), 710 (31.8). Спектр 1Н-ЯМР (δ, м.д.): 8.49 с (1Н, 10-Н), 8.42 с (1Н, 5-Н), 8.23 с (1Н, 20-Н), 7.77 дд (1Н, J 18 и 12 Гц, 31-СН), 6.20 дд (1Н, J 18 и 1 Гц, 32-СН2), 6.10 дд (1Н, J 12 и 1 Гц, 32-CH2), 5.30 д (1Н, J 7 Гц, 17-Н), 4.71 с (1Н, 18-ОН), 3.70 кв (2Н, J 8 Гц, 81-CH2), 3.47 с (3Н, 12-СН3), 3.31 с (3Н, 2-СН3), 3.23 с (3Н, 175-СН3), 3.09 с (3Н, 7-СН3), 2.57 м (1Н, 171-CH2), 2.35-2.00 м (3Н, 171,172-СН2), 1.79 с (3Н, 18-СН3), 1.61 т (3Н, J 8 Гц, 82-CH3), 0.43 с и 0.31 с (2Н, NH). Масс-спектр, m/z: 610.5 (М+).
Предметом изобретения является также фармацевтическая композиция для лечения злокачественных новообразований, включающая в качестве действующего вещества сенсибилизатор, представляющий собой 18-гидроксизамещенный циклоимид хлорина р6 общей формулы I, в которой символы имеют вышеприведенное значение, в эффективном количестве, и фармацевтически приемлемый носитель.
Обычно фармацевтическая композиция подается путем инъекции. Примерный вариант фармацевтической композиции - это стерильный водный раствор. Водный раствор, кроме сенсибилизатора формулы I, содержит, возможно, физиологическую соль и в случае необходимости - пропиленгликоль.
Описанные растворы можно применять непосредственно после их изготовления или можно их хранить в стерильных контейнерах. Фармацевтическую композицию по изобретению можно применять как сенсибилизатор при фотодинамической терапии новообразований.
Новые соединения формулы I были исследованы на клеточных линиях.
Спектр поглощения исследуемого производного (7а) в 1% кремофоре (45 мМ Трис-HCl рН 7,4) характеризуется максимумами: λ1=367 нм (ε=34600), λ2=419 нм (ε=80800), λ3=483 нм (ε=2300), λ4=513 нм (ε=3300), λ5=553 нм (ε=15730), λ6=647 нм (ε=5200), λ7=710 нм (ε=30300 М-1·см-1). Стоковый раствор (0,5 мМ) (7а) в 10% кремофоре характеризуется высокой стабильностью при хранении при +4°С: в течение 2 недель хранения по спектрам поглощения не обнаружено ни выпадения осадка, ни агрегации, ни изменений в спектре поглощения, указывавших бы на модификацию исходного соединения.
Соединение (7а) легко проникает в клетки аденокарциномы легкого человека А549 и накапливается в цитоплазме в мономерной форме, связанной с клеточными мембранными структурами. Высокого внутриклеточного проникновения соединения (7а) удается достичь, обеспечив стабилизацию мономерной формы соединения (7а) в биологических средах с помощью 0.002-0.01% эмульсии Кремофора. При облучении светом мембранно-связанное соединение (7а) не образует гидроксил-радикалов, но характеризуется высоким квантовым выходом генерации синглетного кислорода, равным 0.67±0.03. Эффективная генерация синглетного кислорода под действием возбуждающего света не сопровождается фотоиндуцированной деградацией самого фотосенсибилизатора, что указывает на его достаточно высокую фотостабильность.
Для тестирования активности соединения (7а) на культуре клеток использовали исходный раствор соединения с концентрацией 500 мкМ в 5% растворе Кремофора EL ("Sigma") в дистиллированной воде. Исследования проводили на культуре клеток аденокарциномы легкого человека А549. Клетки культивировали в среде ИГЛА-МЕМ, с добавлением 2 мМ - L-глутамина и 8% эмбриональной телячьей сыворотки, при 37°С во влажной атмосфере с 5% содержанием СО2. Клетки рассевали в 96-луночные планшеты в концентрации 60 тыс.кл./мл. Через 24 часа, в начале логарифмической фазы роста культуры, вносили фотосенсибилизаторы. Концентрацию фотосенсибилизатора варьировали от 0.5 мкМ до 15 нМ. Клетки инкубировали с фотосенсибилизатором в течение 2 часов, затем облучали красным светом как в присутствии фотосенсибилизатора. Облучение проводили с использованием галогеновой лампы мощностью 500 Вт, оснащенной широкополосным фильтром КС-13 (λ≥640 нм) и водным фильтром толщиной 5 см. Плотность мощности составляла 13.6-15.0 mW/см2. Расчетная световая доза составляла 10 Дж/см2. Для оценки цитотоксичности клетки инкубировали в присутствии соединения (7а) в темноте (СО2-инкубатор). Все манипуляции с клетками проводили в условиях пониженной освещенности.
Оценку выживаемости клеток проводили как визуально, оценивая с помощью световой микроскопии морфологические изменения клеток, так и колориметрическим методом с использованием МТТ-теста (J.Carmichael, W.G.DeGraff, A.F.Gazador, J.D.Minna, J.B.Mitchell. Cancer Res., 47,936-942(1987)).
Уровень ингибирования роста клеток вычисляли по формуле:
ИР (%) = [(ODк-ODo)/ODк]×100%,
где: ИР - уровень ингибирования роста клеток в культуре; ODo - оптическая плотность в опыте; ODк - оптическая плотность в контроле, λmax=550 нм.
Рассчитывали концентрацию соединения, при которой наблюдается 50% и 90% торможение роста культуры.
В результате показано, что соединение (7а) обладает фототоксичностью в отношении культуры клеток А549. ИК50 составила 80 нМ. Цитотоксичность в отсутствии облучения в диапазоне эффективных концентраций отсутствовала. Фотоиндуцированная активность соединения (7а) in vitro превышает активность хлорина р6 (ИК50=3.4 мкМ), а также используемых в клинике фотосенсибилизаторов Фотогема (ИК50=8.8 мкМ) и Фотосенса (ИК50=6.5 мкМ).
Таким образом, in vitro соединение (7а) характеризуется высокой фотоиндуцированной активностью и низкой темновой токсичностью.
Совокупность экспериментально полученных фотофизических параметров и результатов приведенных расчетов свидетельствует о том, что новые циклоимидные производные хлорина р6 можно рассматривать в качестве эффективных сенсибилизаторов и перспективных агентов нового поколения для фотодинамической терапии.
Схема синтеза 18-гидроксизамещенных циклоимидов хлорина р6.
A - NH2OH·HCl, Ру; В - АС2O; С - NH2(СН2)3ОН (1), Ac2O (2), NaHCO3(3); D - DDQ, CHCl3; E - TFA/MeOH, F - NaOH/THF.
1. Сенсибилизатор для фотодинамического разрушения клеток злокачественных новообразований, характеризующийся тем, что он представляет собой 18-гидроксизамещенный циклоимид хлорина р6 или 7,8-дигидроксибактериохлорина общей формулы I
где R1 обозначает -Н, -СН3,
,
-(СН2)6ОН
R2 обозначает -СН=СН2,
R3=R4 и представляет собой -ОН или R3 и R4 вместе образуют химическую связь;
R5 обозначает -Н, -ОН, -ОСН3,
,
-(СН2)2(ОН), -(СН2)3OH, -(CH2)4OH, -(CH2)3NHR6;
,
где
R6 одинаковые или различные и обозначают -Н,
2. Сенсибилизатор по п.1, представляющий собой соединение формулы I, где
R1 обозначает -Н, или -СН3,
R2 обозначает -СН=СН2,
R3 и R4 вместе образуют химическую связь,
R5 обозначает -ОН, -(СН2)3ОН.
3. Сенсибилизатор по п.2, выбранный из группы, включающей (17S, 18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6, 175-метил-(17S,18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6, 175-метил(17S,18R)-18-гидрокси-13,15-N-гидроксициклоимид хлорина р6, 175-метил(17S,18R)-18-гидрокси-13,15-N-ацетоксициклоимид хлорина р6.
4. Сенсибилизатор по п.2, представляющий собой соединение формулы I, где
R1 обозначает -Н, или -СН3,
R2 обозначает -СН=СН2,
R3 и R4 вместе образуют химическую связь,
R5 обозначает -(CH2)3ОН.
5. Сенсибилизатор по п.4, представляющий собой (17S,18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6 или 175-метил-(17S,18R)-18-гидрокси-13,15-N-(3-гидроксипропил)циклоимид хлорина р6.
6. Фармацевтическая композиция для лечения злокачественных новообразований, включающая в качестве действующего вещества сенсибилизатор по любому из пп.1-5 в эффективном количестве, и фармацевтически приемлемый носитель.