Препарат для профилактики и лечения инвазионных заболеваний рыб и способ профилактики и лечения инвазионных заболеваний рыб
Иллюстрации
Показать всеИзобретение относится к области рыбоводства. Препарат содержит производное авермектина. В качестве производного авермектина препарат содержит эмамектин или его соль в эффективном количестве. Способ заключается в том, что кормление рыб осуществляют в течение 3-14 дней в дозе 25-400 мкг производного эмамектина на 1 кг рыбной биомассы в день. Препарат и способ позволяют эффективно бороться против эндо- и эктопаразитов рыб на всех стадиях их развития. 2 н. и 9 з.п. ф-лы, 4 ил., 4 табл.
Реферат
Предшествующий уровень техники
Контроль за инвазией морскими вшами (Lepeophtheirus salmonis и Caligus elongatus) в процессах промышленного разведения лосося еще в значительной степени зависит от использования химической обработки (Roth M., Richards R. & Sommerville С. (1993) "Current Practices In The Chemotherapeutic Control of Sea Lice Infestations: A Review" Journal of the Fish Diseases (16(1): 1-26). В настоящее время вспышки этих эктопаразитических веслоногих ракообразных (копепод) обрабатывают погружением в ванны с органофосфатным дихлорофосом (Aquagard® Alpharma) и азаметифосом (Salmosan® Novartis), или пероксидом водорода (Salartect® Brenntag, Paramove® Solvay-Interox), или синтетическими пиретоидами, циперметрином (Excis® Vericore) и дельтаметрином (Alrhamax® Alpharma). Процедуры в ванне являются очень трудоемкими, дорогостоящими и вызывают значительный стресс у рыбы. Кроме того, такая обработка может быть невыполнимой в местах поражения и во время неблагоприятных погодных условий.
За исключением циперметрина (Jakobsen P.J. & Holm J.C. (1990) "Promising Test With New Compound Against Salmon Lice" Norsk Fiskeoppdrett., январь, 16-18) обработки в ваннах являются эффективными только против предшествующей взрослой и взрослых форм морских вшей, позволяя стадиям халимуса выживать и продолжать цикл инвазии. Следовательно, обработка требуется только тогда, когда популяция достигла предшествующей взрослой и взрослой форм, и таким образом должна часто повторяться для эффективного контроля. Устойчивость к органофосфатному дихлорофосу была обнаружена в некоторых популяциях морских вшей (Jones M.W., Sommerville C.S. & Wootten, R. (1992) "Reduced Sensitivity of the Salmon Louse, Lepeophtheirus salmonis, to the Organophosphate Dichlorvos" Journal of Fish Diseases 15: 197-202). Пероксид водорода может вызывать повреждение жабр, и его использование ограничено летом в связи с его токсичностью при более высоких температурах воды (Thomassen J.M. (1993) "Hydrogen peroxide as a Delousing Agent for Atlantic Salmon" in: Pathogens of Wild and Farmed Salmon: Sea Lice (ed. By G. Boxshall & D. Defaye) Ellis Horwood Ltd. London).
Обработка, которая эффективна против всех паразитических стадий морских вшей и других паразитов, которая могла бы вводиться в корм, чтобы избежать неудобств, связанных с использованием ванн, была бы полезна для лососевой индустрии. Обработка через корм позволяет лечение во время неблагоприятных погодных условий и в местах поражения и разрешает одновременное лечение всех садков на участке или всех участков в озере или одиночном заливе, таким образом уменьшая любую перекрестную инвазию, которая может происходить в течение нескольких дней, необходимых для применения обработки в ванной для всех садков на участке. В настоящее время имеющейся в распоряжении обработкой через корм являются регуляторы роста насекомых, дифлюбензурон (Lepsidon® Ewos) и тефлюбензурон (Calicide® Nutreco) (Erdak J.I. (1997) "New Drug Treatment Hits Sea Lice When They are Most Vulnerable". Fish Farming International vol. 24, No. 2). Их способ действия заключается в ингибировании синтеза хитина (Horst M.N. & Walker A.N. (1996) "Biochemical Effects of Diflubenzuron on Chitin Synthesis in the Post-molt blue crab" (Callinectes sapidus) Journal of Crustacean Biology. 15: 401-408), и, следовательно, их активность ограничена стадиями линьки у морских вшей.
Авермектины, продуцируемые культурой Streptomyces avermilitis, обладают очень эффективными антгельминтными и инсектицидными свойствами. Химически модифицированное производное, ивермектин (22,23-дигидроавермектин B1) был разработан как антипаразитическое средство широкого спектра для крупного рогатого скота, овец, лошадей и свиней (Sutherland I.H. (1990) "Veterinary Use of Ivermectin" Acta Leidensia 59: 211-216) и известен на мировом рынке с 1981. Ивермектин также широко используют при лечении некоторых паразитов человека (Ottesen Е.А. & Campbell W.C. (1994) "Ivermectin in Human Medicine" Journal of Antimicrobial Chemotherapy. 34(2): 195-203). Вслед за обнаружением органофосфатной устойчивости у морских вшей (Jones M.W., Sommerville C.S. & Wootten, R. (1992) "Reduced Sensitivity of the Salmon Louse, Lepeophtheirus salmonis, to the Organophosphate Dichlorvos" Journal of Fish Diseases 15: 197-202), ивермектин рассматривался как альтернативная терапия. В добавление к его новому типу действия дополнительное преимущество лежит в его применении, таком как лечение через корм. Хотя ивермектин не получил законной санкции на использование для лосося, он может прописываться ветеринарами в Великобритании во время каскадной процедуры (Anonymous (1998) Amelia No.8 Veterinary Medicines Directorate. Woodham Lane, Newhaw, Addlestone, Surrey KT15 3NB), где разрешенных продуктов бывает недостаточно для обеспечения эффективного контроля за инвазией морскими вшами. Использование ивермектина в течение нескольких лет показало, что он способен осуществлять некоторый контроль, как правило, при принятой интенсивности дозы 25 мкг/кг биомассы дважды в неделю (Rae G.H. (1996) "Guidelines for the Use of Ivermectin Pre-Mix for Pigs to treat Farmed Salmon For Sea Lice" Scottish Salmon Growers Association pamphlet). Однако обнаружено, что ивермектин является токсичным при уровне более чем 25 мкг/кг биомассы дважды в неделю (S.C Johnson, et al., "Toxicity and Pathological Effects of Orally Administered Ivermectin in Atlantic, Chinook, and Coho Salmon and Steelhead Trout", Diseases of Aquatic Organisms. Vol.17: 107-112 (1993).
Эмамектин (4"-дезокси-4"-эпиметиламиноавермектин B1) в последнее время используется для лечения съедобных культур растений (Leibee G.L., Jansson R.K.., Nuessly G. & Taylor J.L. (1995) "Efficacy of Emamectin Benzoate and Bacillus thurin-gensis at Controlling Diamondback Moth (Lepidoptera: Plutellidae) Populations On Cabbage in Florida" Florida Entomologist. 78(1): 82-96).
Краткое содержание изобретения
Настоящее изобретение обеспечивает способ уничтожения, уменьшения или предупреждения паразитов в популяции рыб, включающий кормление эмамектином или его солью популяции рыб при ежедневной дозе от 25 мкг до 400 мкг на кг рыбной биомассы в день в течение периода 3-14 дней.
Кроме того, предоставляется набор для получения лечебного корма для рыб для уничтожения, уменьшения или предупреждения паразитов в популяции рыб, содержащий запас эмамектина или его соли и напечатанные инструкции для кормления эмамектином или солью эмамектина популяции рыб при ежедневной дозе от 25 мкг до 400 мкг на кг рыбной биомассы в день в течение периода 3-14 дней.
Краткое описание чертежей
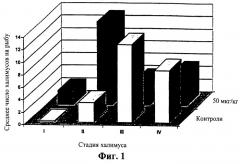
Фиг.1 означает диаграмму, сравнивающую среднее число индивидуальных халимусов (стадии I, II, III и IV) на рыбу в контрольной группе и группе, получившей дозу 50 мкг/кг на 7 день во время исследования титрования дозы (Пример 1).
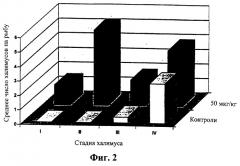
Фиг.2 означает диаграмму, показывающую то же самое сравнение, что и на Фиг.1, но на 14 день.
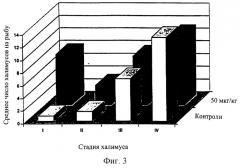
Фиг.3 означает диаграмму, сравнивающую среднее число индивидуальных халимусов (стадии I, II, III и IV) на рыбу в контрольной группе и группе, получившей дозу 50 мкг/кг на 7 день во время исследования подтверждения дозы (Пример 3).
Фиг.4 означает диаграмму, показывающую то же самое сравнение, что и на Фиг.3, но на 14 день.
Подробное описание изобретения
Эмамектин (4"-дезокси-4"-эпиметиламиноавермектин B1), который может быть получен как описано в Патенте США №5288710 или Патенте США №5399717, является смесью двух гомологов, 4"-дезокси-4"-эпиметиламиноавермектина B1a и 4"-дезокси-4"-эпиметиламиноавермектина B1b. Предпочтительно используют соль эмамектина. Неограничивающие примеры солей эмамектина, которые могут использоваться в настоящем изобретении, включают соли, описанные в Патенте США 5288710, например соли, полученные из бензойной кислоты, замещенной бензойной кислоты, бензолсульфоновой кислоты, лимонной кислоты, фосфорной кислоты, винной кислоты, малеиновой кислоты и т.п. Наиболее предпочтительной солью, используемой в настоящем изобретении, является бензоат эмамектина.
Было с удивлением обнаружено, что эмамектин, когда используется при уровнях и графике дозировки согласно настоящему изобретению, не токсичен для популяций рыб. Это особенно удивительное открытие, учитывая тот факт, что ивермектин, как было обнаружено, является токсичным при относительно низких уровнях. Так как ивермектин не может вводиться следующими друг за другом днями благодаря своей токсичности, существует значительный риск, что не все рыбы в данной популяции получат соответствующую дозу из-за излишне агрессивных едоков. Возможность давать эмамектин в течение, по крайней мере, нескольких последующих дней является значительным преимуществом над ивермектином, поскольку кормление в течение нескольких дней увеличивает вероятность того, что больше рыб в данной популяции съест их.
Эмамектин и его соли могут быть использованы согласно настоящему изобретению для уничтожения или уменьшения количества всех типов паразитов рыб, включая эктопаразитов, а также эндопаразитов. Примеры эндопаразитов, которые могут быть уничтожены или уменьшены в количестве, включают, но не ограничиваются этим: тех, кто принадлежит к Phylum Platyhelminthes (классы Monogenea, Digenea и Cestoda); Phylum Aschelminthes (класс Nematoda); и простейшие (например, миксозоановые инфекции (Phylum Myxozoa), микроспоридиальные инфекции (Phylum Microspora), кокцидиальные инфекции (Phylum Apicomplexa) и Phylum Ciliophora). Примеры эктопаразитов, которые могут быть уничтожены или уменьшены в количестве, включают, но не ограничиваются этим: моногенетические трематоды (monogenea); паразиты из Phylum Arthoropoda (класс Crustacea, подкласс Branchiura и подкласс Copepoda (например, включая отряд Cyclopidea, Caligidia и Lernaeopodidea)); и паразиты из отряда Argulus и Phylum Isopoda.
Было обнаружено, что обработка эмамектином согласно настоящему изобретению очень эффективна для морских вшей, то есть паразитов, принадлежащих к подклассу Copepoda, отряду Caligedea, особенно для тех, кто принадлежит к родам Lepeophtheirus и Caligus.
Любые виды рыб, включая пресноводные и морские виды, могут быть обработаны эмамектином для уничтожения или уменьшения паразитов. Примеры рыб, которые могут быть обработаны, включают, но не ограничиваются этим: лосося, форель, полосатую зубатку, морского окуня, тунца, палтуса, арктического гольца, осетра, белокорого палтуса, камбалу, морской язык, карпа, сериолу, полосатого окуня, угря, морского леща, желтохвоста, тилапию, групера и ханоса.
Доза эмамектина, которая эффективна для уменьшения, уничтожения или предупреждения паразитов, может быть запросто определена ветеринаром, хотя она может варьировать в зависимости от вида обрабатываемых рыб, специфических паразитов и степени инвазии. Предпочтительно эмамектином или его солью кормят при дозе от 25 мкг до 100 мкг на кг рыбной биомассы в день, наиболее предпочтительно от 50 до 75 мкг на кг рыбной биомассы в день.
Обработку эмамектином применяют ежедневно, в течение периода от 3 до 14 дней, предпочтительно в течение 7-14 дней, наиболее предпочтительно в течение 1 недели. С удивлением было обнаружено, что эмамектин проявляет продолжительную эффективность вплоть до от 8 до 10 недель после обработки. Таким образом, эмамектин может применяться как профилактическая мера для предупреждения появления паразитов.
Набор согласно настоящему изобретению может быть в любой форме, подходящей для обеспечения запаса эмамектина в течение 7 дней, вместе с написанными инструкциями по его применению согласно уровням дозы и графику, описанным выше. Примеры включают, но не ограничиваются этим, различные контейнеры (например, бутылки, коробки, блистерные упаковки и ампулы) или снабженные упакованными при упаковке вкладышами, описывающими инструкции о циклических дозировках, или инструкции о дозировке напечатаны на или прикреплены к контейнеру. Эмамектин или соль эмамектина в наборе может быть в форме предварительной смеси, содержащей один или более разбавитель и от 0,01 до 1 мас.% эмамектина или соли эмамектина.
Лечебный корм для рыб может быть получен включением подходящего количества эмамектина или его соли в коммерчески доступный кормовой продукт для рыб, чтобы достигнуть требуемых уровней дозы. Количество эмамектина, включенного в корм для рыб, будет зависеть от нормы, с которой будут кормить рыб. Для рыб, получающих норму от 0,2 до 4% от биомассы/день, лечебный корм предпочтительно содержит от 0,5 до 100 мг эмамектина или его соли на кг лечебного корма, более предпочтительно от 1 до 50 мг на кг лечебного корма и наиболее предпочтительно от 5 до 15 мг на кг лечебного корма.
Хотя эмамектин может быть включен в кормовую смесь до дражирования, лечебный корм предпочтительно формируют покрытием гранул корма эмамектином. Для покрытия гранул корма предпочтительно использовать предварительно приготовленную смесь, содержащую:
(a) от 0,01 до 1 мас.% эмамектина или его соли;
(b) от 0,001 до 0,2 мас.% консерванта;
(c) от 1 до 4 мас.% пропиленгликоля или полиэтиленгликоля; и
(d) QS разбавитель.
Консервант предпочтительно является бутилированным гидроксианизолом (БГА). Предпочтительно используют пропиленгликоль. Разбавитель может быть любым из обычно используемых разбавителей, например лактозой, мальтодекстрином, кукурузным крахмалом, карбонатом кальция, микрокристаллической целлюлозой, рисовой шелухой и стержнями початка кукурузы. Предпочтительно разбавителем является мальтодекстрин, кукурузный крахмал или их смесь. Особенно предпочтительная предварительно приготовленная смесь содержит 0,2 мас.% бензоата эмамектина, 0,01 мас.% бутилированного гидроксианизола, 2,5 мас.% пропиленгликоля, 49,8 мас.% кукурузного крахмала и QS мальтодекстрин М-10. Заранее приготовленную смесь предпочтительно получают, используя смеситель интенсивного перемешивания / гранулятор, используя следующую процедуру: Растворяют БГА в пропиленгликоле при перемешивании. Загружают крахмал в смеситель интенсивного перемешивания / гранулятор. Медленно добавляют раствор БГА к крахмалу при перемешивании. Продолжают перемешивать в течение 20-40 минут (цель - 30 мин), чтобы позволить крахмалу абсорбировать раствор. Скоблят внутреннюю стенку резервуара смесителя для удаления любых прилипших материалов. В резервуар смесителя загружают лекарственное средство через сито 20 меш. Перемешивают и измельчают (инструмент для измельчения включен) в течение 10 минут. Загружают мальтодекстрин в резервуар смесителя и перемешивают/измельчают в течение дополнительных 10 минут. Выгружают для упаковки.
Альтернативно можно применять следующий способ, используя смеситель со спирально-лопастной мешалкой: растворяют БГА в пропиленгликоле при перемешивании. Загружают крахмал в меньший смеситель со спирально-лопастной мешалкой (приблизительно половину объема порции). Включают смеситель со спирально-лопастной мешалкой и медленно добавляют раствор БГА в крахмал. Перемешивают до однородности. Останавливают смеситель и оставляют смесь в смесителе в течение примерно 30-60 минут. Отбирают маленькое количество смеси (1-5% от объема порции) в маленький планетарный смеситель. Загружают лекарственное средство в планетарный смеситель и перемешивают в течение 5 минут. Переносят лекарственную предварительную смесь обратно в смеситель со спирально-лопастной мешалкой и перемешивают в течение 10-30 минут. Выгружают лекарственную смесь из смесителя со спирально-лопастной мешалкой и пропускают через измельчающую мельницу (Fitzmill) для разрушения комков. Размолотый материал переносят в другой смеситель со спирально-лопастной мешалкой. Загружают мальтодекстрин в смеситель и перемешивают в течение 10-30 минут. Выгружают для упаковки.
Гранулы корма могут быть покрыты предварительно приготовленной смесью или способом сухого покрытия, или способом масляного покрытия. В способе сухого покрытия заранее приготовленную смесь смешивают с гранулами так, чтобы она однородно распределилась по гранулам, и к смеси добавляют нагретый рыбий жир или растительное масло, чтобы тщательно покрыть гранулы. В способе масляного покрытия предварительно приготовленную смесь сначала смешивают с маленьким количеством нагретого рыбьего жира или растительного масла, которое затем смешивают с гранулами так, чтобы однородно распределить масло на них, и дополнительно добавляют нагретый рыбий жир или растительное масло к покрытым гранулам и перемешивают, пока гранулы не покроются до конца.
Следующие примеры иллюстрируют вышеупомянутое изобретение, хотя эти примеры не следует рассматривать как ограничивающие объем изобретения.
Примеры
Проводили три исследования в Institute of Aquaculture Marine Environmental Research Laboratory в Мачриханиш (Machrihanish), Шотландия. Благородного лосося, Salmo salar L., пост-серебрянок, получали из свободного от болезни косяка и акклиматизировали в присутствии оборудования для теста.
Рыбы содержали в реплицированных группах в резервуарах из пластмассового волокна, каждый объемом 0,54 м3. Каждый резервуар был снабжен натуральной морской водой с температурой окружающей среды (7-14°С) и соленостью (30-35 частей на триллион (чнт)), со скоростью потока приблизительно 18,1 мин-1. Резервуары были снабжены ситами над выпускном отверстии для воды, чтобы удерживать несъеденные рыбные гранулы. У рыб ежедневно исследовали поведение и неблагоприятные реакции на лекарство. Летальные исходы у рыб и появление явных повреждений от морских вшей также регистрировали.
Инвазия морскими вшами.
Морских вшей собирали во время отлова рыбы на промышленных лососевых фермах на западном побережье Шотландии. Яйцевые шнурки, собранные у икряных женских особей вшей, инкубировали в морской воде при температуре окружающей среды и солености 32-35 чнт. Когда искусственно выведенные личинки достигали стадии копепоидной личинки, 38-170 копепоидных личинок на рыбу вносили в каждый из четырех реплицированных резервуаров с рыбой и поступление воды в каждый резервуар перекрывали приблизительно на три часа, чтобы позволить прикрепиться копепоидным личинкам на рыбе. Эту процедуру повторяли 4-5 раз с интервалом 3-5 дней до тех пор, пока не стали присутствовать стадии халимуса I, II, III и IV. Количество халимусов оценивали за 1 день или 2 дня до обработки на подвыборках рыбы (N=6-9 рыб на резервуар). В это время заражали вшами в форме, предшествующей взрослой, и взрослыми вшами, добавляя 5-10 вшей на рыбу в каждый резервуар. Поступление воды в каждый резервуар приостанавливали примерно на один час до тех пор, пока все вши не прикрепятся к рыбе. Количество вшей до обработки основывалось на подвыборке из всей популяции и представлено как среднее число халимусов на рыбу. Затем рыбу случайно перераспределяли из четырех первоначальных резервуаров в каждый контрольный или обработанный резервуар, как описано в экспериментальном плане для каждого исследования, и не проводили никакой дополнительной инвазии во время или после лечения.
Лечебное кормление
Основным рационом являлись 3,5 или 5 мм гранулы для кормления лосося Fulmar™ (ВОСМ Pauls Ltd). Бензоат эмамектина растворяли в пропиленгликоле и смешивали с рыбьим жиром перед тем как нанести покрытие на гранулы корма. Контрольный корм получали таким же путем, используя пропиленгликоль и рыбий жир. Обработку проводили при номинальных интенсивностях дозы 0, 25, 50 и 100 мкг/кг рыбной биомассы в день при кормовой норме 0,5% биомассы в течение периода из семи последовательных дней (дни 0-6). Действительное ежедневное потребление корма определяли в каждом резервуаре, собирая несъеденные гранулы корма приблизительно через 30 минут после введения и вычитая это количество гранул из ежедневно даваемого рациона. Среднюю потребляемую дозу рассчитывали для каждой группы следующим образом:
Среднее потребление корма (%) х номинальная интенсивность дозы (мкг/кг)=Средняя потребляемая доза (мкг/кг)
Оценка морских вшей
Оценку численности морских вшей проводили на 7,14 и 21 день с момента начала обработки. Рыб анестезировали 40 мг/л этил-Р-аминобензоатом (бензокаином) и каждую рыбу исследовали под микроскопом слабого увеличения. Вшей идентифицировали как стадии халимуса I-IV, стадии I или II, предшествующие взрослой, и взрослую. Почти взрослых и взрослых вшей идентифицировали как самцов или самок. Регистрировали количество каждой стадии развития. Любая вошь, которая отсоединилась в анестезирующий раствор, была включена в подсчет и повторно присоединена на рыб после их переноса в свежую морскую воду. Рыб возвращали в удерживающие резервуары после снятия показаний и тех же самых рыб оценивали на 7, 14 и 21 дни.
Пример 1
Исследование на титрование дозы
Температура воды равнялась 7-10°С и соленость составляла 33-34 чнт. Средняя масса рыб до обработки составляла 192 г (±30 г, станд. откл.). До обработки имелось два реплицированных резервуара пробой размером 19 или 20 рыб на резервуар. Результаты такого исследования представлены ниже в Таблице 1.
| Таблица 1Исследование на титрование дозы: Эффективность бензоата эмамектина против вызванной инвазии благородного лосося Salmo solar морскими вшами Lepeophtheirus salmonis. Рыбы получали лечебный корм при норме 0,5% биомассы в день в течение 7 последовательных дней (День 0-День 6). Среднее число морских вшей определяли на 7, 14 и 21 дни. Среднее и стандартное отклонение получали из объединенных данных для двух реплицированных резервуаров (размер пробы N=19 или 20 рыб на резервуар). |
| Время | Номинальная доза мкг/кг | Средняя потребляемая доза* мкг/кг | Среднее общее кол-во вшей (±ст. откл.) | Среднее кол-во халимуса (±ст. откл.) | Среднее кол-во подвижных(±ст. откл.) | % уменьшения относительно контроля (общее кол-во вшей) |
| 0 | 0 | 51,1±15,1 | 24,3±8,8 | 26,7±7,8 | / | |
| 7 день | 25 | 21,5 | 32,6±10,7 | 20,9±8,6 | 11,7±6,0 | 36,2% |
| 50 | 45,0 | 31,9±11,4 | 24,8±10,3 | 7,1±4,1 | 37,5% | |
| 100 | 91,0 | 33,0±10,7 | 29,0±9,8 | 4,0±3,6 | 35,4% | |
| 0 | 44,9±11,1 | 3,2±2,0 | 41,7±10,5 | / | ||
| 14 день | 25 | 13,1±6,9 | 9,7±3,9 | 3,4±6,4 | 70,8% | |
| 50 | 13,4±5,9 | 12,4±3,5 | 1,0±1,2 | 70,3% | ||
| 100 | 15,1±5,8 | 14,1±5,5 | 1,0±3,2 | 66,4% | ||
| 0 | 34,5±9,3 | 0,03±0,2 | 34,5±9,3 | / | ||
| 21 день | 25 | 3,5±2,7 | 2,4±1,9 | 1,1±2,2 | 89,8% | |
| 50 | 1,7±1,3 | 1,6±1,5 | 0,1±0,3 | 95,2% | ||
| 100 | 1,5±1,6 | 1,2±1,2 | 0,3±1,0 | 95,8% | ||
| * Средняя потребляемая доза означает действительную полученную дозу, рассчитанную из процентного потребления корма во время периода лечения. |
Пример 2
Исследование I по подтверждению дозы
Температура воды составляла 12-14°С и соленость равнялась 33-35 чнт. Средняя масса рыб до обработки составляла 224 г (±43 г, станд. откл.). Бензоат эмамектина вводили с номинальной ежедневной интенсивностью дозы 0,25 и 50 мкг/кг биомассы. До обработки имелось три реплицированных резервуара с 15 рыбами на резервуар. Однако в этом исследовании смертность уменьшила число рыбы, пригодной для оценки паразитов, к концу исследования до 9, 10 и 14 в группах с 25 мкг/кг, до 10, 12 и 13 в группах с 50 мкг/кг и только до 2,5 и 5 в контрольных группах. По этой причине проводили второе исследование, подтверждение дозы II (Пример 3, ниже). Результаты данного исследования представлены в Таблице 2, ниже.
| Таблица 2Исследование I по подтверждению дозы: Эффективность бензоата эмамектина против вызванной инвазии благородного лосося Salmo salar морскими вшами Lepeophtheirus salmonis. Рыбы получали лечебный корм при норме 0,5% биомассы в день в течение 7 последовательных дней (День 0-День 6). Среднее число морских вшей определяли на 7, 14 и 21 дни. Среднее и стандартное отклонение получали из объединенных данных для трех реплицированных резервуаров (размер пробы N=2-15 рыб на резервуар). | ||||||
| Время | Номинальная доза мкг/ кг | Средняя потребляемая доза* мкг/кг | Среднее общее кол-во вшей (±ст. откл.) | Среднее кол-во халимуса (±ст. откл.) | Среднее кол-во подвижных (±ст. откл.) | % уменьшения относительно контроля (общее кол-во вшей) |
| 0 | 0 | 60,9±15,1 | 1,9±1,6 | 59,0±14,9 | / | |
| 7 день | 25 | 20,2 | 34,2±15,8 | 1,8±1,7 | 32,4±15,4 | 43,8% |
| 50 | 44,3 | 28,1±13,1 | 3,2±2,2 | 24,9±13,2 | 53,8% | |
| 0 | 40,9±14,4 | 0 | 40,9±14,4 | / | ||
| 14 день | 25 | 9,8±4,4 | 0,30 | 9,5±4,4 | 76,0% | |
| 50 | 4,9±2,7 | 0,6 | 4,3±2,6 | 88,0% | ||
| 0 | 27,3±9,7 | 0 | 27,3±9,7 | / | ||
| 21 день | 25 | 4,9±3,1 | 0 | 4,9±3,1 | 81,9% | |
| 50 | 1,6±1,3 | 0 | 1,6±1,4 | 94,3% | ||
| * Средняя потребляемая доза означает действительную полученную дозу, рассчитанную из процентного потребления корма во время периода лечения. |
Пример 3
Температура воды составляла 9-12°С и соленость равнялась 30-34 чнт. Средняя масса рыб до обработки составляла 418,2 г (±49 г, станд. откл.). Бензоат эмамектина вводили с номинальной ежедневной интенсивностью дозы 0 и 50 мкг/кг биомассы. До обработки имелось три реплицированных резервуара с 15-16 рыбами на резервуар. Результаты данного исследования представлены в Таблице 3, ниже.
| Таблица 3Исследование II по подтверждению дозы: Эффективность бензоата эмамектина против вызванной инвазии благородного лосося Salmo salar морскими вшами Lepeophtheirus salmonis. Рыбы получали лечебный корм при норме 0,5% биомассы в день в течение 7 последовательных дней (День 0-День 6). Среднее число морских вшей определяли на 7, 14 и 21 дни. Среднее и стандартное отклонение получали из объединенных данных для трех реплицированных резервуаров (размер пробы N=15-16 рыб на резервуар). | ||||||
| Время | Номинальная доза мкг/ кг | Средняя потребляемая доза* мкг/кг | Среднее общее кол-во вшей (±ст. откл.) | Среднее кол-во халимуса (±ст. откл.) | Среднее кол-во подвижных (±ст. откл.) | % уменьшения относительно контроля (общее кол-во вшей) |
| 0 | 0 | 74,9±17,1 | 22,7±8,8 | 52,2±13,4 | / | |
| 7 день | 50 | 45,7 | 40,5±12,2 | 30,0±11,8 | 10,5±8,1 | 45,9% |
| 0 | 50,2±10,3 | 0,6±0,8 | 49,5±10,3 | / | ||
| 14 день | 50 | 14,7±5,9 | 12,7±5,7 | 2,0±3,2 | 70,7% | |
| 0 | 38,1±8,6 | 0,1±0,3 | 38,1±8,7 | / | ||
| 21 день | 50 | 2,1±2,1 | 1,5±1,7 | 0,6±1,1 | 94,6% | |
| * Средняя потребляемая доза означает действительную полученную дозу, рассчитанную из процентного потребления корма во время периода лечения. |
Обработка данных
Результаты суммировались для халимусов (стадии халимуса I-IV), подвижных вшей (в предшествующей взрослой и взрослой стадиях) и для всех вшей (объединенные стадия подвижных вшей и стадия халимуса). Данные по количеству вшей на рыбу подвергались обработке по F-критерию на однородность вариаций и корреляционному тесту, чтобы проверить, является ли распределение нормальным. Массы рыб и подсчеты вшей до обработки анализировали односторонним ANOVA (анализом вариантов). Так как вариации не были гетерогенными или нормально распределенными, число вшей после обработки анализировали, используя непараметрический критерий Дунна (Zar 1984).
Во всех трех исследованиях не существовало значительных различий (Р>0,05) в количестве халимусов и подвижных вшей между любым из реплицированных резервуаров в каждой из контрольной, 25, 50 или 100 мкг/кг групп в любой момент времени. Это позволило объединить средние значения для каждого набора реплицированных резервуаров в Таблицах 1, 2 и 3. Однако данные также анализировались отдельно для каждого реплицированного резервуара.
Процентное уменьшение среднего количества морских вшей по отношению к контрольным группам рассчитывали для каждой дозы следующим образом:
Суммарные результаты для каждого из трех исследований представлены ниже в Таблице 4.
Анализ и обсуждение результатов
Потребление корма в обработанных группах находилось в пределах 81-92%. Действительные потребляемые средние дозы рассчитывались для каждой группы и представлены в Таблицах 1,2 и 3 вместе с номинальными интенсивностями дозы. Потребление корма в контрольных группах составляло 77-90%. Было отмечено, что режим кормления и активность ухудшались в некоторых из контрольных групп во время периода исследования. Это связано с более высокими уровнями вшей на контрольных рыбах и было наиболее заметно, когда активность морских вшей возрастала, поскольку халимусы созревали до более пагубных подвижных стадий. Не существовало значительных различий (Р>0,05) в средних значениях массы рыб между любой из обработанных и контрольных групп в конце каждого исследования.
Никакого вредного воздействия или смертельных исходов обработка бензоатом эмамектина не вызвала при любой из исследуемых доз. Было небольшое количество смертельных случаев при исследовании дозы титрования или исследования II на подтверждение дозы, но вследствие высокого количества вшей ряд смертельных случаев или отбраковки встречался в исследовании I на подтверждение дозы (Таблица 4).
Исследование на титрование дозы
В начале изучения общее среднее количество халимусов на рыбу до обработки, основанное на подвыборке из 10 рыб на резервуар, составляло 58,1 (±21,9). Не существовало значительных различий (F3,36=1,70, Р>0,05) в уровнях инвазии между резервуарами перед повторным распределением и обработкой. Среднее количество вшей до обработки, включая подвижные формы, составляло 63-68 на рыбу.
Результаты исследования по титрованию дозы представлены в Таблице 1. Уже на 7 день общее количество вшей на рыбу уменьшилось на 35,4-37,5% во всех обработанных группах по сравнению с контрольными группами. К 21 дню среднее число вшей на рыбу уменьшилось на 89,8, 95,2 и 95,8% соответственно в 25, 50 и 100 мкг/кг группах. Контрольные группы имели 34,5 вши на рыбу, тогда как при дозе 59 мкг/кг среднее значение составляло такую низкую величину как 1,7. Количество вшей по отношению к контрольным группам значительно уменьшалось как при 50, так и при 100 мкг/кг интенсивностях доз на 7, 14 (Р<0,05) и 21 (Р<0,001) дни с начала обработки. Однако не было значительного различия между интенсивностями доз 50 и 100 мкг/кг.
Данные также анализировались отдельно для стадии халимуса и подвижной стадии, и показано, что с 7 по 21 день среднее количество подвижных вшей возрастало в контрольных группах со значения 26,7 до 34,5 на рыбу, поскольку халимус созревал (Таблица 1). Напротив, среднее число подвижных вшей в обработанных группах снижалось до такой низкой величины как 0,1-1,1 на рыбу на 21 день.
Среднее количество халимусов также уменьшалось в контрольных группах, поскольку они созревали, приводя к увеличению числа подвижных стадий (Таблица 1). Однако во всех трех обработанных группах среднее число халимусов уменьшалось более медленно, и не было соответствующего увеличения в количестве у подвижных стадий. На 14 и 21 дни число халимусов было выше во всех трех обработанных группах чем в контрольных группах. Однако многие из халимусов, присутствующих на обработанной рыбе, были анормальными по внешнему виду и, как предполагалось, являлись мертвыми или нежизнеспособными. На 7 день на обработанной рыбе было больше халимусов I и II стадий, чем на контрольных рыбах, которые имели большую долю халимусов III и IV стадий, как показано на Фиг.1. На 14 день (Фиг.2) на обработанных рыбах еще присутствовали халимусы I и II стадий, тогда как контрольные рыбы не имели I или II халимусов, и на них оставалось лишь небольшое количество халимусов III и IV стадий.
На 21 день многие из обработанных рыб не имели подвижных форм вшей, причем некоторые рыбы были полностью свободны как от халимусов, так и от подвижных вшей. Напротив, ни одна из контрольных рыб не была полностью свободна от подвижных вшей (Таблица 4).
Исследование I на подтверждение дозы
В начале исследования общее среднее количество халимусов на рыбу до обработки, основанное на подвыборке из 9 рыб на резервуар, составляло 82,3 (±36,6). Не существовало значительных различий (F3,32=0,55, Р>0,05) в уровнях инвазии между резервуарами перед повторным распределением и обработкой. Среднее количество вшей до обработки, включая подвижные формы, составляло 87-92 на рыбу.
В этом исследовании ряд рыб умерли или были отбракованы в результате достижения высоких уровней инвазии. В контрольных группах, где количество вшей осталось высоким, 75% рыб умерли или были отбракованы, тогда как только 27% рыб, обработанных 50 мкг/кг, умерли или были отбракованы (Таблица 4). Обследование умерших рыб в контрольных группах показало очень большое число подвижных вшей, и вероятно, что контрольные рыбы, которые дожили до 21 дня, были теми, у которых присутствовало меньшее количество вшей. Таким образом, среднее число вшей на рыбу на 21 день могло бы быть много выше, если бы все контрольные рыбы выжили. Все смертельные случаи и отбракованные рыбы явились следствием повреждений, вызванных активностью морских вшей. Повреждения, вызванные морскими вшами, как на контрольных, так и на обработанных рыбах проявлялись в виде областей изъязвления эпидермиса на краниальном и спинном участках и сопровождались сниженной активностью в отношении питания у этих индивидуумов. На 21 день общий внешний вид и режим питания у рыб в обработанной группе заметно улучшились. Напротив, небольшое количество выживших рыб в контрольных группах имели повреждения, вызванные вшами, и продолжали проявлять пониженный ответ в отношении питания.
Результаты исследования I по подтверждению дозы представлены в Таблице 2. В обработанных группах среднее общее число вшей уменьшалось на 44-45% уже на 7 день по сравнению с контрольными группами и к концу испытания на 21 день среднее число вшей уменьшалось на 82% в 25 мкг/кг группах и на 94% в 50 мкг/кг группах. При наивысшей интенсивности дозы 50 мкг/кг количество морских вшей значительно уменьшалось по сравнению с двумя из трех контрольных групп на 14 и 21 дни (Р<0,05). Третий контрольный репликат имел размер пробы в виде только 2 рыб к концу исследования и, следовательно, не был включен в анализ. Хотя значительных различий между индивидуальными репликатами в контрольной и 25 мкг/кг группах не существовало, когда данные объединили для получения большего размера пробы, обнаружились значительные различия (Р<0,001) между этими двумя обработками. Также не существовало значительных различий между 25 мкг/кг репликатами и двумя из 50 мкг/кг репликатами, но вновь, когда данные для этих групп объединили, эти две интенсивности доз значительно различались (Р<0,001). На 21 день объединенные средние количества вшей составляли 27,3 на рыбу в контрольных группах, 4,9 в 25 мкг/кг группе и 1,6 в 50 мкг/кг группе соответственно.
Хотя относительно небольшое количество вшей на предшествующей взрослой и взрослых подвижных стадиях присутствовало в начале исследования, это количество возрастало во всех группах на 7 день, так как стадии халимуса созревали (Таблица 2). Увеличение количества подвижных вшей на рыбах в двух обработанных группах было меньше, чем наблюдалось в контрольных группах. Между 7 и 21 днями среднее количество падало в контрольных группах вследствие естественной смертности и, в этом исследовании, благодаря смерти или отбраковки наиболее тяжело зараженных рыб. В обработанных группах уменьшение среднего количества вшей было даже больше за это время и на 21 день общее число вшей составляло на 82-94% ниже, чем в контрольных группах.
Таблица 2 показывает, что среднее число халимусов падало в контрольной и 25 мкг/кг группах с начала исследования до 14 дня. На 7 и 14 дни количество халимусов было слегка выше в 50 мкг/кг группе, но вновь халимусы, присутствующие на обработанной рыбе, как было обнаружено, не являются жизнеспособными, таким образом на 21 день халимусов не остается на любой из проверенных рыб.
На 21 день 28,6% рыб в 50 мкг/кг группах полностью свободны как от халимусов, так и от подвижных вшей (Таблица 4). Напротив, только 3% рыбы в 25 мкг/кг и ни одной контрольной рыбы полностью свободны от вшей.
Исследование II на подтверждение дозы
Не существовало значительных различий (F3,20=0,428, Р>0,05) в уровнях инвазии между резервуарами перед повторным распределением и обработкой. Количество вшей до обработки, включая подвижные формы, составляло 79-84 на рыбу.
Суммарные результаты, представленные в Таблице 3, показывают, что уже на 7 день среднее общее число вшей в 50 мкг/кг группах уменьшалось на 46% по сравнению с контрольными группами и на 21 день - на 95%. На 21 день контрольные группы имели общее среднее количество 38,1 вшей на рыбу, тогда как 50 мкг/кг группы имели среднее количество только 2,1 вши на рыбу. Количества вшей были