Способ выделения биологически активной фракции (баф), содержащей s-липополисахариды (s-лпс) из грамотрицательных бактерий, баф для лечения и профилактики заболеваний, вызываемых грамотрицательными бактериями, производящими эндотоксичные s-лпс, фармацевтическая композиция, способы индукции протективного иммунитета и улучшения состояния пациента при состояниях, требующих повышения иммунного статуса
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к способу выделения биологически активной фракции (БАФ), содержащей преимущественно S-липополисахарид (ЛПС) из грамотрицательных бактерий, производящих эндотоксичные ЛПС, и может быть использовано в профилактических и лечебных целях. Из грамотрицательных бактерий, производящих эндотоксичные S-ЛПС, выделяют БАФ, имеющую в липиде А S-ЛПС мольное соотношение D-глюкозамина и β-гидроксикислот, выбираемых из группы, содержащей β-гидроксидекановую, β-гидроксидодекановую, β-гидрокситетрадекановую, β-гидроксигексадекановую, равное приблизительно 2:1-4, и мольное соотношение D-глюкозамина и высших жирных кислот, присоединенных как амидной, так и сложноэфирной связью, в липиде А S-ЛПС, равное приблизительно 2:3-7. Выделенные БАФ в составе фармацевтической композиции используют в способах повышения иммунного статуса пациента. Изобретение позволяет выделить из грамоотрицательных бактерий биологически активную фракцию S-ЛПС, характеризующуюся высокой иммуногенностью, способностью индуцировать продукцию цитокинов, с низкой пирогенностью и эндотоксичностью. 5 н. и 36 з.п. ф-лы, 4 ил., 14 табл.
Реферат
Область техники
Изобретение относится к области медицины, в частности к способу выделения биологически активной фракции (БАФ), содержащей преимущественно нативный низкотоксичный S-липополисахарид (S-ЛПС), полученной из бактерий, продуцирующих эндотоксичные липополисахариды (ЛПС), для применения в клинической и экспериментальной медицине с целью профилактики и лечения заболеваний.
Уровень техники
ЛПС являются основными полисахаридными антигенами грамотрицательных бактерий. Они расположены на внешней поверхности наружной мембраны клеточной стенки и играют важнейшую роль в патогенезе многих инфекций (1). ЛПС активно участвуют в построении и функционировании физиологической мембраны микроорганизма и чрезвычайно важны для его роста и выживания (1, гл.2). С другой стороны ЛПС являются первичной мишенью для взаимодействия с антибактериальными лекарственными препаратами и компонентами иммунной системы организма хозяина.
В состав ЛПС входит гидрофильный гетерополисахарид (О-специфический полисахарид), построенный из повторяющихся олигосахаридных звеньев, который в основном определяет иммунологическую специфичность бактериальной клетки. О-Специфический полисахарид ковалентно присоединяется к разветвленному олигосахариду "кора", содержащему 10-12 моносахаридных остатков, который в свою очередь связан с гидрофобным липидным фрагментом - липидом А, удерживающим молекулу ЛПС во внешней мембране микробной клетки. На границе между "кором" и липидом А расположены три остатка 2-кето-З-дезоксиоктулозоновой кислоты (КДО), кетозидная связь которых чрезвычайно кислотолабильна. Полноценные ЛПС, содержащие все три фрагмента - О-специфический полисахарид, "кор" и липид А, выделяют из штаммов грамотрицательных микроорганизмов, которые культивируют на твердых культуральных средах в виде гладких (smooth) колоний и которые, поэтому, называют S-ЛПС. Из штаммов, которые вырастают в виде шероховатых (rough) колоний, обычно выделяют ЛПС, лишенные О-специфической полисахаридной цепи - так называемые R-ЛПС.
В отличие от O-специфического полисахарида, который сам по себе иммунологически неактивен, липидная компонента ЛПС определяет весь комплекс патофизиологических свойств ЛПС, в частности его высочайшую эндотоксичность и пирогенность. Липид А также определяет адъювантные свойства ЛПС и, как следствие, их чрезвычайно высокую иммуногенность.
ЛПС обладают широким спектром "положительных" биологических характеристик, которые интенсивно изучаются в экспериментах на животных и людях, а также in vitro. Под широким спектром "положительных" биологических свойств обычно подразумевают способность ЛПС проявлять себя в качестве мощных протективных антигенов, оказывать антибактериальное и антивирусное действие, а также выступать в качестве иммуностимулятора и адъюванта (1).
Иммунизация животных микрограммовыми количествами ЛПС вызывает индукцию высоких титров специфических антител различных классов, что определяет их вакцинный потенциал. С другой стороны узнавание ЛПС макрофагами приводит к индукции многих провоспалительных медиаторов, включая фактор некроза опухоли-α (ФНО-α), интерлейкины 1,6 и 12 (ИЛ-1, ИЛ-6 и ИЛ-12 соответственно), интерфероны (ИФН) α и β, хемокины и липидные медиаторы (1). Кроме того, макрофаги, активированные ЛПС, могут выступать в роли антиген-презентирующих клеток для CD4+ Т-клеток. В кооперации с ИФН-γ ЛПС стимулирует макрофаги к транскрипции генов, кодирующих NO-синтетазу, что, в свою очередь, приводит к синтезу токсичного окислителя - NO. Стимуляция макрофагов с помощью ЛПС и ИФН-γ приводит к появлению высокоактивного фенотипа, характеризующегося мощным бактерицидным и противоопухолевым потенциалом (1, гл.63). Таким образом, стимуляция макрофагов ЛПС приводит к развитию местного иммунитета к грамотрицательным бактериям и, посредством продукции ИЛ-1, ИЛ-6 и ФНО-α, к различным отдаленным и системным эффектам, что играет важную роль в борьбе не только с инфекцией, но и с опухолями.
С другой стороны, нативные традиционные ЛПС являются весьма опасными для человека биологически активными веществами. Попадание в организм небольшого количества ЛПС в составе бактериального продукта или в качестве контаминирующей субстанции может привести к эндотоксическому шоку, сопровождаемому тяжелыми гемодинамическими расстройствами (1, гл.55). Однако полезные фармакологические эффекты, проявляемые ЛПС при целом ряде патологических состояний (инфекция, опухолевой процесс), являются настолько важными, что в нескольких направлениях предпринимаются попытки применения ЛПС или их производных в клинической медицине (1, гл.63).
Существующие подходы к получению клинически применимых ЛПС сегодня связаны с изменением их нативности, то есть с частичной модификацией их структуры.
Одним из таких подходов является химическая модификация ЛПС, например мягкая щелочная или ферментативная обработка, приводящая к изменениям в структуре липида А. Происходящее при этом элиминирование части жирных кислот и фосфатсодержащих заместителей приводит с одной стороны к уменьшению эндотоксичности ЛПС, но с другой - к снижению уровня иммунного ответа вплоть до полной утраты некоторых иммунобиологических функций модифицированных ЛПС.
До разработки группы соединений, защищаемых настоящим патентом, не удавалось непосредственно использовать ЛПС в качестве вакцин, вследствие их высокой токсичности. Поэтому в состав нескольких разработанных к настоящему времени конъюгированных вакцин против инфекций, вызываемых Salmonella enterica sv paratyphi A, Shigella sonnet, Shigella flexneri, испытывающихся на добровольцах (2, 3, 4), входят конъюгаты О-специфического полисахаридного компонента ЛПС с белковым носителем. Потерянный в результате элиминирования липида А иммуногенный потенциал ЛПС частично восстанавливается с помощью использования белкового носителя и оптимизации схем иммунизации, направленных на индукцию вторичного иммунного ответа.
Патент США 6221386, опубл. 24.04.2001, описывает способ выделения S-ЛПС из грамотрицательных бактерий (Brucella melitensis), производящих эндотоксичные S-ЛПС, в ходе которого:
1) выращивают культуру Brucella melitensis;
2) инактивируют клетки 2% фенолом, затем проводят центрифугирование и неочищенный S-ЛПС осаждают метанолом в 1% ацетате натрия;
3) проводят экстракцию (фенол-водную) с последующим диализом, отделением нерастворимого материала (ультрацентрифугированием) и лиофилизацией;
4) очищают полученный на стадии (3) экстракт от примесей с помощью обработки лизоцимом, нуклеазами и далее протеиназой К.
Однако выделенные S-ЛПС применяются исключительно в капсулированной форме (липосомальных системах), для исключения побочных действий при введении их в организм в эффективных количествах, требуемых для формирования иммунитета.
Другое направление клинического применения денатурированных ЛПС - толерогенные противошоковые вакцины. Идея использовать ЛПС в качестве толерогенной противошоковой вакцины для создания рефрактерности организма к последующему массивному попаданию эндотоксина не нова (1, гл.50). Вместе с тем этот подход не теряет свою актуальность вследствие исключительной важности контроля клинических ситуаций, приводящих к эндотоксическому шоку. Сравнительно недавно в клинических и экспериментальных исследованиях продемонстрирована индукция ранней или поздней толерантности к последующему введению эндотоксина не только с помощью ЛПС, но и его производного монофосфориллипида A (MPL), а также синтетических аналогов липида А (1, гл.50). MPL - также хорошо известен как иммуномодулятор широкого спектра действия и адъювант.
Другой путь снижения эндотоксичности ЛПС - это функциональная детоксификация ЛПС с помощью циклических пептидов (1, гл.23), специфических белков (1, гл.19, 21) или поликатионных соединений (1, гл.11), причем каждое из перечисленных выше соединений способно специфически связываться с липидным фрагментом ЛПС. Это направление представляется перспективным для очистки крови или плазмы больных в системах экстракорпоральной обработки, используя твердофазную матрицу, содержащую лиганды, специфические для липида А. Однако в настоящее время недостаточно изучено, какие процессы могут происходить при введении в организм млекопитающего подобного рода комплексов. Так остается неясным вопрос об их иммуногенности, биодеградируемости, токсичности, возможности накопления в различных тканях и т.д.
Отдельного рассмотрения требует опыт применения ЛПС для лечения опухолевых процессов. Клинические исследования по применению ЛПС для терапии опухолей достаточно хорошо известны (1, гл.63). В настоящее время для лечения опухолей используются не только все возможные варианты модифицированного ЛПС (химические производные, синтетические аналоги, продукты функциональной детоксификации), но и нативный высокотоксичный эндотоксин. Последние исследования в этом направлении посвящены изучению возможностей комбинированной терапии ЛПС с γ-интерфероном. Высокая эндотоксичность позволила авторам данного исследования использовать лишь исключительно низкие дозы для внутривенного введения - 1-4 нг на кг веса.
В отличие от традиционных ЛПС группа низкоэндотоксичных нативных БАФ ЛПС, защищаемых настоящим патентом, отличается чрезвычайно широким интервалом доз клинического применения, что создает новые возможности для клинициста в создании эффективных схем лечения.
Сущность изобретения
Предлагаемый нами оригинальный подход к получению БАФ низкоэндотоксичных нативных S-ЛПС представляет собой комбинацию современных и эффективных методов, при использовании которой появляется возможность, с одной стороны, получения высокоочищенных ЛПС (содержание примесных соединений не более 4%), а с другой стороны - выделения из суммарного "родительского" ЛПС низкоэндотоксичной фракции, причем условия проведения всех этапов выделения и очистки предполагают максимальное сохранение первичной структуры ЛПС.
Выделение и очистка заявляемых БАФ включает экстракцию, ферментативную обработку экстракта для разрушения примесных нуклеиновых кислот и белков и последующее фракционирование сырого ЛПС с помощью различных методов.
Основным методом на стадии экстракции является обработка 45%-ным горячим водным фенолом по Вестфалю (5). В настоящее время именно этот метод используется для выделения ЛПС, так как он, с одной стороны, обеспечивает высокий выход ЛПС, а с другой - предполагает устойчивость гликозидных и кетозидных связей моносахаридных остатков и связей неуглеводных заместителей в полисахаридном и липидном фрагменте ЛПС.
Ферментативную обработку экстракта проводят для расщепления до моно- и олигомерных фрагментов рибо- и дезоксирибонуклеиновых кислот, а также белковых компонентов бактериальной клетки. Ферментативный гидролиз нуклеиновых кислот проводят одновременным действием рибонуклеазы-А и дезоксирибонуклеазы в буферах, содержащих ионы кальция и магния. Выбор нуклеаз не носит принципиального характера: при использовании фермента с пониженной активностью необходимо увеличить его концентрацию и время реакции. Далее к реакционной смеси прибавляют динатриевую соль этилендиаминтетрауксусной кислоты для связывания ионов двухвалентных металлов и протеазу, обычно протеиназу К.
Выделение БАФ S-ЛПС из неочищенного ЛПС, полученного после обработки ферментами, может быть проведено экстракцией смесью хлороформ-метанол-0,2М HCl [6]. Однако при использовании для экстракции смеси с указанным в работе [6] соотношением экстрагентов выделяется продукт с пирогенностью, в 8-16 раз превышающей предел, установленный Фармакопеей для полисахаридных вакцин (0,050 мкг/кг веса кролика).
В этой связи соотношение растворителей в смеси для экстракции с целью повышения ее полярности и гидрофильности было изменено по сравнению с описанным в работе [6] и составило 1:1:0,4-0,5. Выход апирогенной БАФ S-ЛПС при этом не превышал 1% от веса неочищенного ЛПС.
Ультрацентрифугирование проводят в водных, возможно забуференных растворах, возможно содержащих хаотропные агенты, при концентрации ЛПС, не превышающей 1%. Для ЛПС, выделенного из каждого конкретного микроорганизма, условия ультрацентрифугирования, включая скорость и время, подбираются специально. Так при снижении скорости и/или уменьшении времени ультрацентрифугирования наблюдается повышение содержания низкомолекулярного ЛПС в конечном продукте, а при превышении этих параметров - резкое падение выхода. Критерием оптимальности выбора условий ультрацентрифугирования может служить уровень эндотоксичности, БАФ, выделенной из супернатанта.
Важно подчеркнуть, что ультрацентрифугирование, а также все описанные ниже способы выделения апирогенной БАФ S-ЛПС могут быть применены как к продукту ферментативной обработки, так к продукту, полученному на стадии экстракции смесью хлороформ-метанол-0,2М HCl.
Фракционирование БАФ с помощью препаративного электрофореза в полиакриламидном геле представляется достаточно перспективным, т.к. появляется возможность выделять достаточно узкие фракции ЛПС, варьируя количество сшивок в геле (от 7,5 до 12,5%), но, в свою очередь, имеет ряд недостатков. Так, очевидны трудности в разделении граммовых количеств исходного ЛПС, а также осложнения, связанные с возможностью загрязнения целевого продукта фрагментами деградации (механической или химической) полиакриламидного геля.
Указанных выше недостатков лишен метод фракционирования ЛПС с использованием мембран для ультрафильтрации фирмы "Миллипор". Однако в силу значительного разброса в размерах пор этих мембран в результате фракционирования могут быть выделены лишь достаточно 'широкие' фракции S-ЛПС, для которых интервал в значениях молекулярной массы может достигать 20-30kDa, т.е. при использовании. например, мембран с "cut off" 50kDa сквозь поры могут проходить молекулы S-ЛПС с молекулярной массой 60 или даже 70kDa. Кроме того в некоторых случаях для повышения качества разделения возникает необходимость в использовании детергентов, таких как, например, Тритон X-100, роль которых заключается в демицеллировании ЛПС. В этом случае особой проблемой становится удаление детергента из конечного продукта. Для этого часто используется прибавление к раствору ЛПС при фракционировании низших спиртов, обычно этанола в концентрациях до 30%. В этой связи данный подход удобнее всего использовать для удаления из нефракционированного ЛПС его низкомолекулярных фракций.
Ионообменная гель-хроматография представляется достаточно удобным методом выделения целевых S-ЛПС только в том случае, если в их состав входят О-специфические полисахариды, содержащие заряженные остатки, как, например, при фракционировании ЛПС Sh.sonnei, фаза 1(O-полисахарид несет карбоксильные и аминогруппы) (7).
Основным затруднением при использовании как ионообменной, так и гель-проникающей хроматографии является заметная склонность ЛПС к агрегации. Для того чтобы исключить влияние этого нежелательного фактора, возможно введение в элюэнт органических растворителей (спирты, ацетонитрил), хаотропных агентов или детергентов (неионных в случае ионообменной хроматографии). Несмотря на огромный выбор коммерчески доступных носителей для ионообменной хроматографии обычно используется DEAE-Sephadex, а для гель-проникающей хроматографии - Sepharose 2В, 4В или 6B-CL.
Одним из наиболее удобных методов разделения амфифильных высокомолекулярных соединений является гидрофобная хроматография с использованием бутил-, октил- или фенил- Sepharose. Нами показано, что электродиализ с последующим образованием триэтиламмониевой соли ЛПС при подготовке образца для препаративной гидрофобной хроматографии [7] может быть с успехом заменен на обработку хелатирующими ионообменными смолами. Необходимо также обращать внимание на то, что суммарную гидрофобность молекулы ЛПС определяет не только липидная компонента, но и, в заметной степени, природа моносахаридов, входящих в состав O-специфического полисахарида (наличие в нем О- и N-ацетил-, а также дезоксисахаров). С другой стороны, широкий выбор носителей и элюентов для градиентного разделения позволяет во многих случаях успешно оптимизировать процесс выделения целевой фракции S-ЛПС.
Таким образом, предложена методология выделения заявляемой БАФ из различных грамотрицательных бактерий, которая в качестве обязательных стадий включает экстракцию с последующей деградацией примесных белков и нуклеиновых кислот действием ферментов, тогда как дальнейшее фракционирование для получения целевого продукта может быть осуществлено с использованием одного из описанных выше способов или их комбинаций. При этом на выбор стадии процесса фракционирования в каждом конкретном случае влияет несколько факторов, в частности вид микроорганизма, желаемый набор иммунобиологических характеристик (например, пирогенность, токсичность), выход БАФ при использовании того или иного подхода, необходимый количественный уровень целевого продукта, стоимость и характеристики производства и др. факторы.
Приведенная выше схема выделения и очистки заявляемой БАФ на основе S-ЛПС (в отличие от препаратов модифицированных ЛПС) предполагает полное сохранение "нативности" и "неизменяемости" первичной структуры ЛПС.
Анализируя состав и строение заявляемых БАФ, необходимо отметить, что, как и указывалось выше, исходя из данных ЯМР-спектров, во всех случаях структура О-специфического полисахаридного компонента ЛПС, входящего в состав заявляемой БАФ, не отличалась от описанной ранее в литературе.
Что касается олигосахаридного "кора", расположенного в ЛПС на границе О-специфический полисахарид - липид А, исследование, подтверждающее его наличие в составе заявляемых БАФ, было проведено с помощью идентификации в них двух "обязательных" для "кора" компонентов - гептозы [методом комбинированной газожидкостной хроматографии-масс-спектрометрии (ГЖХ-МС)] и КДО (колориметрической реакцией с тиобарбитуровой кислотой).
Единственные обнаруженные к настоящему времени отличия в структуре между "родительскими" ЛПС и заявляемыми препаратами БАФ были установлены нами в результате сопоставления данных анализа жирнокислотного состава методом липида А.
Поэтому в рамках настоящей работы особое внимание было уделено именно липидному компоненту заявляемых БАФ, так как он, как указывалось выше, определяет весь комплекс патофизиологических свойств ЛПС. Ниже после краткого обзора структур липида А из ЛПС семейства Enterobacteriaceae будут рассмотрены некоторые особенности липидного компонента заявляемых БАФ.
В основе липида А лежит дисахарид β-(1'-6)-D-глюкозаминил-D-глюкозамин, который несет две фосфатные группировки - одну в положении 4' невосстанавливающего остатка D-глюкозамина, а другую (присоединенную α-связью) - в положении 1 восстанавливающего остатка D-глюкозамина. Обе аминогруппы остатков аминосахаров в дисахариде замещены остатками (R)-3-гидрокситетрадекановой кислоты [14:0(3-ОН)], а два других остатка этой кислоты присоединены сложноэфирной связью в положения 3 и 3' обоих остатков D-глюкозамина дисахаридного фрагмента. Оба остатка [14:0(3-ОН)], локализованные в невосстанавливающем остатке D-глюкозамина, в свою очередь замещены по гидроксильным группам остатками тетрадекановой и додекановой кислот. Эта, так называемая, "классическая" структура липида А характерна (с некоторыми незначительными вариациями в природе заместителей при фосфатных группах) для подавляющего большинства ЛПС семейства Enterobacteriaceae.
Многочисленные публикации последних десяти лет посвящены установлению первичной структуры липида А ЛПС, выделенных из микроорганизмов этого и других семейств и родов грамотрицательных бактерий, их встречному синтезу и синтезу их многочисленных аналогов, а также исследованию и сопоставлению биологических характеристик выделенных и синтезированных липидов (1, гл.14,46,47). Из анализа результатов этих работ сделан вывод, что любое значительное отклонение от "классической" структуры липида А приводит к заметному, а в некоторых случаях к драматическому снижению их эндотоксичности (1, гл.46, 47). Главную роль при этом играет качественный и количественный состав жирных кислот. Так липид А, содержащий не "классический" набор из шести жирных кислот, а имеющий в своем составе семь или пять их остатков, проявляет значительно более низкую in vivo эндотоксическую активность [пирогенность (кролики) и летальную токсичность (мыши)] (1, гл.46,47) по сравнению с "классическим" липидом А. Кроме того в отличие от "классического" липида А для указанных выше липидов А характерно наличие жирных кислот с более длинной или более короткой углеводородной цепью, которые могут содержать НО-группу при С-2 (а не при С-3), оксогруппу, двойную связь, разветвление у метиленого звена, соседнего с метильной группой, и даже циклопропановый фрагмент. Так, показано, что низкая эндотоксичность ЛПС Bacteroides fragilis связана с тем, что липид А этих ЛПС обладает уникальным набором жирных кислот: часть жирных кислот с тетрадекановым скелетом заменяется жирными кислотами с шестнадцатью атомами углерода (1, гл.7).
В рамках настоящего исследования было показано, что липид А заявляемой БАФ наряду с "обязательными" для "классического" липида А жирными кислотами (в частности, [14:0(3-ОН)], тетрадекановой и додекановой кислотами), содержал и редко встречающиеся жирные кислоты, например, гекса- и октадекановую, при этом наблюдалось также резкое падение содержания [14:0(3-ОН)]. Следовательно строение липида А заявляемых БАФ на основе S-ЛПС заметно отличается от "классического", что явным образом может сказываться на их эндотоксических характеристиках.
В этой связи становится возможным констатировать, что в состав высокоэндотоксичных ЛПС грамотрицательных микроорганизмов могут входить фракции S-ЛПС с пониженным уровнем эндотоксичности и пирогенности, которые могут быть использованы в клинической практике.
В данной работе мы получили несколько доказательств "нативности" заявляемых препаратов. Во-первых, сопоставление жирнокислотного состава липида А и ЯМР-спектров полисахаридных фрагментов БАФ, выделенных разными способами (напр., действием водного фенола и трихлоруксусной кислоты) показало их полную идентичность по этим параметрам. Во-вторых, во всех случаях наблюдались ярко выраженные серологические реакции между БАФ и соответствующих анти-O-сыворотками, а также сыворотками больных людей (с бактериологически подтвержденным диагнозом). В-третьих, в случае наиболее распространенного метода выделения ЛПС - экстракции горячим водным фенолом удалось показать, что при повторной обработке выделенных препаратов в условиях экстракции ни изменения жирнокислотного состава, ни спектральных характеристик выделенных препаратов не происходит. В-четвертых все БАФ проявляли высокую иммунобиологическую активность.
БАФ, защищаемые настоящим патентом, по уровню безопасности резко отличаются от препаратов ЛПС, получаемых традиционными методами. Они удовлетворяют требованиям Технического комитета экспертов ВОЗ по параметрам безопасности для менингококковых и брюшно-тифозной Vi-антигенной полисахаридных вакцин (8).
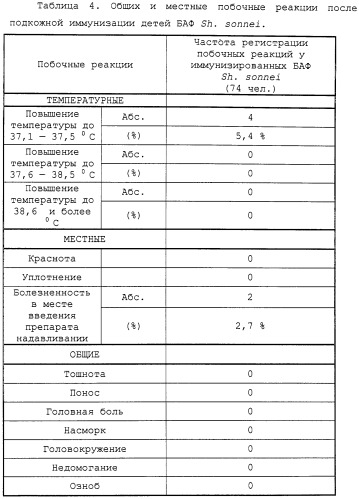
При парентеральном введении добровольцам БАФ Sh.sonnet в дозах 25, 50, 75 мкг под контролем Национального Контрольного Органа России (НКО) в рамках клинических испытаний дизентерийной вакцины не только не наблюдалось эндотоксического шока, но и существенных общих или местных эндотоксических реакций. Таким образом, дозы клинического применения заявляемых БАФ сравнимы с таковыми для капсульных вакцинных полисахаридов и существенно (в 100-1000 раз) выше доз введения человеку рутинных ЛПС при различных клинических исследованиях (9). Многократные последующие клинические испытания препарата подтвердили его высокий уровень безопасности: отсутствие общих реакций, таких как озноб, головная боль, только легкие (<37,6) подъемы температур не более чем у 10% привитых, весьма редкие местные реакции в виде покраснения или болезненности в месте введения.
БАФ Sh.sonnet был также безопасен при введении детям разных возрастных групп 3-6, 7-10, 10-14 лет в дозе 25-50 мкг подкожно. Уровень реактогенности, оцениваемый по общим и местным реакциям, существенно не отличался у детских и взрослых контингентов.
Безопасность БАФ, отсутствие пирогенных реакций при подкожном введении вакцинных доз препарата в клинических и экспериментальных исследованиях может быть иммунологически объяснена сравнительно низкой активацией БАФ продукции α-TNF - одного из ключевых медиаторов эндотоксической реакции. Подкожное введение БАФ Sh.sonnet добровольцам в дозах 50, 75 мкг не приводит к достоверному росту содержания α-TNF в сыворотке крови добровольцев после первичной или вторичной иммунизации.
Проведенные экспериментальные и клинические исследования также свидетельствуют о том, что заявляемые БАФ являются мощными иммуногенами и могут быть использованы в качестве вакцин. Они вызывают индукцию О-специфических протективных антител у млекопитающих, включая человека, при этом гуморальный иммунный ответ представлен всеми основными классами антител IgG, IgA, IgM. Такие антитела являются бактерицидными для микроорганизмов, против которых они направлены. На моделях противоинфекционного иммунитета они обеспечивают защиту макроорганизма от гомологичного штамма возбудителя брюшного тифа или шигеллеза (10). При иммунизации добровольцев отдельными препаратами БАФ отмечается выраженный подъем уровня сывороточных O-специфических антител и сероконверсия (подъем уровня антител ≥4 раз) у 80-90% иммунизированных лиц. Персистенция высоких уровней специфических антител приводит к защите популяции от инфекции шигеллеза Зонне.
Характерной особенностью иммуногенности низкоэндотоксичных БАФ является мощная сочетанная активация как системного, так и местного IgA иммунного ответа. Иммунизация БАФ Sh.sonnei морских свинок приводит к индукции местного иммунитета и защищает их слизистую конъюнктивы глаза от заражения гомологичным вирулентным штаммом. В слюне иммунизированных добровольцев определяются О-специфические антитела, продуцируемые локально и выявляемые с помощью MAT к α-цепи и секреторному компоненту. При этом сероконверсия IgA специфических антител достигает 100% (11).
Проведенные НКО России полевые испытания вакцины против шигеллеза Зонне, представляющей собой фармацевтическую композицию на основе БАФ в эндемичном по инфекции районе Саратовской области, выявили высокую профилактическую эффективность препарата. Препарат обеспечивал защиту гражданского населения в наиболее неблагоприятный летне-осенний период подъема заболеваемости шигеллезом Зонне. Средний индекс эффективности вакцины превысил 90% (12).
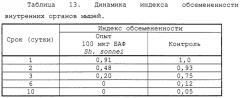
Использование низкоэндотоксичных БАФ в качестве толерогенной противошоковой вакцины эффективно и может снять проблему токсичности подобного препарата, весьма важную для пациентов хирургической клиники. Полная выживаемость экспериментальных животных после инъекции БАФ из ЛПС Shigella sonnei, Salmonella enterica sv typhi, Escherichia coli за 12 часов перед последующем введением летальной дозы эндотоксина свидетельствует о формировании выраженной невосприимчивости к бактериальному эндотоксину.
Низкоэндотоксичные БАФ обладают разносторонним воздействием на иммунную систему и являются иммуномодуляторами, оказывающими влияние на резистентность макроорганизма к опухолевому росту. Иммуномодулирующее действие БАФ в отличие от вакцинного особенно четко проявляется при более высоких дозах препаратов 50-150 мкг и многократном введении.
Группа заявляемых препаратов обладает противораковым эффектом, установленным в эксперименте in vivo с использованием перевиваемых клеток мастоцитомы Р855. Двукратное введение препарата БАФ из Salmonella enterica sv typhi мышам Balb/c до инокуляции клеток мастоцитомы приводит к росту выживаемости животных. Сходный эффект отмечался при введении препарата в ранние (до 24 часов) сроки после инокуляции
БАФ ЛПС существенно повышает резистентность мышей к заражению естественной инфекций Salmonella enterica sv typhimurium - бактериальному патогену с облигатным внутриклеточным паразитированием.
Основой иммуномодулирующего эффекта группы заявляемых препаратов является рациональная активация цитокинов, опосредующих механизмы противоинфекционного иммунитета. Среди ключевых медиаторов иммунитета, играющих важную роль в иммунитете к вирусным и бактериальным инфекциям с внутриклеточным паразитированием, главным представляется γ-интерферон. БАФ из ЛПС Shigella sonnei является мощным индуктором γ-ИФН in vivo в дозе 100 мкг.
БАФ, заявляемые в настоящем патенте, могут быть использованы не только как вакцины, но и как вакцинные носители для конструирования конъюгированных вакцин для млекопитающих, включая человека. С использованием конъюгирующих агентов, в частности карбодиимида, был получен конъюгат капсульного полисахарида вакцинного качества S.typhi (Vi-антигена) с БАФ Sh.sonnei, выбранной в качестве носителя. Конъюгаты, связанные прочной амидной связью, были стабильны в диссоциирующих условиях. БАФ может быть использована также в качестве носителя для белковых антигенов, что особенно важно, вследствие практически полного отсутствия таких матриц в вакцинологии.
Следует подчеркнуть возможность конструирования вакцин и иммуногенов на основе заявляемых БАФ без создания ковалентных химических связей между полимерными молекулами. Нами установлен факт включения в состав высокомолекулярных мицелл, формирующихся при самосборке БАФ, модельного белкового антигена - сывороточного альбумина человека. Подобные "квазиконъюгированные" вакцины представляют собой высокомолекулярные 1000-5000 Кд комплексы, включающие молекулы необходимых антигенов и мицеллообразующего иммуностимулирующего носителя БАФ.
Отдельного рассмотрения требует вопрос об архитектонике надмолекулярных структур ЛПС, которые существуют во внешней мембране клеточной стенки грамотрицательных бактерий и явным образом разрушаются в процессе экстракции, но воссоздаются вновь после удаления полимерных и низкомолекулярных бактериальных компонентов в процессе очистки ЛПС. Выделенные ЛПС в водных растворах склонны к самоорганизации в структуры, которые, как показано с помощью электронной микроскопии (1, гл.11), напоминают фрагменты бактериальной мембраны.
Таким образом, группа заявляемых препаратов представляет собой высокоиммуногенные клинически применимые БАФ, содержащие преимущественно S-ЛПС с низким уровнем эндотоксичности и пирогенности, в состав которого входит липид А, жирнокислотный состав которого может отличаться от жирнокислотного состава, определенного для исходного суммарного ЛПС данного микроорганизма.
ПЕРЕЧЕНЬ ФИГУР ЧЕРТЕЖЕЙ
Полученные продукты по настоящему изобретению были подвергнуты анализу с помощью ЯМР-спектроскопии и хроматомасс-спектрометрии.
Фиг.1 демонстрирует спектр 13С-ЯМР О-специфического полисахарида Sh.sonnei.
Фиг.2 демонстрирует спектр 1Н-ЯМР О-специфического полисахарида Sh.sonnei.
Фиг.3 демонстрирует хроматограмму метанолизата липида А, выделенного из БАФ Sh.sonnei.
Фиг.4 демонстрирует хроматограмму метанолизата липида А из ЛПС Sh.sonnei, выделенного по методу Вестфаля.
ПРИМЕРЫ
Следующие примеры, приведенные в целях детализации и иллюстрации изобретения, не имеют цели ограничения притязаний настоящего изобретения.
Пример 1.
I. Экстракция
Экстракцию высушенных ацетоном бактериальных клеток Sh.sonnei. фаза 1 (20 г) проводили 45%-ным водным фенолом (700 мл) при интенсивном механическом перемешивании в термостатированном при 68-72°С сосуде в течение 15 минут, охлажденную до 10-15°С суспензию подвергали центрифугированию в течение 40 минут при 5000 g, верхний водный слой отделяли и диализовали в течение 5 суток против дистиллированной воды, нерастворимый осадок отделяли центрифугированием при 13,000 g и супернатант лиофилизовали. Выход продукта экстракции составил 12% от веса сухих клеток. Содержание нуклеиновых кислот (УФ-поглощение) и белков (метод Лоури) составляло 35-40% и 10-15%, соответственно. Полученный таким образом продукт экстракции (начальная концентрация 100 мкг/мл) был активен в реакции торможения пассивной гемагглютинации (РТПГА) с кроличьей сывороткой, полученной при иммунизации убитой культурой Sh.sonnei, фаза 1, в разбавлении 1:128.
II. Ферментативный гидролиз
2 г сырого экстракта, содержащего в основном ЛПС, нуклеиновые кислоты и водорастворимые белки, растворяли в 100 мл буфера, содержащего 0,2М NaCl, 0,05М ТРИС-HCl и 0,001М MgCl2H CaCl2, рН 7,2-7,6, полученный раствор перемешивали 2 часа при температуре 37°С с рибонуклеазой А (активность 50-100 единиц/мг, 50 мкг/мл раствора) и дезоксирибонуклеазой (активность 400-800 единиц/мг, 5 мкг/мл раствора), далее к раствору прибавляли протеиназу К (активность 10-20 единиц/мг, 20 мкг/мл раствора), раствор перемешивали 1 час при температуре 50°С. Реакционную смесь диализовали 3 суток против дистиллированной воды и лиофилизовали.
III. Ультрацентрифугирование
1 г продукта, полученного на стадии II, растворили в 120 мл воды, ультрацентрифугирование раствора проводили с использованием ультрацентрифуги Бекман (США) при температуре 5°С, ускорении 80,000 g в течение 8 часов. Полученный супернатант лиофилизовали.
IV. Выделение БАФ с помощью экстракции.
При необходимости вместо стадии III проводили экстракцию смесью хлороформ-метанол-0,2М водн. HCl. Для получения БАФ Sh.sonnet использовали указанную выше смесь при соотношении компонентов 14:13:5; содержание твердой фазы 10 мг/мл.
V. Фракционирование на пористых матрицах.
При необходимости вместо стадии III и/или IV использовали препаративный электрофорез в 10%-ном полиакриламидном геле, (толщина геля 1,5 мм, подвижность БАФ относительно бромфенолового синего 0,1-0,3; элюцию проводили с помощью Whole Gel Eluter, Bio-Rad) или гидрофобную хроматографию (колонка с октил-Сефарозой в буфере, содержащем 10% пропанола и 0,05М бикарбоната аммония, рН 8,1) или с помощью гель-хроматографии на колонке с сефадексом G-50 (1,5M водный бикарбонат аммония) или ультрафильтрацию с помощью системы Pellicon (Millipore) (мембрана с "cut-off" 10kD) или ионообменную хроматографию на колонке с ДЕАЕ-целлюлозой (0.01-0.75 М градиент бикарбоната аммония).
VI. Очистка БАФ
Обессоливание БАФ после фракционирования, если необходимо, проводили с помощью гель-хроматографии на колонке с сефарозой 4B-CL в воде или 0,05М пиридин-ацетатном буфере при температуре 4°С, фракции, содержащие БАФ, которые элюировались вблизи свободного объема колонки, объединяли и лиофилизовали.
Результаты представлены в таблице 1.
| Таблица 1.Выделение БАФ из неочищенного ЛПС Sh.sonnet с использованием различных методов фракционирования | ||
| Стадия | Метод | Выход апирогенной (в дозе 0,050 мкг/кг веса кролика) БАФ в % веса сырого ЛПС |
| III | Ультрацентрифугирование | 3-5% |
| IV | Экстракция ЛПС смесью хлороформ-метанол-0,2 М HCl | <1% |
| V | Препаративный гель-электрофорез в ПААГ | 1-3%* |
| V | Ультрафильтрация на мембранах фирмы "Millipore" | 5-7%* |
| V | Ионообменная хроматография | <1% |
| V | Гидрофобная хроматография | 3-5% |
| V | Гель-хроматография | 3-5% |
| * - доза снижена до 0,0125-0,0250 мкг/кг веса кролика из-за того, что в более высокой дозе продукт пирогенен. |
ПРИМЕР 2. Подтверждение строения О-специфического полисахарида и липида А, выделенных из БАФ Sh.sonnei, с помощью ЯМР-спектроскопии и хроматомасс-спектрометрии.
O-Специфический полисахарид и липид А были выделены из БАФ Sh.sonnei в результате мягкого кислотного гидролиза и последующего осаждения нерастворимого липида А.
Спектры 13С-ЯМР и 1Н-ЯМР О-специфического полисахарида (фиг.1 и 2, соответственно) были записаны с использованием прибора Brucker WM-250 в растворе D2O (образец перед съемкой 1Н был лиофилизован из D2O) при температуре 297 К или 303 К.
Анализ спектральных данных, полученных по методикам COSY, TOCSY и ROESY, позволил сделать однозначное отнесение всех сигналов в спектрах 13С-ЯМР и 1Н-ЯМР и подтвердить, что повторяющееся звено ПС представляет собой β-(1-3)-связанный дисахарид 2-ацетамидо-2-дезокси-4-O-(2-ацетам