Олигопептиды
Иллюстрации
Показать всеОлигопептид или его соль, выбранные из группы, состоящей из олигопептида (1) и (2): Lys-Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu (I), Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu (II), Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp (III), Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln (IV), Ser-Ile-Glu-Gln-Ser-Cys-Asp (V), Ser-Ile-Glu-Gln-Ser-Cys (VI), Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu (VII), Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu (VIII), Gln-Ser-Cys-Asp-Gln-Asp-Glu (IX); 2) олигопептид, имеющий аминокислотную последовательность, полученную посредством делетирования по C- или N- концу одной или нескольких аминокислот в любой аминокислотной последовательности (I)-(IX), и модифицированный олигопептид, представляющий собой биотинилированный или димеризованный по сульфогидрильной группе остатка цистеина олигопептид на основе олигопептида, определенного в (1) или (2). Олигопептиды обладают активностью по стимулированию роста волос. 5 н. и 6 з.п. ф-лы, 4 ил., 1 табл.
Реферат
Техническая область
Данное изобретение относится к олигопептидам, имеющим активность, способствующую росту волос, и агенту, способствующему росту волос, включающему указанный олигопептид в качестве активного ингредиента.
Предпосылки изобретения
Предполагалось, что нормальный морфогенез эпителиальной ткани регулируется факторами, происходящими из клеток мезенхимы, присутствующими вокруг эпителиальной ткани. Заболевания, происходящие в результате аномального морфогенеза эпителиальной ткани, зачастую вызываются аномалиями клеток мезенхимы. Поэтому возник интерес к выяснению механизмов регуляции морфогенеза эпителиальной ткани клетками мезенхимы. Однако вещества, участвующие в регуляции морфогенеза эпителиальных тканей, проявляют свое регуляторное действие в зависимости от времени и пространства и в виде сложной системы и соответственно крайне сложно выделить эти вещества и проанализировать их функции. Также сложно сконструировать модельную экспериментальную систему, упрощающую морфогенез эпителиальной ткани. По этим причинам к настоящему времени не произошло существенного прогресса в исследованиях в данной области. Таким образом, крайне желательно проанализировать механизмы, регулирующие морфогенез эпителиальной ткани, с целью пролить свет на механизм возникновения заболеваний, связанных с морфогенезом эпителиальной ткани, и разработать способы лечения этих заболеваний.
Для этой цели был выделен эпиморфин, участвующий в регуляции морфогенеза эпителиальной ткани (открытая опубликованная патентная заявка Японии, Публикация №25295/94). Было выявлено, что это вещество, являющееся физиологически активным веществом, содержащее белок, который состоит из 277-289 аминокислот в качестве "корового" белка, синтезируется в основном мезенхимальными клетками. Также было обнаружено, что этот эпиморфин имеет действие, способствующее морфогенезу эпителиальной ткани посредством действия на клетки эпителия, и что нормальное формирование ткани не происходит, если эпиморфин не функционирует.
Что касается структуры эпиморфина, обнаружено, что молекула этого эпиморфина может быть грубо разделена по структуре на 4 фрагмента (EP 0698666). То есть, полипептид, состоящий из полноразмерного эпиморфина, может быть разделен на следующие 4 фрагмента, начиная с N-конца: домен спиральной катушки (1), функциональный домен (2), домен спиральной катушки (3) и гидрофобный домен на С-конце. Предполагается, что среди этих фрагментов функциональный домен (домен, определяемый в эпиморфине человека 104-187 аминокислотами) участвует в адгезии клеток и тесно связан с проявлением физиологической активности эпиморфина (вышеупомянутая ЕР публикация).
Так как эпиморфин имеет действие, способствующее нормальному морфогенезу, предполагается, что это вещество может быть использовано в качестве активного ингредиента в лекарственных средствах для профилактического или терапевтического лечения заболеваний, вызванных ненормальным морфогенезом, или лекарственных средств, таких, как агент, способствующий росту волос. Однако нативный эпиморфин, полученный от млекопитающих, практически нерастворим в водной среде, такой, как солевой раствор, что создает сложности в практическом использовании вещества в качестве лекарственного средства. Были сделаны некоторые попытки получить новые производные эпиморфина с хорошей растворимостью, при этом в достаточной степени сохраняющие стимулирующее действие на морфогенез, характерное для нативного эпиморфина. Например, известна модифицированная форма (фрагмент 123), полученный путем удаления гидрофобной области по С-концу (открытая опубликованная патентная заявка Японии №25295/1994).
Известно также, что полипептид, имеющий частичную структуру эпиморфина, стимулирует морфогенез эпителиальной ткани посредством его действия на эпителиальные клетки (Международная Публикация WO98/22505). Этот пептид растворим в водной среде, такой, как физиологический раствор, и в соответствии с вышеуказанной публикацией этот пептид обладает способностью стимулировать рост волос. Однако не было установлено биологической активности в частичной структуре в виде более короткого фрагмента.
Описание изобретения
Целью настоящего изобретения является получение олигопептида с действием, стимулирующим рост волос. Другим объектом настоящего изобретения является получение лекарственного средства, предпочтительно агента, стимулирующего рост волос, содержащего указанные олигопептиды в качестве активного ингредиента. Авторы настоящего изобретения провели широкие исследования для достижения вышеупомянутых целей, и в результате они обнаружили, что некоторые олигопептиды, содержащие частичные структуры эпиморфина, превосходно стимулируют рост волос. Настоящее изобретение было сделано на базе этих открытий.
Таким образом, настоящее изобретение представляет олигопептид или его соль, выбираемые из группы, состоящей из
олигопептида из следующих (1) или (2)
(1) олигопептид представленный
аминокислотной последовательностью (I);
Lys-Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu
аминокислотной последовательностью (II);
Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu
аминокислотной последовательностью (III);
Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp
аминокислотной последовательностью (IV);
Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln
аминокислотной последовательностью (V);
Ser-Ile-Glu-Gln-Ser-Cys-Asp
аминокислотной последовательностью (VI);
Ser-Ile-Glu-Gln-Ser-Cys
аминокислотной последовательностью (VII);
Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu
аминокислотной последовательностью (VIII);
Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu, или
аминокислотной последовательностью (IX); или
Gln-Ser-Cys-Asp-Gln-Asp-Glu
(2) олигопептид, имеющий аминокислотную последовательность, в которой одна или несколько аминокислот делетированы, заменены или добавлены в любой из аминокислотных последовательностей (I)-(IX), и обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX), и модифицированный олигопептид исходного олигопептида, определенного в (1) или (2), обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX).
В соответствии с предпочтительным вариантом осуществления настоящего изобретения получают олигопептид или его соль, представленные любой из аминокислотных последовательностей (I)-(IX), или его модифицированный олигопептид, обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX). Более предпочтительный вариант осуществления включает олигопептид или его соль, представленные любой из аминокислотных последовательностей (II)-(V), или его модифицированный олигопептид, обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (II)-(V). В соответствии с более предпочтительным вариантом осуществления настоящего изобретения, получают олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX), и наиболее предпочтительно, получают олигопептид или его соль, представленные любой из аминокислотных последовательностей (I) или (IX).
Пример модифицированного олигопептида включает биотинилированный олигопептид, и более предпочтительный пример модифицированного олигопептида включает олигопептид, у которого N-конец соединен с биотином со спейсером или без него. Другой пример модифицированного олигопептида включает олигопептид, димеризованный сульфогидрильной группой или остатком цистеина в олигопептиде.
В другом аспекте представлено лекарственное средство, включающее вышеуказанный олигопептид или его физиологически приемлемую соль в качестве активного ингредиента. Лекарственное средство может быть использовано в качестве агента, стимулирующего рост волос у млекопитающего. Дополнительно представлено применение вышеупомянутого олигопептида или его соли для производства вышеупомянутого лекарственного средства, предпочтительно агента, стимулирующего рост волос; и способ стимуляции роста волос, который включает стадию введения эффективного количества вышеуказанного олигопептида или его физиологически приемлемой соли млекопитающему, включая человека.
Краткое описание чертежей
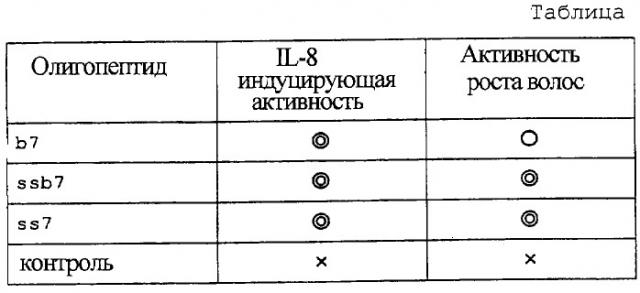
Фиг.1 показывает активность олигопептида, стимулирующую рост волос (представлен аминокислотной последовательностью (II)) по настоящему изобретению. На фигуре (А) показан результат, полученный с помощью биотинилированного олигопептида. Квадрат (большой) показывает результат, полученный с помощью олигопептида b7, а квадрат (маленький) показывает результат, полученный в контроле. (В) показывает результат, полученный с помощью биотинилированного олигопептида с S-S мостиками. Круг (большой) показывает результат, полученный с помощью олигопептида ssb7, а круг (маленький) показывает результат, полученный в контроле. Вертикальная ось показывает показатель роста волос, а горизонтальная ось показывает день от начала применения.
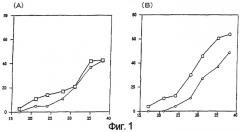
Фиг.2 показывает активность олигопептида, стимулирующую рост волос по настоящему изобретению (биотинилированный олигопептид с S-S мостиками: ss7). На фигуре означает биотинилированный олигопептид с S-S мостиками, означает результат, полученный в первом контроле (тот же самый, что и контроль на Фиг.1), и означает результат второго контроля (случайный 7-мерный олигопептид). Вертикальная ось обозначает показатель роста волос, горизонтальная ось показывает день от начала применения.
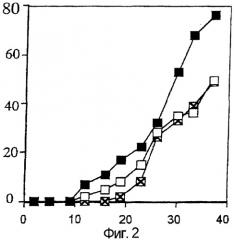
Фиг.3 показывает результат определения влияния b7ΔС1, b7ΔС2, b7ΔС3, b7ΔС4, b7ΔС5, b7ΔN1, b7ΔN2, b7ΔN3 на IL-8 индуцирующую активность. На фигуре Scont обозначает результат блокирующего реагента, PBS обозначает результат фосфатно-буферного раствора, и вертикальная ось показывает относительный объем секреции IL-8.
Фиг.4 показывает результаты оценки влияния олигопептида bk7, полученного присоединением биотина к N-концу олигопептида, представленного аминокислотной последовательностью (I) и олигопептида b7 на IL-8 индуцирующую активность. На этой фигуре PBS обозначает результат фосфатно-буферного раствора, и вертикальная ось показывает относительный объем секреции IL-8.
Наилучший вариант осуществления изобретения
Олигопептид, представленный вышеупомянутой аминокислотной последовательностью (I) по настоящему изобретению, является олигопептидом, состоящим из 11 С-концевых аминокислотных остатков полипептида (II), раскрытого в Международной Публикации WO98/22505. Олигопептид, представленный вышеупомянутой аминокислотной последовательностью (II), соответствует олигопептиду, полученному посредством делетирования аминокислоты (Lys) по N-концу вышеупомянутой аминокислотной последовательности (I). Олигопептид, представленный вышеупомянутыми аминокислотными последовательностями (III)-(VI), соответствует олигопептидам, полученным посредством делетирования одного, двух, трех и четырех аминокислотных остатков по С-концу вышеупомянутой аминокислотной последовательности (II) соответственно. Олигопептид, представленный вышеупомянутыми аминокислотными последовательностями (VII)-(IX), соответствует олигопептидам, полученным посредством делетирования одного, двух и трех аминокислотных остатков по N-концу вышеупомянутой аминокислотной последовательности (II) соответственно. Олигопептид, представленный вышеупомянутыми аминокислотными последовательностями (I)-(IV), обладает активностью, стимулирующей рост волос, что более конкретно показано в нижеследующих примерах. Не ограничиваясь какой-либо специальной теорией, возможно, что С-концевой цистеин аминокислотной последовательности (VI) является ключевым для проявления активности.
Олигопептиды, имеющие аминокислотную последовательность, в которой одна или несколько аминокислот делетированы, заменены или вставлены в одну из аминокислотных последовательностей (I)-(IX), обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX) (в дальнейшем в ссылках иногда обозначаемый как \вариантный олигопептид\), охватываются настоящим изобретением. Такие модифицированные олигопептиды на основе вышеупомянутого олигопептида, представленного любой из вышеупомянутых аминокислотных последовательностей (I)-(IX) или вышеупомянутый вариантный олигопептид, который обладает в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX), также охватываются настоящим изобретением. Специалист в данной области может легко убедиться, что вышеупомянутый вариантный олигопептид и модифицированный олигопептид обладают в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX), с помощью тестового метода, подробно описанного в Примерах настоящего описания или с помощью внесения изменений или модификаций в указанный тестовый метод.
В вышеупомянутом вариантном олигопептиде тип аминокислот, которые можно добавлять или заменять, практически не ограничен. Предпочтительно это L-аминокислоты. Число и положение аминокислоты, которое можно добавлять или заменять, также практически не ограничены, например число добавляемых аминокислот от 1 до 5, предпочтительно от 1 до 3, более предпочтительно от 1 до 2. Одну или несколько аминокислот, предпочтительно от 1 до 5, более предпочтительно от 1 до 3 аминокислот, можно добавить по N-концу или С-концу.
В вышеупомянутом модифицированном олигопептиде термин \модифицированный\ нужно толковать в самом широком смысле, включая химическую модификацию и биологическую модификацию. Примеры модификации включают введение функциональных групп, такое, как алкилирование, этерификация, галогенирование и аминирование, или изменение функциональных групп, такое, как окисление, восстановление, добавление или удаление или введение соединения сахаров (моносахарид, дисахарид, олигосахарид или полисахарид) или липидного соединения, фосфорилирование, биотинилирование. Однако эти модификации не ограничены данными примерами.
Пример предпочтительного модифицированного олигопептида включает биотинилированный олигопептид, и более предпочтительный пример включает олигопептид, у которого N-конец соединен с биотином со спейсером или без него. В вышеупомянутом олигопептиде соответствующая химическая модификация может быть присоединена к биотину при условии поддержания желательной физиологической активности. Способ получения биотинилированного олигопептида более подробно показан в Примерах настоящего описания. Для введения биотина по N-концу посредством спейсера, имеющего соответствующую длину, например, могут быть использованы NHS-Биотин или NHS-LS-Биотин (доступны в Pierce).
Другой предпочтительный пример модифицированного олигопептида включает олигопептид, димеризованный по сульфогидрильной группе остатка цистеина.
Вышеупомянутые олигопептиды могут быть в свободной форме или могут быть получены в виде аддитивных солей кислот или аддитивных солей оснований. Примеры аддитивных солей кислот включают соли минеральных кислот, такие, как гидрохлорид, сульфат, нитрат и фосфат, соли органических кислот, такие, как пара-толуолсульфонат, метансульфонат, цитрат, оксалат, малеат и тартрат. Примеры аддитивных солей оснований включают соли металлов, такие, как соль натрия, соль калия, соль кальция и соль магния, соль аммония, органические аммонийные соли, такие, как соль метиламмония и соль триметиламмония. Олигопептид может образовывать соль с аминокислотами, такими, как глицин, или может образовывать цвиттер-ион в молекуле.
Любые полимеры олигопептида, такие, как димер, охватываются настоящим изобретением. Например, димеризованный олигопептид, образованный S-S связью, охватывается настоящим изобретением. Эти олигопептиды также могут существовать в форме гидрата или сольвата. Вышеупомянутые олигопептиды содержат множественные асимметричные атомы углерода. Хотя стереохимия каждого асимметричного атома углерода не ограничена, предпочтительно, чтобы аминокислотным остатком была бы L-аминокислота. Стереоизомеры, такие, как оптические изомеры или диастереомеры, на основании асимметричных атомов углерода, любые смеси стереоизомеров и рацематы охватываются настоящим изобретением.
Олигопептиды по настоящему изобретению могут быть синтезированы с помощью стандартной химической методики для синтеза пептидов, такой, как твердофазная или жидкофазная методика. Существуют различные статьи о защитных группах для аминогруппы или подобных и конденсирующих агентах для реакции конденсации в области синтеза пептидов и соответственно на эти статьи можно ссылаться при проведении синтеза. В твердофазном методе могут быть использованы разнообразные коммерчески доступные пептидные синтезаторы. Способы введения или удаления защитных групп, например, в работе Protective Groups in Organic Synthesis, T.W. Greene, John Wiley & Sons, Inc. 1981 и др.
С помощью стандартных биологических методов, таких, как процедура экспрессии гена, желаемый олигопептид может быть получен посредством конструирования рекомбинантного вектора, содержащего последовательность ДНК, кодирующую вышеупомянутый олигопептид, получение микроорганизма (трансформанта), трансформированного вектором, и выделение и очистка олигопептида из культуры трансформанта. Способ получения олигопептидов не ограничен этими химическими и биологическими методами. Способы получения модифицированных олигопептидов, включая химическую модификацию и биологическую модификацию, хорошо известны специалистам в данной области, и любой из них может быть использован.
Олигопептид по данному изобретению пригоден в качестве активного ингредиента лекарственного средства, используемого в качестве агента для стимуляции роста волос или подобных. Термин \лекарственное средство\ использован здесь в самом широком смысле, включая агент для стимуляции роста волос, который иногда классифицируют, как квази-лекарство, так же как и лекарственное средство для профилактического или терапевтического лечения заболеваний млекопитающего, включая человека. Термин \агент для стимуляции роста волос\, использованный здесь, должен быть истолкован в самом широком смысле, включая стимуляцию образования волос, стимуляцию роста волос и предотвращение потери волос, и термин не должен быть истолкован в каком-либо ограничивающем смысле.
В качестве лекарственного средства по данному изобретению одно или более веществ из вышеупомянутых олигопептидов или их физиологически приемлемой соли сами по себе могут быть использованы. В целом, однако, предпочтительно получать и вводить фармацевтическую композицию, включающую одно или более из вышеупомянутых веществ в качестве активного ингредиента с использованием одной или более фармацевтически приемлемых добавок. Агент, стимулирующий рост волос, содержащий один или более вышеупомянутых олигопептидов, может быть использован в форме наружных препаратов, таких, как крем, спрей, покрывающий раствор или пластырь. Агент может быть прямо введен в целевую область в форме инъекции. Возможно получать агент в любой форме, удобной для целей использования агента для стимуляции роста волос.
Например, вышеупомянутый олигопептид в качестве активного ингредиента можно добавить в шампунь или ополаскиватель, или вышеупомянутый олигопептид можно вводить в липосомные капсулы для производства препарата. Композиции в вышеупомянутых формах также охватываются настоящим изобретением. Для достижения эффективной чрескожной абсорбции указанных олигопептидов через кератиновый слой кожи в крем предпочтительно добавлять соответствующие детергенты, липидорастворимые вещества и им подобные. Доза вышеупомянутого агента, стимулирующего рост волос, может быть выбрана в зависимости от цели применения, формы агента типа активного ингредиента и т.п. Например, можно определять дозу исходя из доз, более точно показанных в Примерах настоящего описания.
Примеры
Настоящее изобретение будет объяснено более детально в нижеследующих Примерах. Однако рамки данного изобретения не ограничены этими примерами.
Пример 1
Олигопептид, имеющий вышеупомянутую аминокислотную последовательность (II), синтезировали твердофазным методом с использованием Fmoc (иногда называемым \рер7\ в нижеследующих примерах). Также синтезировали модифицированный олигопептид (иногда называемый \b7\ в нижеследующих примерах) с модификацией биотином на N-конце. Каждый из синтезированных олигопептидов был очищен с помощью высокоэффективной жидкостной хромотографии (HPLC), и степень их чистоты была подтверждена на уровне 90% при помощи HPLC и Mass.
Условия HPLC были следующими.
Колонка: ODS-UG-3 (Monomeric ODS, Nomura Kaguku), внутренний диаметр 1,0 мм, длина 100 мм.
Измерение: комнатная температура (25°С).
Регистрация: UV 214 нм, 280 нм.
Элюирующий растворитель: градиент растворителя А и растворителя В (растворитель А: 0.1% трифторуксусная кислота; растворитель В: 90% ацетонитрил /0,1% трифторуксусная кислота, линейный градиент концентрации с 5 мин после (растворитель В: 0%) до 55 мин (растворитель В: 55%).
Скорость потока: 75 мл/мл.
Время удержания
pep7: 21,52 минут (димер), 20,59 минут (мономер)
b7: 29,89 минут (мономер), 32,85 минут (димер).
Пример 2
Олигопептид, полученный в Примере 1, растворили в фосфатно-буфером растворе (PBS) для того, чтобы получить концентрацию 0,3 мг/мл, и этот раствор добавили к такому же объему 100% этанола для получения 50% этанол/PBS раствора с концентрацией 0,15 мг/мл.
Олигопептид сшивали следующим образом.
К раствору олигопептида (5 мл), растворенному в PBS при концентрации 1 мг/мл, постепенно добавляли BMH, растворенный в диметилсульфоксиде (65 мкл) при перемешивании для получения концентрации 33 мкг/мкл, и реакцию осуществляли при 4°С в течение ночи. Далее к раствору добавляли PBS (6,6 мл), и раствор гидрохлорида цистеина растворяли в PBS (5 мл) для получения концентрации 5 мг/мл и смешивали для получения раствора олигопептида, соединенного S-S мостиками в конечной концентрации 0,3 мг/мл (далее в примерах вышеупомянутый олигопептид, полученный сшиванием pep7, иногда называется \ss7\, а биотинилированный ss7 - \ssb7\). Время удержания HPLC при вышеуказанных условиях 33,01 минут. Контрольный раствор был получен подобной реакцией с добавлением реагентов, за исключением того, что вместо раствора олигопептида использовали PBS. К раствору сшитого олигопептида также добавляли тот же объем этанола для получения 50% раствора этанол/PBS с конечной концентрацией 0,15 мг/мл.
Известно, что мыши C3H и C57BL/6 имеют продолжительную фазу телогена в течение примерно 50 дней с 45-го дня после рождения до 95-го дня. Их волосяной цикл легко оценить по изменению цвета кожи, т.е. от розового в телогене до серого или черного в анагене. Для оценки того, стимулируется или нет переход из телогена в анаген при введении олигопептида по данному изобретению, был произведен тест с этими мышами. Мыши C57BL/6 были получены в возрасте 7 недель (от 48 до 50 дней, самки) и шерсть на спине (около 3×2,5 см2) была осторожно выбрита электрическими ножницами для животных так, чтобы не поранить кожу, и было подтверждено, что по цвету кожи волосяной цикл находился на стадии телогена. Раствор олигопептида, полученный, как указано выше, был нанесен 5 мышам из каждой группы, один раз в день, 5 дней в неделю в количестве 0,2 мл до 38 дня от начала теста. Нанесение осуществляли при помощи шприца без иглы. Дипептид (Ile-Lys) и трипептид (Glu-Ile-Lys), у которых N-конец был биотинилирован, были смешаны и затем добавлены к сшитому агенту с получением контрольного раствора.
Несколько человек (двое) наблюдали мышей дважды в неделю невооруженным глазом для оценки по шестибальной шкале соотношения площади восстановившихся волос и площади выбритых волос. Тогда же делали фотоснимки.
Оценку роста волос определяли следующим способом.
Сначала давали следующую оценку в зависимости от соотношения площадей, где цвет кожи менялся на серый или черный на площади, где волосы были выбриты: 0-20%:1, 20-40%:2, 40-60%:3, 60-80%:4, 80-100%:5. Сумма указанных оценок в каждой группе была определена как показатель роста волос. Максимальное значение оценки роста волос было равно 50 для каждого из наблюдателей, а максимальное значение показателя роста волос было равно 100, поскольку оценки делались двумя наблюдателями. В группе, в которой наносился биотинилированный олигопептид с S-S мостиками, переход в анаген происходил раньше на 7 или более дней, чем в контрольной группе, и была очевидна стимуляция восстановления волос в любой момент времени, почти до полного восстановления волос. С другой стороны, в группе, где был использован биотинилированный олигопептид, восстановление волос стимулировалось до примерно 30-го дня с начала теста по сравнению с контрольной группой, аналогично S-S группе. Результаты, показаны на фигуре 1. Результаты ss7 показаны на фигуре 2. Исходя из этих результатов, делается вывод, что олигопептид, представленный аминокислотной последовательностью (II), обладает активностью по стимулированию роста волос.
Пример 3
Олигопептиды b7ΔС1, b7ΔС2, b7ΔС3, b7ΔС4 и b7ΔС5 были синтезированы посредством делетирования одной, двух, трех, четырех или пяти аминокислот по C-концу b7, соответственно и затем блокирования сульфогидрильной группой. Олигопептиды b7ΔN1, b7ΔN2 и b7ΔN3 были синтезированы посредством делетирования одной, двух или трех аминокислот по N-концу b7. Был синтезирован олигопептид bk7 (без блокирования сульфогидрильной группой), представленный аминокислотной последовательностью (I), N-конец которой был связан лизином.
Кератиноциты человека (клетка NHEK, Colnetics, доступны в Sanko Jyun-yaku, Ltd.) культивировали в среде для пролиферации (Clontics), включающей 30 мкг/мл BPE, 0,1 нг/мл EGF человека, 5 мкг/мл инсулина, 0,5 мкг/мл гидрокортизона, 50 мкг/мл гентамицина и 50 нг/мл амфотерина. Эти клетки были заново суспендированы в концентрации 1 х 104 клеток/мл в среде, в которой EGF, инсулин и гидрокортизон были удалены из среды для пролиферации, и затем 100 мкл суспензии поместили в каждую лунку 96-луночного планшета. Одновременно с нанесением клеток к суспензии добавляли 5 мкл 1 мг/мл олигопептида до получения конечной концентрации 50 мкг/мл. После культивирования в течение 16-20 часов количество IL-8 в супернатанте культуры измерили с помощью набора ELISA (ENDOGEN). Была получена хорошая корреляция между индуцирующей активностью секреции IL-8 клетками NHEK и активностью, стимулирующей рост волос (Таблица 1).
Результаты, полученные при оценке индуцирующей активности олигопептидов b7ΔС1, b7ΔС2, b7ΔС3, b7ΔС4, b7ΔС5, b7ΔN1, b7ΔN2 и b7ΔN3 на IL-8 показаны на Фигуре 3. Когда одна или более аминокислоты делетировали по N-концу, секретированный объем IL-8 слегка уменьшился, в то время, когда одна или более аминокислоты были делетированы по С-концу, секретированный объем IL-8 сохранялся до делетирования 4-х аминокислот. При делетировании 5 аминокислот секретированный объем IL-8 существенно понижался. Эти результаты показывают, что можно ожидать почти такую же активность, стимулирующую рост волос, как и у олигопептида b7, при делетировании до 4-х аминокислот по С-концу, или при делетировании до 3-х аминокислот по N-концу. Как показано на Фигуре 4, 11-мерный олигопептид bk7 обладал почти такой же IL-8 индуцирующей активностью, что и олигопептид b7.
Пример 4
N-конец олигопептида pep7 был биотинилирован с помощью NHS-биотина или NHC-биотина (Pierce) в соответствии с инструкциями прилагаемого руководства. Когда использовали NHS-биотин, -O-CO-(CH2)4-(13,5 ) вводили в качестве спейсера между N-концом и биотином, а когда использовали NHS-LC-биотин, -O-CO-(CH2)5-NH-CO-(CH2)4-(22,4 ) вводили в качестве спейсера между N-концом и биотином. Объем секреции IL-8 определяли при помощи биотинилированных олигопептидов так же, как и в Примере 3. Эти олигопептиды обладали почти такой же IL-8 индуцирующей активностью, что и олигопептид b7. Эти результаты показывают, что олигопептид, N-конец которого биотинилирован непосредственно, обладает почти такой же активностью по стимулированию роста волос, что и олигопептид, в котором N-конец биотинилирован посредством спейсера, и оба они более активны, по сравнению с олигопептидом, в который не был введен биотин.
Промышленная применимость
Олигопептид по данному изобретению обладает активностью по стимулированию роста волос и применим, как активный ингредиент в лекарственном средстве, таком как агент, стимулирующий рост волос.
1. Олигопептид или его соль, выбранные из группы, состоящей из олигопептида из следующих (1) и (2):
(1) олигопептид, представленный
аминокислотной последовательностью (I):
Lys-Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu
аминокислотной последовательностью (II):
Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu
аминокислотной последовательностью (III):
Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp
аминокислотной последовательностью (IV):
Ser-Ile-Glu-Gln-Ser-Cys-Asp-Gln
аминокислотной последовательностью (V):
Ser-Ile-Glu-Gln-Ser-Cys-Asp
аминокислотной последовательностью (VI):
Ser-Ile-Glu-Gln-Ser-Cys
аминокислотной последовательностью (VII):
Ile-Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu
аминокислотной последовательностью (VIII):
Glu-Gln-Ser-Cys-Asp-Gln-Asp-Glu или
аминокислотной последовательностью (IX):
Gln-Ser-Cys-Asp-Gln-Asp-Glu,
(2) олигопептид, имеющий аминокислотную последовательность, полученную посредством делетирования по C- или N- концу одной или нескольких аминокислот в любой аминокислотной последовательности (I)-(IX), и обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX), и модифицированный олигопептид, представляющий собой биотинилированный или димеризованный по сульфогидрильной группе остатка цистеина олигопептид на основе олигопептида, определенного в (1) или (2), обладающий в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX).
2. Олигопептид или его соль по п.1, где модифицированный олигопептид является биотинилированным олигопептидом.
3. Олигопептид или его соль по п.2, где модифицированный олигопептид является олигопептидом, в котором N-конец соединен с биотином со спейсером или без него.
4. Олигопептид или его соль по п.1, где модифицированный олигопептид является олигопептидом, димеризованным по сульфогидрильной группе остатка цистеина в аминокислотных последовательностях, описанных выше.
5. Олигопептид или его соль, представленная любой из аминокислотных последовательностей (I)-(IX), по п.1, и его модифицированный олигопептид, представляющий собой биотинилированный или димеризованный по сульфогидрильной группе остатка цистеина олигопептид, который обладает в основном такой же активностью по стимулированию роста волос, что и олигопептид, представленный любой из аминокислотных последовательностей (I)-(IX).
6. Олигопептид или его соль по п.5, где модифицированный олигопептид является биотинилированным олигопептидом.
7. Олигопептид или его соль по п.6, где модифицированный олигопептид является олигопептидом, в котором N-конец соединен с биотином со спейсером или без него.
8. Олигопептид или его соль по п.5, где модифицированный олигопептид является олигопептидом, димеризованным сульфогидрильной группой остатка цистеина в описанных выше аминокислотных последовательностях.
9. Олигопептид или его соль, представленные любой из аминокислотных последовательностей с (I) по (IX) по п. 1.
10. Лекарственное средство для стимулирования роста волос, включающее в качестве активного ингредиента олигопептид по любому из пп.1-8 или его физиологически приемлемую соль.
11. Способ стимуляции роста волос, включающий стадию введения эффективного количества олигопептида по любому из пп.1-8 или его физиологически приемлемой соли млекопитающему, включая человека.