Способы идентификации соединений для регуляции мышечной массы или функции с применением рецепторов рилизинг-фактора кортикотропина
Иллюстрации
Показать всеИзобретение относится к области фармакологии. Сущность изобретения состоит в том, что разработаны способы идентификации соединений-кандидатов для регуляции массы или функции скелетных мышц, включающие взаимодействие тестируемого соединения с рецептором рилизинг-фактора 2 кортикотропина. Описаны также фармацевтическая композиция и способ лечения атрофии скелетных мышц. Технический результат - расширение арсенала средств, предназначенных для регуляции массы или функции скелетных мышц. 9 н. и 26 з.п. ф-лы, 1 табл., 9 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способам идентификации соединений-кандидатов для регуляции массы или функции скелетных мышц или для регуляции активности или экспрессии рецептора рилизинг-фактора-2 кортикотропина (CRF2R). Изобретение также относится к способам лечения атрофии скелетных мышц или к способам индуцирования гипертрофии скелетных мышц, в которых CRF2R применяется как мишень для воздействия, и к способам лечения мышечных дистрофий, в которых CRF2R и рецептор рилизинг-фактора-1 кортикотропина (CRF1R) применяются как мишени для воздействия.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
CRFR и лиганды
Известно два рецептора рилизинг-фактора кортикотропина, идентифицированных к настоящему времени (CRF1R и CRF2R), которые относятся к классу рецепторов (GPCR), сопряженных с G-белком. Активация агонистом CRF1R или CRF2R ведет к Gαs-активации аденилатциклазы. Аденилатциклаза катализирует образование цАМФ, который, в свою очередь, обладает многочисленными эффектами, включая активацию протеинкиназы A, высвобождение внутриклеточного кальция и активацию митоген-активированной протеинкиназы (МАР-киназы). Усиление внутриклеточного синтеза инозиттрифосфата после активации агонистом рецепторов CRF, обнаруженное в других исследованиях, означает, что рецепторы CRFR также сопряжены с Gαq.
CRF1R и CRF2R клонировали от человека, крысы, мыши, курицы, коровы, сома, лягушки и овцы. Для каждого из CRF1R и CRF2R есть единственные в своем роде профили распределения. У человека клонировали три изоформы рецептора CRF2R: альфа, бета и гамма. У крысы были идентифицированы гомологи альфа и бета-CRF2R.
Известно несколько лигандов/агонистов рецепторов CRFR. Рилизинг-фактор кортикотропина (или гормон, CRF или CRH) связывается с CRF1R и CRF2R и активирует их. CRF является главным модулятором ответов организмов на стресс. Такой пептид, состоящий из 41 аминокислоты, контролирует защиту нейронных, эндокринных и иммунных процессов как первичный регулятор гормональной оси системы гипоталамус-гипофиз-надпочечники (ось HPA). Кроме того, существует значительная гомологичность последовательностей CRF и пептида саувагина амфибий, также как пептида telostian уротензина, оба из которых действуют как агонисты CRF1R и CRF2R. Указанные три пептида имеют похожие биологические свойства в качестве гипотензивных агентов и средств, усиливающих секрецию АКТГ. Кроме того, для млекопитающих был описан родственный уротензину урокортин.
Рецепторы CRF можно отличить от нерецепторов CRF фармакологически, путем применения селективных агонистов и антагонистов рецепторов. Такие селективные агонисты и антагонисты, наряду с мышами CRFR-нокаут, применялись при определении того, какой из рецепторов CRF опосредует специфичные биологические ответы.
Довольно хорошо установлена роль CRF1R. У мышей с удаленным CRF1R-геном (CRF1R-нокаут) наблюдается ослабленный ответ на стресс и ослабленная реакция тревоги. CRF1R является главным медиатором оси HPA. В частности, рилизинг-фактор кортикотропина, который высвобождается из гипоталамуса и транспортируется в переднюю долю гипофиза через гипоталамогипофизарную воротную систему, взаимодействует с CRF1R, находящимся на клетках, локализованных в передней доле гипофиза. Активация агонистом CRF1R приводит к высвобождению АКТГ из клеток передней доли гипофиза в большой круг кровообращения. Высвобожденный АКТГ связывает рецептор АКТГ, находящийся на клетках, локализованных в коре надпочечников, что приводит к высвобождению гормонов коры надпочечников, включая кортикостероиды. Кортикостероиды опосредуют многие эффекты, включая без ограничения угнетение иммунной системы через механизм, который заключается в атрофии тимуса и селезенки. Таким образом, активация CRF1R косвенно приводит к регуляции иммунной системы по типу отрицательной регуляции через активацию оси HPA.
Роль CRF2R исследована меньше. У мышей с удаленным CRF2R-геном (CRF2R-нокаут) обнаружено снижение замедленного поглощения пищи после стимуляции урокортином, отсутствие вазодилатации, однако нормальный ответ на стресс. Эксперименты с CRF2R показали, что CRF2R является ответственным за гипотензивные/вазодилатационные эффекты агонистов CRFR и за уменьшение поглощения пищи, наблюдаемое после лечения мышей агонистами CRFR.
Атрофия и гипертрофия скелетных мышц
Скелетные мышцы представляют собой пластичную ткань, которая легко адаптируется к изменениям либо в случае физиологической необходимости для работы или метаболической потребности. Гипертрофия связана с увеличением массы скелетных мышц, в то время как атрофия скелетных мышц связана с уменьшением массы скелетных мышц. Острая атрофия скелетных мышц имеет в основе ряд причин, включая без ограничения: бездействие, обусловленное операцией, постельным режимом или переломом костей; повреждение нерва/денервацию, обусловленное травмой спинного мозга, аутоиммунным заболеванием или инфекционным заболеванием; применение глюкокортикоидов при состояниях, не связанных с заместительной гормональной терапией; сепсис, обусловленный инфекцией или другими причинами; ограниченное поступление питательных веществ, обусловленное болезнью или голоданием; и полет в космос. Атрофия скелетных мышц возникает благодаря нормальным биологическим процессам, однако при определенных медицинских состояниях такой нормальный биологический процесс приводит к инвалидизирующему уровню мышечной атрофии. Например, острая атрофия скелетных мышц является значительным ограничением при реабилитации пациентов после неподвижности, включая без ограничения реабилитацию после ортопедической процедуры. В таких случаях период реабилитации, необходимый для обращения атрофии скелетных мышц, часто оказывается гораздо более длительным, чем период, требуемый для устранения первоначального повреждения. Такая острая атрофия, связанная с бездействием, представляет определенную проблему для пожилого человека, который может уже страдать от значительного, связанного с возрастом дефицита мышечной функции и массы, поскольку такая атрофия может привести к постоянной инвалидности и преждевременной смерти.
Атрофия скелетных мышц может также быть результатом хронических состояний, таких как раковая кахексия, хроническое воспаление, кахексия при СПИДе, хроническая обструктивная болезнь легких (ХОБЛ), застойная сердечная недостаточность, генетические нарушения, например мышечные дистрофии, нейродегенеративные заболевания и саркопения (связанная с возрастом потеря мышечной массы). При таких хронических состояниях атрофия скелетных мышц может приводить к преждевременной потере подвижности, таким образом усугубляя связанную с заболеванием болезненность.
О молекулярных процессах, которые управляют атрофией или гипертрофией скелетных мышц, известно немного. Несмотря на различие инициирующих пусковых механизмов атрофии скелетных мышц в случаях, когда атрофия вызвана различными явлениями, в пораженном болезнью волокне скелетных мышц происходит несколько общих биохимических изменений, включая уменьшение синтеза белков и усиление деградации белков, и изменения как сократительных характеристик, так и свойств белковых изозимов метаболических ферментов при переключении с медленных (высокий окислительный метаболизм/изоформы медленного сократительного белка) на быстрые (высокий гликолитический метаболизм/изоформы быстрого сократительного белка) волокна. Дополнительные изменения, происходящие в скелетной мышце, включают сокращение сосудистой сети и перестройку внеклеточного матрикса. Как быстрое, так и медленное подергивание мышцы свидетельствует об атрофии при соответствующих состояниях, связанных с относительной потерей мышечной массы, зависящей от конкретных стимулов, вызывающих атрофию, или состояния. Важно то, что все указанные изменения согласованно отрегулированы и включаются или выключаются в зависимости от изменений, связанных с физиологической и метаболической потребностью.
Процессы, при которых наступает атрофия и гипертрофия, одни и те же для видов млекопитающих. Многократные исследования показали, что во время атрофии как у грызунов, так и у человека имеют место одни и те же основные молекулярные, клеточные и физиологические процессы. Таким образом, модели атрофии скелетных мышц грызуна успешно применяются для понимания и предсказания атрофических ответов человека. Например, атрофия, индуцированная различными способами, как у грызунов, так и у человека приводит к похожим изменениям в анатомии мышцы, площади поперечного сечения, функции, типе переключения волокна, экспрессии сократительного белка и гистологии. Кроме того, было обнаружено несколько агентов, регулирующих атрофию скелетных мышц как у грызунов, так и у человека. Такие агенты включают анаболические стероиды, гормон роста, инсулиноподобный фактор роста I и бета-адренергические агонисты. Взятые вместе, указанные данные свидетельствуют, что атрофия скелетных мышц возникает в результате общих механизмов как у грызунов, так и у человека.
Несмотря на то, что обнаружены некоторые агенты, регулирующие атрофию скелетных мышц, и одобрено их применение для человека по такому показанию, указанные агенты обладают нежелательными побочными эффектами, такими как гипертрофия сердечной мышцы, неоплазия, гирсутизм, андрогенизация женщин, повышенная заболеваемость и смертность, повреждение печени, гипогликемия, мышечно-скелетная боль, повышенный тургор тканей, тахикардия и отеки. В настоящее время не существует высокоэффективного и избирательного лечения ни острой, ни хронической атрофии скелетных мышц. Таким образом, существует потребность в идентификации других лекарственных средств, регулирующих атрофию скелетных мышц.
Мышечные дистрофии
Мышечные дистрофии охватывают группу наследственных, прогрессирующих мышечных расстройств, отличающихся клинически по избирательной локализации слабости скелетных мышц. Двумя наиболее распространенными формами мышечной дистрофии являются дистрофии Дюшенна и Беккера, каждая из которых возникает в результате наследования мутации в гене дистрофина, который локализован в локусе-Xp21. Другие дистрофии включают без ограничения мышечную дистрофию тазового пояса, которая является результатом мутации множественных генетических локусов, включающих локусы кальпаина p94, адхалоина, γ-саркогликана и β-саркогликана; плече-лопаточно-лицевую (Ландузи-Дежирина) мышечную дистрофию, миотоническую дистрофию и мышечную дистрофию Эмери-Драйфуса. Симптомы мышечной дистрофии Дюшенна, которая наблюдается почти исключительно у мужчин, включают походку вперевалку, \ходьбу на носках ног\, лордоз, частые падения, трудность вставания (из положения сидя) и передвижения вверх по лестнице. Симптомы проявляются приблизительно в возрасте 3-7 лет, к 10-12 годам большинство пациентов прикованы к инвалидному креслу и многие умирают приблизительно в возрасте 20 лет из-за осложнений дыхания. Традиционное лечение мышечной дистрофии Дюшена включает введение преднизона (кортикостероидного лекарственного средства), который, несмотря на то, что не является исцеляющим, замедляет упадок мышечной силы и задерживает потерю трудоспособности. Считается, что кортикостероиды, такие как преднизон, действуют как блокаторы активации и инфильтрации иммунных клеток, которые усиливаются при повреждении мышечных волокон в результате заболевания. К сожалению, лечение кортикостероидами также приводит к атрофии скелетных мышц, которая сводит на нет часть потенциальной выгоды от блокирования иммунного ответа у таких пациентов. Таким образом, существует потребность в идентификации лекарственных средств, которые замедляют повреждение мышечного волокна и задерживают наступление инвалидности у больных с мышечными дистрофиями, однако вызывают меньшую степень атрофии скелетных мышц, чем современные терапевтические методики.
Одной из проблем, связанных с идентификацией соединений, применяемых для лечения атрофии скелетных мышц или мышечных дистрофий, было отсутствие хороших способов скрининга для идентификации таких соединений. Теперь авторами установлено, что CRF2R вовлеченыв регуляцию массы или функции скелетных мышц, и что агонисты CRF2R способны блокировать атрофию скелетных мышц и/или индуцировать гипертрофию скелетных мышц. Настоящее изобретение решает проблему идентификации соединений для лечения мышечной атрофии путем обеспечения способов скрининга с применением CRF2R, которые можно применять для идентификации соединений-кандидатов, применимых для лечения мышечной атрофии. Настоящее изобретение также решает проблему идентификации соединений для лечения мышечной дистрофии путем обеспечения способа скрининга для идентификации соединений-кандидатов, которые активируют как CRF1R, так и CRF2R.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению CRFR для идентификации соединений-кандидатов, которые потенциально применимы для лечения атрофии скелетных мышц и/или для индуцирования гипертрофии скелетных мышц. В частности, изобретение относится к способам in vitro идентификации соединений-кандидатов для регуляции массы или функции скелетных мышц, предусматривающим взаимодействие тестируемого соединения с клеткой, экспрессирующей CRF2R, или взаимодействие тестируемого соединения с выделенным CRF2R и определение того, соединяется ли тестируемое соединение с CRF2R или активирует ли оно CRF2R. Другой пример осуществления изобретения относится к способу идентификации терапевтических соединений-кандидатов из группы, состоящей из одного или более соединений-кандидатов, для которых обнаружено, что они связываются с CRF2R или активируют CRF2R, включающему введение соединения-кандидата животному, отличному от человека, и определение того, регулирует ли соединение-кандидат массу скелетных мышц или мышечную функцию у подвергнутого лечению животного. Еще один пример осуществления изобретения относится к способу идентификации соединений-кандидатов для регуляции массы или функции скелетных мышц, включающему в любом порядке: (i) взаимодействие тестируемого соединения с клеткой, экспрессирующей функциональный CRF2R, и определение уровня активации CRF2R, вызванного тестируемым соединением; (ii) взаимодействие тестируемого соединения с клеткой, экспрессирующей функциональный CRF1R, и определение уровня активации CRF1R, вызванного тестируемым соединением; последующее (iii) сравнение уровня активации CRF2R и уровня активации CRF1R; и (iv) идентификация тех тестируемых соединений, которые проявляют похожую активность в отношении CRF2R и CRF1R или проявляют селективность в отношении CRF2R, в качестве соединений-кандидатов для регуляции массы или функции скелетных мышц.
Изобретение также относится к способам идентификации соединений-кандидатов, которые пролонгируют или усиливают агонист-индуцированную активацию CRF2R или активацию пути передачи сигнала CRF2R. Данные способы предусматривают в любом порядке или одновременно: (i) взаимодействие тестируемого соединения с клеткой, которая экспрессирует функциональный CRF2R; (ii) обработку клетки агонистом CRF2R в течение достаточного времени и при достаточной концентрации, чтобы вызвать десенсибилизацию CRF2R в контрольных клетках; последующее (iii) определение уровня активации CRF2R и идентификацию тестируемых соединений, которые пролонгируют или усиливают активацию CRFR или активацию пути передачи сигнала CRF2R, в качестве соединений-кандидатов для регуляции массы или функции скелетных мышц. В частности, настоящее изобретение относится к способу идентификации терапевтических соединений-кандидатов из группы, состоящей из одного или более соединений-кандидатов, для которых обнаружено, что они пролонгируют или усиливают активацию CRF2R или активацию пути передачи сигнала CRF2R, включающему: введение соединения-кандидата в сочетании с агонистом CRF2R животному, отличному от человека, и определение, регулирует ли соединение-кандидат массу или функцию скелетных мышц у подвергнутого лечению животного.
Изобретение также относится к способам идентификации соединений-кандидатов, увеличивающих экспрессию CRF2R, предусматривающим взаимодействие тестируемого соединения с клеткой или клеточным лизатом, содержащим репортерный ген, оперативно связанный с регуляторным элементом CRF2R-гена, и обнаружение экспрессии репортерного гена. Тестируемые соединения, увеличивающие экспрессию репортерного гена, идентифицируют в качестве соединений-кандидатов для увеличения экспрессии CRF2R. В частности, настоящее изобретение относится к способу определения, можно ли те соединения-кандидаты, которые увеличивают экспрессию CRF2R, применять для регуляции массы или функции скелетных мышц in vivo путем введения соединения-кандидата животному, отличному от человека, и определения, регулирует ли соединение-кандидат массу или функцию скелетных мышц у подвергнутого лечению животного.
Изобретение также относится к способам идентификации соединений-кандидатов, увеличивающих экспрессию CRF, предусматривающим взаимодействие тестируемого соединения с клеткой или клеточным лизатом, содержащим репортерный ген, оперативно связанный с регуляторным элементом CRF-гена, и обнаружение экспрессии репортерного гена. Тестируемые соединения, которые увеличивают экспрессию репортерного гена, идентифицируют в качестве соединений-кандидатов для увеличения экспрессии CRF. В частности, настоящее изобретение относится к способу определения, можно ли те соединения-кандидаты, которые увеличивают экспрессию CRF, применять для регуляции массы или функции скелетных мышц in vivo путем введения соединения-кандидата животному, отличному от человека, и определения, регулирует ли соединение-кандидат массу или функцию скелетных мышц у подвергнутого лечению животного.
Настоящее изобретение также относится к применению агонистов CRF2R, экспрессирующих векторов, кодирующих функциональный CRF2R, экспрессионных векторов, кодирующих конститутивно активный CRF2R или соединений, увеличивающих экспрессию CRF2R или CRF, для лечения атрофии скелетных мышц. В частности, изобретение обеспечивает способы лечения атрофии скелетных мышц у субъекта, который нуждается в таком лечении, предусматривающие введение субъекту безопасного и эффективного количества агониста CRF2R, экспрессионного вектора, кодирующего функциональный CRF2R, экспрессионного вектора, кодирующего конститутивно активный CRF2R, экспрессионного вектора, кодирующего CRF или аналог CRF, или соединение, увеличивающее экспрессию CRF2R или CRF. В конкретном примере осуществления настоящее изобретение относится к способу лечения атрофии скелетных мышц у субъекта, который нуждается в таком лечении, предусматривающему введение субъекту безопасного и эффективного количества агониста CRF2R в сочетании с безопасным и эффективным количеством соединения, которое пролонгирует или увеличивает индуцированную агонистом активацию CRF2R или активацию пути передачи сигнала CRF2R.
Настоящее изобретение также относится к применению агониста CRF2R для увеличения массы или функции скелетных мышц у субъекта. В частности, изобретение обеспечивает способы увеличения массы или функции скелетных мышц у субъекта, которому требуется такое увеличение, предусматривающие идентификацию субъекта, которому требуется увеличение мышечной массы или функции и введение субъекту безопасного и эффективного количества агониста CRFR.
Изобретение также относится к фармацевтическим композициям, содержащим безопасное и эффективное количество агониста CRF2R и фармацевтически приемлемого носителя. В конкретном примере осуществления изобретения фармацевтическая композиция содержит химерное антитело или антитело человека, специфичное к CRF2R. В другом конкретном примере осуществления фармацевтическая композиция содержит CRF или аналог CRF, предпочтительно урокортин II.
Настоящее изобретение также обеспечивает антитела к CRF2R и, в частности, химерные или человеческие антитела, которые являются агонистами CRF2R.
На всем протяжении данной заявки упоминаются различные публикации. Описания данных публикаций во всей их полноте включены тем самым в данную заявку путем ссылок для того, чтобы более полно описать современное состояние области техники, к которой данное изобретение относится.
ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Каждая из нуклеотидных и белковых последовательностей CRFR или белковых последовательностей аналогов CRF, включенная в список последовательностей вместе с соответствующим регистрационным номером(ами) в банках генов (Genbank) или Derwent и видом животного, от которого она клонирована, приведена в таблице 1. Также приведены регистрационные номера родственных нуклеотидных последовательностей, которые кодируют идентичные, или почти идентичные, аминокислотные последовательности в виде последовательности, показанной в списке последовательностей. Такие родственные последовательности отличаются, главным образом, количеством показанных 5′ или 3′ нетранслируемых последовательностей.
| Таблица 1 | ||||
| Описание последовательности | SEQ ID NO: нуклеотид, аминокислота | Вид | GENBANK (GB) DERWENT (D) | Регистрационный №в банке данных GENBANK (GB) DERWENT (D) |
| CRF1R | 1,2 | Homo sapiens | X72304(GB) | E11431(GB) L23332(GB) I92584(D) T37068(D) T28968(D) Q81952(D) |
| вариант CRF1R | 3,4 | Homo sapiens | L23333(GB) | |
| вариант CRF1R | 5,6 | Homo sapiens | NM_004382(GB) | |
| вариант CRF1R | 7,8 | Homo sapiens | AF180301(GB) | |
| α-CRF2R | 9,10 | Homo sapiens | U34587(GB) NM_001883(GB) | E12752(GB) T12247(D) T66508(D) |
| β-CRF2R | 11,12 | Homo sapiens | AF011406(GB) | |
| γ-CRF2R | 13,14 | Homo sapiens | AF019381(GB) | |
| CRF1R | 15,16 | Rattus norvegicus | T28970 (D) | L25438(GB) L24096(GB) I92586(D) Q81954(D) AH006791(GB) |
| α-CRF2R | 17,18 | Rattus norvegicus | U16253(GB) | NM_022714(GB) X01009(D) T12243(D) |
| Вариантβ-CRF2R | 19,20 | Rattus norvegicus | T12244(D) | |
| CRF1R | 21,22 | Mus musculus | NM_007762(GB) | X72305(D) |
| CRF2R | 23,24 | Mus musculus | T28972(D) | U17858(GB) |
| CRF2R | 25,26 | Mus musculus | NM_009953(GB) | |
| CRF1R | 27,28 | Ovis aries | AF054582(GB) | |
| CRF1R | 29,30 | Xenopus laevis | Y14036(GB) | |
| CRF2R | 31,32 | Xenopus laevis | Y14037(GB) | |
| CRF1R | 33,34 | Ameiurus nebulosus | AF229359(GB) | |
| CRF1R | 35,36 | Ameiurus nebulosus | AF229361(GB) | |
| CRF2R | 37,38 | Ameiurus nebulosus | AF229360(GB) | |
| CRF1R | 39,40 | Bos taurus | AB055434(GB) | |
| CRF1R | 41,42 | Gallus gallus | L41563(GB) | |
| Урокортин II | 43 | Mus musculus | AF331517 | |
| Пептид, родственный урокортину | 44 | Homo sapiens | BC002647 |
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
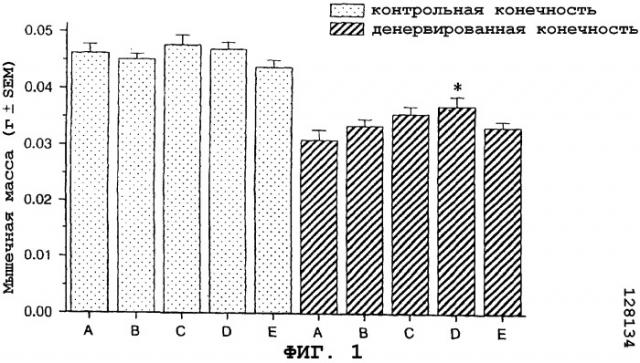
На фиг.1 показан антиатрофический эффект агониста CRF1R/CRF2R саувагина (вводимого подкожно 2 раза в сутки) на медиальную головку икроножной мышцы в модели атрофии, вызванной путем денервации седалищного нерва у мыши.
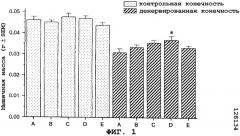
На фиг.2 показан антиатрофический эффект саувагина (вводимого непрерывно при помощи осмотического мининасоса) на переднюю большеберцовую мышцу в модели атрофии, вызванной путем денервации седалищного нерва у мыши.
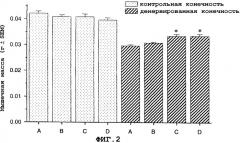
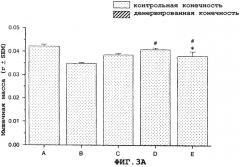
На фиг.3A и 3B показан антиатрофический эффект саувагина (вводимого непрерывно при помощи осмотического мининасоса) на индуцированную глюкокортикоидами атрофию передней большеберцовой мышцы (фиг.3A) и медиальной головки икроножной мышцы (фиг.3B).
На фиг.4A показан антиатрофический эффект саувагина (вводимого подкожно 2 раза в сутки) на индуцированную наложением гипсовой повязки атрофию передней большеберцовой мышцы и влияние индуцированной гипертрофии на незагипсованную (нормальную) переднюю большеберцовую мышцу. На фиг.4B показан антиатрофийный эффект саувагина на индуцированную наложением гипсовой повязки атрофию медиальной головки икроножной мышцы и гипертрофию, индуцированную влиянием саувагина на незагипсованную (нормальную) медиальную головку икроножной мышцу.
На фиг.5 показаны антиатрофический и гипертрофический эффекты саувагина и урокортина (вводимых непрерывно при помощи осмотического мининасоса) на переднюю большеберцовую мышцу в модели атрофии, индуцированной путем денервации седалищного нерва у мыши.
На фиг.6A и 6B показан антиатрофический эффект урокортина (вводимого подкожно 2 раза в сутки) на индуцированную бездействием атрофию передней большеберцовой мышцы (фиг.6A) и медиальной головки икроножной мышцы (фиг.6B).
На фиг.7 показан антиатрофический эффект саувагина (вводимого подкожно 2 раза в сутки) на индуцированную путем денервации атрофию передней большеберцовой мышцы (фиг.7A), разгибателя большого пальца (EDL) (фиг.7B), камбаловидной мышцы (фиг.7C), медиальной головки икроножной мышцы (фиг.7D) и подошвенной мышцы в модели атрофии, индуцированной путем денервации седалищного нерва у крысы, подвергнутой резекции надпочечника. Кроме того, индуцированная саувагином гипертрофия неденервированной мышцы EDL (фиг.7B).
На фиг.8 показано, что для модели атрофии, вызванной путем денервации седалищного нерва у мыши, саувагин (вводимый непрерывно при помощи осмотического мининасоса) имел антиатрофический эффект на переднюю большеберцовую мышцу у мышей дикого типа, однако не у мышей CRF2R-нокаут.
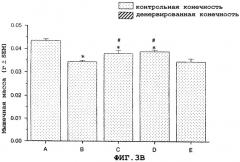
На фиг.9A и 9B показано, что в модели атрофии, вызванной бездействием загипсованной конечности у мыши, саувагин имел антиатрофический эффект на EDL и камбаловидную мышцу, что определяли по измерению массы (фиг.9A) или мышечной функции (фиг.9B).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Термины и определения
Ниже приводится список определений применяемых здесь терминов.
\Агонист\ означает любое соединение, включая без ограничения антитела, которые активируют рецептор. Например, агонисты CRFR включают без ограничения CRF и аналоги CRF.
\Аллельный вариант\ означает вариантную форму данного гена или генного продукта. Для специалиста в данной области очевидно, что большое количество генов в популяции существует в двух или более аллельных формах, а некоторые гены имеют многочисленные аллели.
Термин \антитело\ в его различных грамматических формах означает молекулы иммуноглобулина и иммунологически активные части молекул иммуноглобулина, то есть молекулы, которые содержат антиген-связывающий сайт, который специфически связывается с антигеном. \Очищенное антитело\ означает антитело, которое было частично или полностью отделено от белков и встречающихся в природе органических молекул, с которыми оно связано в природе. Предпочтительно, препарат содержит, по меньшей мере, 60% антител, более предпочтительно, по меньшей мере, 75% антител, еще более предпочтительно, по меньшей мере, 90% антител и наиболее предпочтительно, по меньшей мере, 99% (по сухому весу) антител.
\Аффинность связывания\ означает склонность лиганда к взаимодействию с рецептором, она обратно пропорционально связана с константой диссоциации реакции взаимодействия определенных CRF и CRFR-лиганда. Константу диссоциации можно измерить непосредственным образом через стандартное насыщение, конкурентный анализ или кинетику связывания, или косвенно фармакологическими методами, включающими функциональный анализ и крайние точки.
\Химерное антитело\ означает антитело, которое содержит структурные элементы от двух или более молекул различных антител, то есть от различных видов животных. Химерные антитела включают без ограничения антитела, известные как \гуманизированные антитела\, которые включают без ограничения химерные антитела, образуемые при помощи известной технологии пересадки области, определяющей комплементарность (гипервариабельного участка).
\CRF\ означает рилизинг-фактор кортикотропина, который представляет то же самое, что рилизинг-гормон кортикотропина (CRH). Примеры пептидов CRF включают r/h CRF и CRF овцы (см. патент США № 4415558) и т.п.
\Аналог CRF\ означает вещества, которые действуют как лиганды CRFR. Соответствующие аналоги CRF можно получить от различных видов позвоночных, они включают без ограничения такие вещества, как саувагин (см., например, патент США № 4605642), уротензин (см., например, патенты США №№ 4908352 и 4533654), мышиный урокортин II (SEQ ID NO:43), пептид, родственный урокортину человека (SEQ ID NO:44) (Reyes T.M. и др., Proc. Natl Acad Sci 98:2843-2848 (2001)), урокортин (см., например, заявку WO 97/00063) и аналоги CRF, описанные в патентах США №№: 4415558; 4489163; 4594329; 4605642; 5109111; 5235036; 5278146; 5439885; 5493006; 5663292; 5824771; 5844074 и 5869450, каждый из которых включен здесь в виде ссылки. Предпочтительные аналоги CRF представляют саувагин, урокортин, пептид, родственный урокортину, урокортин II и уротензин.
\Агонист CRFR\ означает соединение или молекулу, которые способны активировать CRF1R или CRF2R, или обоих. Активацию CRFR можно измерить, как описано дальше.
\CRFR\ означает CRF1R или CRF2R.
\CRF1R\ означает любые изоформы CRF1R любого вида животных. Ранее CRF1R был описан как CRF-RA, PC-CRF, CRF (Perrin M.H. и др. Endocrinology 133:3058-3061 (1993), Chen R. и др., Proc. Natl. Acad. Sci. USA, 90:8967-8971 (1993), Chang C-P. и др., Neuron 11:1187-1195 (1993), Kishimoto T. и др., Proc. Natl. Acad. Sci. USA, 92:1108-1112 (1995) и Vita N. и др., FEBS Lett. 335:1-5 (1993)) или рецептор CRH.
Определение CRF1R включает без ограничения те рецепторы, для которых кДНК или геномная последовательность, кодирующая рецептор, депонирована в базе данных последовательностей. Такие последовательности имеют регистрационные номера: X72304, E11431, L23332, I92584, T37068, T28968, Q81952, L23333, NM_004382, AF180301, T28970, L25438, L24096, I92586, Q81954, AH006791, NM_007762, X72305, AF054582, Y14036, AF229359, AF229361, AB055434 и L41563. Нуклеотидные и белковые последовательности таких рецепторов доступны из банков данных GenBank или Derwent, а для удобства здесь в списке последовательностей приведены типичные последовательности.
\CRF2R\ означает любую изоформу CRF2R любого вида животных. CRF2R также был описан как НМ-CRF, CRF-RB (Kishimoto T. и др., Proc. Natl. Acad. Sci. USA, 92:1108-1112 (1995) и Perrin M. и др., Proc. Natl. Acad. Sci. USA, 92:2969-2973 (1995)).
Определение рецептора CR2FR включает без ограничения те рецепторы, для которых последовательность-ДНК, кодирующая рецептор, размещена в базе данных последовательностей. Такие последовательности имеют регистрационные номера: U34587, E12752, NM_001883, T12247, T66508, AF011406, AF019381, U16253, T12244, T28972, U17858, NM_009953, Y14037 и AF229360. Нуклеотидные и белковые последовательности таких рецепторов доступны из банков данных GenBank или Derwent, а для удобства здесь в списке последовательностей приведены типичные последовательности.
Термин \CRFR\ также означает усеченные и/или мутированные белки, в которых области рецепторной молекулы, не требуемые для связывания лиганда или передачи сигнала, удалены или модифицированы. Например, для специалиста в данной области очевидно, что для настоящего изобретения можно было бы применить CRFR с одной или более консервативными заменами в первичной аминокислотной последовательности. В данной области известно, что замена определенных аминокислот другими аминокислотами с похожей структурой или свойствами (консервативные замены) может приводить к \молчащей\ замене, то есть к замене, которая существенно не изменяет функцию. Консервативные замены хорошо известны в данной области. Например, известно, что GPCR могут допускать замену аминокислотных остатков в трансмембранных альфа-спиралях, ориентированных по направлению к липиду, на другие гидрофобные аминокислоты и оставаться функциональными. Рецепторы CRF1R с последовательностями, отличающимися от существующих в природе тем, что они усечены и/или мутированы, так же, как консервативные замены аминокислот, также включены в определение CRF1R. CRF2R с последовательностью, отличающейся от встречающейся в природе тем, что они усечены и/или мутированы, так же, как консервативные замены аминокислот, также включены в определение CRF2R.
Для специалиста в данной области очевидно, что в настоящем изобретении можно применять рецепторы CRFR других видов, отличающиеся от перечисленных выше, в частности видов млекопитающих. Кроме того, для специалиста в данной области очевидно, что при помощи зондов из видов, последовательности CRFR которых известны, известными способами клонирования можно получить кДНК или геномные последовательности, гомологичные известной последовательности, от тех же самых или альтернативных видов. Такие CRF1R также включены в определение CRF1R, и такие CRF2R также включены в определение CRF2R.
Кроме того, для специалиста в данной области очевидно, что функциональные аллельные варианты или функциональные варианты сплайсинга CRFR могли бы существовать для определенных видов, и что такие варианты могут применяться в настоящем изобретении. Варианты сплайсинга CRFR известны, например, в патентах США №№ 5888811, 5786203 и 5728545, каждый из которых включен здесь в виде ссылки. Такие варианты CRF1R также включены в определение CRF1R, и такие варианты CRF2R также включены в определение CRF2R.
Гибриды полипептида CRF1R или CRF2R или фрагмента полипептида CRF1R или CRF2R с полипептидом, не являющимся CRFR, называются гибридными белками CRFR. Применяя известные способы, специалист в данной области может получить гибридные белки CRF1R или CRF2R, которые, несмотря на то, что отличаются от нативных CRF1R и CRF2R, остаются применимыми для целей настоящего изобретения. Например, полипептид, не являющийся CRFR, может быть сигнальной (или лидерной) полипептидной последовательностью, которая одновременно с трансляцией или после завершения трансляции направляет транспорт белка от его сайта синтеза к другому сайту (например, лидерный α-фактор дрожжей). Или полипептид, не являющийся CRFR, может быть добавлен для облегчения очистки или идентификации CRFR (например, поли-His или Flag-пептид). Гибридные белки CRF1R также включены в определение CRF1R, и гибридные белки CRF2R также включены в определение CRF2R.
\Путь передачи сигнала CRF2R\ означает любой сигнальный путь (например, цАМФ, МАР-киназы) или сочетание сигнальных путей, которые модулируются путем присоединения эндогенных или экзогенных лигандов к CRF2R.
Термин \функциональные CRFR\ относится к CRFR, которые присоединяют CRF или аналог CRF in vivo или in vitro вследствие присоединения лигандов.
\Гибридный ген\ означает две или более кодирующие последовательности-ДНК, оперативно связанные для кодирования одного гибридного белка. \Гибридный белок\ представляет собой белковый продукт гибридного гена.
\Ингибировать\ означает частично или полностью блокировать определенный процесс или активность. Например, соединение ингибирует атрофию скелетных мышц, если оно либо полностью, либо частично предотвращает мышечную атрофию.
Как здесь принято, две последовательности-ДНК считаются \оперативно связанными\, если природа связи между двумя последовательностями-ДНК (1) не приводит к внесению мутации \сдвига рамки\, (2) не мешает способности области промотора управлять транскрипцией кодирующих последовательностей или (3) не мешает способности соответствующего РНК-транскрипта транслироваться в белок. Например, кодирующая последовательность и регуляторные последовательности \оперативно связаны\, когда они связаны ковалентно таким образом, чтобы происходила транскрипция кодирующей последовательности под влиянием или контролем регуляторных последовательностей. Таким образом, область промотора оперативно связана с кодирующей последовательностью, где область промотора способна к проведению транскрипции последовательности ДНК так, что образующийся в результате транскрипт способен к трансляции в требуемый белок или полипептид.
\Степень идентичности\ означает процент нуклеотидов или аминокислот, которые в двух сравниваемых последовательностях являются общими, и рассчитывается следующим образом. Для в