Способ получения трансгенных растений с повышенной устойчивостью к фитопатогенам
Иллюстрации
Показать всеИзобретение относится к области генной инженерии, в частности к способу получения трансгенных растений. Выбирают сорт заданного растения. Проводят подготовку маточных растений и осуществляют микроклональное размножение растительного материала для получения листовых эксплантов. Затем создают вектор для переноса генетического материала, экспрессирующий целевой белок, повышающий устойчивость растений к фитопатогенам, и осуществляют агробактериальную трансформацию эксплантов агробактерией Agrobacterium tumifaciens с дальнейшим отбором трансгенной ткани и размножением трансформантов. На этапе трансформации используют постадийную кокультивацию эксплантов, количество шагов которой выбирают в диапазоне от 2 до 5, причем в качестве эксплантов используют листовые диски, у которых соотношение длины среза к площади диска лежит в диапазоне от 0,1 мм/мм2 до 2 мм/мм2. Изобретение позволяет получить трасгенные растения с повышенной устойчивостью к фитопатогенам, а также повысить частоту трансгенной экспрессии, частоту формирования трансгенных тканей, частоту регенерации трансгенных побегов, долю прямых тансформантов, а также снизить частоту сомаклональных изменений. 4 з.п.ф-лы, 7 ил., 12 табл.
Реферат
Изобретение относится к области генетической инженерии растений и может быть использовано для создания трансгенных растений с заданными свойствами.
Обзор
Основной ущерб сельскохозяйственным культурам причиняется вирусными, бактериальными и грибными патогенами, причем наносимый вред существенно превышает таковой от насекомых и других вредителей вместе взятых. В свою очередь, грибы-патогены по вредоносности занимают первое место среди прочих возбудителей заболеваний.
Например, эффективное возделывание земляники ограничивается несколькими болезнями: фитофторозное увядание (Phytophthora fragariae), вертициллярное увядание (Verticillium alboatrum), пятнистость листьев (Mycosphaerella fragariae), листовой ожог (Diplocarpon earliana), скручивание листовых пластинок (Dendrophoma obscurans), серая гниль (Botrytis cinerea), мучнистая роса (Sphaerotheca humuli) и др. Грибы возбудители заболеваний растений не только влияют на рост и развитие растительного организма, но зачастую значительно снижают продуктивность культурных насаждений.
В современном сельском хозяйстве эффективный контроль над грибными патогенами достигается комплексным подходом. С одной стороны, методами традиционной селекции выводятся новые сорта, обладающие повышенной устойчивостью к определенным расам грибов. Однако на получение одного сорта таким способом уходит в среднем около 10 лет. За это время патогены зачастую успевают мутировать и новый сорт теряет резистентность и быстро устаревает. Альтернативный подход - генетическая инженерия. Способ генетической трансформации растений позволяет переносить в них отдельные гены резистентности и получать растения с повышенной устойчивостью к широкому спектру фитопатогенов за короткое время.
Получение трансгенных растений с повышенной устойчивостью обычно сталкивается с проблемами воспроизводимости известных способов и с проблемами получения растений с низким уровнем сомаклональных отклонений.
Известны публикации, посвященные оптимизации способа генетической трансформации земляники садовой, разработанного James et al. (1990) и Nehra et al. (1990). В способе трансформации изменяли: 1) состав минеральной и/или гормональной среды для регенерации и селекции трансформантов, 2) тип и концентрацию селективного агента, 3) генотип сорта, 4) тип штамма и векторную конструкцию, 5) тип и концентрацию углеводов, 6) тип экспланта (листья, черешки, сегменты усов, меристема).
Du Plessis et al. (1997) изменили способ агробактериальной трансформации, заменив в среде селекции и регенерации трансформантов 6-бензиламинопурин на синтетический регулятор роста - тидиазурон. Он оказался более эффективным регулятором роста для земляники. Вместо агробактериального штамма LBA4404 авторы стали использовать C58/PGV2260. Разработанный способ обладает существенным недостатком - очень высокой частотой сомаклональных изменений среди трансформантов.
Dier et al. (2001) показали, что смена сахарозы на глюкозу, в средах мультипликации, кокультивации, селекции и регенерации трансформантов, значительно повышает частоту регенерации трансгенных побегов. Известно решение, в котором авторы делают попытки снизить частоту сомаклональных изменений путем замены сахарозы на мальтозу (Stuart et al. US Patent 4801545, 1989).
Mathews et al. (1998) показали, что концентрация и тип селективного агента в культуральной среде оказывают большое влияние на процесс регенерации трансгенных побегов. Также имеет значение и продолжительность культивирования на селективной среде. Изменение системы селекции позволило получать чистые, нехимерные линии, состоящие только из трансгенных клеток.
Dolgov et al. (1999), используя способ, описанный в работах James et al. (1990) и Nehra et al. (1990), разработанный для сорта Redcoat, получили трансгенное растение земляники садовой сорта Фейерверк. Эффективность метода трансформации для сорта Фейерверк оказалась менее 1%, в то время как для сорта Redcoat эффективность разработанного метода составляла 6,5%.
De Mesa et al. (2000) изменили способ генетической трансформации, скомбинировав способ, разработанный James et al. (1990) и Nehra et al. (1990), с баллистическим методом. Механические повреждения на листовых дисках они наносили микрочастицами.
В перечисленных способах подготовка эксплантов основана на единовременной процедуре подготовки всего числа эксплантов (James et al. 1990 и Nehra et al. 1990). Известен способ, при котором в качестве эксплантов используют целые листовые пластинки, на которые одновременно наносится максимальное количество механических повреждений (Trinh et al. 2001). Оба эти способа повышают частоту некроза.
Humara et al. (1999) показали, что нанесение микротравм ультразвуком на нежную ткань семядольных эксплантах сосны сопровождается более низкой частотой некроза. Способ применим только для эмбриональных тканей зародышей или любых других случаев, когда регенерация идет из эпителиальных клеток.
Известны публикации, в которых способ генетической трансформации оптимизируют для предотвращения некротических реакций при подготовке растительных эксплантов и инокуляции их в агробактериальной суспензии.
Peri et al. (1996) пытались снизить частоту некроза за счет использования антиоксидантов. Добавление в среду кокультивации одновременно таких компонентов, как DTT и PVPP позволило полностью ингибировать некроз и добиться получения фертильных трансгенных растений винограда. Однако способ воспроизводим только на растительном материале одного сорта Superior Seedless.
Olhoft et al. (2001) обнаружили, что соединения с тиоловыми группами, например L-цистеин, способны повышать частоту трансформации агробактериями клеток Glycine max. Эффект проявляется только на стадии кокультивации эксплантов с агробактериями. Авторы обнаружили также, что не только L-цистеин при добавлении в среду кокультивации может позитивно влиять на процесс трансформации. Аналогичную активность проявляли такие вещества, как глутатион, DTT, натрия тиосульфат, ионы меди и хелаты железа. Перечисленные вещества ингибируют активность растительных полифенолоксидаз и пероксидаз, подавляя тем самым развитие некротических реакций, вызванных поранением или патогенами.
Однако все перечисленные химические компоненты, добавляемые в питательную среду, не только влияют на процесс взаимодействия бактерий с растительными клетками, но и оказывают негативное влияние на саму растительную ткань эксплантов.
Известен комбинированный подход для устранения некроза (Hansen, US Pat 6162965). Согласно способу на этапе агробактериальной трансформации используют химические ингибиторы некроза или выбирают агробактериальный штамм, который не индуцирует выраженный некроз, или используют генетический подход, при котором вместе с интересующим геном в растительные клетки переносится ген специфического фактора ингибирования некроза. Такие факторы известны давно, но они обладают крайне узким видоспецифичным характером активности. Автор не приводит данных по влиянию снижения некроза на снижение общего уровня сомаклональных отклонений.
Известные модификации способов трансформации оказывали влияние чаще всего на частоту регенерации трансгенных побегов, либо на частоту формирования трансгенного каллуса. Ни один усовершенствованный способ не приводил к значительному снижению сомаклональных отклонений и морфологических изменений трансгенных растений с повышенной устойчивостью к грибам-фитопатогенам. Например, при экспрессии тауматина в трансгенных растениях огурца (Szwacka et al. 2002) повышение устойчивости к Pseudoperonospora cubensis обнаруживались только у части трансгенных линий, а уровень экспрессии рекомбинантного белка не коррелировал с уровнем устойчивости.
Известно большое число растительных белков, которые в той или иной степени токсичны для фитопатогенов и могут быть использованы при получении растений, устойчивых к грибам-патогенам. Сюда в первую очередь относится обширная группа PR-протеинов (pathogenesis-related proteins), включающая пять семейств (Linthorst 1991). Также к ним относятся антимикробные пептиды (тионины, дефензины и лектины) и рибосомо-инактивирующие протеины. Антигрибная активность лучше всего изучена у белков, относящихся к двум семействам PR-3 (глюканазы) и PR-4 (хитиназы). Оба типа белков относятся по механизму активности к гидролизующим ферментам, разрушающим структурные компоненты клеточной стенки грибов.
Семейство PR-5 или тауматин-подобные белки в этом плане изучены значительно слабее. Они могут проявлять антигрибную активность против широкого спектра грибов патогенов (Abad et al. 1996), например, таких как Alternaria solani, Aspergillus flavus, Aspergillus parasitica, Bipolaris maydis, Bipolaris zeicola, Phytophthora fragariae, Verticillium alboatrum, Mycosphaerella fragariae, Diplocarpon earliana, Dendrophoma obscurans, Botrytis cinerea, Sphaerotheca humuli, Fusarium graminiarum, Fusarium oxysporum, и др. Нет однозначных сообщений и об антибактериальной активности тауматин-подобных белков в трансгенных растениях. Известно, что, как и остальные группы PR белков они, по-видимому, выполняют в растительных клетках защитную функцию. Например, известно, что экспрессия PR-5 (TL) протеинов в растениях активируется атаками патогенов, механическими повреждениями, а также такими метаболитами, как салициловая кислота и АВА (Stintzi et al. 1993). Также известно, что такой тауматин-подобный белок из кукурузы, как зеаматин, проявляет антигрибную активность in vitro, но лишь в сочетании с антибиотиком никкомицин Z ингибирующим синтез хитина (Roberts et al. 1990). Таким образом, зеаматин выступает кофактором, усиливающим действие сублетальной концентрации антибиотика. В таких же условиях проявляет антигрибную активность и тауматин.
Известно, что перенос и экспрессия гена табачного осмотина в трансгенных растениях картофеля повышала их устойчивость к Phytophthora infestans, а в трансгенных растениях табака не влияла на защитные механизмы организма (Liu et al. 1994).
Из работы Datta et al. (1998) известно, что трансгенные растения риса с геном рисового тауматин-подобного белка tlp под контролем 35S промотора обладают повышенной устойчивостью к Rhizoctonia solani.
Dolgov et al. (1999) переносили ген тауматина в растения яблони, моркови, груши и земляники. Авторы подтвердили только интеграцию гена в геном растений, но экспрессия белка в трансгенных тканях не анализировалась.
Schestibratov et al. (2001), используя известный способ генетической трансформации (James et al. 1990 и Nehra et al. 1990), получили растения земляники садовой с геном тауматина. Только у нескольких трансгенных линий была подтверждена экспрессия рекомбинантного белка.
Ни один из известных способов не дает возможности получать трансгенные растения, например земляники садовой, с экспрессией тауматин-подобных белков и в частности тауматина, проявляющие повышенную устойчивость к фитопатогенам и с низким уровнем сомаклональных отклонений.
Известен US Patent 5856154 (Ryals et al. 1999) на способ защиты растений от патогенов, в основе которого лежит создание химерных генов, кодирующих белки группы PR-1, и применение химических агентов для создания условий развития системно индуцируемой резистентности (SAR). Авторы осуществляют выбор типа генетических конструкций с учетом использования фактов по системно индуцируемой резистентности растений, которая вырабатывается растениями в ответ на влияние внешних факторов.
Известен также способ создания трансгенных растений путем введения в растение двух генов, продуцирующих эффект SAR (Baker et al. US Patent Appl. 20020004944, 2002). Тем не менее, в данных работах нет данных, подтверждающих тот факт, что трансформируемые растения в итоге обладают не только устойчивостью, но и сохраняют все морфологические характеристики.
Раскрытие изобретения
Одним из объектов изобретения является усовершенствованный способ агробактериальной трансформации и регенерации трансгенных растений, который характеризуется низкой частотой некроза эксплантов, повышенной частотой транзиентной экспрессии, повышенной частотой регенерации трансгенных побегов, более высокой долей прямых трансформантов, за счет формирования в листовых дисках индуцируемой резистентности к абиотическим и биотическим стрессам, что в конечном итоге приводит к снижению частоты сомаклональных изменений в трансгенном растении.
В соответствии с усовершенствованным способом этапы подготовки, инокуляции и кокультивации эксплантов содержат следующие стадии:
i) стадию выбора одного или более листовых сегментов для подготовки эксплантов; ii) подготовку листовых дисков путем отделения от каждого листового диска сегмента и последующей инокуляции и кокультивации листовых дисков с агробактериями; iii) стадию удаления с листовых дисков избытка агробактерий, отделения со стороны первого среза первой партии эксплантов; iv) стадию переноса эксплантов на среду селекции и регенерации; v) подготовку последующих партий эксплантов в соответствии с пунктами ii) и iv) до формирования последней партии эксплантов из выбранных листовых дисков; причем подготовка каждой из последующих партий эксплантов выполняется после временного интервала, необходимого для трансформации растительных клеток и формирования в листовых дисках индуцируемой резистентности к абиотическим и биотическим стрессам.
К следующему объекту изобретения относится векторная конструкция, которая содержит генетический материал, кодирующий, по крайней мере, один белок, входящий в группу целевых белков и/или белков, ответственных за повышение устойчивости к фитопатогенам и/или снижение некроза.
К другому аспекту изобретения относится то, что генетический материал кодирует устойчивость трансгенного растения к грибам, выбираемым из группы: Phytophthora fragariae, Verticillium alboatrum, Mycosphaerella fragariae, Diplocarpon earliana, Dendrophoma obscurans, Botrytis cinerea, Sphaerotheca humuli.
Другим объектом изобретения является способ получения трансгенного растения, входящего в группу двудольных растений яблони, груши, земляники садовой, моркови и томатов.
К следующему объекту изобретения относится способ получения трансгенного растения земляники садовой, выбираемого из группы сортов: Selekta, Chambly, Oka, Joliette, Yamaska, L'Acadie, L'Authentique Orleans, Rosalyne, Roseberry, Saint-Pierre, Donna, Enzed Levin, Enzed Lincoln, Vilanova, Durval, Redcrest, Bountiful, Redgem, Pelican, Primtime, Mohawk, Latestar, Winoma, Фейерверк.
Краткое описание чертежей
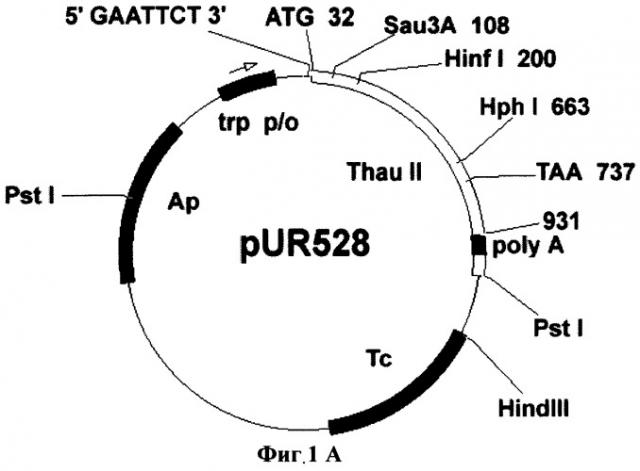
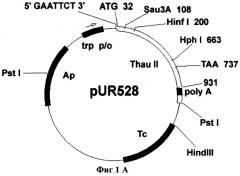
Фиг.1А. Схема плазмиды pUR528.
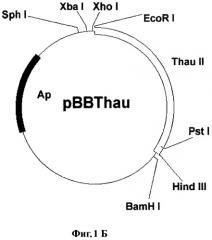
Фиг.1Б. Схема плазмиды pBBThau.
Фиг.1В. Рестрикционный фрагмент XbaI-BamHI из плазмиды pBBThau, несущий последовательность preprothaumatin II.
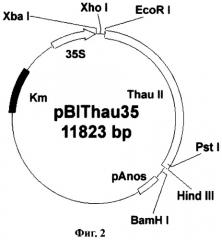
Фиг.2. Схема бинарного вектора pBIThau35. LB и RB - левый и правый краевые повторы Т-ДНК; pAnos - терминатор из гена нопалинсинтетазы; pNOS - промотор из гена нопалинсинтетазы; p35S - промотор 35S РНК вируса мозаики цветной капусты; nptII - ген растительного селективного маркера неомицинфосфотрансферазы; thaull - последовательность preprothaumatin II, кодирующая суперсладкий белок тауматин II.
Фиг.3. Влияние постадийной кокультивации с Agrobacterium tumefaciens на частоту некроза в тканях эксплантов земляники садовой сорта Фейерверк.
Фиг.4. Влияние постадийной кокультивации с A. tumefaciens на транзиентную GUS-экспрессию в тканях эксплантов земляники садовой сорта Фейерверк.
Фиг.5. Влияние постадийной кокультивации на частоту формирования тканей, устойчивых к канамицину (Km+), на исходных эксплантах земляники садовой сорта Фейерверк.
Фиг.6. Влияние постадийной кокультивации с Agrobacterium tumefaciens на частоту регенерации трансгенных побегов земляники садовой сорта Фейерверк.
Фиг.7. Влияние постадийной кокультивации с Agrobacterium tumefaciens на транзиентную GUS-экспрессию в тканях эксплантов яблони.
Варианты осуществления изобретения.
В основе усовершенствованного способа получения трансгенных растений, на примерах земляники садовой и яблони, лежит применение естественных молекулярных механизмов, которые активируются в растениях в процессе развития локально индуцируемой резистентности к абиотическим и биотическим стрессам.
Способ получения трансгенных растений с улучшенными агрономическими характеристиками состоит из следующих этапов.
На первом этапе осуществляют выбор свойств трансгенного растения и создают векторные конструкции для переноса необходимого генетического материала в растительные клетки.
На втором этапе проводят выбор сорта (генотипа), осуществляют подготовку маточных растений для их последующей стерилизации и введения в культуру in vitro, проводят микроклональное размножение растительного материала и подготовку укорененных растений in vitro, которые послужат источником листовых эксплантов.
На третьем этапе осуществляют агробактериальную трансформацию с использованием сконструированных векторных плазмид. С этой целью проводят подготовку бактериальной суспензии, проводят сбор и подготовку листьев и осуществляют постадийную инокуляцию и кокультивацию эксплантов в соответствии с усовершенствованным способом.
На следующем этапе осуществляют селекцию трансгенной ткани, отбор трансформантов и элиминацию агробактерий и проводят микроклональное размножение отобранных трансформантов.
После получения трансгенных растений проводят молекулярно-генетический анализ трансгенных линий. С этой целью осуществляют выделение тотальной ДНК из тканей трансгенных линий, проводят ПЦР анализ интеграции гетерологичной ДНК и гистохимический анализ GUS-активности, а также проводят процедуру Westem-блоттинга для анализа экспрессии целевого гена в листьях и плодах трансгенных линий.
На заключительном этапе с целью селекции линий без сомаклональных отклонений проводят биологическое тестирование: анализ устойчивости к фитопатогенам; органолептический анализ плодов; оценку вегетативной и генеративной активностей трансгенных растений в полевых условиях.
В усовершенствованном способе трансформации стадия подготовки, инокуляции и кокультивации эксплантов с агробактериями выполняется постадийно следующим образом.
Экспланты из одних и тех же листьев нарезаются не единовременно, перед инокуляцией, а, по крайней мере, за более двух независимых подходов с периодичностью в 1 до 5 суток, более предпочтительно через 3 суток. Количество шагов выбирают в диапазоне от 2 до 5, более предпочтительно от 3 до 4.
Ширину экспланта выбирают в пределах от 0,5 до 10 мм. Предпочтительно ширину экспланта выбирают в пределах от 1 до 3 мм. Соотношение между длиной среза и площадью экспланта выбирают в диапазоне от 0,1 до 2 мм/мм2, более предпочтительное значение составляет 0,5 мм/мм2.
С целью повышения эффективности трансформации в состав среды селекции и регенерации входят регуляторы роста и/или селективные агенты. В качестве регуляторов роста используют цитокинины и/или ауксины. Например, в качестве цитокининов могут быть использованы синтетические производные фенилмочевины, а в качестве ауксинов - ИМК, ИУК, НУК, 2,4-Д и их конъюгаты с аминокислотами. Тем не менее, для повышения индуцируемой резистентности к абиотическим и биотическим стрессам регуляторы роста могут быть исключены из состава среды кокультивации. Селективный агент выбирают из группы, в которую входят: неомицин, канамицин, гигромицин, фосфинотрицин. Комбинация, соотношение и концентрация перечисленных компонентов подбираются в зависимости от генотипа.
Например, в случае трансформации земляники садовой концентрацию ТДЗ выбирают в диапазоне от 1 до 10 мг/л. Оптимальная концентрация ТДЗ составляет 5 мг/л. Концентрацию ИМК выбирают в диапазоне от 0 до 2 мг/л. Оптимальная концентрация ИМК составляет 0,3 мг/л. Концентрацию канамицина выбирают в диапазоне от 10 до 100 мг/л. Оптимальная концентрация канамицина составляет 50 мг/л.
Для получения трансгенного растения с заданными свойствами используют векторные конструкции, созданные известным способом (Maniatis Т. et al. 1982), содержащие в своем составе генетический материал, который выбирают из группы, состоящей из: а) генетического материала, кодирующего по крайней мере один целевой белок; б) генетического материала, кодирующего по крайней мере один белок, который содействует снижению некроза на стадии трансформации; в) генетического материала, кодирующего, по крайней мере, один белок, который повышает устойчивость растения к фитопатогенам и который выбирают из группы: PR-1, PR-2, PR-3, PR-4, PR-5; г) генетического материала, кодирующая последовательность которого может состоять из комбинации по крайней мере двух последовательностей, относящихся к подпунктам а) и б), или а) и в), или б) и в), или а), б), в).
Для получения растения с повышенной устойчивостью к патогенам в состав генетической конструкции входят гены, кодирующие устойчивость к грибам, которые выбирают из группы, состоящей из Phytophthora fragariae, Verticillium alboatrum, Mycosphaerella fragariae, Diplocarpon earliana, Dendrophoma obscurans, Botrytis cinerea, Sphaerotheca humuli.
Например, для получения трансгенного растения земляники садовой с повышенной устойчивостью к Botrytis cinerea используют векторную конструкцию pBIThau35, в состав которой входит ген thaumatin II (Schestibratov et al. 2002).
В результате генетической трансформации получают растения, которые содержат генетический материал, кодирующий, по крайней мере, один белок, входящий в группу целевых белков и/или белков, ответственных за повышение устойчивости к фитопатогенам и/или снижение некроза.
В качестве целевого продукта могут быть использованы белки, которые: а) повышают пищевую ценность, б) улучшают вкус, в) придают устойчивость к гербицидам, г) имеют фармацевтическое значение.
Усовершенствованный способ генетической трансформации может быть использован для растений, относящихся к группам однодольных и двудольных.
Для создания трансгенных растений с повышенной пищевой ценностью, улучшенным вкусом и повышенной устойчивостью к фитопатогенам могут быть выбраны двудольные растения.
Например, для трансформации используют растения, выбираемые из группы: яблони, груши, земляники садовой, моркови и томатов.
Могут быть получены трансгенные растения земляники садовой, выбираемые из группы сортов: Selekta, Chambly, Oka, Joliette, Yamaska, L'Acadie, L'Authentique Orleans, Rosalyne, Roseberry, Saint-Pierre, Donna, Enzed Levin, Enzed Lincoln, Vilanova, Durval, Redcrest, Bountiful, Redgem, Pelican, Primtime, Mohawk, Latestar, Winoma, Фейерверк.
Примеры в детальном описании приводятся для земляники садовой сортов Фейерверк и Selekta и яблони сорта Мельба.
Для практического применения могут быть использованы компоненты трансгенного растения: трансгенные клетки, органы (листья, стебли, корни, цветки), целые растения, семена и плоды.
Внесенные изменения в способ агробактериального переноса позволяют получить следующие улучшения в параметрах как самого способа, так и в характеристиках трансгенных растений. Способ позволяет: снизить частоту развития некротических реакций на трансформируемых эксплантах (Фиг.3); повысить частоту транзиентной экспрессии интродуцируемых генов (Фиг.4); повысить частоту формирования новых трансгенных тканей на исходных эксплантах (Фиг.5); повысить соотношения прямых регенерантов по отношению к числу регенерантов, полученных через каллусную стадию (Таблица 6); повысить частоту регенерации трансгеных побегов (Фиг.6); наконец, среди трансгенных линий увеличить долю растений без сомаклональных изменений (Таблица 11).
Экспериментальные протоколы
Данные экспериментальные протоколы относятся к способам, условиям и компонентам сред для процедуры получения трансгенных растений с повышенной устойчивостью к фитопатогенам и улучшенными вкусовыми свойствами на примере земляники садовой. Данные протоколы включают, но не ограничивают изменения параметров концентраций, временных условий и других изменений, которые очевидны из общего уровня техники и входят в область защиты данного изобретения.
А. Материалы и способы используемые при получении трансгенного растения
Конструирование векторной плазмиды для переноса в растительные клетки последовательности preprothaumatin II, кодирующей белок тауматин II.
Ген тауматин II кодирует суперсладкий белок, который в природе встречается в плодах Thaumatococcus danielli, из которых он и был выделен, охарактеризован. Последовательность представляет собой preprothaumatin II - предшественник зрелого тауматина, в состав которого входит нативный сигнальный пептид. Клонирование кДНК тауматина описано в статье (Edens et al. 1982). Применение для экспрессии в клетках E.coli показано Verrips et al. (US Patent 4891316).
Векторная плазмида для переноса в растительные клетки последовательности preprothaumatin II, кодирующей белок тауматин II, конструировалась с использованием хорошо известных методов молекулярного клонирования (Sambrook et aL, 1989).
Для переноса данного гена в растительные клетки за основу была взята плазмида рВI121 (фирма Clontech). Последовательность гена gus в ней заменялась фрагментом preprothaumatin II из плазмиды pUR528 (Unilever Research Laboratorium, The Netherlands; Edens et al. 1982); (Фиг.1А). Фрагмент preprothaumatin II из плазмиды pUR528 вырезался по сайтам EcoRI и HindIII. Промежуточный вектор рВВ (селективный маркер Ар), несущий в своем составе полилинкер SphI-XbaI-XhoI-EcoRI-SmaI-AvaI-BamHI-Xbal-SauI-PstI-HindIII-BamHI-BstXI-Ncil, инкубировался с рестриктазами EcoRI и HindIII. Фрагмент: preprothaumatin II с липкими концами по сайтам EcoRI и HindIII дотировался в линеаризованный вектор рВВ по тем же сайтам. Полученную плазмиду pBBThau (Фиг.1Б) инкубировали с рестриктазами Xbal и BamHI, для того чтобы снова вырезать фрагмент preprothaumatin II, только уже с новыми липкими концами (Фиг.1В). Бинарный вектор рВН21 сначала инкубировали с рестриктазами Smal и SacI, затем лигировали по тупым концам линеаризованную форму плазмиды, затем препарат инкубировали с рестриктазами Xbal и BamHI. В линеаризованный вектор рВI121 лигировали фрагмент XbaI-BamHI последовательности preprothaumatin II, предварительно вырезанный из вектора pBBThau. Схема вектора pBIThau35 представлена на Фиг.2.
Среды культивирования земляники садовой in vitro и проведения генетической трансформации.
Среды мультипликации (М), элонгации и укоренения (ER), кокультивации (СС) и регенерации трансформантов (RT) готовят в соответствии с данными, приведенными в таблице 1. рН во всех средах доводится до 5,7.
| Таблица 1.Среды культивирования земляники садовой in vitro и проведения генетической трансформации. | ||||
| Компоненты | Концентрация | |||
| Среда М | Среда ER | Среда СС | Среда RT | |
| Калия нитрат | 316 мг/л | 316 мг/л | 2900 мг/л | 2900 мг/л |
| Аммония нитрат | 400 мг/л | - | 1650 мг/л | 1650 мг/л |
| Калия фосфат однозамещенный | 170 мг/л | 170 мг/л | 170 мг/л | 170 мг/л |
| Кальция нитрат · 4 H2O | 1133 мг/л | 1133 мг/л | - | - |
| Кальция хлорид | - | - | 332,2 мг/л | 332,2 мг/л |
| Магния сульфат · 7H2O | 369 мг/л | 369 мг/л | 180,7 мг/л | 180,7 мг/л |
| Микросоли MS | 32,83 мг/л | 32,83 мг/л | 32,83 мг/л | 32,83 мг/л |
| Железа сульфат · 7 Н2О | 27,8 мг/л | 27,8 мг/л | 27,8 мг/л | 27,8 мг/л |
| Na2EDTA · 2 Н2O | 37,26 мг/л | 37,26 мг/л | 37,26 мг/л | 37,26 мг/л |
| Сахароза | 30 г/л | 20 г/л | 30 г/л | 30 г/л |
| Витамины MS | 3,5 мг/л | 3,5 мг/л | 3,5 мг/л | 3,5 мг/л |
| Мио-инозитол | 100 мг/л | 100 мг/л | 100 мг/л | 100 мг/л |
| Агар | 8 г/л | 8 г/л | 8 г/л | 8 г/л |
| БАП | 1 мг/л | - | - | 4 мг/л |
| ТДЗ | - | - | - | 1 мг/л |
| ИМК | - | - | - | 0,3 мг/л |
Выбор сорта и подготовка маточных растений.
В экспериментах по генетической трансформации земляники использовался материал in vitro растений: а) сорта Фейерверк (Зубов А.А., ВНИИ генетики и селекции плодовых растений им. И.В. Мичурина, г. Мичуринск) и б) сорта Selekta (Evans E., Южная Африка, 1973 г., PI 551873).
Введение земляники садовой в культуру in vitro проводили путем стерилизации молодых верхушечных почек с усов растений открытого грунта. Для этого концевые почки срезали с небольшим фрагментом побега не более 5-10 мм, затем очищали от поверхностных листочков, замачивали в водном растворе Tween 20 на 1 час, после чего промывали под проточной водой в течение 2 часов. Отмытые экспланты для стерилизации выдерживали 1-5 мин, в зависимости от их размера и возраста, в 2%-ном растворе гипохлорита натрия. После чего их промывали трижды в 100 мл стерильной дистиллированной воды.
Поверхностно стерилизованные побеги рассаживали раздельно в пробирки с 10 мл среды для мультипликации (среда М, см. Таблицу 1). Основные компоненты данной среды соответствуют усовершенствованной по Boxus (1974) среде MS (Murashige et al. 1962), только с двумя изменениями: во-первых, глюкоза в концентрации 22 г/л заменена 30 г/л сахарозы; во-вторых, для стимуляции мультипликации среда дополнена 5 мМ нитрата аммония. После месяца в культуре незараженные экспланты с вновь сформировавшимися побегами целиком пересаживали на среду элонгации и укоренения (среда ER, см. Таблицу 1), которая отличается от среды М отсутствием регуляторов роста, добавочного нитрата аммония и сниженной концентрацией сахарозы (2%). В среднем через 4-6 недель подросшие побеги отделяют друг от друга и рассаживают на свежую среду того же состава для стимуляции укоренения. Укорененные растения использовали в качестве источника листовых дисков в последующих экспериментах по регенерации и трансформации. Такие растения культивируют на среде ER в течение 7-8 месяцев с ежемесячной пересадкой на свежую среду. Для выращивания стерильного материала земляники использовали специальные культуральные банки производства HortiMic (Финляндия) емкостью 250 мл, закрывающиеся пластиковой закручивающейся крышкой.
Подготовка бактериальной суспензии.
Для генетической трансформации бинарными векторами рВI121 и pBIThau35 использовали супервирулентный штамм Agrobacterium thumefaciens СВЕ21 (Ревенкова и др. 1994), сконструированный на основе дикого штамма A. thumefaciens с Ti-плазмидой pTiBo542.
Бактериальные суспензии штаммов СВЕ21/pBIThau35 и СВЕ21/рВI121 для инокуляции эксплантов наращивали в течение ночи в 50 мл среды LB (Таблица 2) при 28°С. Перед инокуляцией суспензию клеток центрифугировали при 5 т.о. в течение 5 минут. Осадок промывали дважды 50 мл жидкой среды MS для удаления остатков среды LB. Промытый осадок клеток ресуспендировали в жидкой среде MS, затем плотность суспензии доводили до ОП600 равной 1.
| Таблица 2.Среда LB для культивирования агробактерий. | |
| Компонент | Концентрация |
| Натрия хлорид | 10 г/л |
| Бактотриптон | 10 г/л |
| Дрожжевой экстракт | 5 г/л |
| рН | 7,5 |
Сбор и подготовка листьев.
С маточных растений, приготовленных описанным выше способом, непосредственно перед постановкой генетической трансформации срезали молодые трехлистники, полностью развернувшиеся. Размер отдельного листового диска в каждом трехлистнике варьировал в пределах 10-15 мм (по направлению центральной жилки). Чтобы уменьшить усыхание листьев в процессе последующих операций, их содержат в закрытых чашках Петри с небольшим количеством (20 мл) жидкой среды MS. Листья с растений срезают не чаще двух раз в месяц. Маточные растения до и после сбора листьев культивируют в одинаковых условиях, при 16-часовом световом дне.
Подготовка, инокуляция и кокультивация эксплантов.
Срезанные трехлистники разделяют на отдельные листовые диски, которые в свою очередь разрезают скальпелем на экспланты различными способами.
Усовершенствованный способ подготовки, инокуляции и кокультивации эксплантов.
В предлагаемом способе листовые диски разрезают скальпелем на чашке Петри в присутствии небольшого количества жидкой среды MS. От каждого листового диска размером 10-15 мм по (направлению центральной жилки) отрезают узкую полоску шириной не более 2 мм и затем выбрасывают. Оставшуюся большую часть листового диска (эксплант А-5) используют в дальнейшем для инокулирования.
На первом шаге экспланты А-5 непосредственно после срезки края переносят аккуратно пинцетом в бактериальную суспензию и замачивают 30 мин. Затем экспланты А-5 переносят в чистые чашки Петри с бумажными фильтрами и подсушивают в течение 5 минут для удаления избытка бактерий, после чего раскладывают в чашки Петри со средой СС, поверхность которой покрыта бумажным фильтром. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 25-28°С в течение 3 суток.
Затем экспланты А-5 переносят в стакан с жидкой средой MS, в течение 3-5 минут интенсивно перемешивают для удаления избытка бактерий. Отмытые экспланты переносят в чашки Петри с небольшим количеством жидкой среды MS. Co стороны первого среза от каждого из эксплантов А-5 скальпелем отрезают полоску шириной около 2 мм, формируя экспланты первой стадии. Экспланты А-1 собирают в стакан с жидкой средой MS с добавлением 500 мг/л цефотаксима и интенсивно перемешивают для удаления остатков агробактерий. После этого экспланты А-1 раскладывают в чашки Петри на поверхность среды RT тыльной стороной к среде. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 23-25°С. Экспланты А-5 снова возвращают на ту же среду СС, где предварительно меняют бумажный фильтр. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 25-28°С в течение следующих 3-х суток.
На втором шаге экспланты А-5 переносят в стакан с жидкой средой MS, в течение 3-5 минут интенсивно перемешивают для удаления избытка бактерий. Отмытые экспланты переносят в чашки Петри с небольшим количеством жидкой среды MS. Co стороны первого среза от эксплантов А-5 скальпелем отрезают следующую полоску шириной от 1 до 2 мм, формируя экспланты второй стадии. Экспланты А-2 собирают в стакан с жидкой средой MS с добавлением 500 мг/л цефотаксима и интенсивно перемешивают для удаления остатков агробактерий. После этого экспланты А-2 раскладывают в чашки Петри на поверхность среды RT тыльной стороной к среде. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 23-25°С. Экспланты А-5 снова возвращают на ту же среду СС, где предварительно меняют бумажный фильтр. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 25-28°С в течение следующих 3-х суток.
На третьем и четвертом шагах из эксплантов А-5 формируют экспланты третьей А-3 и четвертой А-4 стадий в соответствии с процедурой, описанной для второго шага.
На пятом шаге производят обработку последнего экспланта А-5, который переносят в стакан с жидкой средой MS, в течение 3-5 минут интенсивно перемешивают для удаления избытка бактерий, после этого промывают жидкой средой MS с добавлением 500 мг/л цефотаксима для удаления остатков агробактерий. После этого экспланты А-5 раскладывают в чашки Петри на поверхность среды RT тыльной стороной к среде. Чашки заматывают парафильмом и инкубируются в термостате в темноте при температуре 23-25°С.
В качестве контрольного варианта используют известный способ подготовки, инокуляции и кокультивации эксплантов (James et al. 1990 и Nehra et al. 1990).
Селекция трансгенной ткани, отбор трансформантов и элиминация агробактерий.
Экспланты после инокуляции и кокультивации с агробактериями раскладывают в чашки Петри на поверхность среды RT, дополненную 600 мг/л гидролизата казеина, 500 мг/л цефотоксима и 50 мг/л канамицина. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 23-25°С. Цефотоксим используют для элиминации остатков агробактерий на эксплантах. Его концентрацию изменяют в течение пассажей: с каждым месячным пассажем уровень снижают на 100 мг/л от исходных 500 мг/л до конечных 0 мг/л. Канамицин выступает в роли селективного агента, поскольку в векторных конструкциях в качестве селективного маркера используется ген неомицинфосфотрансферазы nptII. Рабочая концентрация канамицина, достаточная для подавления роста нетрансгенной ткани земляники садовой, составляет 50 мг/л. Однако для стимуляции регенерации адвентивных побегов концентрацию канамицина в среде снижют вдвое после отделения каллусных кусочков от исходной ткани эксплантов и переноса их на свежую среду. Отделение трансгенного каллуса от отмирающей ткани эксплантов является ключевым моментом процесса селекции и регенерации трансформантов. Эффективность трансформации без этой процедуры существенно снижается.
Регенерация трансформантов земляники может протекать двумя способами: непосредственно из клеток эксплантов и/или через промежуточную каллусную стадию. В первом случае трансформанты появляются с первого по второй месяц селекции. Регенерация через каллусную стадию значительно растянута во времени, трансформанты могут появляться с третьего по шестой месяц культивирования на селективной среде.
Мультипликация трансформантов.
Регенерировавшие побеги отделяют от исходной ткани эксплантов и переносят для мультипликации на среду М (Таблица 1), допо