Способ получения солей поливалентных металлов жирных кислот
Иллюстрации
Показать всеИзобретение относится к получению солей поливалентных металлов и кислот растительных масел и жиров, которые могут быть использованы в качестве катализаторов и сиккативов в кожевенной, резинообувной, лакокрасочной и других отраслях промышленности. Соли поливалентных металлов жирных кислот получают воздействием на щелочные соли этих кислот водным раствором водорастворимой соли поливалентного металла или смеси водорастворимых солей поливалентных металлов. Соли щелочного металла или аммония получают путем количественного щелочного гидролиза соответствующего растительного масла, жира, низковязких оксидатов или их смесей при обработке последнего(ей) при интенсивном механическом перемешивании и постепенном росте температуры от 20-30°С до 60-100°С эквивалентным количеством щелочи или аммиака, вводимой(ого) в виде 3,26-48,46% водного раствора, в течение 3-10 минут в присутствии начальной добавки стеарата или олеата натрия в количестве 0,5-1,0% от массы гидролизуемого растительного масла, жира, низковязкого оксидата или их смесей, либо содержащей такое же количество мыла щелочного металла и кислот гидролизуемого объекта добавки реакционной смеси предшествующего гидролиза до остаточного содержания щелочи в системе, не превышающего 2-3% от исходной величины, после чего продолжают перемешивание 10-15 мин. В полученную реакционную смесь, не прекращая перемешивания и не снижая температуру, вводят в течение 10-20 мин. предварительно приготовленный и подогретый до температуры 60-98°С водный раствор водорастворимой соли поливалентного металла или смеси солей разных поливалентных металлов в количестве 1 г-экв. на 1 моль взятой на гидролиз щелочи, продолжают перемешивание в течение 15-20 мин. После этого перемешивание прекращают и полученную композицию солей подвергают отделению от водной фазы путем фильтрования, центрифугирования или экстрагирования органическим растворителем. Способ позволяет получать соли поливалентного металла или нескольких поливалентных металлов с анионным составом, полностью качественно и количественно отвечающим кислотному составу конкретного растительного масла или жира. 4 з.п. ф-лы, 3 табл.
Реферат
Изобретение относится к получению солей поливалентных металлов и кислот растительных масел и жиров, которые могут быть использованы в качестве катализаторов и сиккативов в кожевенной, резинообувной, лакокрасочной и других отраслях промышленности.
Известен способ получения состава для жирования кожи (а.с. СССР № 670613), в котором натуральные и гидрированные растительные масла и различные жиры окисляют воздухом в режиме барботажа в присутствии линолеата кобальта как катализатора. В соответствии с а.с. СССР № 1460077 рыбий, норковый жир и смеси жиров окисляют кислородом воздуха в присутствии кобальтовой или марганцевой соли полиненасыщенных кислот. Такого рода катализаторы чаще всего получают из кислот растительных масел и жиров. Например, в нагретое растительное масло, жирные или нафтеновые кислоты, либо в расплавленную канифоль вводят оксид металла и при нагревании получают плавленые сиккативы (а.с. СССР №№ 632713, 905248, 905249, 1420014 и др.).
Наиболее близким к заявляемому является способ (P.M.Лившиц, Л.А.Добровинский. Заменители растительных масел в лакокрасочной промышленности. М.: Химия, 1987, с.34), в соответствие с которым сначала получают растворимые в воде щелочные соли жирных, нафтеновых или смоляных кислот и на их водные растворы воздействуют водным раствором соли поливалентного металла, например хлорида или сульфата. В результате реакции двойного обмена образуется осажденный сиккатив, который переводят в органический растворитель, а водный слой отделяют.
Указанный способ имеет ряд недостатков. Прежде всего, в нем нужно получать соль щелочного металла и жирной кислоты, для чего нужно иметь саму кислоту или смесь кислот в виде определенной композиции (канифоль, нафтеновые кислоты и т.д.). В случае жирных C18 ненасыщенных кислот более доступными являются не сами кислоты, а содержащие их жиры и растительные масла. Получать же из последних указанные кислоты, а тем более выделять и очищать их - задача далеко не простая. Это многостадийный процесс с довольно большим количеством отходов и загрязнений окружающей среды. И совсем не случайно стоимость непредельных кислот из указанного сырья гораздо более высокая, чем многих других кислот иного происхождения.
В отличие от плавленых сиккативов способ двойного обмена не дает возможности сохранять кислотный качественный и количественный состав конкретного растительного масла и жира. Вместе с тем сохранение указанного состава в катализаторе и (или) в сиккативе часто очень важно, поскольку обеспечивает более высокую растворимость, более благоприятные свойства композиций мыл как ПАВ, повышенную эффективность как катализаторов и т.д.
Задача предлагаемого решения заключается в том, чтобы получать композиции солей металла или нескольких металлов с анионным составом, полностью качественно и количественно отвечающим кислотному составу конкретного растительного масла или жира.
Поставленная задача достигается тем, что отвечающие кислотному составу растительного масла, жира, низковязких оксидатов или их смесей и предназначенные для обмена на поливалентный металл смеси солей щелочного металла или аммония получают путем практически количественного щелочного гидролиза соответствующего растительного масла, жира, низковязких оксидатов или их смесей при обработке последнего (их) при интенсивном механическом перемешивании и постепенном росте температуры от 20-30°С до 60-100°С эквивалентным количеством щелочи или аммиака в виде 3,26-48,46%-ных водного раствора в течение 3-10 мин в присутствии начальной добавки стеарата или олеата натрия в количестве 0,5-1,0% от массы гидролизуемого растительного масла, жира, низковязкого оксидата или их смесей, либо содержащей такое же количество мыла щелочного металла и кислот гидролизуемого объекта добавки реакционной смеси предшествующего гидролиза до остаточного содержания щелочи в системе, не превышающего 2-3% от исходной величины, после чего продолжают перемешивание 10-15 мин и в полученную реакционную смесь, не прекращая перемешивания и не снижая температуру, вводят в течение 10-20 мин предварительно приготовленный и подогретый до температуры 60-98°С водный раствор водорастворимой соли поливалентного металла или смеси солей разных поливалентных металлов в количестве 1 г-экв на 1 моль взятой на гидролиз щелочи, продолжают перемешивание в течение 15-20 мин, после чего перемешивание прекращают и полученную композицию солей подвергают отделению от водной фазы путем фильтрования, центрифугирования или экстрагирования органическим растворителем. При этом в качестве оксидатов используют оксидаты растительных масел и рыбьего жира с вязкостью 35-77 сек по вискозиметру ВЗ-4 (20°С), а в качестве щелочного агента при гидролизе используют гидроксиды лития, натрия и калия. В качестве водорастворимых солей поливалентного металла используют хлориды алюминия, кальция, железа (III), марганца (II), кобальта (II), бария; сульфаты марганца (II), кобальта (II) и меди (II), нитраты цинка и свинца (II). А если получаемые соли поливалентного металла подвержены быстрому окислению кислородом воздуха, стадию выделения солей проводят в среде азота.
Характеристика используемого сырья
Подсолнечное масло не пищевое по ГОСТ 1129-81, а также некондиционное без каких-либо ограничений на исходное кислотное число и обводненность.
Соевое масло некондиционное без каких-либо ограничений на исходное кислотное число и обводненность.
Льняное масло по ГОСТ 5791-81, а также некондиционное без каких-либо ограничений на исходное кислотное число и обводненность.
Жир животный 3-го сорта по ГОСТ 1045-73 «Жир животный технический».
Технический рыбий жир 3-го сорта по ГОСТ 1304-76 «Жиры рыб и морских млекопитающих технические», а также некондиционное без каких-либо ограничений на исходное кислотное число и обводненность.
Оксидаты растительных масел и рыбьего жира соответствующей вязкости получали путем жидкофазного окисления их кислородом воздуха в колонне барботажного типа в интервале температур 105-110°С в отсутствии каких-либо солевых катализаторов и прочих добавок.
Щелочные агенты:
гидроксид лития, 1-водный LiOH·Н2О МРТУ 6-09-4539-67;
гидроксид натрия (сода каустическая) по ГОСТ 4328-66;
гидроксид калия по ГОСТ 4203-65;
аммиак водный NH4OH по ГОСТ 3760-64;
Водорастворимые соли металлов:
алюминий хлористый, 6-водный AlCl3·6Н2O по ГОСТ 3759-65;
кальций хлористый, 6-водный CaCl2·6Н2О по ГОСТ 4141-66;
марганец (II) сернокислый, 5-водный MnSO4·5H2O по ГОСТ 435-67;
марганец двухлористый, 4-водный MnCl2·H2О по ГОСТ 612-67;
железо треххлористое, 6-водное FeCl3·6Н2О по ГОСТ 4147-65;
кобальт (II) сернокислый, 7-водный CoSO4·7Н2O по ГОСТ 4462-68;
кобальт (II) двухлористый, 6-водный CoCl2·6H2O по ГОСТ 4525-68;
медь (II) сернокислая, 5-водная CuSO4·5H2O по ГОСТ 4165-68;
цинк азотнокислый, 6-водный Zn(NO3)2·6Н2O по ГОСТ 5106-69;
барий хлористый, 2-водный BaCl2·2H2O по ГОСТ 4108-65;
свинец (II) азотнокислый Pb(NO3)2 по ГОСТ 4236-67.
Проведение процесса получения солей поливалентных металлов и кислот растительных масел, жиров, низковязких оксидатов или их смесей состоит в следующем. В реактор с интенсивным механическим перемешиванием и подогревом через рубашку или жидкостную баню загружают расчетное количество растительного масла, жира, низковязкого оксидата или их смеси. Включают механическое перемешивание и вводят добавку натриевого мыла или полученной ранее реакционной смеси предшествующего гидролиза. После этого вводят водный раствор щелочи или аммиака и включают обогрев. Контроль ведут методом отбора проб и определения в них остаточного содержания щелочи. Как только последнее окажется менее 3% от исходного количества взятой на гидролиз щелочи, приготовление щелочных солей для обменного процесса считается завершенным. К этому моменту температура реакционной смеси оказывается в диапазоне 60-100°С.
По достижении указанного состояния, не прекращая интенсивного механического перемешивания, вводят предварительно приготовленный и подогретый до температуры 60-98°С водный раствор водорастворимой соли поливалентного металла или смеси водорастворимых солей поливалентных металлов. Ввод делают постепенно, давая возможность ранее добавленному количеству полностью распределяться по всему объему системы и в основном прореагировать. По мере превращения реакционной массы в эмульсию-суспензию и далее преимущественно в суспензию ввод раствора водорастворимой соли поливалентного металла (смеси водорастворимых солей поливалентных металлов) несколько замедляют.
После полного ввода всего раствора водорастворимой соли (смеси водорастворимых солей) поливалентного (ых) металла(ов) интенсивное механическое перемешивание продолжают еще некоторое время для количественного завершения обменного процесса и некоторого структурирования твердой фазы. По истечении указанного времени образовавшиеся суспензии солей поливалентных металлов и кислот растительных масел и жиров подвергают фильтрованию, центрифугированию, или экстрагированию органическими растворителями.
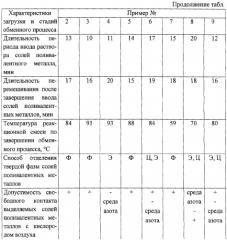
Выявлено, что соли кобальта и ненасыщенных кислот, будучи смоченными водно-органической фазой, очень быстро окисляются кислородом воздуха и меняют цвет на зеленый. Аналогичное явление, хотя и в гораздо меньшей степени обнаружено и для некоторых солей других металлов. В таких случаях выделение солей ведут в атмосфере азота.
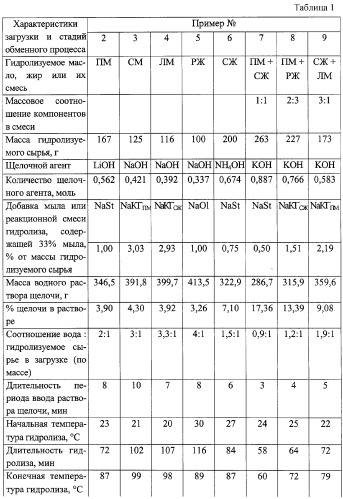
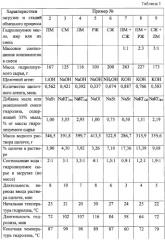
Пример № 1.
В стальной реактор емкостью 1,4 л в виде стакана автоклава с соотношением высоты к диаметру 2,5:1, снабженный вращающейся со скоростью 1440 об/мин механической мешалкой лопастного типа, загрузочным патрубком и карманом для термопары в крышке, а также перемещаемой вдоль продольной оси реактора жидкостной баней с нагревателем на наружной поверхности своего корпуса, вводят 300 г подсолнечного масла и 2,3 г стеарата натрия, включают механическое перемешивание и обогрев жидкостной бани. Сразу же через загрузочный патрубок, не прекращая механического перемешивания, вводят в течение 3 мин 182,7 г 31%-ного раствора гидроксида калия. По ходу процесса отбирают пробы реакционной массы, в которых определяют остаточное содержание щелочи. Через 47 мин последнее оказалось 0,06 моль/кг, что составляет ˜ 2,9% от исходного количества. Температура в этот момент достигла 64°С. Продолжают перемешивание еще 10 мин после чего вводят в течение 10 мин без прекращения перемешивания 500 г подогретого до 67°С водного раствора, содержащего 0,5055 моля хлорида марганца (II). Перемешивание продолжают еще 20 мин, после чего образовавшуюся однородную кашеподобную массу переносят на фильтр, где и происходит отделение и промывка дистиллированной водой твердых солей марганца и кислот подсолнечного масла.
Примеры 2-9.
Характеристики реакционного аппарата, порядок загрузки реагентов и последовательности операций в стадиях гидролиза и обмена катиона щелочного металла (аммония) на катион поливалентного металла аналогичны описанным в примере 1. Отличаются природой гидролизуемого триглицерида, природой щелочи, природой соли поливалентного металла, некоторыми загрузочными, временными и температурными характеристиками, а также способами отделения целевых солей поливалентных металлов от водного раствора глицерина и соли щелочного металла (аммония) и допустимостью свободного контакта отделяемых солей поливалентных металлов с кислородом воздуха. Полученные данные сведены в таблицу 1. При этом использованы обозначения: ПМ, СМ, ЛМ - подсолнечное, соевое и льняное масло; РЖ и СЖ - рыбий и свиной жир; NaSt, NaOl, NaКГПМ, NaКГСЖ - стеарат, олеат натрия, Na - соли кислот гидролиза масла или жира; Ф, Ц и Э - фильтрование, центрифугирование и экстрагирование, «+» - контакт отделяемых солей с воздухом, в том числе и длительный, допустим; «-» - длительный контакт отделяемых солей поливалентных металлов с воздухом недопустим; нужна атмосфера азота.
Примеры 10-17.
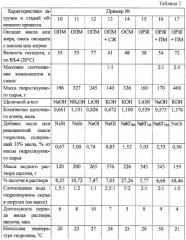
Реакционный аппарат, порядок загрузки реагентов и последовательности операций в стадиях щелочного гидролиза и обмена катиона щелочного металла (аммония) на катион поливалентного металла аналогичны описанным в примере 1. Отличаются параметрами, указанными в примерах № 2-9, а также использованием для гидролиза низковязких оксидатов растительных масел и рыбьего жира индивидуально и в смеси с растительными маслами и жирами в любых соотношениях. Полученные данные сведены в таблицу. При этом использованы обозначения, приведенные в описании к примерам 2-9, а также ОПМ, ОЛМ, ОСМ и ОРЖ - оксидаты подсолнечного, льняного, соевого масла и рыбьего жира.
Примеры 18-21.
Реакционный аппарат, гидролизуемое сырье и щелочной агент, их количества, соотношение водатидролизуемое сырье, порядок загрузки реагентов и последовательности операций в стадиях щелочного гидролиза и обмена катиона щелочного металла на катион поливалентного металла аналогичны описанным в примере 16. Отличаются содержанием мыл в реакционных смесях предшествующих гидролизов, которые используются в качестве стимулирующей добавки вместо мыл щелочных металлов и индивидуальных жирных кислот. Полученные данные приведены в табл.3.
| Табл.3 | ||||
| Характеристики загрузки и стадий обменного процесса | Пример № | |||
| 18 | 19 | 20 | 21 | |
| Содержание мыла в реакционной смеси ранее проводимого гидролиза, % мас | 24,62 | 47,12 | 58,31 | 66,74 |
| Добавка реакционной смеси ранее проведенного гидролиза, % от массы гидролизуемого сырья | 2,60 | 1,55 | 1,41 | 1,45 |
| Расчетная добавка мыл, % от массы гидролизуемого сырья | 0,64 | 0,73 | 0,82 | 0,97 |
| Длительность периода ввода раствора щелочи, мин | 10 | 8 | 10 | 10 |
| Начальная температура гидролиза, °С | 26 | 28 | 30 | 22 |
| Длительность гидролиза, мин | 152 | 143 | 131 | 116 |
| Конечная температура гидролиза, °С | 93 | 97 | 95 | 96 |
| Остаточное содержание щелочи в реакционной смеси по результатам последнего анализа, % от исходной дозировки | 2,9 | 2,9 | 2,7 | 2,6 |
| Дополнительное перемешивание, мин | 13 | 14 | 12 | 11 |
| Температура водного раствора нитрата цинка перед вводом, °С | 89 | 93 | 91 | 95 |
| Длительность периода ввода раствора нитрата цинка, мин | 19 | 17 | 13 | 16 |
| Длительность перемешивания после завершения ввода раствора нитрата цинка, мин | 16 | 17 | 19 | 18 |
| Температура реакционной смеси по завершении обменного процесса, °С | 87 | 90 | 88 | 91 |
| Способ отделения твердой фазы солей цинка | Ф | Ф | Ф | Ф |
| Допустимость контакта отделяемых солей цинка с кислородом воздуха | + | + | + | + |
Положительный эффект предлагаемого решения состоит в следующем:
1. Получение солей щелочных металлов (аммония) для обменной замены на соли поливалентных металлов производится не путем нейтрализации имеющихся свободных карбоновых кислот или их смесей, а путем щелочного гидролиза растительных масел, жиров, низковязких оксидатов и их смесей, т.е. из гораздо более доступного и дешевого сырья.
2. Нет никакой необходимости в качестве промежуточных стадий выделять и очищать кислоты из продуктов щелочного гидролиза масел и жиров. Аналогично и в отношении солей этих кислот и щелочных металлов, а также аммония. Это существенно сокращает потери сырья, а также выход загрязнений окружающей среды.
3. Удается сохранять анионный состав солей поливалентных металлов на хорошо отвечающем кислотному составу конкретного масла или жира уровне. Более того указанный состав можно существенно менять, используя различные смеси жиров и растительных масел, а также при переходе к оксидатам последних и их смесям. Это позволяет решать многие конкретные задачи управления функциональным составом солей за счет варьирования анионным составом.
4. Указанным способом можно получать комбинации солей разных металлов, которые другими способами получить гораздо труднее. К тому же появляется возможность естественного распределения анионов между катионами различных металлов, что может существенно повлиять на активность комбинированных катализаторов и сиккативов, их растворимость в различных средах, поверхностно-активные свойства и многие другие характеристики.
5. Стадии щелочного гидролиза и обменного разложения без всякого труда можно сделать автономными и реализовывать в разных масштабах. В частности на базе щелочного мыла одной партии гидролиза можно провести десятки вариантов получения солей поливалентных металлов или их разнообразных комбинаций, что в ряде случаев очень важно и желаемо.
1. Способ получения солей поливалентных металлов жирных кислот путем воздействия на щелочные соли этих кислот водным раствором водорастворимой соли поливалентного металла или смеси водорастворимых солей поливалентных металлов, отличающийся тем, что соли щелочного металла или аммония получают путем количественного щелочного гидролиза соответствующего растительного масла, жира, низковязких оксидатов или их смесей при обработке последнего(ей) при интенсивном механическом перемешивании и постепенном росте температуры от 20-30°С до 60-100°С эквивалентным количеством щелочи или аммиака, вводимой (ого) в виде 3,26-48,46%-го водного раствора, в течение 3-10 мин в присутствии начальной добавки стеарата или олеата натрия в количестве 0,5-1,0% от массы гидролизуемого растительного масла, жира, низковязкого оксидата или их смесей, либо содержащей такое же количество мыла щелочного металла и кислот гидролизуемого объекта добавки реакционной смеси предшествующего гидролиза до остаточного содержания щелочи в системе, не превышающего 2-3% от исходной величины, после чего продолжают перемешивание 10-15 мин и в полученную реакционную смесь, не прекращая перемешивания и не снижая температуру, вводят в течение 10-20 мин предварительно приготовленный и подогретый до температуры 60-98°С водный раствор водорастворимой соли поливалентного металла или смеси солей разных поливалентных металлов в количестве 1 г-экв на 1 моль взятой на гидролиз щелочи, продолжают перемешивание в течение 15-20 мин, после чего перемешивание прекращают и полученную композицию солей подвергают отделению от водной фазы путем фильтрования, центрифугирования или экстрагирования органическим растворителем.
2. Способ по п.1, отличающийся тем, что используют оксидаты растительных масел и рыбьего жира с вязкостью 35-77 с по вискозиметру ВЗ-4 (20°С).
3. Способ по п.1, отличающийся тем, что в качестве щелочного агента при гидролизе используют гидроксиды лития, натрия и калия.
4. Способ по п.1, отличающийся тем, что в качестве солей поливалентных металлов используют сульфаты кобальта (II), марганца (II), меди (II); хлориды кобальта (II), марганца (II), кальция, бария, алюминия и железа(III); нитраты цинка и свинца (II).
5. Способ по п.1, отличающийся тем, что в случаях быстрого окисления получаемых солей поливалентных металлов и кислот растительных масел и жиров кислородом воздуха стадию выделения таких солей проводят в среде азота.