Способ борьбы с конкретными насекомыми-вредителями путем нанесения антраниламидных соединений
Иллюстрации
Показать всеОписывается способ борьбы с чешуекрылыми, равнокрылыми, полужесткокрылыми, трипсами и с жесткокрылыми насекомыми-вредителями, путем контактирования указанных насекомых или окружающей их среды с артроподицидно эффективным количеством соединения формулы I, его N-оксида или сельскохозяйственно-приемлемой соли, эффективным против членистоногих, в которой А и В независимо представляют О или S; R1, R2 представляют собой Н, C1-С6алкил; R3 обозначает Н, C1-С6алкил, С2-С6алкенил, С2-С6алкинил или С3-С6циклоалкил, каждый из которых может быть замещен; R4 представляет собой Н, C1-С6алкил, С2-С6алкинил, C1-С6галогеналкил, CN, галоген, С1-С4алкокси, С1-С4галогеналкокси, NO2; R5 обозначает Н, С1-С6алкил, C1-С6галогеналкил, С1-С4гидроксиалкил, СО2R10, C(О)NR10R11, галоген или С1-С4алкокси; R6 обозначает Н, C1-С6алкил, С1-С6галогеналкил; R7 представляет собой C1-С6алкил, С2-С6алкенил, C1-С6галогеналкил или фенильное кольцо, бензильное кольцо или 5- или 6-членное гетероароматическое кольцо, нафтильную циклическую систему или 8- или 10-членную конденсированную гетеробициклическую систему. Описывается также соединение формулы I и соединение бензоксазина формулы 10. Данные соединения эффективны в отношении беспозвоночных вредителей в сельском хозяйстве. 3 н. и 19 з.п. ф-лы, 13 табл.
Реферат
Настоящее изобретение относится к способу использования некоторых антраниламидов, их N-оксидов, сельскохозяйственно-приемлемых солей и композиций для борьбы с беспозвоночными вредителями в сельском хозяйстве и в областях, не относящихся к сельскому хозяйству.
Борьба с беспозвоночными вредителями имеет очень важное значение для выращивания высокоурожайных культур. Ущерб, наносимый беспозвоночными вредителями во время выращивания и хранения сельскохозяйственных культур, может приводить к значительному снижению продуктивности и, тем самым, к повышению стоимости продукта для потребителя. Важное значение также имеет борьба с беспозвоночными вредителями лесов, тепличных культур, декоративных растений, культур, выращиваемых в питомниках, при хранении пищевых продуктов и волокон; с вредителями, поражающими крупный рогатый скот, с бытовыми вредителями и с насекомыми, приносящими вред здоровью человека и животных. Для этих целей имеется множество коммерчески доступных продуктов, однако, необходимость в получении новых соединений, которые являются еще более эффективными, менее дорогостоящими, менее токсичными и более безопасными для окружающей среды, или обладают другими механизмами действия, остается актуальной.
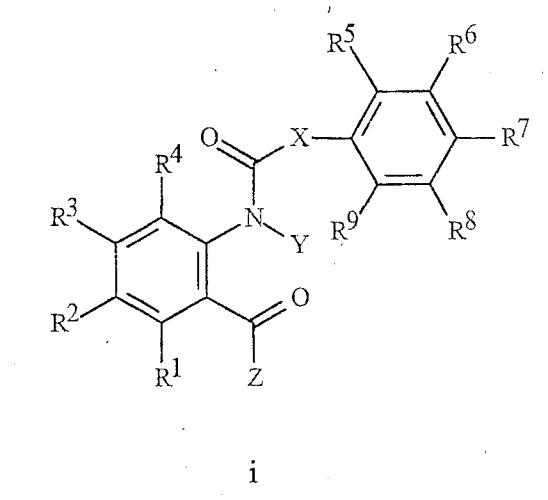
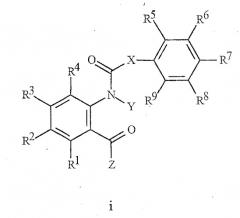
В NL 9202078 описаны производные N-ацилантраниловой кислоты формулы i, используемые в качестве инсектицидов:
где Х представляет собой прямую связь;
Y представляет собой Н или С1-С6 алкил;
Z представляет собой NH2, NH(С1-С3алкил) или N(С1-С3алкил)2; и
R1-R9 независимо представляют Н, галоген, С1-С6алкил, фенил, гидрокси, С1-С6алкокси или С1-С7ацилокси.
Краткое описание изобретения
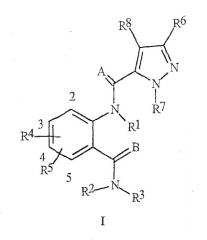
Настоящее изобретение относится к способу борьбы с чешуекрылыми, равнокрылыми, полужесткокрылыми, трипсами и с жесткокрылыми насекомыми-вредителями, предусматривающему контактирование указанных насекомых или окружающей их среды с определенным количеством соединения формулы I, его N-оксидов или сельскохозяйственно-приемлемой соли, эффективным против членистоногих:
где А и В независимо представляют О или S;
R1 представляет собой Н, С1-С6алкил, С2-С6алкоксикарбонил или С2-С6алкилкарбонил;
R2 представляет собой Н или С1-С6алкил;
R3 представляет собой Н; С1-С6алкил, С2-С6алкенил, С2-С6алкинил или С3-С6циклоалкил, каждый из которых необязательно замещен одним или несколькими заместителями, выбранными из группы, состоящей из галогена, CN, NO2, гидрокси, С1-С4алкила,
С1-С4-алкокси, С1-С4галогеналкокси, С1-С4алкилтио,
С1-С4алкилсульфинила, С1-С4алкилсульфонила, С2-С6алкоксикарбонила,
С2-С6алкилкарбонила, С3-С6триалкилсилила, фенила, фенокси,
5-членных гетероароматических колец и 6-членных гетероароматических колец;
где каждый из фенила, фенокси, 5-членного гетероароматического кольца и 6-членного гетероароматического кольца необязательно замещен одним-тремя заместителями, независимо выбранными из группы, состоящей из С1-С4алкила,
С2-С4алкенила, С2-С4алкинила, С3-С6циклоалкила,
С1-С4галогеналкила, С2-С4галогеналкенила, С2-С4галогеналкинила, С3-С6галогенциклоалкила, галогена, CN, NO2, С1-С4алкокси,
С1-С4галогеналкокси, С1-С4алкилтио, С1-С4алкилсульфинила,
С1-С4алкилсульфонила, С1-С4алкиламино, С2-С8диалкиламино,
С3-С6циклоалкиламино, С4-С8(алкил)(циклоалкил)амино,
С2-С4алкилкарбонила, С2-С6алкоксикарбонила,
С2-С6алкиламинокарбонила, С3-С8диалкиламинокарбонила и
С3-С6триалкилсилила;
С1-С4алкокси; С1-С4алкиламино; С2-С8диалкиламино;
С3-С6циклоалкиламино; С2-С6-алкоксикарбонил или С2-С6алкилкарбонил;
R4 представляет собой Н, С1-С6алкил, С2-С6алкенил,
С2-С6алкинил, С3-С6циклоалкил, С1-С6галогеналкил, CN, галоген,
С1-С4-алкокси, С1-С4галогеналкокси или NO2;
R5 представляет собой Н, С1-С6алкил, С1-С6галогеналкил,
С1-С4алкоксиалкил, С1-С4гидроксиалкил, С(О)R10, CO2R10, С(О)NR10R11,
галоген, С1-С4алкокси, С1-С4галогеналкокси, NR10R11, N(R11)С(О)R10,
N(R11)CO2R10 или S(О)nR12;
R6 представляет собой Н, С1-С6алкил, С1-С6галогеналкил, галоген, CN, С1-С4алкокси или С1-С4галогеналкокси;
R7 представляет собой С1-С6алкил, С2-С6алкенил, С2-С6алкинил, С3-С6циклоалкил, С1-С6галогеналкил, С2-С6галогеналкенил, С2-С6галогеналкинил или С3-С6галогенциклоалкил; или
R7 представляет собой фенильное кольцо, бензильное кольцо или 5- или 6-членное гетероароматрическое кольцо, нафтильную циклическую систему или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую систему, где каждое кольцо или циклическая система необязательно замещены одним-тремя заместителями, независимо выбранными из R9;
R8 представляет собой Н, С1-С6алкил, С1-С6галогеналкил, галоген, С1-С4алкокси или С1-С4галогеналкокси;
и каждый из R9 независимо представляет собой С1-С4алкил,
С2-С4алкенил, С2-С4алкинил, С3-С6циклоалкил, С1-С4галогеналкил,
С2-С4галогеналкенил, С2-С4галогеналкинил, С3-С6галогенциклоалкил,
галоген, CN, NO2, С1-С4-алкокси, С1-С4галогеналкокси,
С1-С4алкилтио, С1-С4алкилсульфинил, С1-С4алкилсульфонил,
С1-С4алкиламино, С2-С8диалкиламино, С3-С6циклоалкиламино,
С4-С8(алкил)(циклоалкил)амино, С2-С4алкилкарбонил,
С2-С6алкоксикарбонил, С2-С6алкиламинокарбонил,
С3-С8диалкиламинокарбонил или С3-С6триалкилсилил;
R10 представляет собой Н, С1-С4алкил или С1-С4галогеналкил;
R11 представляет собой Н или С1-С4алкил;
R12 представляет собой С1-С4алкил или С1-С4галогеналкил; и
n равно 0, 1 или 2.
Настоящее изобретение также относится к такому способу, в котором беспозвоночный вредитель или окружающая его среда подвергаются контакту с композицией, содержащей биологически эффективное количество соединения формулы, I или с композицией, содержащей соединение формулы I и биологически эффективное количество, по крайней мере, одного дополнительного биологически активного соединения.
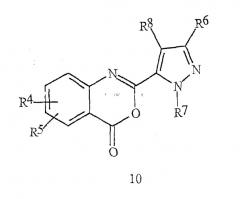
Кроме того, настоящее изобретение относится к соединению бензоксазинона формулы 10
где R4, R5, R6, R7 и R8 определены выше в формуле I.
Соединение формулы 10 может быть использовано в качестве синтетического промежуточного соединения для получения соединения формулы I.
Подробное описание изобретения
В вышеприведенном описании, термин "алкил", используемый отдельно или в сложных словах, таких как "алкилтио" или "галогеналкил", означает алкил с прямой или разветвленной цепью, такой как метил, этил, н-пропил, изопропил или различные бутильные, пентильные или гексильные изомеры. Термин "алкенил" означает алкены с прямой или разветвленной цепью, такие как 1-пропенил, 2-пропенил или различные бутенильные, пентенильные или гексенильные изомеры. Термин "алкенил" также означает полиены, такие как 1,2-пропадиенил и 2,4-гексадиенил. Термин "алкинил" означает алкины с прямой или разветвленной цепью, такие как 1-пропинил, 2-пропинил или различные бутенильные, пентинильные или гексинильные изомеры. Термин "алкинил" может также означать группы, состоящие из множества тройных связей, такие как 2,5-гексадиинил. Термин "алкокси" означает, например, метокси, этокси, н-пропилокси, изопропилокси и различные бутокси-, пентокси- и гексилоксиизомеры. Термин "алкоксиалкил" означает алкил, имеющий алкоксизаместитель. Примерами "алкоксиалкила" являются СН3ОСН2, СН3ОСН2СН2, СН3СН2ОСН2, СН3СН2СН2СН2ОСН2 и СН3СН2ОСН2СН2. Термин "алкилтио" означает алкилтиогруппы с прямой или разветвленной цепью, такие как метилтио, этилтио и различные пропилтио-, бутилтио- и гексилтиоизомеры. Термин "циклоалкил" означает, например, циклопропил, циклобутил, циклопентил и циклогексил.
Термин "гетероциклическое кольцо" или "система гетероциклических колец" означает кольцо или циклические системы, в которых, по крайней мере, один атом на кольце не является атомом углерода и это кольцо содержит 1-4 гетероатома, независимо выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждое гетероциклическое кольцо содержит не более 4 атомов азота, не более 2 атомов кислорода и не более 2 атомов серы. Такое гетероциклическое кольцо может быть связано посредством любого доступного атома углерода или азота в результате замены водорода на указанном атоме углерода или азота. Термин "система ароматических циклов" означает полностью ненасыщенные карбоциклы и гетероциклы, в которых, по крайней мере, одно кольцо указанной полициклической системы является ароматическим (где термин "ароматический" означает, что для данной циклической системы выполняется правило Хюккеля). Термин "гетероароматическое кольцо" означает полностью ароматические кольца, в которых, по крайней мере, один атом кольца не является углеродом, которые содержат 1-4 гетероатома, независимо выбранных из группы, состоящей из азота, кислорода и серы, при условии, что каждое гетероциклическое кольцо содержит не более 4 атомов азота, не более 2 атомов кислорода и не более 2 атомов серы (где "ароматический" означает, что выполняется правило Хюккеля). Такое гетероциклическое кольцо может быть связано посредством любого доступного атома углерода или азота в результате замены водорода на указанном атоме углерода или азота. Термин "ароматическая гетероциклическая система" означает полностью ароматические гетероциклы и гетероциклы, в которых по крайней мере, одно кольцо указанной полициклической системы является ароматическим (где термин "ароматический" означает, что для данной циклической системы выполняется правило Хюккеля). Термин "конденсированная гетеробициклическая система" означает циклическую систему, состоящую из двух конденсированных колец, в которых, по крайней мере, один атом кольца не является углеродом, и это кольцо может быть ароматическим или неароматическим, как определено выше.
Термин "галоген", используемый отдельно или в сложных словах, таких как "галогеналкил", означает фтор, хлор, бром или иод. Кроме того, если этот термин используется в сложных словах, таких как "галогеналкил", то указанный алкил может быть частично или полностью замещен атомами галогена, которые могут быть одинаковыми или различными. Примерами галогеналкила являются F3С, ClCH2, CF3СН2 и CF3CCl2. Термины "галогеналкенил", "галогеналкинил", "галогеналкокси" и т.п. могут быть определены аналогично термину "галогеналкил". Примерами "галогеналкенила" являются (Cl)2С=СНСН2 и CF3СН2СН=СНСН2. Примерами "галогеналкинила" являются НС≡CCHCl, CF3С≡С, CCl3С≡С и FCH2С≡ССН2. Примерами "галогеналкокси" являются CF3О, CCl3СН2О, HCF2СН2СН2О и CF3СН2О.
Общее число атомов углерода в группе-заместителе указано префиксом "Сi-Сj", где "i" и "j" означают числа от 1 до 8. Так, например, С1-С4алкилсульфонил означает метилсульфонил-бутилсульфонил; С2алкоксиалкил означает СН3ОСН2; С3алкоксиалкил означает, например, СН3СН(ОСН3), СН3ОСН2СН2 или СН3СН2ОСН2; и С4алкоксиалкил означает различные изомеры алкильной группы, замещенной алкоксигруппой, содержащей в сумме 4 атома углерода, и примерами таких групп являются СН3СН2СН2ОСН2 и СН3СН2ОСН2СН2. В приведенном выше описании, если соединение формулы I включает гетероциклическое кольцо, то все заместители связаны с этим кольцом посредством любого доступного атома углерода или азота в результате замены водорода на указанном углероде или азоте.
Термин "необязательно замещенный одним-тремя заместителями" означает, что одно-три доступных положения могут быть замещены на указанной группе. Если группа содержит заместитель, которым может быть водород, например, R6, и если в качестве заместителя выбран водород, то это эквивалентно тому, что указанная группа является незамещенной.
Соединения формулы I могут существовать в форме одного или нескольких стереоизомеров. Различными стереоизомерами являются энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Следует отметить, что один стереоизомер может быть более активным и/или он может обладать более благоприятным эффективным действием, если он является преимущественным по сравнению с другим(и) стереоизомером(ами), или если он отделен от другого стереоизомера(ов). Кроме того, разделение, обогащение и/или селективное получение указанных стереоизомеров может быть осуществлено специалистом в данной области. В соответствии с этим, соединения формулы I могут присутствовать в виде смеси стереоизомеров, в виде отдельных стереоизомеров или в оптически активной форме. Аналогичным образом, соединения формулы 10 могут существовать в виде одного или нескольких стереоизомеров. Различными стереоизомерами являются энантиомеры, диастереомеры, атропизомеры и геометрические изомеры. Следует отметить, что один стереоизомер соединения формулы 10 может быть более подходящим для получения конкретного стереоизомера формулы I. Кроме того, разделение, обогащение и/или селективное получение указанных стереоизомеров может быть осуществлено специалистом в данной области. В соответствии с этим, соединения формулы 10 могут присутствовать в виде смеси стереоизомеров, в виде отдельных стереоизомеров или в оптически активной форме.
Солями соединений формулы I являются кислотно-аддитивные соли, образованные неорганическими или органическими кислотами, такими как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, щавелевая, пропионовая, салициловая, винная, 4-толуолсульфоновая или валериановая кислоты.
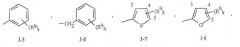
Как указано выше, R7 представляет собой (среди прочих) фенил, бензил, 5- или 6-членное гетероароматическое кольцо, нафтильную циклическую систему или ароматическую 8-, 9- или 10-членную конденсированную гетеробициклическую систему, где каждый цикл или циклическая система необязательно замещены одним-тремя заместителями, независимо выбранными из R9. Термин "необязательно замещенный", относящийся к указанным группам R7, означает, что эти группы являются незамещенными или имеют, по крайней мере, один неводородный заместитель, не влияющий на активность против беспозвоночного вредителя, которой обладает незамещенный аналог. Следует также отметить, что J-1 - J-4, указанные ниже, означают 5- или 6-членные гетероароматические кольца. Примером фенильного кольца, необязательно замещенного 1-3 R9, является кольцо, представленное на фиг.1 как J-5, где r означает целое число от 0 до 3. Примером бензильного кольца, необязательно замещенного 1-3 R9, является кольцо, представленное на фиг.1 как J-6, где r означает целое число от 0 до 3. Примером нафтильной циклической системы, необязательно замещенной 1-3 R9, является система, представленная на фиг.1 как J-59, где r означает целое число от 0 до 3. Примерами 5- или 6-членного гетероароматического кольца, необязательно замещенного 1-3 R9, являются кольца, представленные на фиг.1 как J-7 - J-58, где r означает целое число от 0 до 3. При этом, следует отметить, что J-7 - J-26 являются примерами J-1; J-27 - J-41 являются примерами J-2; а J-46 - J-58 являются примерами J-3 и J-4. Атомы азота, которым требуется заместитель для заполнения их валентности, замещены Н или R9. Следует отметить, что группы J могут быть замещены лишь менее чем тремя группами R9 (например, от J-19, J-20, J-23 - J-26 и J-37 - J-40 могут быть замещены лишь одним R9). Примерами ароматических 8-, 9- или 10-членных конденсированных гетеробициклических систем, необязательно замещенных 1-3 R9, являются системы, представленные на фиг.1 как J-60 - J-90, где r означает целое число от 0 до 3. Хотя группы R9 представлены в этих структурах как J-5 - J-90, однако, следует отметить, что их присутствие является необязательным, поскольку они являются необязательными заместителями. Следует также отметить, что если положение связывания между (R9)r и группой J представлено как плавающее, то (R9)r может быть связан с любым доступным атомом углерода группы J. Кроме того, следует отметить, что если положение присоединения на группе J представлено как плавающее, то группа J может быть присоединена к остальной части соединения формулы I посредством любого доступного атома углерода группы J в результате замещения атома водорода.
Фигура 1
Предпочтительными способами, с точки зрения стоимости, легкости синтеза или применения и/или биологической эффективности, являются:
Предпочтительный вариант 1: Способы получения соединения формулы I, где оба А и В представляют О;
R7 представляет собой фенильное кольцо или 5- или 6-членное гетероароматическое кольцо, выбранное из группы, состоящей из
где каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R9;
Q представляет собой О, S, NH или NR9; и
W, Х, Y и Z независимо представляют N, CN или CR9, при условии, что в J-3 и J-4, по крайней мере, один из W, Х, Y и Z представляет собой N.
Предпочтительный вариант 2: Способы предпочтительного варианта 1, где:
все R1, R2 и R8 представляют Н;
R3 представляет собой С1-С4алкил, необязательно замещенный галогеном, CN, ОСН3 или S(О)рСН3;
группа R4 присоединена в положении 2;
R4 представляет собой СН3, CF3, OCF3, OCHF2, CN или галоген;
R5 представляет собой Н, СН3 или галоген;
R6 представляет собой СН3, CF3 или галоген;
R7 представляет собой фенил или 2-пиридинил, каждый из которых является необязательно замещенным; и
р равно 0, 1 или 2.
Предпочтительный вариант 3. Способы предпочтительного варианта 2, где R3 представляет собой С1-С4алкил, а R6 представляет собой CF3.
Предпочтительный вариант 4. Соединение предпочтительного варианта 2, где R3 представляет собой С1-С4алкил, а R6 представляет собой Cl или Br.
Предпочтительными соединениями формулы 10 являются:
Предпочтительный вариант А. Соединения формулы 10, где:
R7 представляет собой фенильное кольцо или 5- или 6-членное гетероароматическое кольцо, выбранное из группы, состоящей из
где каждое кольцо необязательно замещено одним-тремя заместителями, независимо выбранными из R9;
Q представляет собой О, S, NH или NR9; и
W, Х, Y и Z независимо представляют N, СН или CR9, при условии, что в J-3 и J-4, по крайней мере, один из W, Х, Y и Z представляет собой N.
Предпочтительный вариант В: Соединения предпочтительного варианта А, где:
R8 представляет собой Н;
группа R4 присоединена в положении 2;
R4 представляет собой СН3, CF3, OCF3, OCHF2, CN или галоген;
R5 представляет собой Н, СН3 или галоген;
R6 представляет собой СН3, CF3 или галоген; и
R7 представляет собой фенил или 2-пиридинил, каждый из которых является необязательно замещенным.
Предпочтительный вариант С. Соединения предпочтительного варианта В, где R6 представляет собой CF3.
Предпочтительный вариант D. Соединения предпочтительного варианта В, где R6 представляет собой Cl или Br.
Рассматриваются соединения формулы 10, где R4 находится в положении 2 и представляет собой СН3, Cl или Br; R5 находится в положении 4 и представляет собой F, Cl, Br, I или CF3; R6 представляет собой CF3, Cl или Br; R7 представляет собой 3-Cl-2-пиридинил или 3-Br-2-пиридинил; а R8 представляет собой Н.
Для получения соединений формулы I может быть использован один или несколько из следующих способов и вариантов, приведенных на схемах 1-22. Определения А, В и R1-R9 в соединениях формул 2-40, представленных ниже, приведены выше в разделе "Краткое описание изобретения", если это не оговорено особо. Соединения формул 1а-d, 2a-d, 3a, 4a-d, 5a-b, 17a-c, 18а и 32а-b представляют собой различные подряды соединений формул 1, 2, 3, 4, 5, 17, 18 и 32. На этих схемах Het означает группу, представленную ниже:
Типичный способ получения соединения формулы 1а приведен на схеме 1.
Метод, описанный на схеме 1, предусматривает осуществление реакции сочетания амина формулы 2 с хлорангидридом формулы 3 в присутствии акцептора кислоты с получением соединения формулы Ia. Типичными акцепторами кислоты являются аминовые основания, такие как триэтиламин, N,N-диизопропилэтиламин и пиридин; другими акцепторами являются гидроксиды, такие как гидроксид натрия и калия, и карбонаты, такие как карбонат натрия и карбонат калия. В некоторых случаях могут быть использованы акцепторы кислоты на полимерной основе, такие как связанный с полимером N,N-диизопропилэтиламин и связанный с полимером 4-(диметиламино)пиридин. Реакция сочетания может быть осуществлена в подходящем инертном растворителе, таком как тетрагидрофуран, диоксан, диэтиловый эфир или дихлорметан, с получением анилида формулы 1а.
Тиоамид формулы 1b может быть получен на следующей стадии из соответствующего амида формулы Ia путем обработки одним из ряда стандартных реагентов переноса тиогруппы, включая пентасульфид фосфора и реагент Лавессона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфид).
Как показано на схеме 2, альтернативная методика получения соединений формулы 1а предусматривает проведение реакции взаимодействия амина формулы 2 с кислотой формулы 4 в присутствии дегидратирующего агента, такого как дициклогексилкарбодиимид (DCC), 1,1'-карбонилдиимидазол, хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты или гексафторфосфат бензотриазол-1-илокси-трис-(диметиламино)фосфония.
И в этом случае могут быть использованы реагенты на полимерной основе, такие как связанный с полимером циклогексикарбодиимид. Реакция сочетания может быть проведена в подходящем инертном растворителе, таком как дихлорметан или N,N-диметилформамид. Способы синтеза по схемам 1 и 2 являются лишь репрезентативными примерами широкого ряда способов осуществления реакции сочетания, которые могут быть использованы для получения соединений формулы I; реакция сочетания такого типа широко описана в литературе по химическому синтезу.
Каждому специалисту в данной области также будет очевидно, что хлорангидриды формулы 3 могут быть получены из кислот формулы 4 различными хорошо известными способами. Так, например, хлорангидриды формулы 3 могут быть легко получены из карбоновых кислот формулы 4 путем взаимодействия карбоновой кислоты 4 с тионилхлоридом или оксалилхлоридом в инертном растворителе, таком как толуол или дихлорметан, в присутствии каталитического количества N,N-диметилформамида.
Как показано на схеме 3, амины формулы 2а обычно получают из соответствующих 2-нитробензамидов формулы 5 путем каталитического гидрирования нитрогруппы.
Типичные методики предусматривают восстановление водородом в присутствии металлического катализатора, такого как палладий на угле или оксид платины, в гидроксильных растворителях, таких как этанол и изопропанол. Амины формулы 2а могут быть также получены путем восстановления цинком в уксусной кислоте. Эти методики хорошо описаны в химической литературе. Заместители R1, такие как С1-С6алкил, могут быть введены на этой стадии по хорошо известным методикам, включая либо метод прямого алкилирования, либо, в основном, предпочтительный метод восстановительного алкилирования амина. Кроме того, как показано на схеме 3, обычно используемой методикой является объединение амина 2а с альдегидом в присутствии восстановителя, такого как цианоборогидрид натрия, с получением соединений формулы 2b, где R1 представляет собой С1-С6алкил.
На схеме 4 показано, что соединения формулы 1с могут быть алкилированы или ацилированы с использованием подходящего алкилирующего или ацилирующего агента, такого как алкилгалогенид, алкилхлорформиат или ацилхлорид, в присутствии основания, такого как гидрид натрия или н-бутиллитий в инертном растворителе, таком как тетрагидрофуран или N,N-диметилформамид, с получением анилидов формулы Id, где R1 не является водородом.
Промежуточные амиды формулы 5а могут быть легко получены из коммерчески доступных 2-нитробензойных кислот. Могут быть использованы типичные способы образования амида. Как показано на схеме 5, такими способами являются прямая реакция сочетания с дегидратацией кислот формулы 6 с аминами формулы 7 с использованием, например, DCC, и превращение этих кислот в активированные формы, такие как хлорангидриды или ангидриды кислот, с последующей реакцией сочетания с аминами с образованием амидов формулы 5а.
Особенно подходящими реагентами для реакции этого типа, включая активацию кислоты, являются алкилхлорформиаты, такие как этилхлорформиат или изопропилхлорформиат. Способы получения амида хорошо описаны в химической литературе. Амиды формулы 5а могут быть легко превращены в тиоамиды формулы 5b с использованием коммерчески доступных реагентов переноса тиогруппы, таких как пентасульфид фосфора и реагент Лавессона.
Промежуточные антраниламиды формулы 2с или 2d могут быть также получены из ангидридов N-карбоксиантраниловой кислоты формул 8 или 9, соответственно, как показано на схеме 6.
Типичные методики предусматривают объединение эквимолярных количеств амина 7 с ангидридом N-карбоксиантраниловой кислоты в полярных апротонных растворителях, таких как пиридин и N,N-диметилформамид при температуре в пределах от комнатной температуры до 100°С. Заместители R1, такие как алкил и замещенный алкил, могут быть введены путем катализируемой основанием реакции алкилирования ангидрида N-карбоксиантраниловой кислоты 8 с известными алкилирующими реагентами R1-Lg (где Lg означает нуклеофильно заменяемую уходящую группу, такую как галогенид, алкил- или арилсульфонаты или алкилсульфаты) с получением алкилзамещенного промежуточного соединения 9. Ангидриды N-карбоксиантраниловой кислоты формулы 8 могут быть получены способами, описанными Coppola, Synthesis 1980, 505-36.
Как показано на схеме 7, альтернативная методика получения конкретных соединений формулы 1с предусматривает проведение реакции амина 7 с бензоксазиноном формулы 10.
Реакция, описанная на схеме 7, может быть проведена в чистом виде или в различных подходящих растворителях, включая тетрагидрофуран, диэтиловый эфир, пиридин, дихлорметан или хлороформ при оптимальных температурах, составляющих в пределах от комнатной температуры до температуры кипения с обратным холодильником растворителя. Общая реакция бензоксазинонов с аминами с получением антраниламидов хорошо описана в химической литературе. Обзор химии бензоксазинонов можно найти у Jakobsen et al., Biorganic and Medicinal Chemistry 2000, 8, 2095-2103, и в цитируемых там работах. См. также Coppola, J. Heterocyclic Chemistry 1999, 36, 563-588.
Бензоксазиноны формулы 10 могут быть получены в соответствии с различными методиками. Две методики, которые являются особенно подходящими, подробно приведены на схемах 8-9. На схеме 8 бензоксазинон формулы 10 получают непосредственно с помощью реакции сочетания пиразолкарбоновой кислоты формулы 4а с антраниловой кислотой формулы 11.
Эта реакция включает последовательное добавление метансульфонилхлорида в присутствии третичного амина, такого как триэтиламин или пиридин, к пиразолкарбоновой кислоте формулы 4а, затем добавления антраниловой кислоты формулы 11 с последующим повторным добавлением третичного амина и метансульфонилхлорида. Эта методика дает, в основном, хорошие выходы бензоксазинона и более детально проиллюстрирована в примерах 6 и 8.
На схеме 9 проиллюстрировано альтернативное получение бензоксазинонов формулы 10, предусматривающее проведение реакции сочетания хлорангидрида пиразоловой кислоты формулы 3а с ангидридом N-карбоксиантраниловой кислоты формулы 8 с получением непосредственно бензоксазинона формулы 10.
Для этой реакции, подходящими являются такие растворители, как пиридин или пиридин/ацетонитрил. Хлорангидриды формулы 3а могут быть получены из соответствующих кислот формулы 4а различными методами синтеза, такими как хлорирование тионилхлоридом или оксалилхлоридом.
Ангидриды N-карбоксиантраниловой кислоты формулы 8 могут быть получены из изатинов формулы 13, как показано на схеме 10.
Изатины формулы 13 получают из анилиновых производных формулы 12 способами, хорошо описанными в литературе. Окисление изатина 13 пероксидом водорода дает, в основном, хорошие выходы соответствующего ангидрида N-карбоксиантраниловой кислоты 8 (Angew. Chem. Int. Ed. Engl. 1980, 19, 222-223). Ангидриды N-карбоксиантраниловой кислоты могут быть также получены из антраниловых кислот 11 с помощью хорошо известных методик, предусматривающих проведение реакции соединения 11 с фосгеном или с эквивалентом фосгена.
Синтез репрезентативных кислот формулы 4 проиллюстрирован на схемах 11-16. Синтез пиразолов формулы 4а проиллюстрирован на схеме 11.
Синтез соединений формулы 4а на схеме 11 включает ключевую стадию введения заместителя R7 путем алкилирования или арилирования пиразола формулы 14 соединениями формулы 15 (где Lg представляет собой уходящую группу, определенную выше). В результате окисления метильной группы образуется пиразолкарбоновая кислота. Некоторые из более предпочтительных групп R6 представляют собой галогеналкилы.
Синтез пиразолов формулы 4а также проиллюстрирован на схеме 12.
Эти кислоты могут быть получены путем металлирования и карбоксилирования соединений формулы 18, в качестве ключевой стадией. Группу R7 вводят способом, описанным на схеме 11, то есть, путем алкилирования или арилирования соединением формулы 15. Репрезентативными группами R6 являются, например, циано, галогеналкил и галоген.
Эта методика может быть использована, в частности, для получения 1-(2-пиридинил)пиразолкарбоновых кислот формулы 4b, как показано на схеме 13.
Реакция пиразола формулы 17 с 2,3-дигалогенпиридином формулы 15а дает хорошие выходы 1-пиридилпиразола формулы 18а с хорошей специфичностью для достижения желаемой региохимии. В результате металлирования соединения 18а диизопропиламидом лития (LDA) с последующим гашением литиевой соли диоксидом углерода получают 1-(2-пиридинил)пиразолкарбоновую кислоту формулы 4b. Подробное описание этих методик приводится в примерах 1, 3, 6, 8 и 10.
Синтез пиразолов формулы 4с приведен на схеме 14.
На схеме 14 проиллюстрирована реакция необязательно замещенного фенилгидразина формулы 19 с кетопируватом формулы 20 с получением сложных эфиров пиразола формулы 21. В результате гидролиза сложных эфиров образуются пиразоловые кислоты формулы 4с. Эта методика может быть, в частности, использована для получения соединений, в которых R7 представляет собой необязательно замещенный фенил, а R6 представляет собой галогеналкил.
Альтернативный синтез пиразоловых кислот формулы 4с приведен на схеме 15.
Способ, описанный на схеме 15, предусматривает проведение реакции 3+2-циклоприсоединения соответствующим образом замещенного иминогалогенида 22 либо с замещенными пропиолатами формулы 23, либо с акрилатами формулы 25. Реакция циклоприсоединения с акрилатом требует дополнительного окисления промежуточного пиразолина в пиразол. В результате гидролиза сложных эфиров образуются пиразоловые кислоты формулы 4с. Предпочтительными иминогалогенидами для этой реакции являются трифторметилиминохлорид формулы 26 и иминодибромид формулы 27. Такие соединения, как соединение 26, являются известными (J. Heterocycl. Chem. 1985, 22(2), 565-8). Такие соединения, как соединение 27, могут быть получены известными способами (Tetrahedron Letters 1999, 40, 2605). Эти методики могут быть использованы, в частности, для получения соединений, где R7 представляет собой необязательно замещенный фенил, а R6 представляет собой галогеналкил или бром.
Исходные пиразолы формулы 17 являются известными соединениями, либо они могут быть получены известными методами. Пиразол формулы 17а (соединения формулы 17, где R6 представляет собой CF3, а R8 представляет собой Н) может быть получен в соответствии с методиками, описанными в литературе (J. Fluorine Chem. 1991, 53(1), 61-70). Пиразолы формулы 17с (соединения формулы 17, где R6 представляет собой Cl или Br, а R8 представляет собой Н) могут быть также получены в соответствии с методиками, описанными в литературе (Chem. Ber. 1966, 99(10), 3350-7). Подходящий альтернативный способ получения соединения 17с проиллюстрирован на схеме 16.
В способе, описанном на схеме 16, в результате металлирования сульфамоилпиразола формулы 28 н-бутиллитием с последующим прямым галогенированием аниона либо гексахлорэтаном (если R6 представляет собой Cl), либо 1,2-дибромтетрахлорэтаном (если R6 представляет собой Br) получают галогенированное производное формулы 29. Удаление сульфамоильной группы под действием трифторуксусной кислоты (TFA) при комнатной температуре происходит полностью и дает хороший выход пиразолов формулы 17с. Специалисту в данной области будет очевидно, что соединение формулы 17с представляет собой таутомер формулы 17b. Подробное описание эксперимента в соответствии с методиками приводится в примерах 8 и 10.
Пиразолкарбоновые кислоты формулы 4d, где R6 представляет собой Н, С1-С6алкил или С1-С6галогеналкил, могут быть получены способом, проиллюстрированным на схеме 17.