Средство для лечения и профилактики туберкулеза
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и используется для лечения и профилактики туберкулеза. Применение бетулина в качестве средства для лечения и профилактики туберкулеза. Применение экстракта бересты в качестве средства для лечения и профилактики туберкулеза при содержании бетулина в экстракте бересты свыше 70%. Бетулин и экстракт бересты способствуют эффективному лечению и профилактике туберкулеза. 2 н.п. ф-лы, 6 ил., 15 табл.
Реферат
Область техники
Изобретение относится к области медицины, а более конкретно к лечению и профилактике туберкулеза.
Уровень техники
После длительного периода снижения заболеваемости людей туберкулезом, наблюдавшегося в середине прошлого века, а в России вплоть до начала 1990-х годов, произошло резкое ухудшение эпидемиологической ситуации. Всемирная организация здравоохранения (ВОЗ) еще в апреле 1993 года объявила туберкулез проблемой "всемирной опасности", поскольку по данным этой организации треть населения планеты инфицирована туберкулезом.
В России ежегодно регистрируется 75-85 тысяч впервые выявленных больных туберкулезом, а в 1999 году - почти 100 тысяч человек. Из общей смертности от инфекционных заболеваний до 75% составляет смерть от туберкулеза.
Лечение туберкулеза даже обычного (чувствительного к лекарствам) - длительный процесс, проводимый с использованием одновременно нескольких (4-5) противотуберкулезных препаратов. Стандартная схема лечения обычного (чувствительного) туберкулеза, рекомендованная ВОЗ (схема DOTS), заключается в шестимесячном ежедневном приеме стандартного набора четырех лекарств (рифампицин, изониазид, пиразинамид, этамбутол, стрептомицин).
Для лечения лекарственно-устойчивого (по отношению хотя бы к одному из перечисленных препаратов) туберкулеза применяются иные лекарства, нежели в схеме DOTS - так называемые "резервные препараты" или "препараты второго ряда" (офлоксацин, каприомицин, этионамид, циклосерин, паск), которые также необходимо принимать комплексно, не менее 4-х одновременно на протяжении от 1,5 до 2 лет. Многие резервные препараты вызывают тяжелые побочные эффекты, при этом вероятность излечения колеблется в пределах от 50% до 80%. Среди побочных действий (характерных и для препаратов "первого ряда): дисбактериоз, нарушение менструальной функции и потенции, поносы, стоматиты, потеря волос, изменение крови - снижение общего белка, лейкоцитов, эритроцитов, тромбоцитов.
В связи с этим является актуальным отыскание новых средств, пригодных для лечения и профилактики туберкулеза, которые не давали бы тяжелых побочных эффектов, в частности средств, которые могут быть получены из природных продуктов.
В качестве такого средства в патенте РФ №2210379 описывается экстракт коры осины (Populus tremila).
Однако исследование противотуберкулезного (туберкулоцидного) действия экстракта коры осины проводилось лишь в условиях in vitro.
Сущность изобретения
Авторами настоящего изобретения в процессе исследований in vitro и in vivo было обнаружено, что в качестве противотуберкулезного средства может быть использован бетулин, а также содержащий его, с концентрацией не менее 70%, экстракт бересты (верхней, белой части коры березы).
Раскрытие изобретения
В отличие от указанного в патенте РФ 2210379 активность средств в соответствии с настоящим изобретением была подтверждена не только в условиях in vitro, но и в условиях in vivo.
Кроме того, обнаружено и профилактическое действие бетулина и экстракта бересты в отношении туберкулеза, которое применительно к экстракту коры осины не изучалось.
Исследования бетулина проводились in vivo на мышиной модели активного экссудататива некротического туберкулеза и in vitro в культуре макрофагов, зараженных МБТ (микобактериями M.tuberculosis).
При этом решались следующие задачи:
1. Определить показатель выживаемости животных после заражения смертельной дозой МБТ в различных экспериментальных группах животных.
2. Изучить микробиологическими методами in vivo возможную бактерицидную и бактериостатическую активность исследуемых препаратов.
3. Изучить морфологическими методами характер репаративных процессов паренхиматозных органов в процессе лечения экспериментального туберкулеза мышей исследуемых групп.
4. Оценить действие Бетулина на уровень жизнеспособности МБТ in vitro и влияние на цитотоксическое действие МБТ на перитонеальные макрофаги.
Исследованию подвергался сухой экстракт бересты с содержанием бетулина, определенным ВЭЖХ, 72%, полученный от ООО "Березовый мир", г.Москва.
Определение специфической активности препарата Бетулин проводили на самцах инбредных мышей линии C 57 B L/6, полученных из вивария Центрального научно-исследовательского института туберкулеза Российской Академии медицинских наук. Вес мышей - 20 грамм. Мышей заражаливнутривенным введением М.tuberculosis штамма H37Rv из коллекции института Пастера (Франция) в ретроорбитальный синус глаза в дозе 5×106 KOE. В препаративных количествах МБТ были получены в лаборатории иммуногенетики указанного института. Аликвоты (1 мл) хранили при -70°С. Для определения количества КОЕ микобактерий в полученной суспензии отбирали аликвоту, готовили серию последовательных разведений и 20 мкл каждого разведения помещали в капле на чашку Петри с агаром Дюбо. Чашки культивировали при 37°С в течение 14 суток для определения концентрации МБ в инфицирующем материале. Для заражения мышей аликвоту размораживали, переводили в фосфатно-буферный раствор, содержащий 0,025% Твина 80, и доводили до концентрации 5×106 КОЕ/мл.
Все экспериментальные животные были разделены на следующие группы:
1 группа - интактные животные - 15 шт.;
2 группа - инфицированные животные, не получающие лечения - 15 шт.;
3 группа - инфицированные животные, получающие комбинацию противотуберкулезных препаратов (изониазид + рифампицин) - ПТП - в дозе 38 мг/кг - 15 шт.;
4 группа - инфицированные животные, получающие ПТП в стандартной дозе и Бетулин в дозе 25 мг/кг - 15 шт.;
5 группа - инфицированные животные, получающие ПТП в стандартной дозе и Бетулин в дозе 50 мг/кг - 15 шт.;
6 группа - инфицированные животные, получающие Бетулин в дозе 25 мг/кг - 15 шт.;
7 группа - инфицированные животные, получающие Бетулин в дозе 50 мг/кг - 15 гол.;
8 группа - неинфицированные животные, получающие - ТВИН-80 (без бетулина) - 10 шт.
Препараты вводили внутрижелудочно, ежедневно, в течение 2 месяцев, через две недели после заражения. Экстракт бересты суспидировали в воде с содержанием 1% раствора ТВИНА-80. Животным 8-й группы вводили внутрижелудочно ТВИН-80 в дозе, аналогичной используемой в других подопытных грппах. Через 2 месяца половину живых животных выводили из эксперимента методом цервикальной дислокации для микробиологических, иммунологических и морфологических исследований, а оставшихся оставляли еще на 2 месяца для оценки пролонгированного противомикробного эффекта бетулина.
Для оценки эффективности исследуемого препарата от каждого животного брали кусочки легкого, печени и селезенки для гистологического и целый орган для микробиологического исследования. При микробиологическом исследовании проводили бактериоскопию и качественно-количественный анализ макроскопически выявленных изменений в печени, селезенке и легких с подсчетом индекса поражения и индекса эффективности по формуле:
Для бактериоскопии кусочки легкого, печени и селезенки подвергали специальной обработке. Из полученного гомогената паренхиматозных органов готовили мазки, которые окрашивали люминесцентными красителями.
Для гистологического изучения кусочки легкого, печени и селезенки фиксировали 10% забуференным формалином, заключали в парафин, готовили гистологические срезы, которые окрашивали гематоксилином и эозином.
Количество микобактерий в селезенке и легких зараженных мышей определяли через 2 месяца после начала лечения и через 2 месяца после окончания лечения. Селезенки и легкие гомогенизировали в 2 мл физиологического раствора, готовили серию 10-кратных разведений исходной суспензии в физиологическом растворе и 50 мкл каждого разведения помещали на чашку Петри, покрытую агаром Дюбо.
Чашки Петри с нанесенными суспензиями клеток селезенки или легкого инкубировали в течение 18-20 дней при 37 С, после чего подсчитывали число колоний на чашке и определяли количество КОЕ микобактерий в селезенке и легких по следующим формулам:
Nсел=2N1×Р/0.1; Nлег=2N1×Р/0.1,
где
Nсел - количество колоний в селезенке,
Nлег - количество колоний в легких.
Определение влияния бетулина на микобактерии в культуре макрофагов проводили на перитонеальных макрофагах мышей линии C57BL6. Препарат для исследования готовили следующим образом: первое разведение препарата проводилось в 120 мкл диметилсульфоксида (использовали по 5 мг экстракта бересты для каждого разведения). Затем препараты разводились в полной среде RPMI 1640. Конечная концентрация препаратов составляла 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 2 мкг/мл, 0,2 мкг/мл и 0,02 мкг/мл.
Перитонеальные макрофаги (МФ) выделяли из клеток перитонеального экссудата мышей через 5-6 дней после внутрибрюшинной инъекции 3% пептона. Очистку от немакрофагальных клеток перитонеального экссудата осуществляли адгезией макрофагов на пластиковых чашках Петри. Прикрепившиеся макрофаги переводили из монослоя в суспензию раствором Версена. Заражение макрофагов микобактериями (МБТ) осуществляли в плоскодонных 96-луночных планшетах в среде RPMI с 2% FCS. Для этого очищенную суспензию перитонеальных макрофагов (50000 на лунку) подвергали повторной адгезии в лунках планшета, после чего к сформированным монослоям макрофагов добавляли различные концентрации М. tuberculosis (соотношение макрофагмикобактерии (МФ:МБТ) - 1:2,5; 1:5; 1:10). Зараженные макрофаги инкубировали в СО2-инкубаторе в течение ночи для фагоцитоза микобактерии. После инкубации в лунки добавляли исследуемый препарат в концентрациях 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 2 мкг/мл, 0,2 мкг/мл и 0,02 мкг/мл. В качестве контроля были оставлены разведения микобактерии без препарата. Инкубировали с препаратом в течение 48 часов в СО2-инкубаторе. За 18 часов до истечения срока инкубации в лунки добавляли метку (5,6-[3H]-урацил, разведенный в среде RPMI 1640 с 2% FCS). Жизнеспособность микобактерии в смешанной культуре с макрофагами оценивали по избирательному включению М.tuberculosis 5,6-[3H]-урацила в живые клетки на жидкостном сцинтилляторе. Перед подсчетом включенной метки макрофаги разрушались замораживанием при -80°С. Все измерения проводились в трипликатах.
Определение влияния исследуемого препарата на микобактериальную культуру проводили следующим образом: М.tuberculosis H37Rv в количестве 5×105, 2,5×105, 1,25×105 КОЕ/лунку помещали в полной среде RPMI 1640 с 2% FCS в 96-луночной планшете (по 3 лунки на каждое разведение). После 2-часовой инкубации в СО2-инкубаторе (атмосфера - 20% кислорода, 5% углекислого газа, 37°С) в лунки был внесен препарат в концентрациях 2 мкг/мл, 0,2 мкг/мл и 0,02 мкг/мл. После добавления препарата 96-луночные плашки инкубировали в течение 48 часов в CO2-инкубаторе при тех же условиях. За 18 часов до истечения срока инкубации в лунки добавляли метку (5,6[3H]-урацил, разведенный в среде RPMI 1640 с 2% FCS). После окончания времени инкубации производили измерение количества включенной в живые микобактерии метки на жидкостном сцинтилляторе. Об активности исследуемых препаратов судили по количеству включенного 5,6[3H]-урацила в живые микобактерии по сравнению с интактным контролем. Все измерения проводились в трипликатах.
Цитотоксическое действие препарата на макрофаги оценивали по выходу из разрушенных макрофагов в среду фермента лактатдегидрогеназы (ЛДГ) с помощью набора Promega's CytoTox 96® (Promega). Для тестирования были взяты концентрации препарата 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 2 мкг/мл, 0,2 мкг/мл и 0,02 мкг/мл. Препарат в каждой из концентраций добавляли к чистой культуре перитонеальных макрофагов, а также к культуре перитонеальных макрофагов, зараженных M.tuberculosis H37Rv в соотношениях макрофаг: микобактерия (МФ:МБТ) - 1:2,5; 1:5 и 1:10 (таблица 1). Результаты цветной реакции измеряли на фотоколориметре (Sigma) при длине волны 490 нм. Все измерения проводились в трипликатах.
| Таблица 1Схема проведения эксперимента | ||||
| Концентрация 160 мкг/мл | Макрофаги без микобактерий | Макрофаги + микобактерии (соотношение 1:2,5) | Макрофаги + микобактерии (соотношение 1:5) | Макрофаги + микобактерии (соотношение 1:10) |
| Концентрация 80 мкг/мл | Макрофаги без микобактерий | Макрофаги + микобактерии (соотношение 1:2,5) | Макрофаги + микобактерии (соотношение 1:5) | Макрофаги + микобактерии (соотношение 1:10) |
| Концентрация 40 мкг/мл | Макрофаги без микобактерий | Макрофаги + микобактерий (соотношение 1:2,5) | Макрофаги + микобактерий (соотношение 1:5) | Макрофаги + микобактерий (соотношение 1:10) |
| Концентрация2 мкг/мл | Макрофаги без микобактерий | Макрофаги + микобактерии (соотношение 1:2,5) | Макрофаги + микобактерии (соотношение 1:5) | Макрофаги + микобактерии (соотношение 1:10) |
| Концентрация 0,2 мкг/мл | Макрофаги без микобактерий | Макрофаги + микобактерии (соотношение 1:2,5) | Макрофаги + микобактерии (соотношение 1:5) | Макрофаги + микобактерии (соотношение 1:10) |
| Концентрация 0,02 мкг/мл | Макрофаги без микобактерий | Макрофаги + микобактерии (соотношение 1:2,5) | Макрофаги + микобактерии (соотношение 1:5) | Макрофаги + микобактерии (соотношение 1:10) |
Результаты исследования
Результаты исследования бетулина в системе in vivo.
Основными показателями резистентности животного к туберкулезу являются срок выживаемости после инфицирования, способность контролировать размножение микобактерий в органах (то есть количество микобактерий, измеряемое в КОЕ) и степень патологических изменений легочной ткани.
У мышей контрольной группы, не получавших никаких препаратов, выживаемость после смертельной дозы заражения составила 31±2.07 дней.
Мыши, получавшие только бетулин в дозе 25 мг/кг в течение 2 месяцев после заражения, прожили 26±0.56 дней, а в дозе 50 мг/кг - 37.86±2.48 дней. Мыши, получавшие ПТП совместно с бетулином в разных дозах, оставались живы в течение всего эксперимента. (Данные представлены в таблице 2)
| Таблица 2Выживаемость мышей после внутривенного заражения летальной дозой M.tuberculosis H37Rv | |
| Группа животных | Среднее время выживаемости X±SD |
| Контрольные животные | 31±2.074 |
| Бетулин 25 мг/кг | 26.38±0.565 |
| Бетулин 50 мг/кг | 37.86±2.483 |
| * различия по выживаемости между контрольными животными и получавшими 25мг/кг бетулина достоверны (р<0.05), а между контрольной группой и группой, получавшей бетулин в дозе 50мг/кг, р>0.05 |
Результаты микробиологического исследования
В результате бактериоскопического исследования материала, полученного от мышей 3,4,5 терапевтических групп через 2 месяца после начала лечения, выявить микобактерии при просмотре 100 полей зрения не удалось.
При изучении посевного материала от мышей 3,4,5 групп в эти же сроки ни в одном наблюдении роста колоний МБТ не обнаружено (данные представлены в таблице 3).
| Таблица 3Индексы поражения внутренних органов мышей и индексы эффективности химиотерапии через 2 месяца после начала лечения. | |||
| № гр. | Режим химиотерапии | Индекс поражения (ЕД) | Индекс эффективности (%) |
| 1 | Стандарт ПТП | 0 | 100 |
| 2 | Стандарт ПТП+25 мг/кг Бетулина | 0 | 100 |
| 3 | Стандарт ПТП+50 мг/кг Бетулина | 0 | 100 |
Результаты исследования бетулина в системе in vitro
Целями исследования антимикобактериального и цитотоксического действия бетулина в системе макрофаг-микобактерия были следующие:
1. Выяснить, оказывает ли препарат цитотоксическое действие на эукариотические клетки в системе in vitro.
1. Подобрать действующие концентрации препарата, которые не оказывали бы цитотоксического воздействия на макрофаги.
3. Выяснить, оказывают ли подобранные концентрации бетулина ингибирующее действие на микобактерии туберкулеза.
4. Определить, оказывает ли бетулин ингибирующее воздействие на микобактерии, фагоцитированные макрофагами.
5. Определить, уменьшает ли бетулин разрушение макрофагов при заражении их микобактериями туберкулеза в системе макрофаг-микобактерии.
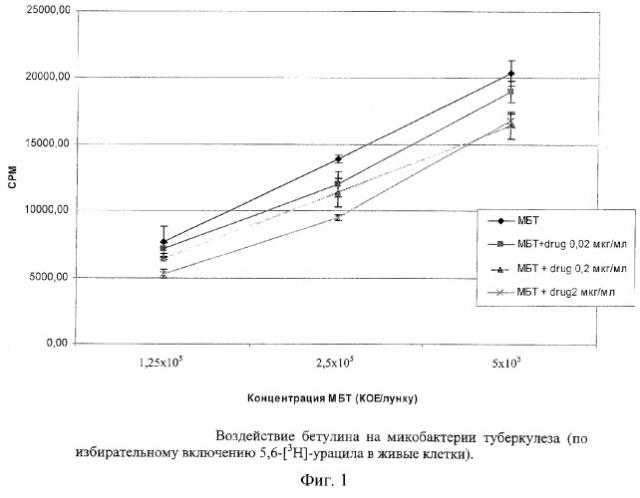
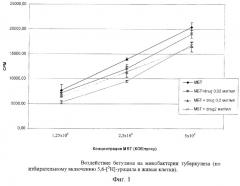
Результаты исследований представлены в табл.4, 5, 6 и 7 и диаграммах 1, 2, 3 и 4 (фиг. 1-4).
Как видно из таблицы 4, бетулин в концентрации 160, 80 и 40 мкг/мл оказывал цитотоксическое действие на интактные макрофаги. Процент специфического лизиса макрофагов значительно повышался при добавлении препаратов и достигал 89,8% при воздействии бетулина в дозе 160 мкг/мл.
| Таблица 4Выход ЛДГ из незараженных микобактериями макрофагов при воздействии бетулина в высоких концентрациях | |||||
| Концентрация препарата | без препарата | 40 мкг/мл | 80 мкг/мл | 160 мкг/мл | |
| % специфического лизиса незараженных МФ | М | 29,117 | 61,793 | 81,223 | 89,800 |
| SD | 16,692 | 16,030 | 17,818 | 20,835 |
При дальнейшей раститровке препарата бетулина была выявлены концентрации препарата, которые не оказывали цитотоксического действия на макрофаги. Как видно из таблицы 5, процент специфического высвобождения ЛДГ из макрофагов, инкубированных с препаратом в концентрациях 2, 0,2 и 0,02 мкг/мл, не достоверно отличался от процента специфического лизиса макрофагов, не обработанных препаратом.
| Таблица 5Выход ЛДГ из незараженных микобактериями макрофагов при воздействии бетулина в низких концентрациях | |||||
| Концентрация препарата | без препарата | 0,02 мкг/мл | 0,2 мкг/мл | 2 мкг/мл | |
| % специфического лизиса незараженных МФ | М | 0,000 | - 1,409 | - 2,052 | 5,820 |
| SD | 0 | - 5,084 | - 6,000 | 10,960 |
Учитывая полученные результаты по цитотоксическому эффекту бетулина, было испытано как прямое воздействие бетулина (в концентрациях 2, 0,2 и 0,02 мкг/мл) на микобактерии, так и эффект действия бетулина на микобактерии, фагоцитированные макрофагами. Результаты представлены на диаграммах 1, 2 и в таблицах 6, 7.
Как видно из диаграммы 1 (фиг. 1), при прямом воздействии на микобактерии бетулин оказывал ингибирующее воздействие во всех концентрациях. Наибольшее ингибирующее воздействие (31,76%) препарат оказывал в концентрации 2 мкг/мл (таблица 6).
| Таблица 6Ингибиция роста микобактерий при добавлении препарата (по сравнению с контрольным ростом микобактерий без препарата) | ||||||||||
| Концентрация препарата | 0,02 мкг/мл | 0,2 мкг/мл | 2 мкг/мл | |||||||
| Количество МБТ, КОЕ/лунку | 1,25×105 | 2,5×105 | 5×105 | 1,25×105 | 2,5×105 | 5×105 | 1,25×105 | 2,5×105 | 5×105 | |
| % ингибиции роста МБТ | М | 6,49 | 13,65 | 6,74 | 16,44 | 18,32 | 19,34 | 31,24 | 31,76 | 17,59 |
| SD | 1,02 | 1,15 | 0,43 | 2,45 | 1,78 | 1,48 | 4,99 | 1,00 | 0,98 |
При изучении воздействия разных концентраций бетулина на микобактерии, фагоцитированные макрофагами, установлено, что ингибиция роста микобактерий была достоверна при воздействии бетулина в самой высокой дозе (2 мкг/мл) на микобактерии, фагоцитированные макрофагами в соотношении МФ:МБТ 1:5 макрофаг (диаграмма 2, фиг. 2). При этом процент ингибиции роста микобактерий составил 42,06% (см. таблицу 7).
| Таблица 7Ингибиция роста микобактерий, фагоцитированных макрофагами, при добавлении препарата (по сравнению с контрольным ростом микобактерий, фагоцитированных макрофагами, без препарата | ||||||||||
| Концентрация препарата | 0,02 мкг/мл | 0,2 мкг/мл | 2 мкг/мл | |||||||
| Соотношение МФ:МБТ | 1:2,5 | 1:5 | 1:10 | 1:2,5 | 1:5 | 1:10 | 1:2,5 | 1:5 | 1:10 | |
| % ингибиции роста МБТ | М | -40,92 | 14,89 | -1,67 | -26,96 | 17,37 | -7,22 | -33,09 | 42,06 | -2,34 |
| SD | -14,84 | 3,91 | -0,19 | -6,63 | 4,05 | -0,78 | -16,33 | 9,00 | -0,18 |
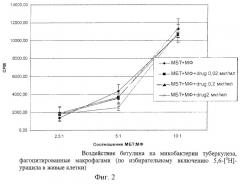
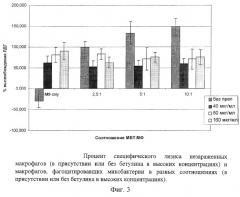
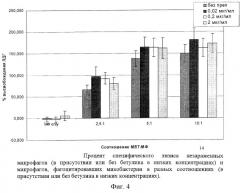
Исходя из полученных данных об ингибировании бетулином роста микобактерий в питательной среде, а также ингибировании роста микобактерий, фагоцитированных перитонеальными макрофагами, было важно сравнить цитотоксическое действие, которое оказывают микобактерии на макрофаги без препарата и в присутствии бетулина. В эксперименте были использованы как высокие концентрации препарата бетулина (40, 80 и 160 мкг/мл), так и концентрации, не оказывающие цитотоксического эффекта на макрофаги (20, 0,2 и 02 мкг/мл). Результаты представлены на диаграммах 3, 4 (фиг. 3, 4) .
Как видно из диаграммы 3 (фиг. 3), процент специфического лизиса макрофагов, зараженных микобактериями (контроль, без воздействия бетулина), был высоким при всех соотношениях МФ:МБТ и варьировался от 98,67% (МФ:МБТ 1:1,25) до 147,62% (МФ:МБТ 1:10). Добавление в систему МФ:МБТ препарата бетулина в дозах 40, 80 и 160 мкг/мл оказывало воздействие на выход ЛДГ из макрофагов - во всех концентрациях препарат уменьшал разрушение макрофагов практически при всех соотношениях МФ:МБТ. Исключение составила доза бетулина 80 мкг/мл: процент специфического лизиса при соотношении МФ:МБТ 2,5:1 был 82,62%, а при соотношении МФ:МБТ 5:1-71,30%, что было недостоверно по сравнению с контролем (без препарата, 98,67% и 132,69% соответственно).
Результаты, полученные при испытании бетулина в системе макрофаг-микобактерии в концентрациях, не вызывающих разрушения макрофагов (0,02, 0,2 и 2 мкг/мл), показали, что препарат ни в одной дозе не приводил к уменьшению разрушения макрофагов, зараженных микобактериями (диаграмма 4, фиг. 4).
Таким образом, бетулин в высоких концентрациях (40, 80, 160 мкг/мл) уменьшал процент специфического лизиса макрофагов, происходящего при заражении микобактериями туберкулеза. При испытании низких доз бетулина (0,02, 0,2, 2 мкг/мл) такого эффекта не наблюдалось.
При исследовании прямого воздействия бетулина в низких дозах (0,02, 0,2, 2 мкг/мл) на микобактерии и воздействия на микобактерии, фагоцитированные макрофагами, был выявлен ингибирующий рост микобактерий эффект бетулина в концентрации 2 мкг/мл. Причем при воздействии бетулина непосредственно на микобактерии ингибиция роста микобактерий наблюдалась при всех соотношениях МФ:МБТ 1:2,5; 1:5 и 1:10, а при воздействии бетулина на микобактерии, фагоцитированные макрофагами, достоверная ингибиция роста микобактерий наблюдалась только в соотношении МФ:МБТ 1:5.
Результаты гистологического исследования
У здоровых мышей, длительно получавших ТВИН (8 гр.), обращает внимание полнокровие внутренних органов, максимально выраженное в легких и печени.
Просветы кровеносных сосудов заметно расширены, заполнены плотной эритроцитарной массой. По ее периферии определяются моноциты, лимфоциты и эозинофильные лейкоциты.
О высокой проницаемости сосудов респираторного отдела свидетельствует выход эритроцитов в окружающие ткани, формирование множественных мелких кровоизлияний. В просветах альвеол определяются скопления зрелых макрофагов фагоцитарного типа, главным образом эритрофагов. Межальвеолярные перегородки отечны, умеренно инфильтрированы мононуклеарами; в петлях капиллярной сети определяются полинуклеарные эозинофилы.
У зараженных МБТ мышей, получавших 2 месяца противотуберкулезные препараты (3 гр.), в легких преобладала воздушная паренхима. Вокруг сосудов мелкого и среднего калибра формировались небольшие клеточные инфильтраты (пневмонические фокусы), содержащие зрелые макрофагальные и лимфоидные элементы; нейтрофильные лейкоциты выявляли относительно редко. В просветах сосудов можно было видеть единичные эозинофильные лейкоциты, что отражает развитие у мышей аллергической реакции на противотуберкулезные препараты.
В печени изменения гепатоцитов отражали процессы регенерации (гипертрофия цитоплазмы, появление двух ядер). В перипортальной зоне наблюдали небольшие лимфоидно-макрофагальные инфильтраты, в составе которых выявляли единичные нейтрофилы.
Для селезенки большинства животных 3 группы была характерна диффузная, реже локальная, инфильтрация белой и красной пульпы мононуклеарами разной степени зрелости. В отдельных случаях выявляли крупные многоядерные макрофаги с темной цитоплазмой.
У мышей 4-й и 5-ой групп, получавших комплексное лечение противотуберкулезными препаратами и бетулином, паренхиматозные органы имели наиболее близкое к норме гистологическое строение, пневмонические фокусы не определялись. Наблюдали небольшие периваскулярные скопления мононуклеаров без выявления нейтрофильных лейкоцитов. Большая часть легочной паренхимы сохраняла воздушность. Однако кровеносные сосуды были расширены, в их просвете определялись скопления эритроцитов, моноцитов и эозинофилов. Эти же клеточные элементы, а также зрелые макрофаги - эритрофаги, располагались во внутриальвеолярном пространстве. Не было выявлено особенностей гистологической структуры органов в зависимости от применяемой дозы бетулина (25 или 50 мг/кг).
Аналогичные лимфоидно-макрофагальные скопления, выход эритроцитов наблюдали в перипортальной зоне печени. Часть гепатоцитов имела признаки белковой дистрофии, хотя и менее выраженной, чем у животных 2-й группы.
В белой пульпе селезенки отмечалась гипертрофия мальпигиевых телец. Они имели хорошо выраженные светлые центры, которые содержали значительное число лимфобластов и лимфоцитов. Трабекулярная сеть была заметно утолщена за счет активации клеток соединительной ткани и выраженного фибриллогенеза. Небольшие скопления мононуклеаров редко содержали многоядерные макрофаги.
Отмеченное у опытных животных реактивное состояние микроциркуляторного русла, формирование кровоизлияний можно объяснить влиянием твина. Об этом свидетельствует аналогичная картина изменения кровеносных сосудов у здоровых контрольных мышей, получавших этот растворитель без бетулина.
Экспериментальное испытание бетулина на модели экссудативно-некротического туберкулеза мышей показало его положительное влияние на процессы заживления и восстановления структурно-функциональных особенностей легких и других паренхиматозных органов при длительном его применении на фоне специфической антибактериальной терапии. В сочетании с противотуберкулезными препаратами бетулин позволяет получить более выраженное сокращение площади воспалительного процесса по сравнению с традиционным лечением. Более того, у животных, получавших этот препарат, наблюдается более полное восстановление структуры легких, печени и селезенки, по сравнению с обычным этиотропным лечением.
Последующие исследования бетулина относились к оценке эффективности бетулина при профилактическом введении его. Кроме того, были проведены дополнительные исследования антимикобактериальной активности при высокой концентрации бетулина в экстракте бересты (98%).
Определение профилактической активности бетулина проводили с использованием экстрактов бересты (БЭС) с содержанием бетулина 72% (БЭС-1) и 98% (БЭС-2) на самцах инбредных мышей линии C57BL/6. Мышам в течение двух недель вводили БЭС внутрижелудочно в различных дозах, а затем заражали внутривенным введением М.tuberculosis штамма H37Rv из коллекции института Пастера (Франция) в ретроорбитальный синус глаза в дозе 5×106 KOE. Для определения количества КОЕ микобактерий в полученной суспензии отбирали аликвоту, готовили серию последовательных разведений и 20 мкл каждого разведения помещали в капле на чашку Петри с агаром Дюбо. Чашки культивировали при 37°С в течение 14 суток для определения концентрации МБ в инфицирующем материале. Для заражения мышей аликвоту размораживали, переводили в фосфатно-буферный раствор, содержащий 0,025% Твина 80 и доводили до концентрации 5×106 KOE/мл.
Материалы и методы исследования
Все экспериментальные животные были разделены на следующие группы:
1 группа - интактные животные - 15 шт.;
2 группа - инфицированные животные, не получающие лечения - 15 шт.;
3 группа - инфицированные животные, получавшие БЭС-1 с содержанием бетулина 72% в течение двух недель до заражения в дозе 25 мг/кг-15 шт.;
4 группа - инфицированные животные, получавшие БЭС-1 в течение двух недель до заражения в дозе 50 мг/кг - 15 шт.;
5 группа - инфицированные животные, получавшие БЭС-1 в течение двух недель до зараженияв дозе 100 мг/кг - 15 шт.;
6 группа - инфицированные животные, получавшие БЭС-2 с содержанием бетулина 98% в дозе 25 мг/кг - 15 шт.;
7 группа - инфицированные животные, получавшие БЭС-2 в дозе 50 мг/кг - 15 шт.;
8 группа - инфицированные животные, получавшие БЭС-2 в дозе 100 мг/кг, растворитель Бетулина - ТВИН-80 - 10 шт.;
9 группа - неинфицированные животные, получавшие растворитель БЭС - ТВИН-80 - 10 шт.
Препараты вводили внутрижелудочно, ежедневно, в течение 2 недель, предварительно растворив их в воде с содержанием 1% ТВИНА-80. Через две недели после введения половину мышей выводили из эксперимента методом цервикальной дислокации для гистологического исследования паренхиматозных органов. Животным 9-й группы вводили внутрижелудочно ТВИН-80 в дозе, аналогичной используемой в других подопытных группах. Оставшихся животных оставляли для оценки выживаемости после заражения вирулентной культурой МБТ.
Для оценки эффективности исследуемых препаратов от каждого животного брали кусочки легкого, печени и селезенки для гистологического исследования.
Результаты исследования
| Таблица 8Выживаемость мышей после внутривенного заражения летальной дозой M.tuberculosis H37Rv | |
| ГРУППЫ ЖИВОТНЫХ | Дни выживания (M±SD) |
| КОНТРОЛЬ | 34,4±1,74 |
| БЭС-1 (25 мг/кг) | 52,3±2,04 |
| БЭС-1 (50 мг/кг) | 60,0±6,13 |
| БЭС-1 (100 мг/кг) | 57,0±1,53 |
| БЭС-2 (25 мг/кг) | 61,0±1,27 |
| БЭС-2 (50 мг/кг) | 55,6±1,73 |
| БЭС-2 (100мг/кг) | 65,7±2,33 |
Из таблицы видно, что мыши, получавшие БЭС-1 и БЭС-2 в течение двух недель перед заражением, жили значительно дольше, нежели мыши контрольной группы. Причем максимальная разница по показателю выживаемости была между мышами котрольной группы и мышами, получавшими БЭС-2 в дозе 100 мг/кг (р<0,001).
Результаты гистологического исследования
У здоровых мышей, получавших исследуемый препарат за 2 недели перед заражением МБТ, имело место полнокровие паренхиматозных органов, особенно легких. У всех животных, независимо от применяемой дозы исследуемых препаратов, наблюдали изменения микроциркуляторного русла.
Просветы кровеносных сосудов были расширены, заполнены скоплениями эритроцитов. В отдельных участках легочной паренхимы происходил выход форменных элементов крови в окружающие ткани, формировались мелкие, а иногда и крупные зоны кровоизлияний.
На этом фоне у всех опытных животных обращало внимание появление в сосудах, петлях капиллярной сети и межальвеолярных прегородках повышенного количества моноцитов и лимфоцитов. Степень инфильтрации легких мононуклеарами была максимально выражена у мышей, получавших БЭС-2 (с содержанием бетулина 98%). У них же наблюдали более высокую, чем при введении БЭС-1 (с содержанием бетулина 72%), частоту выявления альвеолярных макрофагов. В ряде случаев они формировали небольшие скопления, содержали в цитоплазме значительное количество мелких включений, что свидетельствовало об активации фагоцитарной функции клеток, макимально выраженной у животных, получавших БЭС-2 в дозе 100 мг/кг.
Исходя из полученных гистологических данных, можно сказать, что профилактическое введение БЭС как с содержанием бетулина 72%, так и с содержанием бетулина 98% оказывает определенное влияние на макрофагальную реакцию легких, вызывая активацию альвеолярных макрофагов, особенно выраженную у мышей, получавших БЭС с содержание бетулина 98%. Именно у мышей этих опытных групп наблюдали зависимость фагоцитарной функции клеток от применяемой дозы БЭС, максимально выраженной при введении БЭС с содержанием бетулина в дозе 100 мг/кг.
Отмеченное у всех опытных мышей повышение проницаемости кровеносных сосудов, выход эритроцитов в окружающие ткани, очевидно, связан с некоторым побочным действием растворителя БЭС - твином. Аналогичные изменения легких и печени наблюдали у контрольных животных, получавших этот растворитель. Об этом же свидетельствует и тот факт, что повышение дозы БЭС обоих видов до 100 мг/кг не влияло на частоту формирования и распространенность в легких участков кровоизлияний.
Таким образом, при профилактичеком введении препаратов бетулина обнаружена активация иммунокомпетентных клеток (макрофагов, моноцитов и лимфоцитов), при этом степень активации иммунокомпетентных клеток при введении БЭС-2 в дозе 100 мг/кг была наиболее значительной. Наблюдалось существенное увеличение сроков выживания опытных животных по сравнению с контрольными, при этом максимальное увеличение сроков выживания наблюдалось при применении БЭС -2 в дозе 100 мг/кг.
Исследование антимикобактериальной активности БЭС-2
Исследования выполнены на мышах инбредной линии С 57 В 1/6. В экспериментах использовались 10 мышей обоего пола, весом 21-24 грамма, в возрасте 2-4 месяцев.
В работе использовали вирулентный штамм М. tuberculosis H37Rv (Pasteur).
Первое разведение препарата (использовали по 5 мг каждого препарата) проводилось в 120 мкл диметилсульфоксида. Затем препараты разводились в полной среде RPMI 1640. Конечная концентрация препаратов составляла 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 4 мкг/мл, 0,4 мкг/мл и 0,04 мкг/мл.
1. Определение влияния исследуемого препарата на микобактерии в культуре макрофагов. Перитонеальные макрофаги (МФ) выделяли из клеток перитонеального экссудата мышей через 5-6 дней после внутрибрюшинной инъекции 3% пептона. Очистку от немакрофагальных клеток перитонеального экссудата осуществляли адгезией макрофагов на пластиковых чашках Петри. Прикрепившиеся макрофаги переводили из монослоя в суспензию раствором Версена. Заражение макрофагов микобактериями (МБТ) осуществляли в плоскодонных 96-луночных планшетах в среде RPMI с 2% FCS. Для этого очищенную суспензию перитонеальных макрофагов (50000 на лунку) подвергали повторной адгезии в лунках планшета, после чего к сформированным монослоям макрофагов добавляли различные концентрации М.tuberculosis (соотношение макрофаг:микобактерии (МФ:МБТ) - 1:2,5; 1:5; 1:10). Зараженные макрофаги инкубировали в СО2-инкубаторе в течение ночи для фагоцитоза микобактерий. После инкубации в лунки добавляли исследуемый препарат в концентрациях 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 4 мкг/мл, 0,4 мкг/мл и 0,04 мкг/мл. В качестве контроля были оставлены разведения микобактерий без препарата. Инкубировали с препаратом в течение 48 часов в CO2-инкубаторе. За 18 часов до истечения срока инкубации в лунки добавляли метку (5,6-[3H]-урацил, разведенный в среде RPMI 1640 с 2% FCS). Жизнеспособность микобактерий в смешанной культуре с макрофагами оценивали по избирательному включению М. tuberculosis 5,6-[3H]-урацила в живые клетки на жидкостном сцинтилляторе. Перед подсчетом включенной метки макрофаги разрушались замораживанием при -80°С. Все измерения проводились в трипликатах.
2. Определение влияния исследуемого препарата на микобактериальную культуру. М. tuberculosis H37Rv в количестве 5×105, 2,5×105, 1,25×105 КОЕ/лунку помещали в полной среде RPMI 1640 с 2% FCS в 96-луночной планшете (по 3 лунки на каждое разведение). После 2-часовой инкубации в СО2-инкубаторе (атмосфера - 20% кислорода, 5% углекислого газа, 37°С) в лунки был внесен препарат в концентрациях 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 4 мкг/мл, 0,4 мкг/мл и 0,04 мкг/мл. После добавления препарата 96-луночные плашки инкубировали в течение 48 часов в СО2-инкубаторе при тех же условиях. За 18 часов до истечения срока инкубации в лунки добавляли метку (5,6-[3H]-урапил, разведенный в среде RPMI 1640 с 2% FCS). После окончания времени инкубации производили измерение количества включенной в живые микобактерий метки на жидкостном сцинтилляторе. Об активности исследуемых препаратов судили по количеству включенного 5,6-[3H]-урацила в живые микобактерий по сравнению с интактньм контролем. Все измерения проводились в трипликатах.
3. Определение цитотоксического действия препарата на макрофаги. Цитотоксическое действие препарата оценивали по выходу из разрушенных макрофагов в среду фермента лактатдегидрогеназы (ЛДГ) с помощью набора Promega's CytoTox 96® (Promega). Для тестирования были взяты концентрации препарата 160 мкг/мл, 80 мкг/мл, 40 мкг/мл, 4 мкг/мл, 0,4 мкг/мл и 0,04 мкг/мл.. Препарат в каж