Иммобилизованная форма доксорубицина
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к фармации и онкологии. Противоопухолевое средство содержит доксорубицин в качестве активного вещества. Оно дополнительно содержит оксипропилметилцеллюлозу, глицерин и воду при соотношении компонентов, мас.%: доксорубицин 0,075-0,13, оксипропилметилцеллюлоза 4,0-6,0, глицерин 2,0-4,0, вода - остальное. Изобретение позволяет снизить токсичность средства. 4 табл., 2 ил.
Реферат
Изобретение относится к экспериментальной медицине, в частности к средствам, обладающим противоопухолевой активностью.
Наиболее близкой лекарственной формой является лиофилизированный порошок доксорубицина, применяемый внутривенно после растворения в изотоническом растворе натрия хлорида по схеме: 60-75 мг/м2 поверхности тела 1 раз в 3 недели и при раке мочевого пузыря внутрипузырно в дозе 30-50 мг 1 раз в неделю [Бредер В.В. Методы введения химиопрепаратов при лечении онкологических заболеваний. - Мед. сестра. - 2001. - №2. - С.33-35; Машковский М.Д. Лекарственные средства: Пособие для врачей: В 2 т. - Т.2. - Изд. 13-е, новое. - Харьков: Торсинг, 1997, с.437.]
Указанная лекарственная форма доксорубицина имеет недостаток - вызывает ряд тяжелых побочных эффектов со стороны жизненно важных систем организма (подавление костно-мозгового кроветворения и иммунных реакций организма, кардиотоксическое действие, нарушение деятельности желудочно-кишечного тракта, аллергические реакции, воспаление и изъязвление слизистых оболочек полости рта, флебосклероз, при попадании в окружающие ткани - тяжелый целлюлит, некроз). [Противоопухолевая химиотерапия: Справочник. / Под ред. Переводчиковой Н.И. - М.: Медицина, 1993. - 224 с.; Шаповалова С.П. Действие доксорубицина на иммуногенез / Шаповалова С.П., Малкова И.В. // Антибиотики и химиотерапия. - 1983. - №4. - С.304-307].
Таким образом, основным недостатком раствора доксорубицина, вводимого внутривенно, является высокая токсичность и побочное действие.
Задачей изобретения является расширение ассортимента лекарственных форм доксорубицина для лечения опухолей слизистой оболочки полости рта.
Поставленная задача достигается тем, что иммобилизованная форма доксорубицина, кроме доксорубицина, содержит оксипропилметилцеллюлозу и глицерин при следующем соотношении компонентов, мас.%
| Доксорубицин | 0,075-0,13 |
| Оксипропилметилцеллюлоза | 4-6 |
| Глицерин | 2-4 |
| Вода очищенная | остальное |
Изобретение поясняется следующими таблицами и чертежами:
Таблица 1. Стабильность модельных смесей доксорубицина с полимерами.
Таблица 2. Диффузия доксорубицина из полимерных матриц в агар.
Таблица 3. Стабильность иммобилизованной формы доксорубицина в процессе хранения при (4±2)°С.
Таблица 4. Влияние иммобилизованной формы доксорубицина на ткани слизистой оболочки полости рта.
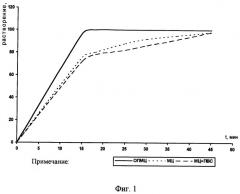
Фигура 1. Растворение доксорубицина из полимерных матриц в приборе «Вращающаяся корзинка», %.
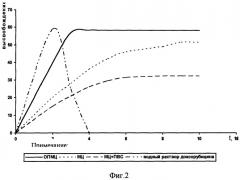
Фигура 2. Высвобождение доксорубицина из полимерных матриц при диализе через мембрану, %.
Введение в состав иммобилизованной формы доксорубицина оксипропилметилцеллюлозы позволяет снизить токсичность доксорубицина, увеличить время и степень его высвобождения из лекарственной формы, а следовательно, повысить эффективность.
Для увеличения адгезии к слизистой оболочке полости рта введен глицерин.
Характеристика объектов:
Доксорубицина гидрохлорид - (8S,10S)-10-[(3-амино-2,3,6-тридеокси-α-L-ликсогексо-пиранозил)окси]-7,8,9,10-тетрагидро-6,8,11-тригидрокси-8-(гидроксиацетил)-1-метокси-5,12-нафтацендион гидрохлорид. Доксорубицин ЛЭНС (ФС 42-3374-97). Регистрационный номер: Р №000005/01-2000. Кристаллический порошок или пористая масса красного цвета, гигроскопичен, умеренно растворим в воде, не растворим в спирте. Обладает высокой противоопухолевой и противолейкозной активностью. Доксорубицин действует на генетический аппарат опухолевой клетки, подавляя синтез ДНК и РНК [Государственный реестр лекарственных средств / МЗ РФ. - М., 1998. - 1004 с.]. Выбранное количество доксорубицина обусловлено оптимальным цитотоксическим действием при местном внутрипузырном введении (30-50 мг на 380-400 см2, то есть 0,075-0,13 мг/см2).
Оксипропилметилцеллюлоза (ОПМЦ) представляет собой смешанный эфир пропиленгликоля и метилцеллюлозы. ОПМЦ - белое волокнистое или порошкообразное вещество с желтым оттенком. Набухает в воде с последующим образованием вязкого прозрачного раствора. Практически не растворима в 95% спирте и эфире. Нетоксична. Широко применяется в фармацевтической промышленности в качестве пленочного покрытия твердых лекарственных форм, эмульгатора в медицинских аэрозолях, связующего в производстве таблеток, основы лекарственных пленок [Тенцова А.И. Полимеры в фармации / А.И.Тенцова, М.Т.Алюшин. - М.: Медицина, 1985. - С.10-20.].
ОПМЦ не образует нерастворимых комплексов с доксорубицином в отличие от натрий-карбоксиметилцеллюлозы (Na-КМЦ) (таблица 1), обеспечивает максимальное, равномерное растворение и высвобождение доксорубицина из полимерной матрицы по сравнению с метилцеллюлозой (МЦ) и комбинацией метилцеллюлозы с поливиниловым спиртом (МЦ+ПВС) (фигуры 1, 2 и таблица 2) и, следовательно, позволит повысить терапевтический эффект. Выбранные количества ОПМЦ обусловлены тем, что при концентрации ниже 4% снижается прочность полимерной матрицы и время контакта со слизистой оболочкой, а при содержании более 6% снижается высвобождение.
Введение в полимерную матрицу 2-4% глицерина (ФС 42-2202-99) обеспечивает адгезию на слизистой оболочке полости рта (таблица 3).
Таким образом, оптимальной иммобилизованной формой доксорубицина является полимерная матрица из оксипропилметилцеллюлозы, содержащая 0,075-0,13% доксорубицина и 2-4% глицерина.
Для предлагаемого состава с учетом свойств входящих ингредиентов разработана технология изготовления, которая состоит из следующих этапов.
1. Санитарная обработка производства. Подготовка помещения, персонала, вспомогательных материалов, оборудования, сырья.
2. Получение лекарственной композиции.
2.1. Приготовление раствора оксипропилметилцеллюлозы и глицерина в воде очищенной.
2.2. Растворение доксорубицина в воде очищенной.
2.3. Смешивание раствора полимера с раствором антибиотика.
2.4. Деаэрация.
3. Получение полимерной матрицы.
3.1. Розлив лекарственной композиции на подложки.
3.2. Сушка.
3.3. Дозирование. 4. Фасовка и упаковка полимерных матриц.
Пример по способу получения.
С целью повышения стабильности полимерные матрицы готовят в асептических условиях в соответствии с требованиями нормативной документации с использованием стерильной посуды. Навеску ОПМЦ заливают частью стерильной воды очищенной, нагретой до 50-70°С, и периодически перемешивают до растворения полимера, добавляют глицерин. Доксорубицин растворяют в оставшемся количестве стерильной воды и тщательно смешивают с раствором полимера до однородности.
После деаэрации однородную полимерную лекарственную композицию разливают на подложки и сушат при температуре 40-60°С в течение 5-6 часов. Высушенные полимерные матрицы снимают с подложек, дозируют и упаковывают в стерильные стеклянные флаконы из дрота для лекарственных средств (ТУ 62-2-1077) (стекло НС-1), укупоривают резиновыми пробками марки ИР-119 (ТУ 38-006108-90) и металлическими колпачками "под обкатку". Флаконы помещают в картонные коробки. Хранят при температуре (4±2)°С в защищенном от света месте (в холодильнике) в течение 12 месяцев (таблица 3).
Снижение токсичности доксорубицина в иммобилизованной форме подтверждено результатами применения (таблица 4).
Пример по способу использования.
При аппликации полимерной матрицы с доксорубицином на слизистую оболочку верхней губы кролика в течение 20 дней не выявлено аллергических реакций, воспаления и изъязвления слизистых оболочек полости рта, изменений в базальном слое и поверхностном слое плоских клеток. На 10-й день отмечалось лишь развитие слабо выраженной гидропической дистрофии в слое шиповатых клеток эпителия в виде увеличения размеров отдельных клеток с появлением в их цитоплазме единичных мелких вакуолей, заполненных цитоплазматической жидкостью, и с 15-го дня эксперимента наблюдалось развитие более выраженной гидропической дистрофии в клетках шиповатого слоя, которая в части клеток достигает баллонной дистрофии. Наряду с этим отмечалось истончение слоя шиповатых и поверхностного слоя плоских клеток. Патологических изменений в подлежащей соединительной ткани на всех сроках эксперимента не выявлено. Таким образом, исследования показали, что иммобилизованная форма доксорубицина не обладает побочным действием и оказывает несущественное цитотоксическое воздействие на единичные клетки шиповатого слоя, которые полностью восстанавливались через 5-7 дней.
Микробиологическим методом диффузии в агар с использованием тест-культуры Вас. cereus var. mycoides 537 (споры) определено количество несвязанного доксорубицина в ткани слизистой оболочки полости рта кролика в месте аппликации (136,1±16,6 мкг/г), что обеспечит эффективность разработанной иммобилизованной формы доксорубицина [Машковский М.Д. Лекарственные средства: Пособие для врачей: В 2 т. - Т.2. - Изд. 13-е, новое. - Харьков: Торсинг, 1997, с.437].
Таким образом, предлагаемая иммобилизованная форма доксорубицина обладает низкой токсичностью в отношении тканей слизистой оболочки полости рта. Разработан оптимальный способ изготовления иммобилизованной формы доксорубицина, исключающий изменения структуры и физико-химических свойств лекарственного вещества.
Предлагаемая иммобилизованная форма доксорубицина позволяет расширить ассортимент имеющихся лекарственных средств для лечения опухолей слизистой оболочки полости рта.
Приводим примеры:
1. доксорубицин 0,12
оксипропилметилцеллюлоза 6,0
глицерин 2,5
вода - остальное
2. доксорубицин 0,13
оксипропилметилцеллюлоза 5,0
глицерин 3,0
вода - остальное
3. доксорубицин 0,10
оксипропилметилцеллюлоза 4,0
глицерин 2,0
вода - остальное
| Таблица 1Иммобилизованная форма доксорубицина | ||||
| Полимеры | Срок наблюдения, час. | Показатели качества | ||
| Внешний вид модельной смеси | Количественное содержание доксорубицина, % | |||
| Микробиологический метод | Спектрофотометрический метод | |||
| ОПМЦ | Свежеприготовленные | Оранжево-красный, прозрачный раствор | 98,31±4,22 | 99,52±0,б5 |
| 24 | Оранжево-красный, прозрачный раствор | - | 98,46±0,47 | |
| МЦ | Свежеприготовленные | Оранжево-красный, прозрачный раствор | 99,10±4,98 | 99,69±0,48 |
| 24 | Оранжево-красный, прозрачный раствор | - | 98,59±0,39 | |
| МЦ+ПВС | Свежеприготовленные | Оранжево-красный, прозрачный раствор | 98,07±4,5б | 99,54±0,75 |
| 24 | Оранжево-красный, прозрачный раствор | - | 98,44±0,39 | |
| Na-КМЦ | Свежеприготовленные | Оранжево-красный, прозрачный раствор | 98,85±5,04 | 99,48±0,90 |
| 0,5 | Малиново-красный раствор с хлопьями темно-красного цвета | 97,42±5,03 | 65,81±2,87 |
| Таблица 2Иммобилизованная форма доксорубицина | |
| Полимер-носитель доксорубицина | Зоны угнетения роста Bacillus cereus var.mycoides 537 (споры), мм |
| ОПМЦ | 33,17±1,54 |
| МЦ | 29,00±2,48 |
| МЦ+ПВС | 27,67±1,43 |
| Таблица 3Иммобилизованная форма доксорубицина | ||
| Показатели качества полимерных матриц | Свежеприготовленные | Через 12 месяцев хранения |
| Окраска | Ярко-красная | Ярко-красная |
| Адгезия, Н·10-3 | 78,8±3,3 | 69,2±1,0 |
| Растворимость, мин | 10,0±0,5 | 10,0±0,8 |
| Количественное содержание, отн. % | 102,87±1,97 | 101,40±2,76 |
| Значения Rf в системах:метанол - 11% раствор аммиака (8:2) | 0,62±0,02 | 0,59±0,04 |
| Этанол - 11% раствор аммиака (10:4) | 0,53±0,03 | 0,55±0,02 |
| Ацетон-бензол-вода-11% раствор аммиака (12:2:2:2) | 0,41±0,03 | 0,40±0,03 |
| метанол-фосфатный буфер (рН=7,4) - ацетонитрил (3:5:3) | 0,65±0,04 | 0,65±0,02 |
| хлороформ-метанол-вода - 11% раствор аммиака (16:6:1:1) | 0,43±0,01 | 0,38±0,06 |
| Диаметр зон угнетения роста Bacillus cereus var. mycoides 537(споры), мм | 33,17±1,54 | 31,33±1,07 |
| Таблица 4Иммобилизованная форма доксорубицина | |||||
| Показатели гистологического строения | Срок наблюдения, сут. | ||||
| 5 | 10 | 15 | 20 | 25 | |
| Базального слоя | Норма | Норма | Норма | Норма | Норма |
| Слоя шиповатых клеток | Норма | Увеличение размера отдельных клеток | Баллонная дистрофия отдельных клеток | Истончение слоя | Норма |
| Поверхностного слоя плоских клеток эпителия | Норма | Норма | Норма | Истончение слоя | Норма |
Противоопухолевое средство, содержащее доксорубицин в качестве активного вещества, отличающееся тем, что дополнительно содержит оксипропилметилцеллюлозу, глицерин и воду при соотношении компонентов, мас.%:
| Доксорубицин | 0,075-0,13 |
| Оксипропилметилцеллюлоза | 4,0-6,0 |
| Глицерин | 2,0-4,0 |
| Вода | Остальное |