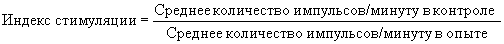Способ определения индекса стимуляции лимфоцитов для оценки иммунного статуса норок
Иллюстрации
Показать всеИзобретение относится к ветеринарии. Способ определения индекса стимуляции лимфоцитов для оценки иммунного статуса норок, включающий выделение лимфоцитов из периферической крови и лимфоидных органов, доведение их концентрации до рабочей, постановку реакции бласттрансформации с митогеном фитогемагглютинином, инкубацию лимфоциотов и учет результатов реакции радиометрическим способом, отличающийся тем, что концентрацию лимфоцитов доводят до рабочей концентрации 10-15×106 кл/мл, а инкубацию лимфоцитов осуществляют в течение 48-54 часов при температуре 37,5-40,0°С, индекс стимуляции лимфоцитов определяют по формуле:
Способ обеспечивает повышение эффективности оценки иммунного статуса норок путем повышения чувствительности реакции бласттрансформации. 4 табл.
Реферат
Способ относится к иммунологическим методам исследования и используется для оценки иммунного статуса животных. Способ основан на определении степени активности лимфоцитов, трансформирующихся в бласты.
Известен способ оценки иммуного статуса мышей с помощью реакции бласттрансформации лимфоцитов селезенки, взятых в концентрации 5×106 кл/мл питательной среды и культивируемых в термостате при 37°С течение 72 часов (Фримель X. Иммунологические методы. - М., 1979.- С.159-164). При постановке реакции с лимфоцитами норок применение рекомендуемых концентрации клеток и времени их культивирования не позволяют лимфоцитам достаточно активно трансформироваться в бласты.
Ближайшим прототипом выбран способ бластной трансформации лимфоцитов крови и лимфоидных органов свиней (Методические рекомендации по изучению клеточного иммунитета у свиней при вирусных инфекциях/Сост.: А.А.Коломыцев, В.В.Макаров, В.И.Попов.- Покров, 1988.-С.65-69). Лимфоциты из лимфоидных органов выделяют методом измельчения их в питательной среде, с последующим ресуспензированием клеток и подсчетом их концентрации. Из периферической крови лимфоциты выделяют с помощью дифференциального центрифугирования форменных элементов в градиенте плотности 17% верографина. После отмывания лимфоцитов крови и лимфоидных органов центрифугированием в питательной среде доводят концентрацию клеток до рабочей - 2×106 кл/мл питательной среды. При постановке реакции в четыре контрольных пробирки вносят по 0,5 мл рабочей суспензии лимфоцитов, 0,2 мл сыворотки свиней и по 0,3 мл питательной среды. В четыре опытных пробирки вносят по 0,5 мл суспензии лимфоцитов, 0,2 мл сыворотки свиней, 0,2 мл питательной среды и по 0,1 мл раствора митогена фитогемагглютинина, в разведении 1:100. Опытные и контрольные пробирки инкубируют в термостате при 37-38°С в течение 72 часов.
Учет результатов реакции бластной трансформации лимфоцитов проводят радиометрическим способом в жидкостном сцинтиляционном β-счетчике. Включение радиоактивной метки в лимфоцитах, трансформирующихся в бласты, выражают в импульсах в минуту. Подсчитывают среднее количество импульсов радиоактивной метки с лимфоцитов в опытных и контрольных пробирках с последующим определением индекса стимуляции по формуле:
Известный метод не обладает достаточной чувствительностью для оценки иммунного статуса норок.
Задачей предлагаемого способа является повышение эффективности оценки иммунного статуса норок путем повышения чувствительности реакции бласттрансформации лимфоцитов. Способ осуществляется следующим образом: используют микрообъемы суспензий лимфоцитов периферической крови, селезенки и лимфоузлов, доводят рабочую концентрацию лимфоцитов до 10-15×106 кл/мл питательной среды, инкубируют лимфоциты в течение 48-54 часов при температуре 37,5-40,0°С, индекс стимуляции определяют по формуле:
Совокупность признаков предлагаемого способа позволяет повысить эффективность оценки иммунного статуса норок на 56-61%.
Отличительными признаками предлагаемого способа оценки иммунного статуса норок являются: доведение рабочей концентрации лимфоцитов до 10-15×106 кл/мл питательной среды, инкубирование лимфоцитов в течение 48-54 часов при температуре 37,5-40,0°С, индекс стимуляции определяют по формуле:
Пример 1.
Для иммунологического исследования отбирали пробы периферической крови, селезенки и лимфоузлов от 20 норок половозрелого возраста темно-коричневого окраса (стандарт).
При постановке реакции бластной трансформации использовали микрообъемы лимфоцитов периферической крови, селезенки, лимфоузлов.
Для достижения поставленной задачи при постановке реакции блатной трансформации подбирали концентрацию лимфоцитов норок и продолжительность инкубации клеток.
В 12 лунок первого ряда круглодонного 96-луночного планшета вносили по 0,01 мл суспензии лимфоцитов крови норок, взятых в концентрации 2×106 кл/мл питательной среды. В 12 лунок второго, третьего, четвертого, пятого, шестого рядов вносили по 0,01 мл суспензии лимфоцитов крови норок в концентрации 6, 10, 12, 15, 17×106 кл/мл питательной среды соответственно. Затем в шесть контрольных лунок каждого ряда вносили по 0,05 мл питательной среды 199. В следующие шесть опытных лунок каждого ряда - по 0,03 мл питательной среды 199 и по 0,02 мл митогена фитогемагглютинина, в разведении 1:100. Содержимое лунок инкубировали при 37,5-40,0°С в течение 42, 48, 54, 60, 68, 72 часов. По аналогичной схеме осуществляли постановку реакции бласттрансформации лимфоцитов с клетками селезенки и лимфоузлов.
По истечении указанных сроков инкубации проводили учет результатов реакции радиометрическим методом с подсчетом индекса стимуляции лимфоцитов по формуле, предлагаемой Фримелем X.:
Результаты реакции бласттрансформации лимфоцитов периферической крови, селезенки, лимфоузлов норок представлены в таблицах 1, 2, 3.
По данным, представленным в таблицах, видно, что большее количество импульсов радиоактивной метки в лимфоцитах крови, селезенки и лимфоузлов норок выявлено при использовании концентрации клеток 10-15×106 в мл питательной среды, инкубируемых в течение 48-54 часов.
| Таблица 4 | ||
| Сравнительный анализ результатов реакции бласттрансформации лимфоцитов норок, полученных с использованием предлагаемого и известного способов | ||
| Результаты реакции, импульсы/минуту | ||
| по Коломыцеву А.А. | предлагаемым способом | |
| КРОВЬ | ||
| Контроль | 271±1,32 | 662±2,59 |
| Опыт | 6662±3,91 | 16632±3,49 |
| Индекс стимуляции | 24±2,61 | 25±2,98 |
| СЕЛЕЗЕНКА | ||
| Контроль | 291±3,61 | 580±1,57 |
| Опыт | 5623±4,36 | 15690±2,95 |
| Индекс стимуляции | 19±2,78 | 27±2,26 |
| ЛИМФОУЗЛЫ | ||
| Контроль | 162±2,61 | 468±2,59 |
| Опыт | 4320±3,81 | 14080±3,13 |
| Индекс стимуляции | 26±3,21 | 30±1,86 |
Использование предлагаемого способа оценки иммунного статуса норок позволяло определить большее количество импульсов радиоактивной метки лимфоцитов крови, селезенки и лимфоузлов норок в сравнении с методом, описанным Коломыцевым А.А., в контрольных лунках на 68%, 49%, 65% соответственно, в опытных на 59%, 64%, 69% соответственно, что свидетельствует об эффективности предлагаемого способа.
Таким образом, предлагаемый способ позволяет повысить эффективность оценки иммунного статуса норок на 60-65%.
Способ определения индекса стимуляции лимфоцитов для оценки иммунного статуса норок, включающий выделение лимфоцитов из периферической крови и лимфоидных органов, доведение их концентрации до рабочей, постановку реакции бласттрансформации с митогеном фитогемагглютинином, инкубацию лимфоциотов и учет результатов реакции радиометрическим способом, отличающийся тем, что концентрацию лимфоцитов доводят до рабочей концентрации 10-15×106 кл/мл, а инкубацию лимфоцитов осуществляют в течение 48-54 ч при температуре 37,5-40,0°С, индекс стимуляции лимфоцитов определяют по формуле