Гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент, способы их получения (варианты), фокусированная библиотека и фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к новым гетероциклическим соединениям, включающим 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1 или их фармацевтически приемлемым солям, N-оксидам или гидратам, обладающим свойствами блокаторов глутамат-индуцированного транспорта ионов кальция, в частности нейропротекторным действием. Изобретение также относится к фокусированной библиотеке для поиска биологически активных соединений-лидеров, включающей по крайней мере одно гетероциклическое соединение общей формулы 1, и к фармацевтической композиции в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, содержащей соединения изобретения в качестве активной субстанции. В соединении общей формулы 1
R1 представляет атом водорода; R2 представляет атом хлора, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, необязательно замещенный азагетероциклил; или R1 и R2 вместе с атомами азота и серы, к которым они присоединены образуют необязательно замещенный и необязательно конденсированный с другими циклами 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазин или необязательно замещенный и необязательно конденсированный с другими циклами 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триазабензоциклогептен-8-он. Изобретение также раскрывает способы получения различных соединений общей формулы 1. 6 н. и 4 з.п. ф-лы, 4 табл.
Реферат
Данное изобретение относится к синтезу новых химических веществ, поиску новых физиологически активных веществ, соединений-лидеров и лекарственных кандидатов, получаемых на основании скрининга комбинаторных или фокусированных библиотек соединений, а также к фармацевтической композиции.
Более конкретно, настоящее изобретение относится к новым гетероциклическим соединениям, включающим 2-аминопиридин-3-сульфоновый фрагмент и представляющим интерес как потенциальные физиологически активные вещества (агонисты, антагонисты и модуляторы рецепторов, ингибиторы ферментов, онколитики, антибактериальные и противопаразитарные агенты, и т.д.), к фокусированной библиотеке и фармацевтической композиции, содержащей в качестве активной субстанции новые новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент.
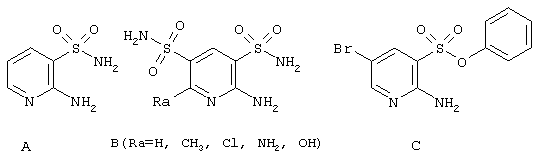
Существует большое количество физиологически активных гетероциклических соединений, включающим 2-аминопиридин-3-сульфоновый фрагмент, в том числе 2-аминопиридин-3-сульфамид [Котовская С.К. и др. Хим. Фарм. Ж., 1979, 13(4), 54-57], 2-аминопиридин-3,4-дисульфамиды [Grapoe E.J. et al. J. Med, Pharm. Chem. 1961, 4, 369-383] и фениловый эфир 2-амино-5-бромпиридин-3-сульфокислоты [Fischer, M.; Troschuetz, R. Synthesis, 2003, 10, 1603-1609], представленные ниже
Циклизацией 2-аминопиридин-3-сульфамидов А и В альдегидами и кислотами получены соответствующие 2(4)Н-пиридо[2,3-е][1,2,4]тиадиазин 1,1-диоксиды D и Е, представленные ниже в Таблице 1.
| Таблица 1Известные 2(4)Н-пиридо[2,3-е][1,2,4]тиадиазин 1,1-диоксиды D и Е | |||||
| Соед. | Ra | Rb | Rc | Rd | Литература |
| D | H | Н | н | Н | а |
| D | Н | Н | SO2NH2 | СН3 | b |
| D | H | Н | SO2NH2 | NH2 | b |
| D | Н | H | SO2NH2 | ОН | b |
| D | Н | H | SO2NH2 | Cl | b |
| E | Н | H | Н | H | |
| E | СН3 | H | Н | H | а, с |
| E | NH2 | H | Н | H | а |
| E | 3-пиридил | H | H | H | d |
| E | Н | C2H5 | SO2NH2 | H | е |
| E | CH2SCH2Ph | Н | SO2NH2 | H | b |
| E | Н | H | SO2NH2 | СН3 | b |
| E | Н | H | SO2NH2 | NH2 | b |
| E | Н | H | SO2NH2 | ОН | b |
| E | Н | H | SO2NH2 | Cl | b |
| E | CH2SCH2Ph | H | SO2NH2 | СН3 | b |
| а Котовская С.К. и др. Хим. Форм. Ж., 1979, 13(4), 54-57.b Grapoe E.J. et al. J. Med, Pharm. Chem., 1961, 4, 369-383.с Tullio P. de; et al. Tetrahedron, 1995, 51(11), 3221-3234.d Osselaere J.P. Eur. J. Med. Chem. 1974, 9, 310-312.e Yale H.L., Sheehan, J.T. J. Org. Chem., 1961, 26, 4315-4325. |
Следует отметить, что среди известных 2(4)Н-пиридо[2,3-е][1,2,4]тиадиазин 1,1-диоксидов Е имеются кардиоваскулярные и антигипертенсивные лекарства, действующие как ангиотенсивные AT1 рецептор антагонисты F [Squibb & Sons, 1995, Pat. US 5378704] и активаторы калиевых (АТР) каналов G [University of Liege, Drug Data Rep. 2000, 22(7), 600], а гетероциклы, включающие 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-4-он-1,1-диоксидный фрагмент, являются, например, ингибиторами путей сигнальной трансдукции Н [Bristol-Meers Squibb, 1998, Pat. US 6156746].
Новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент и 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-4-он-1,1-диоксидный фрагмент, представляют интерес в качестве нейропротекторов. Глутаматергическая система является основной возбуждающей нейромедиаторной системой в мозге и участвует в реализации целой серии физиологических и патологических процессов. Известно, что широкий круг неврологических заболеваний (таких, как БА, хорея Гентингтона, боковой амиотрофический склероз, а также ишемия мозга) связан с иксайтотоксическим действием нейромедиаторных возбуждающих аминокислот (ВАК) - глутамата и аспартата (Excitatory Ammo Acids and Drug Research, Ed. by M.R.Szewczak & N.J.Hrib, Alan R. Liss, Inc., New York, 1989, p.380; The NMDA Receptor, Eds. Watkins & Collngridge G., 1989, IRL Press). В соответствии с этим механизмом деполяризация мембран нейронов при длительной активации глутаматных рецепторов ЦНС, а именно рецепторов N-метил-D-аспартата (NMDA), и т.н. «non-NMDA»-рецепторов, в частности рецепторов «амино-3-гидрокси-5-метилизоксазол-4-пропионовой кислоты / каиновой кислоты» (АМРА/КА), приводит к нарушению кальциевого гомеостаза в нервных клетках и инициирует целый ряд патологических метаболических процессов (в том числе, образование свободнорадикальных метаболитов), вызывающих в конечном итоге гибель нервных клеток (D.W.Choi, Neuron, 1988, v.1, p.623-634).
Возможность регуляции пула внутриклеточного кальция определяет большое фармакологическое значение специфических блокаторов транспорта кальция, связанного с глутаматными рецепторами ЦНС. В настоящее время ряд антагонистов NMDA- и АМРА/КА рецепторов предложен в качестве антидепрессантов [J.Maj, V.Klimek, Z.Rogoz, G.Skuza - Pol. J. Pharmacol., 1993, v.45, pp.549-553; R.Trullas, P.Skolnick - Eur. J. Pharmacol., 1990, v.185, No 1, pp.1-10], анксиолитиков [R.W.Dunn, R.Corbet, L.L.Martin, J.F.Payack, L.Laws-Ricker, C.A.Wilmot, D.K.Rush, J.F.Cornfeldt, S.Fielding - Prog. Clin. Biol. Res., 1990, v.361, (Curr. Future Trends Anticonvulsant Anxiety, Stroke Ther.), pp.495-512], противосудорожных препаратов [J.M.Ferkany, W.J.Krezotarski - Prog. Clin. Biol. Res., 1990, v.361 (Curr. Future Trends Anticonvulsant Anxiety, Stroke Ther.), pp.525-541; W.J.Schmidt, B.Zadow, B.D.Kretschmer. - Aminoacids, 1991, v.1, No 2, pp.225-237) и нейропротекторов (S.Fielding, J.Wilker, J.C.Chernack, V.Ramizer, C.A.Wilmot, M.L.Cornfeldt, K.A.Rudolphi, L.L.Martin, J F.Payck, D.K.Rush - Prog. Clin. Biol. Res., 1990, v.361, pp.495-512 (Curr. Future Trends Anticolvunsant Anxiety, Stroke Ther.); T.Nakao, A.Nishiyama, H.Tanaka, Y.Morimot, S.Takehara - Pat. Jap. 04,257,589 [92,257,589] (C 07 D 495/14) от 12.02.1991).
В случае БА, в частности, предполагается, что один из основных механизмов гибели нервных клеток связан со значительным возрастанием восприимчивости нейронов к иксайтотоксическому действию ВАК в результате воздействия на нервные клетки патологической формы β-амилоидного пептида, играющего ключевую роль в патогенезе БА. В результате этого нетоксические в нормальных условиях концентрации медиатора глутамата становятся в условиях развивающегося β-амилоидоза токсическими для нейронов и вызывают их гибель (Koh et al., Brain Res., 1990, v.533, p.315; Mattson et al., J. Neuroschi., 1992, v.12, p.376).
В этой связи поиск эффективных блокаторов глутамат-индуцированного транспорта ионов кальция, в частности в ряду антагонистов NMDA-рецепторов мозга, способных защищать нервные клетки от нейротоксического действия избыточных концентраций ионов кальция является оригинальным и перспективным подходом к созданию новых нейропротекторов для лечения и защиты от широкого круга нейродегенеративных заболеваний (Danysz et al., Drug, News & Perspectives, 1995, v.8, №5, p.261).
Учитывая высокий потенциал физиологической активности гетероциклических соединений, включающих 2-аминопиридин-3-сульфоновый фрагмент и 2,3,4,5-тетрагидро-1,2,5-бензотиадиазепин-4-он-1,1-диоксидный фрагмент, актуальным является разработка новых соединений этого типа, фокусированных библиотек и фармацевтических композиций, включающих этих соединения.
В результате проведенных исследований, направленных на поиск новых физиологически активных веществ, соединений-лидеров, изобретатели получили не известные ранее новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент, которым свойственна физиологическая активность, фокусированную библиотеку и фармацевтическую композицию, включающую эти соединения.
Следует отметить, что несмотря на заметное количество гетероциклических соединений, включающих 2-аминопиридин-3-сульфоновый фрагмент, опубликованных в патентной и научной литературе, некоторые из них до настоящего времени известны не были.
Ниже приведены определения терминов, которые использованы в описании этого изобретения:
«Комбинаторная библиотека» означает коллекцию соединений, полученных параллельным синтезом, предназначенную для поиска лида или оптимизации биологической активности лид-соединения, причем каждое соединение библиотеки соответствует общему скэффолду и библиотека является коллекцией родственных гомологов или аналогов.
«Фокусированная библиотека» означает комбинаторную библиотеку, или совокупность нескольких комбинаторных библиотек, или совокупность библиотек и веществ, специальным образом организованную с целью увеличения вероятности нахождения хитов и лидеров или с целью повышения эффективности их оптимизации. Дизайн фокусированных библиотек, как правило, связан с направленным поиском эффекторов (ингибиторов, активаторов, агонистов, антагонистов и т.п.) определенных биомишеней (ферментов, рецепторов, ионных каналов и т.п.).
«Лид-соединение» означает соединение с выдающейся активностью, относящейся к определенной болезни.
«Скэффолд» означает общую структурную формулу, или молекулярный каркас, или инвариантную область соединений, характерную для всех соединений, входящих в комбинаторную библиотеку.
«Хемотип» означает серию соединений, объединенную общей структурной формулой и обладающую определенным общим свойством, например каким-то видом физиологичекой активности. Можно сказать, например, "новый хемотип активаторов калиевых каналов", или "известный хемотип киназных ингибиторов", и т.д. Как правило, наличие общего структурного фрагмента у соединений в рамках одного хемотипа является необходимым и достаточным условием для наличия у них общего свойства.
«Заместитель» означает химический радикал или группу, которые присоединяются к другому радикалу, группе или к скэффолду, включая, но не ограничивая атом галогена, «инертный заместитель», нитро группа, сульфо группа, сульфамидная группа, гидроксильная группа, амино группа, карбоксиалкильная группа, алкоксикарбонильная группа, карбамоильная группа и др.
«Инертный заместитель» ("Non-interfering substituent") означает низко- или нереакционоспособный радикал, инертный к дальнейшим превращениям и к среде, включая, но не ограничивая С1-С7 алкил, С2-С7 алкенил, С2-С7 алкинил, С1-С7 алкокси, С7-С12 аралкил, замещенный аралкил, С7-С12 гетероциклилалкил, замещенный гетероциклилалкил, С7-C12 алкарил, С3-С10 циклоалкил, С3-С10 циклоалкенил, фенил, замещенный фенил, толуил, ксиленил, бифенил, C2-С12 алкоксиалкил, С2-С10 алкилсульфинил, С2-С10 алкилсульфонил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, замещенный алкокси, фторалкил, арилоксиалкил, гетероциклил, замещенный гетероциклил и нитроалкил, где m и n имеют значение от 1 до 7. Предпочтительными «инертными заместителями» являются C1-С7 алкил, С2-C7 алкенил, С2-С7 алкинил, C1-С7 алкокси, С7-C12 аралкил, С7-C12 алкарил, С3-С10 циклоалкил, С3-С10 циклоалкенил, фенил, замещенный фенил, (СН2)m-O-(C1-С7алкил), -(CH2)m-N(C1-С7алкил)n, арил, замещенный арил, гетероциклил и замещенный гетероциклил.
«Замещенная группа, замещенный радикал или скэффолд» означают, соответственно, группу, радикал или скэффолд, у которых имеется заместитель, включая, но не ограничивая: инертный заместитель, атом галогена, нитро группа, циано группа, сульфо группа, гидроксильная группа, амино группа, карбоксиалкильная группа, карбоксильная группа, карбамоильная группа. Например, замещенный алкил означает алкил, у которого имеется один или несколько заместителей, например гидроксиалкил или метилоксикарбонилалкил, амино-метоксикарбонил-метил, диметиламиноалкил, 2-гидрокси-2-метоксикарбонил-этил и др.; замещенная амино группа означает амино группу, у которой имеется один или два заместителя, например ациламино группа, N,N-диалкиламино группа, N-ацил-N-арил-амино группа, ацетил-метоксикарбонилметил-амино группа и др.; замещенный фенил означает фенил, у которого имеется один или несколько заместителей, например 2-метоксикарбонилфенил, 4-амино-3-метоксикарбонилфенил, 3,4-диаминофенил и др.
«Необязательно замещенная группа, необязательно замещенный радикал или скэффолд» означают, соответственно, группу, радикал или скэффолд, включающие группы, радикалы или скэффолды с заместителями и без заместителей. Например, понятие необязательно замещенная аминогруппа включает незамещенную аминогруппу и аминогруппы, содержащие любые, не противоречащие химии заместители, включая, но не ограничивая ациламино группы, N,N-диалкиламино группы, N-ацил-N-арил-амино группы, ацил-метоксикарбонилметил-амино группы и др.
«Арил» означает один или более ароматических циклов, каждый из которых включает 5 или 6 атомов углерода. «Арил» может быть конденсированным полициклом, например, как нафталин или неконденсированным, например как бифенил. «Замещенный арил» имеет один или несколько «не мешающих» заместителей.
«Галоген» означает атом фтора, хлора, брома или иода.
«Гетероцикл» означает один или несколько насыщенных или ароматических циклов с 5, 6 или 7 атомами, по крайней мере, один из которых является гетероатомом. Преимущественными гетероатомами являются сера, кислород и азот. «Гетероцикл» может быть конденсированным полициклом, например, как бензимидазол, бензоксазол. бензтиазол, хинолин, или неконденсированным, например, как бипиридил.
«Азогетероцикл» означает гетероцикл, включающий, по крайней мере, один атом азота, например, как бензимидазол, бензоксазол, бензтиазол, хинолин.
«Замещенный гетероцикл» означает гетероцикл, имеющий один или несколько «не мешающих» заместителей.
«Параллельный синтез» означает метод проведения химического синтеза комбинаторной библиотеки индивидуальных соединений.
Целью настоящего изобретения являются новые гетероциклические соединения, включающие 2-аминопиридин-3-сульфоновый фрагмент.
Поставленная цель достигается гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R1 представляет атом водорода;
R2 представляет атом хлора, необязательно замещенную гидроксильную группу необязательно замещенную амино группу необязательно замещенный азогетероцикл;
или R1 и R2 вместе с атомами азота и серы, к которым они присоединены, образуют необязательно замещенный и необязательно конденсированный с другими циклами 1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазин или необязательно замещенный и необязательно конденсированный с другими циклами 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-он, исключая фениловый эфир 2-амино-5-бромпиридин-3-сульфокислоты.
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются 2-аминопиридин-3-сульфокислоты и их производные общей формулы 1.1
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R2 имеет вышеуказанное значение.
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются 1,1-диоксо-4H-пиридо[2,3-е][1,2,4]тиадиазины с необязательно замещенными аннелированными карбоциклами или гетероциклами общей формулы 1.2
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R3 и R4 независимо друг от друга представляют атом водорода, атом галогена, инертный заместитель, необязательно замещенную гидроксильную группу, необязательно замещенную аминогруппу, необязательно замещенный С1-С3алкилоксикарбонилС1-С3алкил, необязательно замещенный аминокарбонил, необязательно замещенный аминокарбонилС1-С3алкил или необязательно замещенный аминокарбонилС1-С3алкил,
или R3 и R4 вместе с атомами углерода, к которому они присоединены, образуют необязательно замещенный и необязательно конденсированный циклоалкил или циклоакенил, необязательно замещенный арил или гетероциклил.
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются 5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-оны общей формулы 1.3
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R5 и R6 независимо друг от друга представляют атом водорода или инертный заместитель, а R7 и R8 независимо друг от друга представляют атом водорода, инертный заместитель, остаток аминокислоты или необязательно замещенную этиленовую группу.
Согласно изобретению предпочтительными гетероциклическими соединениями, включающими 2-аминопиридин-3-сульфоновый фрагмент, являются амиды 3-(1,1-диоксо-1,4-дигидропиридо[2,3-е][1,2,4]тиадиазин-3-ил)-пропионовой кислоты общей формулы 1.4
или их фармацевтически приемлемыми солями, N-оксидами или гидратами, в которых:
R3, R4 и R5 имеют вышеуказанное значение, а R9 представляет необязательно замещенную аминогруппу или необязательно замещенный азогетероцикл.
Новые 2-амино-5-бромпиридин-3-сульфамиды 1.1 получают с использованием общеизвестных способов синтеза, в частности, сульфохлорированием 2-амино-5-бромпиридина 2 и взаимодействием образующегося сульфохлорида 3 с аминами или азагетеро циклам и общей формулы 4 по приведенной ниже схеме 1:
Схема 1
в которых R2 имеют вышеуказанное значение.
Данное изобретение относится к способу получения 7-бром-1,1-диоксо-4Н-пиридо[2,3-е][1,2,4]тиадиазинов с необязательно замещенными аннелированными карбоциклами общей формулы 1.2, который заключается во взаимодействии 2-амино-5-бромпиридин-3-сульфамида 1.1(1) с циклическими ангидридами дикарбоновых кислот общей формулы 5 по схеме 2:
Схема 2
Данное изобретение относится к способу получения 3-бром-5,5-диоксо-5,6,7,9-тетрагидро-5-тиа-1,6,9-триаза-бензоциклогептен-8-оны общей формулы 13, который заключается во взаимодействии 2-амино-5-бромпиридин-3-сульфохлорида 3 с α-аминокислотами или их эфирами 6 и последующей циклизации образующихся соединений 1.1(а) по схеме 3
Амиды 3-(1,1-диоксо-1,4-дигидропиридо[2,3-е][1,2,4]тиадиазин-3-ил)-пропионовой кислоты общей формулы 1.4 получают исходя из 5,5-диоксо-3,5-дигидро-2Н-5-тиа-4,9,9b-триаза-циклопента[а]нафталин-1-онов общей формулы 1.2 по приведенной ниже схеме 4:
Схема 4
в которых R3 и R4 имеют вышеуказанное значение; R9 представляет необязательно замещенную амино группу, необязательно замещенный азогетероцикл.
Целью настоящего изобретения являются фокусированная библиотека для поиска биологически активных соединений-лидеров.
Поставленная цель достигается фокусированной библиотекой, включающей, по крайней мере, одно гетероциклическое соединение, включающее 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1 или его фармацевтически приемлемую соль, N-оксид или гидрат.
Целью настоящего изобретения являются новая фармацевтическая композиция в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
Поставленная цель достигается фармацевтической композицией, включающей по крайней мере одно гетероциклическое соединение, включающее 2-аминопиридин-3-сульфоновый фрагмент, общей формулы 1 или его фармацевтически приемлемую соль, N-оксид или гидрат.
Фармацевтически приемлемые соли соединений могут быть получены традиционным путем, например действием на соединения соответствующей кислотой или основанием. N-оксиды могут быть получены окислением соответствующих азотсодержащих соединений. Гидраты соединений могут быть получены, например, при перекристаллизации из водных растворов, или образуются спонтанно в процессе синтеза.
Ниже изобретение описывается с помощью примеров получения конкретных соединений и фокусированной библиотеки. Структуры полученных соединений подтверждались данными хроматографического и спектрального анализа.
Приведенные ниже примеры иллюстрируют, но не ограничивают данное изобретение.
Пример 1. 2-Амино-5-бромпиридин-3-сульфамид 1.1(1). Прибавляли небольшими порциями 2-амино-5-бромпиридин 2 [54 г (0,31 моль)] к охлажденной на ледяной бане хлорсульфоновой кислоте [200 мл (3 моль)]. Смесь кипятили в колбе с обратным холодильником в течение 3 ч. После охлаждения смесь выливали на 500 г мелко раздробленного льда при интенсивном перемешивании. Образовавшийся при этом желтый осадок 2-амино-5-бромпиридин-3-сульфохлорида 3 отфильтровывали, промывали холодной водой, затем петролейным эфиром и высушивали. Получали 72,4 г (86%), 2-амино-5-бромпиридин-3-сульфохлорида 3 с т.пл. 151-153°С. Полученный продукт 3 [72,4 г (0,27 моль)] суспендировали при перемешивании в 1000 мл 10% водного раствора аммиака. Через 0,5 часа суспензию концентрировали под вакуумом до объема 300 мл. Образовавшийся осадок 2-амино-5-бромпиридин-3-сульфамида 1.1(1) отфильтровывали, промывали водой и петролейным эфиром. Получали 41,5 г (61%) 2-амино-5-бромпиридин-3-сульфамида 1.1(1) (Таблица 2).
Пример 2. Общая методика синтеза замещеных 2-амино-5-бромпиридин-3-сульфамидов 1.1(2-169). Способ получения фокусированной библиотеки 2-амино-5-бромпиридин-3-сульфамидов 1.1(2-169). Раствор 0,27 г (0,003 моль) 2-амино-5-бромпиридин-3-сульфохлорида 3 в 3 мл диоксана охлаждали на ледяной бане до температуры 5°С и при интенсивном перемешивании прибавляли раствор 0,003 моль амина 4 и 0,28 г (0,0035 моль) пиридина в 2 мл диоксана. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем при температуре 50°С в течение 1 часа. Смесь оставляли на ночь при комнатной температуре. Затем смесь выливали в воду. Образовавшийся осадок очищали перекристаллизацией из пропанола-2, отфильтровывали, промывали холодной водой и высушивали. Получали фокусированную библиотеку состоящую из замещеных 2-амино-5-бромпиридин-3-сульфамидов 1.1(2-169), представленных в таблице 2.
| Таблица 2 | |||
| № п.п. соед. 1.1 | Формула | Мол. Вес. | Аналитические данные |
| 1 | 252,09 | Спектр ЯМР 1Н: 6,4 (с, 2Н, NH2), 7,3 (с, 2Н, SO2NH2), 7,9 (д, 1Н, J=2,3 Hz, 4CH), 8,1 (д, 1Н, J=2,3 Hz, 6CH). LC MS, m/z 253 (M+1). | |
| 2 | 364,17 | LC MS, m/z 365 (M+1) | |
| 3 | 370,23 | LC MS, m/z 371 (M+1) | |
| 4 | 388,24 | LC MS, m/z 389 (M+1) | |
| 5 | 421,11 | LC MS, m/z 422 (M+1) | |
| 6 | 360,28 | LC MS, m/z 361 (M+1) | |
| 7 | 446,37 | LC MS, m/z 447 (M+1) | |
| 8 | 368,25 | LC MS, m/z 369 (M+1) | |
| 9 | 396,19 | LC MS, m/z 397 (M+1) | |
| 10 | 430,63 | LC MS, m/z 432 (M+1) | |
| 11 | 343,20 | LC MS, m/z 344 (M+1) | |
| 12 | 329,18 | LC MS, m/z 330 (M+1) | |
| 13 | 358,22 | LC MS, m/z 359 (M+1) | |
| 14 | 358,22 | LC MS, m/z 359 (M+1) | |
| 15 | 356,24 | LC MS, m/z 357 (M+1) | |
| 16 | 308,20 | LC MS, m/z 309 (M+1) | |
| 17 | 308,20 | LC MS, m/z 309 (M+1) | |
| 18 | 362,63 | Т.пл. 196-198°С. Спектр ЯМР 1Н: 2,90 (с, 3Н, СН3),6,62(с, 2Н, NH2), 7,09 (д, 2Н, J=9,3 Hz, 2ArH), 7,18(д, 2H, J=9,3 Hz, 2АrН), 7,87 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,10 (д, 1Н, J6-4=2,3 Hz, 6CH), 10,38 (c, lH, NH). LC MS, m/z 364 (М+1) | |
| 19 | 376,66 | LC MS, m/z 378 (M+1) | |
| 20 | 422,69 | LC MS, m/z 424 (M+1) | |
| 21 | 376,66 | LC MS, m/z 378 (M+1) | |
| 22 | 390,69 | LC MS, m/z 392 (M+1) | |
| 23 | 348,26 | LC MS, m/z 349 (M+1) | |
| 24 | 334,24 | LC MS, m/z 335 (M+1) | |
| 25 | 362,29 | LC MS, m/z 363 (M+1) | |
| 26 | 320,21 | LC MS, m/z 321 (M+1) | |
| 27 | 364,17 | LC MS, m/z 365 (M+1) | |
| 28 | 388,24 | LC MS, m/z 389 (M+1) | |
| 29 | 388,24 | LC MS, m/z 389 (M+1) | |
| 30 | 416,30 | LC MS, m/z 417 (M+1) | |
| 31 | 356,24 | LC MS, m/z 357 (M+1) | |
| 32 | 356,24 | LC MS, m/z 357 (M+1) | |
| 33 | 336,25 | Т.пл. 137-139°С. Спектр ЯМР 1: 0,89 (т, 6Н, 2СН3), 1,55 (секст, 4Н, 2ССН2С), 3,14 (т, 4Н, CH2NCH2), 6,49 (с, 2Н, NH2), 7,86 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,17 (д, lH, J6-4=2,3 Hz, 6CH). LC MS, m/z 337 (M+1) | |
| 34 | 400,25 | LC MS, m/z 401 (M+1) | |
| 35 | 356,24 | LC MS, m/z 357 (M+1) | |
| 36 | 356,24 | LC MS, m/z 357 (M+1) | |
| 37 | 356,24 | LC MS, m/z 357 (M+1) | |
| 38 | 392,27 | LC MS, m/z 393 (M+1) | |
| 39 | 393,26 | LC MS, m/z 394 (M+1) | |
| 40 | 348,26 | LC MS, m/z 349 (M+1) | |
| 41 | 346,18 | LC MS, m/z 347 (M+1) | |
| 42 | 346,18 | LC MS, m/z 347 (M+1) | |
| 43 | 334,24 | LC MS, m/z 335 (M+1) | |
| 44 | 354,23 | LC MS, m/z 355 (M+1) | |
| 45 | 363,24 | LC MS, m/z 364 (M+1) | |
| 46 | 372,24 | LC MS, m/z 373 (M+1) | |
| 47 | 427,32 | LC MS, m/z 428 (M+1) | |
| 48 | 427,32 | LC MS, m/z 428 (M+1) | |
| 49 | 356,24 | LC MS, m/z 357 (M+1) | |
| 50 | 334,24 | LC MS, m/z 335 (M+1) | |
| 51 | 334,24 | LC MS, m/z 335 (M+1) | |
| 52 | 334,24 | LC MS, m/z 335 (M+1) | |
| 53 | 372,24 | LC MS, m/z 373 (M+1) | |
| 54 | 397,30 | LC MS, m/z 398 (M+1) | |
| 55 | 386,23 | LC MS, m/z 387 (M+1) | |
| 56 | 306,18 | Т.пл. 166-168°С. Спектр ЯМР 1Н: 1,88 (м, 4Н, 2СН2), 3,29 (т, 4Н, CH2NCH2), 6,61 (с, 2Н, NH2), 7,86 (д, 1H,J4.6=2,3 Hz, 4CH), 8,19 (д, 1Н, J6-4=2,3 Hz, 6CH). LC MS, m/z 307 (М+1) | |
| 57 | 407,27 | LC MS, m/z 408 (M+1) | |
| 58 | 384,30 | LC MS, m/z 385 (М+1) | |
| 59 | 431,74 | LC MS, m/z 433 (М+1) | |
| 60 | 403,34 | LC MS, m/z 404 (М+1) | |
| 61 | 425,35 | Т.пл. 171-173°С. Спектр ЯМР 1Н: 2,14 (с, 3Н, СН3), 2,24 (с, 3Н, СН3), 2,89 (м, 4Н, CH2NCH2), 3,29 (м, 4Н, CH2NCH2), 6,65 (с, 2Н, NH2), 6,84 (м, 2Н, 4',6'СН), 6,98 (т, 1Н, 5'СН), 7,86 (д, 1Н, J4-6=2,3 Hz, 4CH), 8,24 (д, 1Н, J6-4=2,3 Hz, | |
| 6CH). LC MS, m/z 426 (M+1) | |||
| 62 | 425,35 | LC MS, m/z 426 (M+1) | |
| 63 | 368,25 | LC MS, m/z 369 (M+1) | |
| 64 | 342,22 | LC MS, m/z 343 (M+1) | |
| 65 | 418,27 | LC MS, m/z 419 (M+1) | |
| 66 | 376,66 | LC MS, m/z 378 (M+1) | |
| 67 | 370,27 | LC MS, m/z 371 (M+1) | |
| 68 | 348,26 | LC MS, m/z 349 (M+1) | |
| 69 | 294,17 | LC MS, m/z 295 (M+1) | |
| 70 | 351,27 | LC MS, m/z 352 (M+1) | |
| 71 | 400,25 | LC MS, m/z 401 (M+1) | |
| 72 | 388,24 | LC MS, m/z 389 (M+1) | |
| 73 | 421,11 | LC MS, m/z 422 (M+1) | |
| 74 | 376,66 | LC MS, m/z 378 (M+1) | |
| 75 | 356,24 | LC MS, m/z 357 (M+1) | |
| 76 | 322,23 | LC MS, m/z 323 (M+1) | |
| 77 | 356,24 | LC MS, m/z 357 (M+1) | |
| 78 | 335,22 | LC MS, m/z 336 (M+1) | |
| 79 | 336,21 | LC MS, m/z 337 (M+1) | |
| 80 | 370,27 | LC MS, m/z 371 (M+1) | |
| 81 | 394,29 | LC MS, m/z 395 (M+1) | |
| 82 | 439,33 | LC MS, m/z 440 (M+1) | |
| 83 | 411,32 | LC MS, m/z 412 (M+1) | |
| 84 | 356,24 | LC MS, m/z 357 (M+1) | |
| 85 | 370,23 | LC MS, m/z 371 (M+1) | |
| 86 | 374,28 | LC MS, m/z 375 (M+1) | |
| 87 | 384,30 | LC MS, m/z 385 (M+1) | |
| 88 | 465,29 | LC MS, m/z 466 (M+1) | |
| 89 | 403,34 | LC MS, m/z 404 (M+1) | |
| 90 | 398,28 | LC MS, m/z 399 (M+1) | |
| 91 | 370,27 | LC MS, m/z 371 (M+1) | |
| 92 | 372,24 | LC MS, m/z 373 (M+1) | |
| 93 | 372,24 | LC MS, m/z 373 (M+1) | |
| 94 | 322,23 | LC MS, m/z 323 (M+1) | |
| 95 | 360,21 | LC MS, m/z 361 (M+1) | |
| 96 | 370,27 | LC MS, m/z 371 (M+1) | |
| 97 | 356,24 | LC MS, m/z 357 (M+1) | |
| 98 | 322,23 | LC MS, m/z 323 (M+1) | |
| 99 | 382,28 | LC MS, m/z 383 (M+1) | |
| 100 | 348,26 | LC MS, m/z 349 (M+1) | |
| 101 | 348,26 | LC MS, m/z 349 (M+1) | |
| 102 | 464,19 | LC MS, m/z 465 (M+1) | |
| 103 | 348,26 | LC MS, m/z 349 (M+1) | |
| 104 | 392,27 | LC MS, m/z 393 (M+1) | |
| 105 | 425,35 | LC MS, m/z 426 (M+1) | |
| 106 | 362,29 | LC MS, m/z 363 (M+1) | |
| 107 | 407,29 | LC MS, m/z 408 (M+1) | |
| 108 | 348,24 | LC MS, m/z 349 (M+1) | |
| 109 | 360,21 | LC MS, m/z 361 (M+1) | |
| 110 | 396,19 | LC MS, m/z 397 (M+1) | |
| 111 | 392,66 | LC MS, m/z 394 (M+1) | |
| 112 | 392,66 | LC MS, m/z 394 (M+1) | |
| 113 | 372,24 | LC MS, m/z 373 (M+1) | |
| 114 | 446,37 | LC MS, m/z 447 (M+1) | |
| 115 | 384,30 | LC MS, m/z 385 (M+1) | |
| 116 | 349,25 | LC MS, m/z 350 (M+1) | |
| 117 | 380,62 | LC MS, m/z 382 (M+1) | |
| 118 | 400,27 | LC MS, m/z 401 (M+1) | |
| 119 | 427,32 | LC MS, m/z 428 (M+1) | |
| 120 | 384,30 | LC MS, m/z 385 (M+1) | |
| 121 | 324,20 | LC MS, m/z 325 (M+1) | |
| 122 | 352,25 | LC MS, m/z 353 (M+1) | |
| 123 | 415,29 | LC MS, m/z 416 (M+1) | |
| 124 | 435,32 | LC MS, m/z 436 (M+1) | |
| 125 | 368,25 | LC MS, m/z 369 (M+1) | |
| 126 | 360,21 | LC MS, m/z 361 (M+1) | |
| 127 | 412,19 | LC MS, m/z 413 (M+1) | |
| 128 | 372,24 | LC MS, m/z 373 (M+1) | |
| 129 | 416,30 | LC MS, m/z 417 (M+1) | |
| 130 | 370,27 | LC MS, m/z 371 (M+1) | |
| 131 | 425,35 | LC MS, m/z 426 (M+1) | |
| 132 | 413,34 | LC MS, m/z 414 (M+1) | |
| 133 | 356,24 | LC MS, m/z 357 (M+1) | |
| 134 | 356,24 | LC MS, m/z 357 (M+1) | |
| 135 | 342,22 | LC MS, m/z 343 (M+1) | |
| 136 | 346,18 | LC MS, m/z 347 (M+1) | |
| 137 | 362,63 | LC MS, m/z 364 (M+1) | |
| 138 | 376,66 | LC MS, m/z 378 (M+1) | |
| 139 |