Токоферолы, токотриенолы, другие хроманы и производные по боковым цепям и их применение
Иллюстрации
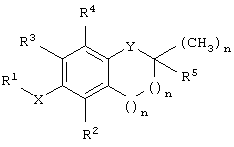
Показать всеИзобретение относится к новым производным токоферола, токотриенола и другим производным хромана общей формулы I
где Х выбран из группы, включающей кислород и азот;
Y выбран из группы, включающей кислород, азот и серу, где, когда Y представляет собой кислород или азот, n равно 1, и, когда Y представляет собой серу, n равно 0;
R1 представляет собой остаток карбоновой кислоты, карбоксамида, сложного эфира, спирта, амина или сульфата; R2 представляет собой метил; R3 представляет собой метил; R4 представляет собой метил и R5 выбран из группы, включающей алкил, алкенил, алкинил, карбоксил и сложноэфирный остаток, где, когда Y представляет собой азот, указанный азот замещен группой R6, где R6 представляет собой водород или метил;
где, когда Х представляет собой кислород, Y представляет собой кислород и R5 представляет собой фитил, тогда R1 не является бутановой кислотой. Изобретение также относится к фармацевтической композиции на основе этих соединений, способу лечения клеточно-пролиферативного заболевания и способу индукции апоптоза клеток.
Технический результат - получения новых соединений, обладающих антипролиферативным действием. 8 н. и 28 з.п. ф-лы., 4 табл. 19 ил.
Реферат
Предпосылки изобретения
Область изобретения
Настоящее изобретение в целом относится к области органической химии и к соединениям с антипролиферативными и проапоптотическими свойствами. Более конкретно, настоящее изобретение относится к соединениям на основе хромана и его производным и аналогам и их применению в качестве антипролиферативных, проапоптотических, иммуномодулирующих и противовирусных средств.
Область техники
Биология клеточной пролиферации и клеточной гибели (апоптоза) является крайне сложной, включающей множество межклеточных путей передачи сигнала и множество продуктов взаимодействия генов. Раковые клетки могут проявлять разнообразные дефекты нормального контроля регуляции клеточной пролиферации, которые позволяют им увеличивать свою численность. Кроме того, раковые клетки проявляют дефекты механизмов, участвующих в элиминации аномальных клеток с помощью многостадийного процесса, рассматриваемого как запрограммированная клеточная гибель или апоптоз. Таким образом, сочетание нерегулируемой клеточной пролиферации и супрессии гибели, затрагивающей пути передачи сигнала, способствует как росту раковых клеток, так и их жизнеспособности.
Происходит ли увеличение численности клеток или не происходит, зависит от баланса экспрессии отрицательно и положительно регулирующих рост продуктов регуляторных генов и наличия и отсутствия функциональных путей передачи сигнала клеточной гибели. Отрицательно регулирующие рост регуляторные гены приводят к блокированию клеток в ходе клеточного цикла. Положительно регулирующие рост регуляторные гены стимулируют клетки к прохождению клеточного цикла. Гены, участвующие в апоптозе, могут быть как проапоптотического, так и противоапоптотического характера, и динамический баланс между ними определяет выбор роста клетки или ее гибели.
Раковые клетки для выживания и увеличения своей численности проходят ряд мутаций в течение времени, которые устраняют регуляторный контроль, что дает им способность к неконтролируемому росту и жизнеспособности даже в присутствии проапоптотических сигналов и придает свойства, позволяющие ускользать от обнаружения и удаления с помощью защитной реакции иммунной системы. Злокачественные опухоли могут быть причиной смерти пациентов при отсутствии удаления хирургическим путем или эффективного лечения с помощью лекарственных препаратов.
Существует большое разнообразие патологических состояний пролиферации клетки, которые нуждаются в новых терапевтических стратегиях и препаратах для достижения терапевтического успеха. Данные патологические состояния могут наблюдаться почти во всех типах клеток, способных к аномальной клеточной пролиферации или аномальной быстроте реагирования на сигналы клеточной гибели. В числе типов клеток, проявляющих патологические или аномальные характеристики роста и гибели, находятся (1) фибробласты, (2) эндотелиальные клетки сосудов и (3) эпителиальные клетки. Таким образом, необходимы новые способы лечения локальных или распространенных патологических состояний во всех или почти во всех системах органов и тканях человека.
Большинство злокачественных опухолей, являющихся специфическими для мужчин, такие как опухоли предстательной железы или яичек, или специфическими для женщин, такие как опухоли молочной железы, яичников или шейки матки, или поражающих мужчин и женщин в равной степени, такие как опухоли печени, кожи или легких, со временем претерпевают повышенное количество генетических повреждений и эпигенетических воздействий и становятся в равной степени высоко метастатическими и плохо поддающимися лечению. Хирургическое удаление обособленных злокачественных опухолей является оправданно эффективным только в случае, если злокачественная опухоль не распространилась далеко за пределы первичного очага поражения. Как только злокачественная опухоль распространяется на другие ткани и органы, хирургические процедуры должны дополняться другими более специфическими процедурами для уничтожения нездоровых или малигнизированных клеток. Большинство из обычно применяемых дополнительных процедур удаления нездоровых или малигнизированных клеток, такие как химиотерапия или биооблучение, не являются локальными по отношению к расположению опухолевых клеток и, хотя они оказывают пропорционально большее разрушающее действие на малигнизированные клетки, часто до некоторой степени затрагивают нормальные клетки.
Некоторые производные токоферолов, токотриенолов и витамин Е применяются в качестве проапоптотических и ингибирующих синтез ДНК веществ. Структурно витамин Е состоит из хроманольной группы и алкильной боковой цепи. Существует восемь основных форм витамина Е, встречающихся в природе: альфа (α), бета (β), гамма (γ) и дельта (δ) токоферолы и α, β, γ и δ токотриенолы. Токоферолы отличаются от токотриенолов наличием насыщенной фитильной боковой цепи в отличие от ненасыщенной изопренильной боковой цепи. Четыре формы токоферолов и токотриенолов отличаются числом метильных групп у хроманольной группы (α содержит три, β и γ содержат две и 8 содержит одну группу).
RRR-α-токоферилсукцинат представляет собой производное RRR-α-токоферола, которое структурно модифицировано с помощью сложноэфирной связи для присоединения сукцинильной группы взамен гидроксильной группы по 6-му положению в хромановой группе. Данный сложный эфир RRR-α-токоферола, содержащий сукцинатную составляющую, представляет наиболее эффективную форму витамина Е, оказывающую биологическое действие в виде запуска апоптоза и ингибирования синтеза ДНК. Данная форма витамина Е индуцирует в опухолевых клетках переход в апоптоз, не оказывая индуцирующего апоптоз влияния на нормальные клетки. Основное преимущество данной формы витамина Е в качестве противоопухолевого вещества заключается в том, что многие малигнизированные клетки либо экспрессируют низкие уровни эстеразы, либо вовсе не экспрессируют эстеразы, которые могут отщепить сукцинатную группу, преобразуя RRR-α-токоферол из сукцинатной формы в свободный RRR-α-токоферол. RRR-α-токоферол не обладает ни высокой антипролиферативной, ни запускающей апоптоз биологической активностью. Однако сложноэфирный сукцинат витамина Е не эффективен в vivo, поскольку естественные эстеразы хозяина отщепляют сукцинатную группу, преобразуя в неэффективное противораковое средство RRR-α-токоферол.
Данные предшествующего уровня техники недостаточны из-за отсутствия эффективных способов ингибирования нежелательной или неконтролируемой клеточной пролиферации при большом ряде патофизиологических состояний, характеризующихся отсутствием или небольшим воздействием на нормальные клетки. Настоящим изобретением реализована данная давно существующая необходимость и потребность в данной области.
Сущность изобретения
Согласно одному варианту осуществления настоящего изобретения предложено соединение, имеющее структурную формулу
где Х представляет собой кислород, азот или серу; Y выбран из группы, включающей кислород, азот и серу, при этом в случае, когда Y представляет собой кислород или азот, n равно 1, и когда Y представляет собой серу, n равно 0; R1 выбран из группы, включающей алкил, алкенил, алкинил, арил, гетероарил, карбоновую кислоту, карбоксилат, карбоксамид, сложный эфир, тиоамид, сложный тиолэфир, тиолкислоту, сахарид, алкоксисвязанный сахарид, амин, сульфонат, сульфат, фосфат, спирт, эфир и нитрил; R2 выбран из группы, включающей водород, метил, бензилкарбоновую кислоту, бензилкарбоксилат, бензилкарбоксамид, сложный бензиловый эфир, сахарид и амин; R3 выбран из группы, включающей водород, метил, бензилкарбоновую кислоту, бензилкарбоксилат, бензилкарбоксамид, сложный бензиловый эфир, сахарид и амин; R4 выбран из группы, включающей метил, бензилкарбоновую кислоту, бензилкарбоксилат, бензилкарбоксамид, сложный бензиловый эфир, сахарид и амин, и R5 выбран из группы, включающей алкил, алкенил, алкинил, арил, гетероарил, карбоксил, амин и сложный эфир, где, когда Y представляет собой азот, указанный азот замещен R6, где R6 выбран из группы, включающей водород и метил; где, когда Х представляет собой кислород, R2 представляет собой метил, R3 представляет собой метил, R4 представляет собой метил и R5 представляет собой фитил, тогда R1 не является бутановой кислотой.
Согласно другому варианту осуществления настоящего изобретения предложен способ лечения клеточно-пролиферативных заболеваний, включающий введение животному фармакологически эффективной дозы соединения, имеющего структурную формулу
где Х представляет собой кислород, азот или серу; Y выбран из группы, включающей кислород, азот и серу, при этом, когда Y представляет собой кислород или азот, n равно 1, и, когда Y представляет собой серу, n равно 0; R1 выбран из группы, включающей алкил, алкенил, алкинил, арил, гетероарил, карбоновую кислоту, карбоксилат, карбоксамид, сложный эфир, тиоамид, сложный тиолэфир, тиолкислоту, сахарид, алкоксисвязанный сахарид, амин, сульфонат, сульфат, фосфат, спирт, эфир и нитрил; R2 выбран из группы, включающей водород, метил, бензилкарбоновую кислоту, бензилкарбоксилат, бензилкарбоксамид, сложный бензиловый эфир, сахарид и амин; R3 выбран из группы, включающей водород, метил, бензилкарбоновую кислоту, бензилкарбоксилат, бензилкарбоксамид, сложный бензиловый эфир, сахарид и амин; R4 выбран из группы, включающей метил, бензилкарбоновую кислоту, бензилкарбоксилат, бензилкарбоксамид, сложный бензиловый эфир, сахарид и амин, и R5 выбран из группы, включающей алкил, алкенил, алкинил, арил, гетероарил, карбоксил, амин и сложный эфир, где, когда Y представляет собой азот, указанный азот замещен с помощью R6, где R6 выбран из группы, включающей водород и метил.
Согласно еще одному варианту осуществления настоящего изобретения предложена фармацевтическая композиция, содержащая соединение, представленное здесь, и фармацевтически приемлемый носитель.
Согласно еще одному варианту осуществления настоящего изобретения предложен способ индуцирования апоптоза клетки, включающий стадию контактирования указанной клетки с фармакологически эффективной дозой соединения согласно настоящему изобретению.
Другие и дополнительные аспекты, признаки, выгоды и преимущества настоящего изобретения будут понятны из последующего описания предпочтительных воплощений изобретения, представленных с целью иллюстрации изобретения.
Краткое описание чертежей
Для того чтобы вышеперечисленные признаки, преимущества и объекты изобретения, а также остальное были бы ясны в деталях, далее следуют более конкретные описания с отсылкой к некоторым вариантам осуществления, которые проиллюстрированы прилагаемыми чертежами. Данные чертежи образуют часть описания. Следует отметить, однако, что прилагаемые чертежи иллюстрируют предпочтительные варианты осуществления изобретения и поэтому не должны рассматриваться как ограничивающие его объем.
На фиг.1 представлена общая структура токоферола, токотриенола и других соединений на основе хромана.
На фиг.2 представлены основные соединения 1-29 на основе токоферола, синтезированные и исследованные здесь.
На фиг.3А, 3В и 3С представлены основные способы органического синтеза для химической модификации хроманольных соединений по положению R1.
На фиг.4 представлены основные способы органического синтеза для химической модификации хроманольных соединений по положению R2.
На фиг.5 представлены основные способы органического синтеза для химической модификации хроманольных соединений по положению R3 и R4.
На фиг.6 представлены основные способы органического синтеза для химической модификации хроманольных соединений по положению R5.
На фиг.7 представлены основные способы органического синтеза всех рацемических аналогов 1-аза-α-токоферола. На фиг.7А представлена схема синтеза соединений 31-38 и на фиг.7В представлена схема синтеза соединений 39-43.
На фиг.8 представлены средние значения массы тела самок мышей безопухолевой линии Balb/c на 11-е сутки и на 23-и сутки изучения максимально переносимой дозы.
На фиг.9 представлено сравнение среднего процентного значения массы опухоли после лечения в раковых клетках молочной железы человека MDA МВ-435 (фиг.9А), раковых клетках предстательной железы человека DU-145 (фиг.9В) и раковых клетках толстого кишечника человека НТ-29 (фиг.9С).
Подробное описание изобретения
Следующие определения даны с целью облегчения понимания описываемого здесь изобретения. Любые термины, не определенные конкретным образом, должны интерпретироваться согласно обычным значениям терминов в данной области.
Применяемый здесь термин "индивидуум" относится к животным и человеку.
Применяемый здесь термин "биологическое ингибирование" или "ингибирование" роста пролиферирующих клеток должен включать частичное или полное ингибирование роста и также подразумевает снижение скорости пролиферации или роста клеток. Биологически ингибирующая доза композиции согласно настоящему изобретению может быть определена с помощью оценки действия исследуемого соединения на рост малигнизированных или аномально пролиферирующих клеток в культуре ткани, на рост опухоли у животных и в клеточной культуре или любым другим способом, известным специалисту в данной области.
Применяемый здесь термин "индукция запрограммированной клеточной гибели или апоптоза" включает частичную или полную гибель клетки с проявлением клетками апоптотических характеристик, определяемых морфологически и биохимически. Доза композиции согласно настоящему изобретению, индуцирующая апоптоз, может быть определена с помощью оценки эффектов исследуемого соединения, действующего на рост малигнизированных или аномально пролиферирующих клеток в культуре ткани, на рост опухоли у животных и в клеточной культуре или любым другим способом, известным специалисту в данной области.
Применяемый здесь термин "индукция остановки клеточного цикла" должен включать остановку роста в результате задержки обработанных клеток на стадии GO/G1 или G2/M клеточного цикла. Доза композиции согласно настоящему изобретению, индуцирующая остановку клеточного цикла, может быть определена с помощью оценки действия исследуемого соединения на рост малигнизированных или аномально пролиферирующих клеток в культуре ткани, на рост опухоли у животных и в клеточной культуре или любым другим способом, известным специалисту в данной области.
Применяемый здесь термин "индукция клеточной дифференцировки" должен включать остановку роста в результате индуцирования прохождения обработанными клетками стадии клеточной дифференцировки, в ходе которой не происходит пролиферации клеток. Доза композиции согласно настоящему изобретению, индуцирующая дифференцировку клеток, может быть определена с помощью оценки действия исследуемого соединения на рост малигнизированных или аномально пролиферирующих клеток в культуре ткани, на рост опухоли у животных и в клеточной культуре, или любым другим способом, известным специалисту в данной области.
Настоящее изобретение относится к токоферолам, токотриенолам и другим хромановым производным вместе с производными по насыщенной фитильной или ненасыщенной изопренильной боковым цепям или без них, и их аналогам, например азо- и тиоловым аналогам. Применяя эфирные и некоторые другие химические связи для присоединения различных последовательностей к токоферолу, токотриенолу и другим хромановым производным, получали новые противоопухолевые соединения для применения в vivo. Основные структуры новых соединений согласно настоящему изобретению представлены на фиг.1, предпочтительные соединения представлены на фиг.2, и возможные пути их синтеза представлены на фиг.3-7. Новые свойства данных молекул включают введение функциональных групп в хромановую структуру по положениям R1-R5 и введение функциональных групп в фитильную и изопренильную боковые цепи, в частности в соединения на основе токоферолов и токотриенолов (фиг.1). Кроме того, представлены соединения с гетероатомными заместителями (N или S) кислорода хроманового кольца (фиг.7). Особенно предпочтительные соединения включают 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (1), 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)пропионовую кислоту (2), 2,5,8-триметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислому (7), 2,7,8-триметил(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (8), 2,8-диметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (9), 2-(N,N-(карбоксиметил)-2-(2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (12), 2,5,7,8-тетраметил-(2RS-(4RS,8RS,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (15), 2,5,7,8-тетраметил-2R-(2RS,6RS,10-триметилундецил)хроман-6-илокси)уксусную кислоту (17), хлорид 3-(2,5,7,8-тетраметил-(2R-(4R,8,12-триметилтридецил)хроман-6-илокси)пропил-1-аммония (19), 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-3-ен-6-илокси)уксусную кислоту (20), сульфат 2-(2,5,7,8-тетраметил-(2R-(4R,8,12-триметилтридецил) хроман-6-илокси)триэтиламмония (21), 6-(2,5,7,8-тетраметил-(2R-(4R,8,12-триметилтридецил)хроман)уксусную кислоту (22), 2,5,7,8-тетраметил-(2R-(гептадецил)хроман-6-илокси)уксусную кислоту (25), 2,5,7,8-тетраметил-2R-(4,8-диметил-1,3,7-EZ-нонотриен)хроман-6-илокси)уксусную кислоту (26), E,Z,RS,RS-(фитилтриметилбензолтиол-6-илокси)уксусную кислоту (27), 1-аза-α-токоферол-6-илоксилуксусную кислоту (39), 1-аза-α-токоферол-6-илоксилметилацетат (40), 1-аза-N-метил-α-токоферол-6-илоксилметилацетат (41), 1-аза-N-метил-α-токоферол-6-илоксилуксусную кислоту (42), 6-(2,4-динитрофенил)азо-(2,5,7,8-тетраметил)-2-(4,8,12-триметилтридецил)-1,2,3,4-тетрагидрохинолин (43).
Фармакодинамически полученные соединения согласно настоящему изобретению обладают улучшенным терапевтическим индексом и являются эффективными ингибиторами роста раковых клеток, т.е. они проявляют высокую противоопухолевую активность с минимальными побочными эффектами. Указанные соединения, которые не могут легко разлагаться, поскольку у млекопитающих отсутствуют известные эстеразы, могут применяться при лечении злокачественных опухолей и расстройств, характеризующихся избытком клеточной пролиферации, а также в отношении клеток, увеличивающихся в количестве в результате супрессии механизмов гибели клеток, с минимальными побочными эффектами. Соединения согласно настоящему изобретению ингибируют рост раковых клеток с помощью индукции апоптоза и остановки синтеза ДНК. Индукция апоптоза данными соединениями опосредуется активацией TGF-β, стресс-киназы и путей передачи сигнала лиганда Fas/Fas. He исключается индукция апоптоза другими путями, например с помощью продукции церамида. Данные свойства ингибирования роста позволяют применять данные соединения для лечения пролиферативных заболеваний, включая злокачественные опухоли различных клеточных типов и происхождения, ненеопластических гиперпролиферативных заболеваний и расстройств с дефектами путей передачи сигнала к апоптозу. Несколько соединений согласно настоящему изобретению являются как сильными индукторами апоптоза, так и сильными ингибиторами синтеза ДНК в малигнизированных клетках, представляющих собой клетки различного происхождения.
Проиллюстрировано терапевтическое применение соединений согласно настоящему изобретению для лечения злокачественных опухолей и других заболеваний и расстройств, характеризующихся избытком клеточной пролиферации или неспособностью клеток к гибели. Новые производные (таблицы 1 и 2), показанные при концентрации ЕС50, индуцируют апоптоз раковых клеток молочной железы человека (раковых клеток молочной железы MDA MB 435, MDA MB 231 и MCF-7), раковых клеток предстательной железы человека (PC-3, DU-145 и LnCaP), раковых клеток яичника человека (С-170), раковых клеток шейки матки человека (МЕ-180), эндометриальных клеток человека (RL-95-2), лимфоидных клеток человека (миеломы, Raji, Ramos, Jurkat и HL-60), раковых клеток толстого кишечника (НТ29 и DLD-1) и раковых клеток легких (А-549). Новые производные не демонстрируют индукцию апоптоза нормальных эпителиальных клеток молочной железы человека (НМЕС) и иммортализованных, но не онкогенных, клеток молочной железы MCF-10A.
Данные новые соединения и способы согласно настоящему изобретению могут применяться для лечения неопластических заболеваний и ненеопластических заболеваний. Типичными примерами неопластических заболеваний являются рак яичника, рак шейки матки, рак эндометрия, рак мочевого пузыря, рак легких, рак молочной железы, рак предстательной железы, рак яичек, глиомы, фибросаркомы, ретинобластомы, меланомы, саркомы мягких тканей, остеосаркомы, рак толстого кишечника, карцинома почки, рак поджелудочной железы, базально-клеточная карцинома и плоскоклеточная карцинома. Типичные примеры ненеопластичеких заболеваний выбраны из группы, включающей псориаз, доброкачественные пролиферативные заболевания кожи, ихтиоз, папиллому, рестеноз, склеродермию и гемангиому.
Соединения и способы согласно настоящему изобретению могут применяться для лечения ненеопластических заболеваний, развивающихся в результате неспособности отдельных клеток нормально пройти запрограммированную клеточную гибель или апоптоз. Типичными примерами заболеваний и расстройств, возникающих в результате неспособности клеток к гибели, являются аутоиммунные заболевания. Аутоиммунные заболевания характеризуются повреждением собственных клеток, тканей и органов клетками иммунной системы. Типичная группа аутоиммунных заболеваний включает аутоиммунный тиреоидит, рассеянный склероз, тяжелую миастению, системную красную волчанку, герпетиформный дерматит, целиакию и ревматоидный артрит. Данное изобретение не ограничивается аутоиммунными заболеваниями, а включает все расстройства, имеющие иммунный компонент, такие как воспалительный процесс при образовании сердечно-сосудистых бляшек или кожные повреждения, вызванные ультрафиолетовым облучением.
Соединения и способы согласно настоящему изобретению могут применяться для лечения расстройств и заболеваний, развивающихся в результате вирусной инфекции. Типичными примерами заболеваний и расстройств, возникающих в результате вирусных инфекций, являются вирусы иммунодефицита человека (ВИЧ). Поскольку данные соединения участвуют в работе внутриклеточных путей передачи сигнала, они способны влиять на наружный клеточный сигнал любого типа, такой как цитокины, вирусы, бактерии, токсины, тяжелые металлы и т.п.
Способы согласно настоящему изобретению могут применяться для лечения любых животных. Более предпочтительно, способы согласно настоящему изобретению применимы для человека.
В основном для фармакологически эффективного достижения клеточной гибели и антипролиферативного эффекта данные соединения и их аналоги могут вводиться в любой терапевтически эффективной дозе. Предпочтительно структурно-модифицированные токоферолы и токотриенолы и аналоги вводят в дозе приблизительно от 0,1 до 100 мг/кг. Более предпочтительно структурно модифицированные токоферолы и токотриенолы и аналоги вводят в дозе приблизительно от 0,1 до 10 мг/кг.
Введение композиций согласно настоящему изобретению может проводиться местным, внутриглазным, парентеральным, пероральным, интраназальным, внутривенным, внутримышечным, подкожным или любым другим подходящим путем. Вводимая доза зависит от возраста, клинической стадии и тяжести заболевания или генетической предрасположенности индивидуума, расположения, массы тела, вида сопутствующего лечения, если оно имеет место, и природы патологического или злокачественного состояния. Эффективная система доставки, пригодная для способа согласно настоящему изобретению, может применяться в таких формах как капсулы, таблетки, жидкие растворы, суспензии или эликсиры для перорального применения или стерильные жидкие формы, такие как растворы, суспензии или эмульсии. Для местного применения могут использоваться такие формы, как мази, кремы или спреи. Предпочтительно применяется любой инертный носитель в комбинации с подходящими растворителями, такими как солевой раствор или фосфатный буферный солевой раствор, или любой носитель, такой как этанол, ацетон или ДМСО, в котором соединения, применяемые в данном способе согласно настоящему изобретению, обладают подходящими свойствами растворимости.
Существует большое количество патологических злокачественных и незлокачественных клеточно-пролиферативных состояний и накопления клеток в результате отсутствия нормального процесса клеточной гибели, для которых композиции и способы согласно настоящему изобретению будут обеспечивать терапевтический успех. Данные патологические состояния могут наблюдаться почти во всех типах клеток, способных к аномальной клеточной пролиферации или дефектных в отношении механизмов запрограммированной клеточной гибели. Среди типов клеток, которые проявляют способность к патологическому или аномальному росту или аномальной гибели, представлены (1) фибробласты, (2) эндотелиальные клетки сосудов и (3) эпителиальные клетки. Из вышесказанного можно увидеть, что способы согласно настоящему изобретению пригодны для лечения местных или системных патологических состояний во всех или почти во всех системах органов и тканей индивидуумов.
Специально предусмотрено, что фармацевтические композиции могут быть получены с помощью новых соединений на основе хромана и их производных и аналогов согласно настоящему изобретению. В таком случае фармацевтическая композиция содержит новые соединения согласно настоящему изобретению и фармацевтически приемлемый носитель. Специалисту в данной области будет легко определить без большого числа экспериментов соответствующие дозы и пути введения соединений и аналогов согласно настоящему изобретению.
Таким образом, настоящее изобретение направлено на создание и эффективное применение новых соединений, которые могут специфически воздействовать на раковые клетки и также отрицательно регулировать сигналы, стимулирующие рост, положительно регулировать сигналы, ингибирующие рост, отрицательно регулировать сигналы, способствующие выживаемости, и/или положительно регулировать сигналы, приводящие к гибели. Более конкретно, в данном изобретении разработаны и описаны новые соединения, активирующие факторы ингибирования роста, запускающие пути передачи сигнала к гибели и ингибирующие синтез ДНК.
Следующие примеры представлены с целью иллюстрации различных вариантов осуществления изобретения и не ограничивают изобретение каким-либо образом.
Пример 1
Методы органического синтеза
Синтез ряда токоферола, токотриенола и других хромановых производных, содержащих или не содержащих производных по насыщенной фитильной или ненасыщенной изопренильной боковым цепям, и их аналогов возможен с помощью структурных модификаций хромановой кольцевой системы (фиг.3-6) и гетероатомных заместителей (N или S) кислорода хроманового кольца (фиг.7А и 7В). Структурные переменные R1, R2, R3, R4, R5 и Х представляют группы на хромановой системе, которые изменяемы, и Y представляет либо кислород, либо гетероатомные заместители (N или S) кислорода хроманового кольца. Используя химические реакции алкилирования, можно синтезировать большое количество соединений, содержащих различные группы R1, особенно когда Х представляет собой кислород. После алкилирования дальнейшая химическая модификация групп R1 позволяет синтезировать большой диапазон новых соединений. Бромирование метильных групп бензила хроманового кольца обеспечивает промежуточные соединения, которые допускают варьирование групп R2, R3 и R4. Также возможно варьирование группы R5, особенно исходя из коммерчески доступной 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты. В случае присутствия азотного гетероатомного заместителя кислорода хроманового кольца, азот может быть замещен с помощью R6, который представляет собой водород или метил. Замена Х на группы, отличные от кислорода, которые идентичны Х в токоферолах и токотриенолах, может выполняться с помощью химических реакций с палладием (для Х=СН2) и нуклеофильного ароматического замещения (для X=N или S). Другие возможные модификации хромановой структуры включают ненасыщенное состояние по положениям 3-4 и сужение цикла для получения пятичленного фуранильного кольца.
Используемые реагенты могут быть как коммерчески доступными, так и полученными согласно известным способам. Безводный СН2Cl2 и ТГФ получали с помощью дистилляции. Все другие применяемые растворители представляли собой реагенты. Безводные условия реакции поддерживали в слабо положительной атмосфере аргона в высушенной в печи стеклянной посуде. Хроматографию на силикагеле проводили через силикагель с 230-400 меш, приобретенный в ЕМ Science. Обычные спектры 1Н- и 13С-ЯМР получали на спектрометре Varian Unity при частотах 300,132 МГц и 75,033 МГц соответственно. Спектр ЯМР регистрировали с контролем с ТМС (0 м.д.) или с пиком CDCl3 с изотопными примесями (7,26 и 77,0 м.д. для 1H и 13С соответственно). Высокоразрешающую электронную масс-спектроскопию с ударной ионизацией проводили в Mass Spectrometry Center в University of Texas at Austin.
Пример 2
Синтез и характеристики нового соединения токоферола-2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусной кислоты (1)
Раствор R,R,R-α-токоферола (0,5 г, 1,16 ммоль) в N.N-диметилформамиде (20 мл) обрабатывали метилбромацетатом (3,4 г, 8,3 ммоль) и избытком порошкообразного NaOH (1,2 г, 30 ммоль). Полученную желтую суспензию энергично перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь подкисляли с помощью 5 н. HCl и экстрагировали диэтиловым эфиром (3×30 мл). Объединенные эфирные фазы промывали с помощью H2O (3×30 мл) и солевым раствором (1×30 мл) и затем сушили над Na2SO4. Раствор эфира концентрировали до желтой маслянистой жидкости, которую очищали с помощью хроматографии на силикагеле, проводя элюирование 19 об.% EtOAc и 2% уксусной кислотой в гексане. Полученную желтую жидкость растворяли в диэтиловом эфире (30 мл), промывали Н2O (3×20 мл) и солевым раствором (1×20 мл) и затем сушили над Na2SO4. Полученный раствор концентрировали до светло-желтой маслянистой жидкости и сушили в вакууме в течение 48 ч. В результате получали соединение 1 в виде воскообразного не совсем белого твердого вещества (0,50 г, 88%). 1H-ЯМР (CDCl3/ТМС, м.д.): 0,87 (м, 12Н, 4а'-, 8а'-, 12а'-, 13'-СН3), 1,0-1,6 (м, 24Н, 4'-, 8'-, 12'-СН, 1'-, 2'-, 3'-, 5'-, 6'-, 7'-, 9'-, 10'-,11'-CH2, 2а-СН3), 1,81 (м, 2Н, 3-СН2), 2,07, 2,14, 2,16 (3 х с, 9Н, 5а-, 7а-, 8а-СН3), 2,59 (т, J=6,6 Гц, 2Н, 4-СН2), 4,34 (с, 2Н, ОСН2); 13С-ЯМР (CDCl3, м.д.): 11,7, 11,8, 12,7 (5а-, 7а-, 8а-СН3), 19,6, 19,7 (СН3), 20,6, 21,0 (СН2), 22,6, 22,7 (СН3), 23,8 (2а-СН3), 24,4, 24,8 (СН2), 28,0 (СН), 31,2 (3-СН2), 32,7, 32,8 (СН), 37,3, 37,4, 37,5, 39,4, 40,0 (СН2), 69,2 (ОСН2), 75,0 (2-С), 117,8, 123,2, 125,4, 127,3 (арил С), 147,0, 148,5 (арил С-O), 173,7 (СООН); HRMS (CI, m/z): 489,394374 (М+Н+), вычисл. для С31Н53O4 489, 394386). Все определения были подтверждены с помощью HMQC, DEPT-135 и 1H-NOSEY.
Соединения 2-6 синтезировали способом, индентичным синтезу соединения 1, используя соответствующие бромалкановые кислоты.
2,5,7,8-Тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман)-6-илокси)пропионовая кислота (2)
(выход 89%). 1H-ЯМР (CDCl3/TMC, м.д.): 0,87 (м, 12Н, 4а'-, 8а'-, 12а'-, 13'-СН3), 1,0-1,6 (м, 24Н, 4'-, 8'-, 12'-СН, 1'-, 2'-, 3'-, 5'-, 6'-, 7'-, 9'-, 10'-, 11'-СН2, 2а-СН3), 1,81 (м, 2Н, 3-СН2), 2,09, 2,14, 2,19 (3 х с, 9Н, 5а-, 7а-, 8а-СН3), 2,59 (т, J=6,6 Гц, 2Н, 4-СН2), 2,85 (т, J=6,4 Гц, 2Н, СН2СООН), 3,96 (т, J=6,4 Гц, 2Н, ОСН2); 13С-ЯМР (CDCl3, м.д.): 11,7, 11,8, 12,7 (5а-, 7а-, 8а-СН3), 19,6, 19,7 (СН3), 20,6, 21,0 (СН2), 22,6, 22,7 (СН3), 23,8 (2а-СН3), 24,4, 24,8 (СН2), 28,0 (СН), 31,2 (3-СН2), 32,7, 32,8 (СН), 35,1, 37,3, 37,4, 37,5, 39,4, 40,0 (СН2), 67,5 (ОСН2), 74,8 (2-С), 117,5, 122,9, 125,8, 127,8 (арил С), 147,6, 148,0 (арил С-O), 177,1 (СООН); HRMS (CI, m/z): 503, 408610 (М+Н)+, вычисл. для С32Н55O4 503,410036.
2,5,7,8-Тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)бутановая кислота (3)
(выход 85%). 1H-ЯМР (CDCl3/TMC, м.д.): 0,87 (м, 12Н, 4а'-, 8а'-, 12а'-, 13'-СН3), 1,0-1,6 (м, 26Н, 4'-, 8'-, 12'-СН, 1'-, 2'-, 3'-, 5'-, 6'-, 7'-, 9'-, 10'-, 11'-СН2, 2а-СН3), 1,81 (м, 2Н, 3-СН2), 2,14, 2,17, 2,21 (3 х с, 9Н, 5а-, 7а-, 8а-СН3), 2,62 (т, J=6,6 Гц, 2Н, 4-СН2), 2,72 (т, J=7,2 Гц, 2Н, СН2СООН), 3,74 (т, J=6,1 Гц, 2Н, ОСН2); 13С-ЯМР (CDCl3, м.д.): 11,7, 11,8, 12,7 (5а-, 7а-, 8а-СН3), 19,6, 19,7 (СН3), 20,6, 21,0 (СН2), 22,6, 22,7 (СН3), 23,9 (2а-СН3), 24,4, 24,8, 25,3 (СН2), 28,0 (СН), 30,9, 31,2 (3-СН2), 32,7, 32,8 (СН), 37,3, 37,4, 37,5, 39,4, 40,0 (СН2), 71,3 (ОСН2), 74,8 (2-С), 117,5, 122,9, 125,7, 127,7 (арил С), 147,8, 147,9 (арил С-O), 178,9 (СООН); HRMS (CI, m/z): 516,424374 (М+Н)+, вычисл. для С33Н57O4 516,424386.
2,5,7,8-Тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)валериановая кислота (4)
(выход 90%). 1H-ЯМР (CDCl3/TMC, м.д.): 0,87 (м, 12Н, 4а'-, 8а'-, 12а'-, 13'-СН3), 1,0-1,6 (м, 28Н, 4'-, 8'-, 12'-СН, 1'-, 2'-, 3'-, 5'-, 6'-, 7'-, 9'-, 10'-, 1'-СН2, 2а-СН3), 1,81 (м, 2Н, 3-СН2), 2,09, 2,14, 2,18 (3 х с, 9Н, 5а-, 7а-, 8а-СН3), 2,49 (т, J=6,8 Гц, 2Н, СН2СООН), 2,59 (т, J=6,6 Гц, 2Н, 4-СН2), 3,68 (т, J=5,5 Гц, 2Н, ОСН2); 13С-ЯМР (CDCl3, м.д.): 11,7, 11,8, 12,7 (5а-, 7а-, 8а-СН3), 19,6, 19,7 (СН3), 20,6, 21,0, 21,4 (СН2), 22,6, 22,7 (СН3), 23,8 (2а-СН3), 24,4, 24,8 (СН2), 28,0 (СН), 30,0 (СН2), 31,2 (3-СН2), 32,7, 32,8 (СН), 35,8, 37,3, 37,4, 37,5, 39,4, 40,0 (СН2), 72,2 (ОСН2), 74,9 (2-С), 117,8, 123,2, 125,4, 127,3 (арил С), 147,6, 148,3 (арил С-O), 178,7 (СООН); HRMS (CI, m/z): 530,433514 (М+Н)+, вычисл. для С34Н59O4 530, 433516.
2,5,7,8-Тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)гексановая кислота (5)
(выход 77%). 1H-ЯМР (CDCl3/ТМС, м.д.): 0,87 (м, 12Н, 4а'-,8а'-, 12а'-, 13'-СН3), 1,0-1,6 (м, 30Н, 4'-, 8'-, 12'-СН, 1'-, 2', 3'-, 5'-, 6'-, 7'-, 9'-, 10'-, 11'-СН2, 2а-СН3), 1,81 (м, 2Н, 3-СН2), 2,08, 2,12, 2,16 (3 х с, 9Н, 5а-, 7а-, 8а-СН3), 2,32 (т, J=6,5 Гц, 2Н, CH2COOH), 2,57 (т, J=6,6 Гц, 2Н, 4-СН2), 3,64 (т, J=5,5 Гц, 2Н, ОСН2); 13С-ЯМР (CDCl3, м.д.): 11,8, 11,9, 12,7 (5а-, 7а-, 8а-СН3), 19,6, 19,7 (СН3), 20,6, 21,0 (CH2), 22,6, 22,7 (СН3), 23,8 (2а-СН3), 24,4, 24,6, 24,8, 25,7 (СН2), 28,0 (СН), 30,0 (СН2), 31,3 (3-СН3), 32,7, 32,8 (СН), 34,0, 37,3, 37,3, 37,4, 39,3, 40,0 (СН2), 72,6 (ОСН2), 74,7 (2-С), 117,4, 122,7, 125,4, 127,8 (арил С), 147,6, 148,2 (арил С-O), 179,6 (СООН); HRMS (CI, m/z): 545, 457026 (М+H)+,вычисл. для С35Н61O4 545, 456986.
2,5,7,8-Тетраметил-2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)октановая кислота (6)
(выход 91%). 1H-ЯМР (CDCl3/TMC, м.д.): 0,87 (м, 12Н, 4а'-, 8а'-, 12а'-, 13'-СН3), 1,0-1,6 (м, 34Н, 4'-, 8'-, 12'-СН, 1'-, 2'-, 3'-, 5'-, 6'-, 7'-, 9'-, 10'-, 11'-CH2, 2а-СН3), 1,81 (м, 2Н, 3-СН2), 2,08, 2,11, 2,16 (3 х с, 9Н, 5а-, 7а-, 8а-СН3), 2,36 (м, 2Н, СН2СООН), 2,58 (т, J=6,6 Гц, 2Н, 4-СН2), 3,62 (т, J=5,5 Гц, 2Н, ОСН2); 13С-ЯМР (CDCl3, м.д.): 11,7, 11,8, 12,7 (5а-, 7а-, 8а-СН3), 19,6, 19,7 (СН3), 20,6, 21,0 (СН2), 22,6, 22,7 (СН3), 23,8 (2а-СН3), 24,4, 24,6, 24,8, 25,1, 25,7, 26,6 (CH2), 28,0 (СН), 30,0 (СН2), 31,3 (3-СН2), 32,7, 32,8 (СН), 34,0, 37,3, 37,3, 37,4, 39,3, 40,0 (СН2), 72,7 (ОСН2), 74,6 (2-С), 117,6, 122,8, 125,5, 127,6 (арил С), 147,5, 148,3 (арил С-O), 179,4 (СООН); HRMS (CI, m/z): 573,484396 (М+Н)+, вычисл. для С37Н65O4 573, 488286.
2,5,8-Триметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусная кислота (7)
Раствор R,R,R-α-токоферола (75 мг, 0,18 ммоль) в N,N-диметилформамиде (2 мл) обрабатывали метилбромацетатом (0,4 г, 2,8 ммоль) и избытком порошкообразного NaOH (0,5 г, 12,5 ммоль). Полученную желтую суспензию энергично перемешивали в течение 24 ч при комнатной температуре. Реакционную смесь подкисляли с помощью 5 н. HCl и экстрагировали диэтиловым эфиром (3×10 мл). Объединенные эфирные фазы промывали Н2О (3×10 мл) и солевым раствором (1×10 мл) и затем сушили над Na