Применение ретигабина для невропатических болей
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и касается применения соединения формулы I для лечения невропатических болей. Соединение I (ретигабин) обладает высокой эффективностью для лечения аллодинии; болей, обусловленных гипералгезией; фантомных болей; невропатической боли при диабетической невропатии; невропатической боли при мигрени. Соединение малотоксично и обладает высокой биодоступностью. 6 з.п. ф-лы, 1 табл.
Реферат
Изобретение относится к применению 2-амино-4-(4-фторбензиламино)-1-этоксикарбониламинобензена формулы I
(согласно INN: ретигабин)
или к его применимым в фармацевтике солям для профилактики и лечения невропатических болей.
Понятие "невропатическая боль", такая как аллодиния и гипералгезия, обозначает особый вид болевой чувствительности, отличающейся от обычного восприятия болевых раздражении. Пациенты, страдающие гипералгезией, воспринимают болевые раздражения гораздо тяжелее по сравнению со здоровыми людьми. Понятием "аллодиния" называют феномен восприятия боли, возникающей при контакте с определенным объектом либо под воздействием тепла или холода, т.е. обусловленной факторами, которые как таковые не являются болевыми раздражителями. Такие ощущения проявляются иногда в очень сильной степени и переносятся человеком тяжело.
Это неадекватное восприятие боли в различных языках интерпретируется по-разному с использованием терминов, которые в их значении частично перекрывают друг друга, но далеко не во всех случаях являются синонимами. Так, в частности, в немецком языке общеприняты понятия "Allodynia", (аллодиния), "Paraesthesie" (парестезия), "Hyperesthesie" (гиперестезия), "Hyperalgesie" (гипералгезия) и "Phantomschmerz" (фантомная боль), тогда как в английском языке наряду с понятиями "allodynia", "hyperalgesia" и "phantom limb pain" используются также понятия "reflex sympathetic distrophy" (RSD) (Rogers and Valley, 1994) и "sympathetically maintained pain" (SMP) (J.N. Rogers, M.A. Valley, Reflex sympathetic distrophy; Clin. Pediatr. Med. Surg. 11(1), стр.73-83 (январь 1994)).
Под аллодинией имеется в виду сверхнеприятное вплоть до проявления болевых ощущений восприятие тепловых или вызываемых соприкосновением с соответствующими объектами раздражений, обусловленное снижением порога болевой чувствительности только в случае таких стимуляторов. Под гипералгезией подразумевается крайне повышенное восприятие болевых раздражений самого разного типа, являющихся самими по себе таковыми, что также обусловлено снижением порога болевой чувствительности. Под фантомной болью имеются в виду болевые ощущения, источник которых отсутствует, например, после ампутации конечности, т.е. боль, локализуемая человеком в отсутствующей конечности. В научной литературе для этого типа болевых ощущений часто используют обобщенное понятие "опосредованная невропатическая боль". Характерным при этом является тот факт, что собственно болевые ощущения обусловлены не наличием вызывающего обычную боль раздражителя, а генерируются периферической или центральной нервной системой, поскольку механизм воспринимающей и проводящей боль системы работает в этих условиях иначе. В отличие от других форм боли невропатическая боль в большинстве случаев носит хронический характер и обычно не поддается или плохо поддается лечению классическими анальгетиками, такими как опиоиды.
К заболеваниям, при которых наблюдается измененный механизм воспринимающей и проводящей боль системы, относятся среди прочих следующие:
1. Классические последствия при инфекционном заболевании Herpes zoster (опоясывающий лишай) описаны как длительная, устойчивая аллодиния (H.L. Fields, M. Rowbotham, R. Baron, Postherpetic neuralgia: irritable nociceptors and diafferentation, Neurobiol. Dis. 5(4) стр. 209-227 (октябрь 1998)).
2. У пораженных СПИДом пациентов на различных стадиях заболевания появляются болевые ощущения, которые относятся к разновидностям гипералгезии и которые необходимо четко отличать от ноцицептивной боли (т.е. боли, вызываемой болевыми раздражителями) (M. Lefkowitz, Pain management for the AIDS patient, J. Fla. Med. Assoc. 83(10), стр. 701-704 (декабрь 1996)).
3. Ожоговые раны приводят к возникновению в пораженных частях тела невропатической гипералгезии, и хотя вызвавшая боль причина (высокая температура) уже устранена, ожоговые раны часто являются крайне болезненными.
4. После терапии высокими дозами цитостатиков, применяемых при лечении рака, от пациентов часто также приходится слышать жалобы на болевые ощущения (J.M. Brant, Cancer-related neuropathic pain, материалы Nurse Pract. Forum 9(3), стр. 154-162 (сентябрь 1998)). К.Д. Таннеру и другим (K..D. Tanner, D.В. Reichling, J.D. Levine, Nociceptor hyper-responsiveness during vincristineinduced painful peripheral neuropathy in the rat. J. Neurosci 18(16), стр. 6480-6491 (15 августа 1998)) удалось доказать, что причина болей, возникающих в связи с лечением винкристином, обусловлена повышенной возбудимостью периферических болевых рецепторов, или, иными словами, имеет место гипералгезия.
5. Опухолевое заболевание как таковое может также вызвать (например, в результате хронического сдавления нервов опухолью) невропатические боли, относящиеся к разновидностям гипералгезии (J.M. Brant, Cancer-related neuropathic pain, материалы Nurse Pract. Forum 9(3), стр. 154-162 (сентябрь 1998)).
6. Невралгия тройничного нерва является одной из широко распространенных форм гипералгезии, которая часто проявляется без видимого повреждения нервов (K..J. Burchiel, Trigeminal neuropathic pain, материалы Acta Neurochir. Suppl. 58, стр.145-149, Вена (1993).
7. У больных диабетом во время болезни часто в форме позднего повреждения появляется гипералгезия. Больные жалуются на сильные боли конечностей при одновременном снижении тактильности кожи (D.S. Bell, Lower limb problems in diabetic patients. What are the causes? What are the remedies? Postgrad. Med. 89(8), стр.237-240, 243-244 (июнь 1991)).
8. Возникающую при фибромиалгии диффузную боль также относят к формам аллодинии (I.J. Russel, Advances in fibromyalgia: possible role for central neurochemicals. Am. J. Med. Sci. 315(6), стр.377-384 (июнь 1998)).
9. Еще одним заболеванием, при котором наблюдаются симптомы гипералгезии и аллодинии, является вульводиния. Это заболевание характеризуется хроническими ложными ощущениями (жжением, покалыванием, зудом) в области вульвы при отсутствии возбудителей инфекции, которые могли быть причиной таких явлений (T.G. Bohl и др., Vulvodymia and its differential diagnoses, Semin. Cutan. Med. Surg. 17(3), стр.189-195 (сентябрь 1998)).
10. У пациентов с хроническими болями в спине часто можно наблюдать компрессию (сдавление, защемление) нервных корешков спинного мозга. Помимо хронических болей это компрессионное повреждение нервных корешков проявляется также в неприятных, спонтанно возникающих сенсорных ощущениях (парестезия). Даже после устранения сдавления хирургическим путем многие пациенты продолжают тем не менее жаловаться на болевые ощущения. Такие повторяющиеся ощущения относят к невропатическим болям и, поставив соответствующий диагноз, можно четко определить их отличие от других (воспалительных) форм боли (J. Sorensen, M. Bengtsson, Intravenous phentolamine test - an aid in the evaluation of patients with persistent pain after lowback surgery? материалы Acta Anaesthesiol. Scand. 41(5), стр.581-585 (май 1997)).
11. У 10-20% пациентов с повреждениями спинного мозга в ряде случаев появляются очень сильные болевые ощущения, которые из-за недостатка неповрежденного спинного мозга генерируются в головном мозге и не могут быть соотнесены с болевым стимулом. Такая боль считается главной невропатической болью (Р.К. Eide, Pathophysiological mechanismum of central neuropathic pain after spinal cord injury, Spinal Cord. 36(9), стр.601-612 (сентябрь 1998)).
12. Возникающая после ампутации боль по своим характерным признакам является невропатической болью (A. Hill, Phantom limb pain: a review of the literature on attributes and potential mechanismus, J. Pain Symptom Manage 17(2), стр.125-142 (февраль 1999)).
13. Внутренние органы также могут быть источником гипералгезии (Е.А. Mayer, G.F. Gabhart, Basic and clinical aspects of visceral hyperalgesia [см. комментарий в Gastroenterology 180(2), стр.618 (февраль 1995)], Gastroenterology 107(1), стр.271-293 (июль 1994 г.)). Пациенты с такой формой гипералгезии страдают от несоразмерных ощущений физиологических реакций в различных участках желудочно-кишечного тракта, таких, например, как чувство переполнения желудка, боли в желудке или вздутия, хотя соответствующие патологические причины подобных ощущений отсутствуют.
Как уже указывалось выше, повышенная или неадекватная реакция на боль является симптомом самых разных заболеваний, и невозможно дать однозначный ответ на вопрос, имеет ли место какой-либо единый для всех случаев патогенез. Такое разнообразие болевых ощущений подтверждается и тем, что неадекватная реакция на боль может проявляться совершенно по-разному. Общим, однако, для всех этих реакций на боль является то, что морфин либо вовсе не дает никакого эффекта, либо достичь положительный эффект можно лишь при использовании таких дозировок, которые вызывают нежелательные побочные действия. Факторы, обусловливающие реакцию на боль, могут быть самыми разными.
Так, в частности, для пациентов с аллодинией, индуцированной герпесом, достаточно сквозняка, чтобы вызвать у них жгучие боли. При лечении этих пациентов следует исходить из того, что возбудители каким-то образом повреждают нейроны, в результате чего снижается порог болевой чувствительности. В случае диабета предполагается, что недостаточное снабжение нервов кислородом и питательными веществами вследствие микроангиопатии приводит к хроническому повреждению нервов. Это повреждение вызывает в свою очередь процесс регенерации, проявляющийся в почковании нервных волокон.
Процессы перестройки в спинном мозге, равно как и в периферической нервной системе рассматриваются многими авторами в качестве возможной причины гипералгезии (см., например, A.I. Basbaum, Spinal mechanismus of acute and persistent pain, Reg. Anesth. Pain Med. 24(1), стр. 59-67 (январь-февраль 1999)). В результате хронической компрессии (сдавления) нервов последние повреждаются, однако полностью не разрушаются. В острых случаях компрессии возбуждается локальный болевой сигнал, тогда как при хронической компрессии индуцируются факторы транскрипции в теле клетки (а тем самым вне участка компрессии в спинном мозге), и такая индукция продолжается в течение нескольких недель. Нейропептиды, такие как субстанция Р, активируют почкование нервных волокон, а также не пораженные соседние нейроны. Кроме того, было установлено, что тела нервных клеток экспрессируют с повышенным уровнем норадреналиновые рецепторы. В результате этого нейроны могут спонтанно, без внешнего импульса активироваться и спонтанно вызывать болевые ощущения.
После внешнего стимулирования к головному мозгу направляются не отдельные импульсные разряды, а непрерывные разряды (Т. Herdegen, М. Zimmermann, Immediate erali genes (IEGs) incoding inducible transcription factors (ITFs) and neuropeptides in the nervous system: functional networks for long-term plasticity, опубликовано в Neuropeptides in the spinal cord (под ред. F. Nyberg, H.S. Sharma, Z. Wiesenfeld-Hallin), Progress in Brain Research, том 104, стр. 299-321, изд-во Elsevier Piblishers, Amsterdam (1995)).
Участие норадреналиновых рецепторов, вещества-переносчика симпатической нервной системы, дает основание говорить о "поддержании" этой системой боли, поскольку в результате физиологического активирования симпатической нервной системы активируются и эти нейроны. Поэтому в английском языке широкое распространение получило понятие "reflex sympathetic distrophy" (RSD) (J.N. Rogers, M.A. Valley, Reflex sympathetic distrophy, Clin. Pediatr. Med. Surg. 11(1), стр. 73-83 (январь 1994)) или "sympathetically maintained pain" (SMP).
Цитостатики, такие как винкристин, непосредственно повышают возбудимость болевых рецепторов периферической нервной системы и предположительно вызывают таким образом гипералгезию (К.D. Tanner, D.В. Reichling, J.D. Levine, Nociceptor hyper-responsiveness during vincristine-induces painful peripheral neuropathy in the rat, J. Neurosci. 18(16), стр.6480-6491 (август 1998)).
В экспериментах на животных специалисты пытались выяснить основные общие механизмы гипералгезии. Когда у крыс частичной лигатурой одного из отходящих от спинного мозга нервов вызывалась обнаруживаемая периферически сильная гипералгезия, в спинном мозге удавалось выявить группы сверхактивных нейронов в виде аномально (эктопически) спонтанно активных очагов (H.L. Pan, J.C. Eisenach, S.R. Chen, Gabapentin suppresses ectopic nerve discharges and reverses allodynia in neuropathic rats, J. Pharmacol. Exp. Ther. 288(3), стр.1026-1030 (март 1999)). Введением в соответствующих дозах габапентина, медикамента с выраженным действием при невропатической боли, можно подавить спонтанную активность этих очагов нервных клеток (эктопические очаги). При таком же диапазоне доз удается подавить периферическую гипералгезию. Аналогичные опыты проводились также на другой модели (H.J. Haebler, X.G. Liu, S. Eschenfelder, W. Jaenig, Is sympathetic-sensory coupling in L5 spinal nerve-injured rats direct? Soc. Neurosci. Abstr. 24, стр. 2084 (1998)). При рассечении спинномозгового нерва L5, начиная с 4-го дня, в течение нескольких недель наблюдалась неожиданно спонтанная активность отдельных нервных волокон из остатка указанного нерва. Этот феномен с определенной долей вероятности можно соотнести с фантомной болью. Спонтанную активность этих нервных волокон после ампутации можно объяснить растормаживанием NMDA-субтипа глутаматового рецептора (М. Zhuo, NMDA receptor-dependent long term hyperalgesia after tail amputation in mice, Eur. J. Pharmacol. 349(2-3), стр.211-220 (22 мая 1998)).
Возможное участие NMDA-рецептора подтверждают также исследования, при проведении которых удалось установить, что благодаря интратекальному введению антагонистов NMDA можно ослабить боль.
Резюмируя вышесказанное, можно констатировать, что состояние повышенного возбуждения соответствующих нервов может играть определенную роль в качестве причины гипералгезии, соответственно неадекватного восприятия боли, но вместе с тем нельзя исключить и влияние других факторов.
При терапии указанных заболеваний необходимо проводить четкое различие между симптоматическим лечением болевых ощущений и лечением причин заболевания с учетом защиты нервных клеток (R. Moerz, Schmerzbehandlung bei diabetischen Neuropathien, Fortschritte der Medizin 13, стр.29-30(1999)).
Для пациентов, испытывающих невропатическую боль, обусловленную диабетом, во избежание дальнейшего прогрессирования болезни и для предупреждения возможных осложнений, таких как поражения нижних конечностей, основной программой является оптимизация обмена веществ, однако такое лечение не оказывает влияния на симптомы боли.
Причину заболевания, т.е. нейродегенеративное повреждение нервов и лежащую в основе заболевания микроангиопатию, можно лечить, применяя защищающие нервные клетки (нейропротективные) субстанции, такие как альфа-липоновая кислота, либо иные антиоксиданты, такие как витамин Е, релевантные (важные) для нервной системы витамины, такие как витамин B1, B6 или В 12, или же улучшающими кровообращение мерами, такими как физические тренировки.
Такой вид лечения не оказывает быстрого воздействия на боль, однако если при этом удается улучшить функциональную полноценность нервной системы, то вполне возможно достичь и ослабления на длительное время болевых ощущений.
В отличие от этого собственно симптоматическая терапия боли вынуждена прибегнуть к другим медикаментам. Причина в том, что ни анальгетики, такие как производные морфина, воздействующие на центральную нервную систему, ни обычные анальгетики, такие как парацетамол или ацетилсалициловая кислота, воздействующие на периферическую нервную систему, в этих случаях не дают требуемого эффекта. Поэтому приходится применять антидепрессанты, такие как амитриптилин, имипрамин или пароксетин, либо противосудорожные средства, такие как карбамазепин или габапентин. Трамадол как опиоидный анальгетик благодаря его способности воздействовать и на другие рецепторы адренергической системы также эффективен.
В патентной литературе описывается использование топирамата (патент US 5760007) и моксонидина (заявка ЕР 901790) для лечения невропатических болей. Цель такого подхода состоит в лечении симптомов боли как таковых, а не обусловливающих их причин. Все указанные медикаменты при этом позволяют ослабить болевые симптомы лишь у части пациентов.
Возникновение невропатической боли, индуцируемой герпесом, можно предупредить за счет применения виростатиков на ранней стадии заболевания, защитив таким путем нервные клетки от вредного воздействия вируса и снизив тем самым проявление невропатических болей, однако по завершении острой стадии этого инфекционного заболевания эффективность названных медикаментов по отношению к симптоматическим болям практически равна нулю. Ослабить эти боли у пациентов с таким заболеванием можно за счет приема антидепрессантов, карбамазепина или габапентина.
При обусловленных компрессией невропатических болях, например при синдроме карпального туннеля или при сдавлении (защемлении) корешков спинномозговых нервов, первичную причину заболевания можно устранить хирургическим путем, расширив "узкие места" (места сдавления). При заблаговременном назначении медикаментов, обладающих нейропротективным (защитным) действием, дальнейший процесс повреждения нервов можно замедлить или приостановить. Тем не менее несмотря на хирургическое вмешательство значительная часть пациентов еще длительное время и после операции страдает от болей, не поддающихся удовлетворительному лечению классическими анальгетиками. В этих случаях целесообразно применять антидепрессанты и такие медикаменты, как карбамазепин или габапентин.
При фантомной боли лечить ее первопричину, ампутацию, естественно, невозможно и, таким образом, для устранения невропатических болей применимо лишь симптоматическое лечение с использованием вышеназванных групп медикаментов. Тем не менее в последнее время предпринимаются попытки при плановых ампутациях путем блокады проводимости рассекаемых нервов в течение нескольких дней до проведения операции противодействовать развитию невропатических болей. Хотя первые положительные результаты и получены, тем не менее однозначного подтверждения эффективности такого подхода, основанного на контролируемых клинических исследованиях, до настоящего времени еще нет.
Резюмируя вышесказанное, можно констатировать, что для симптоматического лечения невропатических болей классические анальгетики малоэффективны. С учетом этого применяют такие медикаменты, как антидепрессанты, карбамазепин или валпроат, которые в принципе не обладают анальгетическим действием по отношению к не невропатическим болям. Однако и при таком лечении часто не удается добиться удовлетворительных результатов.
Таким образом, существует настоятельная необходимость в разработке новых субстанций для избирательного лечения невропатических болей.
Целью изобретения в соответствии с этим является получение субстанции, с помощью которой можно было бы лечить болевые симптомы невропатических болей.
Неожиданно было установлено, что ретигабин формулы I
обладает высокоэффективным действием против невропатических болей. Тем самым открываются совершенно новые возможности для профилактики и лечения невропатических болей.
Ретигабин и способ его получения известны (заявка DE 4200259).
Ретигабин представляет собой производное неопиоидного анальгетика флупиртина, который, как было установлено, наряду с анальгетической эффективностью обладает также противосудорожным действием. За счет оптимизации структуры с целью более четкого разграничения требуемых (противосудорожных) свойств и нежелательных (анальгетических) эффектов путем моделирования с использованием фармакофора удалось определить границу между противосудорожным и анальгетическим действием субстанций этого класса.
По сравнению с флупиртином ретигабин обладает более сильным противосудорожным действием, тогда как никакого анальгетического эффекта, что было установлено на моделях острой боли, он не проявляет (A. Rostock, С. Tober, С. Rundtfeldt, R. Bartsch, J. Engel, E.E. Polymeropoulos, В. Kutscher, W. Loescher, D. Honack, H.S. White, H.H. Wolf, D-23129: a new anticonvulsant with a broad spectrum activity in animal models of epileptic seizures, Epilepsy Res. 23(3), стр.211-223 (апрель 1996)).
Ретигабин обладает, как было установлено на экспериментальных моделях приступов эпилепсии, широким спектром действия (С. Tober, A. Rostock, С. Rundfeldt, R. Bartsch, D-23129: a potent anticonvulsant in the amygdala kindling model of complex partial seizures, Eur. J. Pharmacol 303(3), стр.163-169 (15 мая 1996)) и проходит в настоящее время клинические испытания при лечении эпилепсии.
В некоторых публикациях (например в заявке ЕР 857065) описано, кроме того, применение ретигабина для лечения нейродегенеративных заболеваний.
Авторам настоящего изобретения удалось неожиданным образом установить, что проявляемое ретигабином эффективное действие против невропатических болей зависит от его дозировки. Анальгетическое же действие, как и ожидалось и было установлено в этой модели в ранней фазе, проявлялось лишь в самой малой степени и его можно сопоставить со сравнительной субстанцией габапентином.
Фармакологические исследования
Исследование подавления гипералгезии на крысах на модели с использованием формалина
В этой модели животным в заднюю конечность с подошвенной стороны подкожно инъецировали низкопроцентный раствор формалина, изучая при этом две фазы их поведенческой реакции на вызванную боль (M.J. Field, R.J. Oles, A.S. Lewis, S. McCleary, J. Hughes, L. Singh, Gabapentin (neurontin) and S-(+)-3-isobutylgaba represent a novel class of selective antihyperalgesic agents, Br. J. Pharmacol. 121(8), стр.1513-1522 (август 1997)). Ранняя фаза, продолжавшаяся максимум до 10-ой минуты, характеризовалась тем, что животные беспрерывно облизывали и покусывали пораженную конечность. Позднюю тоническую фазу, наступающую через 20-60 мин после инъекции, можно охарактеризовать как стадию проявления гипералгезии. Эта индуцированная формалином гипералгезия включает центральные механизмы, инициируемые сенситивностью нейронов в дорсальном роге спинного мозга, возникающей вследствие повреждения ткани или возрастающим активированием С-афферентных волокон.
Field и др. (1997) установили, что опиоиды в этой модели неэффективны в указанной поздней фазе поведенческих реакций, проявляющихся в гипералгезии. Противосудорожное средство габапентин в отличие от этого снижал в зависимости от вводимых доз болевые реакции у крыс.
Исследования с использованием ретигабина
Методика
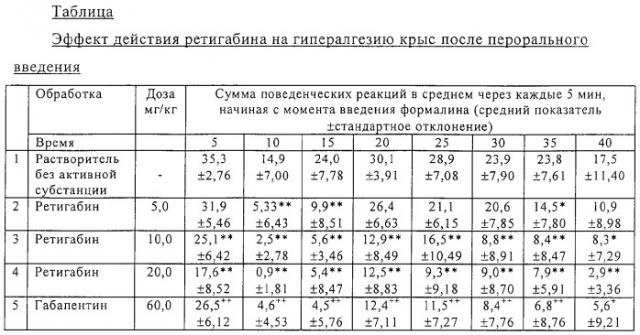
Самцов крыс Sprague Dawley весом 70-90 г поодиночке подвергали соответствующей адаптации и наблюдали их по меньшей мере за 15 мин до начала опыта. Подкожная инъекция 0,05 мл 2,5% формальдегида в изотоническом растворе поваренной соли в заднюю конечность с подошвенной стороны вызывала сильную немедленную реакцию, проявлявшуюся в покусывании и облизывании в течение нескольких минут, с последующим переходом в позднюю гипералгезическую фазу, продолжавшуюся вплоть до 60 мин после инъекции формалина. Проявляющиеся в поздней фазе (начиная с 10-ой минуты) реакции (покусывание и облизывание) являются мерой определения гипералгезических реакций. Эти реакции фиксировали в течение 40 мин через каждые 5 минут. Тестируемые субстанции вводили перорально за 60 мин до инъекции формалина. В качестве сравнительной субстанции служил габапентин. Опыт проводили в группах по 15 животных.
Результаты
В зависимости от вводимых перорально доз в 5, 10 и 20 мг/кг ретигабин подавлял соответственно позднюю фазу болевых реакций, обозначаемую как гипералгезия или невропатическая боль. Действие 10 мг/кг ретигабина соответствовало примерно эффекту, достигаемому при пероральном введении габапентина в дозировке 60 мг/кг (см. таблицу).
Как и при использовании габапентина, эффективность действия в ранней фазе боли, т.е. анальгетическое действие, проявлялось лишь в малой степени. Так, в частности, число болевых реакций в ранней фазе у контрольной группы достигало в общей сложности 35, а в поздней фазе 30. При использовании же ретигабина число болевых реакций в ранней фазе в зависимости от вводимых доз снижалось до 32, 25 и 18 соответственно, тогда как в поздней фазе этот показатель составлял максимум 5, а в некоторых случаях болевые реакции практически вообще не наблюдались.
При использовании габапентина число болевых реакций в ранней фазе также снижалось лишь до 27, тогда как в поздней фазе этот показатель состалял менее 6.
Статистически значимые различия при использовании ретигабина в сравнении с группой, обработанной растворителем без активной субстанции, определяли дисперсионным анализом согласно нижеследующему критерию Уильямса (*р<0,05, **р<0,01).
Статистически значимые различия при использовании ретигабина в сравнении с группой, обработанной растворителем без активной субстанции, определяли согласно критерию Стъюдента (+p>0,05,++p<0,01).
Ретигабин формулы I известным образом можно вводить в состав соответствующих фармацевтических композиций, таких как таблетки, капсулы, драже, пилюли, гранулы, сиропы, эмульсии, суспензии и растворы, с использованием при необходимости фармацевтически приемлемых носителей и/или вспомогательных веществ.
При пероральном или парентеральном введении суточная доза соединения формулы I должна составлять от 50 до 500 мг. При пероральном введении предпочтительно назначать разовые дозы от 30 до 60 мг, а при парентеральном введении от 5 до 20 мг (количества указаны соответственно в пересчете на свободное основание). В случае необходимости указанные количества могут варьироваться в зависимости от веса тела и методики введения.
1. Применение соединения формулы I
или его фармацевтически приемлемых солей для профилактики и лечения невропатических болей.
2. Применение соединения формулы I по п.1 для лечения аллодинии.
3. Применение соединения формулы I по п.1 для лечения болей, обусловленных гипералгезией.
4. Применение соединения формулы I по п.1 для лечения фантомных болей.
5. Применение соединения формулы I по п.1 для лечения невропатической боли при диабетической невропатии.
6. Применение соединения формулы I по п.1 для лечения невропатической боли при мигрени.