Штамм птичьего реовируса, вакцина, содержащая указанный реовирус, способ получения птичьих реовирусов, способ изготовления вакцины и способ борьбы с патологиями птицы, вызываемыми птичьими реовирусами
Иллюстрации
Показать всеИзобретение относится к области вирусологии. Предложен новый штамм птичьего реовируса ЕСАСС №99011475, принадлежащего к новому антигенному классу птичьих реовирусов. Предложены также способ получения таких реовирусов, вакцина, содержащая такой реовирус, способ ее получения и способ борьбы против патологических состояний птицы с помощью такой вакцины. Предложенная группа изобретений позволяет повысить эффективность вакцинации птиц против реовирусов. Изобретение может быть использовано в ветеринарии. 5 н. и 4 з.п. ф-лы, 3 ил., 3 табл.
Реферат
Настоящее изобретение относится к птичьему реовирусу и к вакцине, содержащей живой аттенуированный или инактивированный птичий реовирус.
За последние несколько десятилетий промышленное производство бройлеров превратилось в индустрию, которая отличается своей высокой производительностью в выращивании поголовья птиц в закрытом помещении. Однако явная тенденция к увеличению эффективности фазы разведения не может быть реализована без решения некоторых связанных с ней проблем. Основной проблемой является повышенная частота инфекционных заболеваний, которые часто возникают в связи с большой скученностью животных, содержащихся в тесных помещениях. Многие из болезней домашних птиц, наносящих самый большой экономический ущерб, были ограничены или искоренены путем вакцинации или путем обработки терапевтическими агентами, такими как антибиотики. Однако, к сожалению, пока еще имеется целый ряд заболеваний сложной этиологии, которые не могут быть предотвращены с использованием лекарственных средств и для которых не существует подходящей программы вакцинации.
В конце 1970-х годов промышленное птицеводство столкнулось с проблемами, связанными со сложными заболеваниями у цыплят-бройлеров, страдающих кишечными патологиями. Одно из таких заболеваний, которое приводит к ряду патологических состояний у пораженных цыплят, включая энтерит, было названо по его главному клиническому признаку и макроскопическим наблюдениям синдромом недостаточности всасывания (синдромом малабсорбции) (MAS). Альтернативно, это заболевание называется инфекционным синдромом задержки роста и карликовости, синдромом «бледная птица» или синдромом «хрупкость костей». Хотя с MAS связано большое число разнообразных патологических состояний, однако, во всех случаях наблюдается плохой рост и задержка оперения. Кроме того, с MAS коррелирует широкий ряд других признаков и поражений, таких как летальность, выделение слишком жидких экскрементов и/или плохо переваренной пищи, атрофия поджелудочной железы, провентрикулит, искривление костей, атрофия тимуса и бурсы, и т.д.
Kouwenhoven et al. (Avian Pathology 17, 879-892, 1988) определили MAS no пяти критериям, а именно:
(i) замедление роста в течение периода вплоть до 3 недель после инфицирования однодневных цыплят;
(ii) выделение помета, имеющего вид от желто-оранжевых слизистоподобных до жидких испражнений;
(iii) повышенная активность щелочной фосфатазы (ALP) в плазме;
(iv) пониженная концентрация каротеноида в плазме (РСС);
(v) макроскопически увеличенные эпифизарные пластинки роста.
Замедленный рост у бройлеров становится заметным в возрасте 1 недели или ранее. В поголовье может быть заражено от 5 до 20% птиц, а в возрасте 4 недель эти птицы будут иметь наполовину меньший рост или еще меньше, чем их однопометный приплод. У зараженных птиц наблюдается плохое переваривание пищи, кишечник является белесым и содержит непереваренную пищу.
Хотя патогенез MAS пока еще плохо изучен, однако, вероятно, что патогенез этого синдрома обусловлен прямым действием инфекционного агента(агентов) на пищеварительный тракт и связанные с ними органы, что может также объяснять часто повторяющееся выделение очень жидких экскрементов и/или плохо переваренной пищи.
Описанный здесь синдром приводит, в целом, к потере продуктивности, включая снижение прироста массы, плохое переваривание пищи и снижение рыночной стоимости пораженного поголовья. В результате поражения птиц MAS промышленное птицеводство ежегодно терпит большие экономические потери. Поэтому промышленное птицеводство нуждается в способах борьбы с MAS, которые позволили бы предотвращать одно или несколько из многообразных патологических состояний бройлеров.
Реовирусы, поражающие домашнюю птицу, широко распространены во всем мире. Было обнаружено, что реовирусы являются этиологическим агентом артритного заболевания, которое поражает суставную капсулу, служащую основной опорой туловищу, и сухожильные перемычки в конечностях и которое называется вирусным артритом/теносиновитом.
В некоторых работах сообщалось, что реовирусы были также выделены от цыплят, обнаруживающих MAS-ассоциированные патологические состояния. В этих работах высказано предположение, что эти реовирусы имеют этиологическую взаимосвязь с одним или несколькими MAS-ассоциированными патологическими состояниями, но четкого доказательства причастности реовирусов к MAS в этих работах представлено не было.
Как сообщается в работе van der Heide et al. (Avian Diseases 25, 847-856, 1981), реовирус был выделен из кишечника молодых бройлеров с клинической диареей. Хотя этот реовирусный изолят был способен индуцировать поражения теносиновитом, переломы бедренной головки и остеопороз, однако, этот изолят не приводил к соответствующему индуцированию диареи у цыплят, экспериментально зараженных реовирусом.
Page et al. (Avian Diseases 26, 618-624, 1981) выделили реовирусы у поголовья с экспериментально вызванной хромотой, задержкой роста и неравномерным развитием оперения. Хотя пероральная инокуляция восприимчивых цыплят бройлерного типа обнаруживала явное влияние на прирост массы, развитие оперения и индуцированные поражения в ряде органов, однако, о индуцировании диареи или жидкого помета не сообщалось.
Hieronymys et al. (Avian Diseases 27, 246-254, 1983) сообщали о выделении нескольких штаммов реовируса из кишечника цыплят с подозрением на MAS и установили антигенную взаимосвязь этих штаммов со штаммом реовируса S1133, который обычно используется в качестве вакцинного штамма для борьбы с инфекционным теносиновитом. Эти авторы подтвердили, что несмотря на то, что реовирусы были выделены от цыплят с клиническим MAS, пока еще не доказано, что эти реовирусы являются этиологическим агентом MAS.
Eidson et al. (Poultry Science 64, 2081-2086, 1985) исследовали воздействие инактивированной реовирусной вакцины, полученной на основе штамма СO8, выделенного Hieronymys et al., на поголовье бройлеров, пораженных MAS, а также теносиновитом. Хотя эта вакцина оказывала позитивное действие на массу поголовья бройлеров, однако, какого-либо изменения в переваривании пищи не наблюдалось. Кроме того, не сообщалось о каком-либо воздействии вакцины на ассоциированные с энтеритом патологические состояния, такие как жидкий помет.
Rosenberger et al. (Avian Diseases 33, 535-544, 1989) также выделили несколько штаммов реовирусов из сухожилий и костного мозга бройлерных цыплят, выращенных на птицефермах. Хотя, цыплята, инокулированные этими штаммами реовирусов, были обследованы на клиническое заболевание, однако, о каких-либо признаках диареи или жидкого помета у этих цыплят не сообщалось.
Kauwenhoven et al. (Avian Pathology 17, 879-892, 1988) также исследовали роль реовируса в синдроме недостаточности всасывания. Эти авторы не могли репродуцировать MAS с использованием реовируса, выделенного на птицеферме, и сделали вывод, что реовирус не является первичным этиологическим агентом MAS. В этой работе было сделано предположение, что инфекционные агенты, включая реовирусы и аденовирусы, могут действовать как определенный тип инициатора при синдроме недостаточности всасывания.
Однако, помимо вышеупомянутых публикаций, сообщалось, что с MAS ассоциированы и многие другие вирусы. Такими вирусами являются ротавирусы, парвовирусы, энтеровирус-подобные вирусы, тогавирус-подобные вирусы, коронавирус-подобные вирусы, аденовирусы и калицивирусы. Кроме того, было также высказано предположение, что в этиологии этой болезни участвуют бактерии. В предшествующих работах было также указано, что за MAS-подобные синдромы, наблюдаемые в полевых условиях, также ответственны микотоксины, и было высказано предположение, что не следует исключать возможность того факта, что микотоксины или другие токсины являются агентами-возбудителями MAS.
В недавно опубликованном обзоре (World Poultry 14, 57-58, 1998), McNulty систематизировал существующие данные относительно MAS. McNulty особо подчеркнул тот факт, что вакцины против MAS не существует и указал, что выделение вирусов, а также вирусологические и микробиологические исследования образцов, выделенных на птицефермах, до сих пор не дали полезных результатов в отношении идентификации агента(ов)-возбудителя(ей) MAS. McNulty высказал предположение, что этот метод, вероятно, не может дать полезные результаты. Исходя из этого, был сделан вывод, что наилучшим средством для борьбы против MAS являются соответствующие меры по содержанию птицы на фермах с MAS-зараженной продукцией.
Поэтому в настоящее время необходимость в получении вакцины, которая индуцировала бы эффективную защиту против некоторых кишечных заболеваний у кур, таких как кишечные заболевания, ассоциированные с MAS и приводящие к выделению слишком жидкого помета и/или плохо переваренной пищи, еще остается актуальной.
Кроме того, птичьи реовирусы обнаруживают значительную антигенную гетерогенность, и обнаружение новых антигенных классов птичьих реовирусов может иметь важное значение для использования реовирусных вакцин в целях вакцинации домашней птицы.
Авторы настоящего изобретения идентифицировали новый антигенный класс птичьих реовирусов. Кроме того, было продемонстрировано, что птичьи реовирусы, принадлежащие к новому антигенному классу, способны индуцировать явно выраженные патологические состояния, также ассоциируемые с MAS, такие как выделение слишком жидких экскрементов и/или плохо переваренной пищи и замедление роста.
Поэтому целью настоящего изобретения является выделение агента-возбудителя MAS-подобного кишечного патологического состояния, принадлежащего к новому антигенному классу птичьих реовирусов.
Другой целью настоящего изобретения является получение вакцины, которая обеспечивает эффективную защиту домашней птицы от поражения птичьими реовирусами нового антигенного класса.
Еще одной целью настоящего изобретения является получение вакцины, которая обеспечивает эффективную защиту домашней птицы от кишечных заболеваний, также ассоциируемых с MAS.
Было обнаружено, что все эти цели могут быть достигнуты благодаря выделению птичьего реовируса, принадлежащего к антигенному классу птичьих реовирусов, отличающегося тем, что этот птичий реовирус, принадлежащий к антигенному классу, способен продуцировать антисыворотку у животного, которая в анализе по снижению бляшек приводит, по крайней мере, к 75%-ному снижению числа бляшек, образованных птичьим реовирусом ERS, образец которого депонирован в ЕСАСС, Salisbury, UK под инвентарным №99011475.
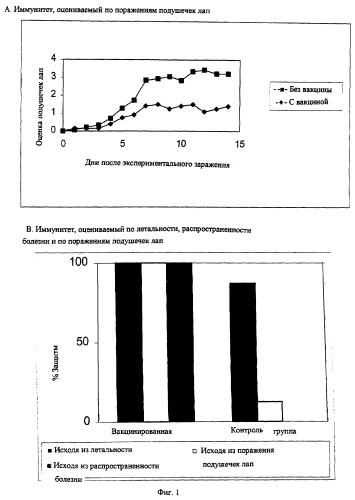
Как было установлено из наблюдений, эти птичьи реовирусы не только обнаруживают неизвестные ранее антигенные свойства (Пример 1, Таблица 2 и 3), но было также обнаружено, что птичьи реовирусы настоящего изобретения способны индуцировать у цыплят-бройлеров выделение слишком жидких экскрементов и/или плохо переваренной пищи, а в некоторых случаях даже приводят к гибели животного. Поэтому новый птичий реовирус определен в данном описании как штамм кишечного реовируса (ERS).
Выделение жидкого помета у поголовья бройлеров является одним из патологических состояний, которые также обычно наблюдаются у MAS-пораженных бройлеров при выгульном содержании. Кроме того, предполагается, что это клиническое патологическое состояние является одной из причин наиболее явно выраженных клинических симптомов у MAS-пораженных бройлеров, т.е. симптомов задержки роста. В примерах было показано, что птичий реовирус настоящего изобретения вызывает выделение жидкого помета у бройлеров, перорально инфицированных этим реовирусом, то есть в этом случае вокруг клоаки птицы наблюдается слой из слипшихся испражнений. Эксперименты, описанные в этих примерах, также показали, что пероральное инфицирование новым птичьим реовирусом также приводит к задержке роста у инфицированных бройлеров по сравнению с контрольными цыплятами.
Анализ по снижению числа бляшек представляет собой анализ, который широко используется специалистами для определения антигенной взаимосвязи между вирусными изолятами (птичьего реовируса) (см., например, Nersessian et al., Am.J.Vet.Res. 50, 1475-1480, 1989). Кроме того, описание анализа по снижению числа бляшек, проводимого в целях настоящего изобретения, представлено в Примере 1. Очевидно, что антисыворотка, предназначенная для использования в анализе по снижению числа бляшек, должна быть надлежащего качества. Способы получения такой сыворотки также описаны в Примере 1.
В основном, соответствующая антисыворотка, продуцированная против «живых» птичьих реовирусов, может быть получена путем подкожной или внутримышечной инокуляции 3-4-недельных SPF-цыплят (SPF-экспериментальное животное, свободное от патогенных микробов) живым вирусным штаммом, имеющим инфекционный титр от 102.0 до 109.0 TCID50/животное; а более предпочтительно от 103.0 до 106.0 TCID50/животное. Кровь может быть взята у животных через 3-4 недели, а предпочтительно через 4 недели после инфицирования. Цыплята могут быть снова инфицированы тем же самым живым вирусным штаммом через 3-4 недели после первого инфицирования приблизительно той же дозой, которая была использована для первого инфицирования. Кровь берут через 2-4 недели после второго инфицирования. Соответствующая антисыворотка, продуцированная против инактивированных штаммов птичьих реовирусов, может быть получена путем подкожной или внутримышечной инокуляции 3-4-недельных SPF-цыплят препаратом инактивированного вируса. Инфекционный титр этого препарата перед инактивацией может составлять 107.0-1011.0 TCID50/животное; а более предпочтительно - 108.0-1010.0 TCID50/животное. Кровь может быть взята у животных через 3-4 недели, а предпочтительно через 4 недели после инокуляции. Через 3-6 недель после первой инокуляции цыплята могут быть снова инокулированы тем же самым инактивированным вирусным препаратом в той же самой дозе, которая была использована после первой инокуляции. Кровь берут через 2-4 недели после второй инокуляции.
Идентификация нового птичьего реовируса настоящего изобретения позволяет получить новые вакцины на основе птичьего реовируса, которые могут обеспечивать эффективную защиту домашней птицы от патологических состояний, вызываемых инфицированием птичьими реовирусами нового антигенного класса. В частности, новый птичий реовирус позволяет получать вакцинные препараты на основе нового птичьего реовируса, которые могут обеспечивать эффективную защиту домашней птицы от патологических состояний, таких как выделение слишком жидких экскрементов и/или плохо переваренной пищи и замедление роста. Такие патологические состояния также ассоциируются с MAS.
Птичий реовирус настоящего изобретения может быть также выделен в полевых условиях. Важным аспектом способа такого выделения является идентификация целевых животных, предназначенных для использования в качестве источников для выделения вирусов. Типичный бройлер, который может быть использован для этой цели, должен обнаруживать следующие признаки: выделение слишком жидких экскрементов и/или плохо переваренной пищи и замедление роста.
Затем, у зараженных кур выделяют кишку с последующей гомогенизацией этого органа в подходящем буфере. После этого гомогенизованную ткань центрифугируют и супернатант фильтруют через фильтры с размером пор 0,2 мкм. Образец фильтрата добавляют в свежеприготовленные препараты первичных куриных клеток, предпочтительно клеток печени куриных эмбрионов (CEL), и через 4-8 дней после инкубирования монослои оценивают на присутствие цитопатического эффекта (СРЕ). Если СРЕ отсутствует, то замороженную/оттаянную суспензию первого монослоя добавляют к свежеприготовленным клеткам CEL. Если после первого или второго пассажа наблюдается СРЕ, то этот вирус затем дополнительно охарактеризовывают по его способности к in vivo-индуцированию у бройлеров выделения слишком жидких экскрементов и/или плохо переваренной пищи, и по его антигенным свойствам, определенным путем проведения анализа на снижение числа бляшек или иммунофлуоресцентного анализа (ИФА) с использованием специфических поликлональных и моноклональных антител, описанных ниже. Способ выделения птичьего реовируса настоящего изобретения более подробно описан в Примере 1.
Хотя, в способе выделения птичьего реовируса в качестве предпочтительного исходного материала используют кишечник, однако, этот птичий реовирус может быть выделен из печени зараженных цыплят-бройлеров или из помета этих цыплят-бройлеров. Не исключается также, что для выделения птичьего реовируса настоящего изобретения в качестве исходного материала могут служить и другие органы.
В частности, настоящее изобретение относится к птичьему реовирусу, описанному выше, причем в анализе на снижение числа бляшек индуцированная антисыворотка против птичьего реовируса может приводить, по крайней мере, к 80%-ному, а предпочтительно, по крайней мере, к 90%-ному снижению числа бляшек, образуемых птичьим реовирусом ERS, образец которого депонирован в ЕСАСС, Salisbury, UK под инвентарным №99011475.
В еще более предпочтительном варианте своего осуществления настоящее изобретение относится к птичьему реовирусу, который обнаруживает специфический тип иммунологической реакции со специфической панелью поликлональной антисыворотки и моноклональных антител (Moabs). Этот специфический тип реакции отличается от типа реакции, который обнаруживался до настоящего времени для известных реовирусов.
Моноклональные антитела могут быть использованы для идентификации характеристик инфекционного агента и для определения сходства и отличий между различными изолятами одних и тех же или подобных микроорганизмов. В работе Vakharia et al., (Proceedings of the Internatinal Symposium on adenovirus and reovirus infections in poulttry, Rauischholzhausen, Germany, 1996, 295-304) описана панель из 9 моноклональных антител (Moabs) против реовирусов и исследование полевых изолятов птичьих реовирусов на их реактивность по отношению к этим Moabs. Различные характеры реактивности панели антител Moabs позволили провести классификацию изолятов исходя из сходства типов их реактивности.
В этом варианте своего осуществления настоящее изобретение относится к птичьим реовирусам, описанным выше, которые, кроме того, характеризуются (i) по своей способности реагировать в ИФА с поликлональной антисывороткой, продуцируемой против изолята птичьего реовируса, предпочтительно против реовирусного штамма-прототипа 1133; и (ii) по отсутствию способности реагировать в ИФА с Moabs INT 13-06, INT 14-11 и 15-01 INT (образцы которых депонированы в ЕСАСС под инвентарным №99011472, 99011473 и 99011474 соответственно).
Птичий вирус настоящего изобретения, определенный по типу реакции с панелью антител, представляет собой новый антигенный тип реовирусов, как продемонстрировано в Примере 1 и в Таблице 3. Несмотря на тот факт, что многие из известных штаммов реовирусов, показанных в Таблице 3, были выделены из тканей цыплят-бройлеров (включая кишечник), обнаруживающих признаки и поражения, ассоциированные с MAS, птичьи реовирусы настоящего изобретения, имеющие новые антигенные свойства, определенные выше, не описаны в предшествующих работах.
Еще более предпочтительным птичьим реовирусом настоящего изобретения является птичий реовирус ERS (изолят 1), который является характерным для птичьих реовирусов настоящего изобретения и образец которого депонирован в ЕСАСС под инвентарным №99011475.
Птичий реовирус настоящего изобретения может быть в форме живого вируса, живого аттенуированного вируса или инактивированного вируса.
В другом своем аспекте настоящее изобретение относится к вакцине, которая может быть использована для защиты домашней птицы от патологических состояний, возникающих в результате инфицирования птичьим реовирусом, таких как кишечные патологии, ассоциированные с MAS, и которая содержит птичий реовирус настоящего изобретения и фармацевтически приемлемый носитель или разбавитель.
Птичий реовирус настоящего изобретения может быть введен в вакцину в виде живого аттенуированного вируса или инактивированного вируса. Способность птичьего реовируса индуцировать MAS-ассоциированные патологические состояния, описанные выше, значительно снижается или полностью отсутствует в том случае, если птичий реовирус присутствует в форме живого аттенуированного или инактивированного вируса.
Ослабление птичьего реовируса настоящего изобретения может быть достигнуто методами, обычно используемыми специалистами в этих целях, такими как методы, описанные Gouvea et al. (Virology 126, 240-247, 1983). Вкратце, для этого после выделения вируса из животного-хозяина вирусную суспензию вводят в первичные фибробласты куриных эмбрионов (CEF). Если изолят не способен продуцировать СРЕ, то пассаж вируса повторяют (например, 3-10 раз) до тех пор, пока не будет наблюдаться СРЕ. Как только СРЕ становится обнаруживаемым, клетки и жидкие клеточные культуры собирают, замораживают и оттаивают, после чего осветляют путем центрифугирования, а супернатант, содержащий изолят птичьего реовируса, разделяют на аликвоты и хранят при -20°С. Эта процедура может быть повторена (например, 10-100 раз) для последующей аттенуации вируса.
Вакцина настоящего изобретения может быть получена стандартными способами, такими как, например, способы, обычно используемые для получения коммерчески доступных вакцин на основе живых и инактивированных реовирусов. Получение вакцинных композиций для лечения животных описано inter alia в работе «Handbuch der Schutzimpfungen in der Tiermedizin» (eds: Mayr, A.et al., Verlag Paul Parey, Berlin und Hamburg, Germany, 1984) и «Vaccines for Veterinary Applications» (ed: Peters, A.R. et al., Butterworth-Heinemann Ltd, 1993).
Вкратце, восприимчивый субстрат инокулируют живым или живым аттенуированным птичьим реовирусом настоящего изобретения и размножают до тех пор, пока вирус не будет реплицироваться до нужного инфекционного титра или до нужного количества антигена, после чего материал, содержащий реовирус, собирают и приготавливают фармацевтическую композицию, обладающую профилактической активностью.
Если необходимо, то после адаптации этих птичьих реовирусов к данному субстрату каждый субстрат, способный поддерживать репликацию птичьего реовируса, определенного выше, может быть использован для продуцирования вакцины настоящего изобретения. Подходящими субстратами являются первичные (птичьи) клеточные культуры, такие как клетки печени куриных эмбрионов (CEL), фибробласты куриных эмбрионов (CEF) или клетки куриной почки (СК), клеточные линии млекопитающих, такие как клеточная линия VERO или клеточная линия BGM-70, или птичьи клеточные линии, такие как QT-35, QM-7 или LMH. Обычно, после инокуляции клеток вирус размножают в течение 3-10 дней, после чего супернатант клеточной культуры собирают, и если это необходимо, фильтруют или центрифугируют для удаления клеточного дебриса.
Альтернативно, птичий реовирус настоящего изобретения может быть размножен в оплодотворенных куриных яйцах с последующим сбором материала, содержащего птичий реовирус, стандартными методами.
Вакцина настоящего изобретения, содержащая живой аттенуированный вирус, может быть изготовлена и предложена для коммерческих поставок в форме (замороженной) суспензии или в лиофилизованной форме. Эта вакцина, кроме того, содержит фармацевтически приемлемый носитель или разбавитель, который обычно используется в таких композициях. Носителями являются стабилизаторы, консерванты и буферы. Подходящими стабилизаторами являются, например, SPGA, углеводы (такие как сорбит, маннит, крахмал, сахароза, декстран, глутамат или глюкоза), белки (такие как сухая молочная сыворотка, альбумин или казеин) или продукты их разложения. Подходящими буферами являются, например, фосфаты щелочного металла. Подходящими консервантами являются тимеросал, мертиолат и гентамицин. Разбавителями являются вода, водный буфер (такой как забуференный физиологический раствор), спирты и полиолы (такие как глицерин).
Если необходимо, то живые вакцины настоящего изобретения могут содержать адьювант. Примеры подходящих соединений и композиций с адьювантной активностью аналогичны примерам, которые упомянуты ниже в связи с получением инактивированных вакцин.
Хотя живая вакцина настоящего изобретения может быть введена путем инъекции, например внутримышечной и подкожной инъекции, однако, предпочтительно, если эту живую вакцину вводят с помощью недорогостоящей техники для массового введения, обычно используемой для вакцинации птичьим реовирусом. Этот способ предусматривает использование воды для питья и вакцинацию путем опрыскивания.
Альтернативными способами введения живой вакцины являются введение in ovo, закапывание в глаза и введение путем смачивания клюва.
В предпочтительном варианте своего осуществления настоящее изобретение относится к вакцине, направленной против кишечных патологических состояний, таких, которые наблюдаются при MAS, и содержащей птичий реовирус в инактивированной форме. Главное преимущество инактивированной вакцины заключается в том, что могут быть получены повышенные уровни защитных антител продолжительного действия. Это свойство делает такую инактивированную вакцину особенно подходящей для вакцинации птицеводами.
Целью инактивации вирусов, выделенных после стадии размножения, является устранение возможности репликации вирусов. В основном, это может быть достигнуто химическими или физическими средствами. Химическая инактивация может быть осуществлена путем обработки вирусов, например, ферментами, формальдегидом, β-пропиолактоном, этилен-имином или его производным. Если необходимо, то это инактивирующее соединение может быть затем нейтрализовано. Материал, инактивированный формальдегидом, может быть, например, нейтрализован тиосульфатом. Физическая инактивация может быть, предпочтительно, осуществлена путем облучения вирусов излучением высокой энергии, таким как УФ-излучение или гамма-излучение. Если необходимо, то после обработки рН может быть доведен приблизительно до значения 7.
Вакцина, содержащая инактивированный птичий реовирус, может включать, например, один или несколько из вышеупомянутых фармацевтически приемлемых носителей или разбавителей, подходящих для этой цели.
Предпочтительно инактивированная вакцина настоящего изобретения содержит одно или несколько соединений с адъювантной активностью. Соединениями или композициями, подходящими для этой цели, являются гидроксид, фосфат или оксид алюминия, эмульсия типа «масло в воде» или «вода в масле», полученная на основе минерального масла, такого как Bayol F® или Marcol 52®, или растительного масла, такая как ацетат витамина Е, и сапонины.
Инактивированные вакцины обычно вводят парентерально, например внутримышечно или подкожно.
Вакцина настоящего изобретения содержит эффективную дозу птичьего реовируса в качестве активного компонента, т.е. количество иммунизирующего материала на основе птичьего реовируса, которое вырабатывает у вакцинированных птиц или у их потомства иммунитет против заражения вирулентным вирусом. В настоящем описании термин «иммунитет» определяют как индуцирование значительно более высокого уровня защиты поголовья вакцинированных птиц по сравнению с невакцинированной группой.
Обычно, живая вакцина настоящего изобретения может быть введена в дозе 102-109 TCID50 на птицу, а инактивированная вакцина может содержать антигенный эквивалент 104-1010 TCID50 на птицу.
Хотя вакцина на основе птичьего реовируса настоящего изобретения может быть с успехом использована для иммунизации цыплят, однако, эта вакцина может с таким же успехом использована для вакцинации других домашних птиц, таких как индейки, цесарки и перепела. Цыплятами могут быть бройлеры, племенное поголовье кур и яичные куры.
Поскольку кишечные патологии, такие как патологии, ассоциированные с MAS, как известно, наблюдаются, главным образом, у цыплят-бройлеров, то настоящее изобретение, предпочтительно, относится к вакцине, которая может быть использована для защиты бройлеров от кишечных патологий, таких как патологии, ассоциированные с MAS.
Возраст животных, иммунизируемых живой или инактивированной вакциной настоящего изобретения, является таким же, как и возраст животных, иммунизируемых имеющимися в настоящее время коммерчески доступными вакцинами, изготовленными на основе живых или инактивированных птичьих реовирусов. Так, например, бройлеры могут быть вакцинированы живой аттенуированной вакциной настоящего изобретения непосредственно в возрасте от одного дня и старше. Вакцинация родительского поголовья, такого как бройлеры-производители, может быть выполнена живой аттенуированной или инактивированной вакциной настоящего изобретения или их комбинацией. Преимуществом программы иммунизации такого типа является непосредственная защита однодневного потомства, обеспечиваемая материнскими антителами, вертикально наследуемыми птицей-молодняком. Типичная программа вакцинации кур-производителей предусматривает вакцинацию этих кур-производителей в возрасте 6 недель живой аттенуированной вакциной с последующей вакцинацией кур в возрасте 14-18 недель инактивированной вакциной. Альтернативно, вакцинация живой вакциной может быть осуществлена с последующими двумя вакцинациями инактивированными вакцинами кур в возрасте 10-12 недель и 16-18 недель.
Настоящее изобретение также относится к комбинированным вакцинам, включающим, помимо птичьего реовируса настоящего изобретения, один или несколько вакцинных компонентов других патогенов, вызывающих инфекции у домашних птиц. К этим другим патогенам, вызывающим инфекции у домашних птиц, относятся также птичьи реовирусы, которые по своим антигенным свойствам отличаются от птичьих реовирусов настоящего изобретения, и в число которых входят штаммы птичьего реовируса, ассоциированные с теносиновитом.
Предпочтительными вакцинными компонентами в комбинированной вакцине являются живые аттенуированные или инактивированные формы патогенов, вызывающих инфекции у домашних птиц.
В частности, настоящее изобретение относится к комбинированной вакцине, где все компоненты этой вакцины присутствуют в инактивированной форме.
Предпочтительно эта комбинированная вакцина содержит один или несколько (инактивированных) вакцинных штаммов вируса инфекционного бронхита (IBV), вируса ньюкаслской болезни (NDV), вируса инфекционного бурсита птиц (IBDV), аденовируса домашних птиц (FAV), вируса EDS и вируса ринотрахеита индеек (TRTV).
В рамках настоящего изобретения нижеследующие микроорганизмы и клеточные линии гибридом были депонированы в Европейской коллекции клеточных культур животных (ЕСАСС) Salisbury, UK, 14 января, 1999:
| вирус/гибридома | Инвентарный номер |
| птичий реовирус ERS | 9901475 |
| INT 13-06 | 99011472 |
| INT 14-11 | 99011473 |
| 15-01 INT | 99011474 |
Примеры
Пример 1
Характеризация новых птичьих реовирусов
А. Выделение новых птичьих реовирусов
У цыплят с кишечными нарушениями и жидким пометом, приводящем к задержке роста, были отдельно выделены кишечник и/или печень. Эти органы отдельно гомогенизировали в гомогенизаторе на максимальной скорости в течение 20 минут с использованием стеклянных шариков (2 мм) и PBS с антибиотиками. Затем гомогенизированные ткани центрифугировали. Кишечный гомогенат центрифугировали при 4000 об/мин, а печень центрифугировали при 1200 об/мин в течение 15 минут каждый. Затем супернатанты фильтровали под давлением через фильтры со снижающимся размером пор (5; 1,2; 0,45; 0,2 мкм). Сто микролитров суспензии, пропущенной через 0,2 мкм-фильтр, добавляли к свежеприготовленным первичным клеткам печени куриных эмбрионов (CEL), находящихся в колбах для тканевых культур. После инкубирования в течение 4-8 дней монослои исследовали на присутствие цитопатического эффекта (СРЕ). Если СРЕ отсутствовал, монослои замораживали при -20°С, и через 24 часа эти монослои оттаивали. Затем к свежеприготовленным клеткам CEL добавляли 1 мл этой замороженной/оттаянной суспензии. Если через 4-8 дней СРЕ не обнаруживался, то эта культура оценивалась как негативная на вирус, растущий на клетках CEL. Если после первого пассажа или после второго пассажа наблюдался СРЕ, то этот вирус дополнительно охарактеризовывали с помощью анализа на снижение числа бляшек и с помощью иммунофлуоресцентного анализа (ИФА).
В. In vitro-характеризация новых птичьих реовирусов с помощью анализа на снижение числа бляшек
1. Продуцирование антисыворотки против различных штаммов птичьих реовирусов
Штамм ERS (живой)
Десять 3-недельных SPF-цыплят инфицировали путем подкожной инъекции 105.8 TCID50/особь штамма ERS (изолят 2). Через три недели после инфицирования брали кровь и выделяли сыворотку, а птицу снова инфицировали 105.6 TCID50/особь. Через две недели после второго инфицирования брали кровь и выделяли сыворотку. После сбора всю сыворотку подвергали термоинактивации при 56°С в течение 30 минут и хранили в виде небольших аликвот при -20°С.
Штамм 2177 (живой)
Пятнадцать 4-недельных SPF-цыплят подкожно инфицировали путем подкожной инъекции 104.2 TCID50. Через четыре недели после инфицирования брали кровь и выделяли сыворотку. После сбора всю сыворотку подвергали термоинактивации при 56°С в течение 30 минут и хранили в виде небольших аликвот при -20°С.
Штаммы 1733 и 2408 (инактивированные)
Двенадцать 4-недельных SPF-цыплят инфицировали путем внутримышечной инъекции одного из штаммов птичьего реовируса 1733 или 2408, стимулированного эмульсией типа «вода/масло». Доза на одно животное: 490 ELISA-единиц/особь: инфекционный титр перед инактивацией составлял от 107.0 до 1010.0 TCID50/особь. Через 4 недели после инфицирования брали кровь и выделяли сыворотку. После сбора всю сыворотку подвергали термоинактивации при 56°С в течение 30 минут и хранили в виде небольших аликвот при -20°С.
Инактивированные коммерчески доступные вакцины, содержащие штаммы птичьего реовируса:
Десять 3-4-недельных SPF-цыплят инфицировали путем внутримышечной или подкожной инъекции одного из следующих коммерчески доступных вакцин на основе инактивированного птичьего реовируса: ISBI; Fort Dodge; Kaketsuken и Intervet International BV. Через три недели после инфицирования у цыплят брали кровь и выделяли сыворотку. После сбора сыворотки всю сыворотку подвергали термоинактивации при 56°С в течение 30 минут и хранили в виде небольших аликвот при 20°С.
Сыворотки, полученные как описано выше, использовали в ИФА и в анализе по снижению числа бляшек.
2. Иммунофлуоресцентный анализ (ИФА)
ИФА осуществляли, в основном, как описано в нижеследующем параграфе С. Для этого, вкратце, клетки Vero культивировали в 96-луночных полистироловых микротитрационных планшетах до достижения конфлюэнтности. Различные монослои инокулировали штаммом реовируса 1133. В первую лунку планшета добавляли 100 мкл куриной сыворотки. Приготавливали 3-кратные серийные разведения. После стадий инкубирования и промывки планшеты подвергали реакции с 1:100-разведенным козьим антикуриным антителом, меченным флуоресцеин-изотиоцианатом. Присутствие флуоресценции наблюдали с использованием флуоресцентного микроскопа. Титр (качество сыворотки) определяли путем разведения до конечной точки. Оно представляет собой наиболее высокое разведение сыворотки, при котором эта сыворотка еще способна индуцировать явный флуоресцентный сигнал. В Таблице 1 представлены результаты ИФА для сывороток, использованных в тесте по снижению числа бляшек.
| Таблица 1 | |
| Сыворотка против штамма птичьего реовируса | Конечное разведение (выраженное в lоg2) |
| 2177 | 2025 (11,0) |
| ERS | 6075 (12,6) |
| 1733 | 6075 (12,6) |
| 2408 | 18225 (14.2) |
| Arvax | 75 (6,2) |
| Nobilis Reo | 18225 (14,2) |
| Tri Reo | 6075 (11,6) |
| Olivax Reo | 18225 (14,2) |
| Негативная сыворотка | <3 (<1) |
Nobilis ReoTM поставляется фирмой Intervet International b.v.
ArvaxTM поставляется фирмой ISBI
Tri ReoTM поставляется фирмой Fort Dodge
Olivax ReoTM поставляется фирмой Kaketsuken.
3. Анализ на снижение числа бляшек:
В анализе на снижение числа бляшек для определения антигенной взаимосвязи между птичьими реовирусами, принадлежащими к новому антигенному классу, и для идентификации новых птичьих