Слитый полипептид, способный связываться с полипептидом vegf, и кодирующая его молекула нуклеиновой кислоты, их получение и применение
Иллюстрации
Показать всеИзобретение относится к области генной инженерии и может быть использовано в фармацевтической и медико-биологической промышленности. Предложена химерная последовательность нуклеиновой кислоты, кодирующая слитый полипептид, способный связываться с фактором роста эндотелия сосудов (VEGF) и ингибировать его специфическое митогенное действие. Молекула слитого полипептида включает иммуноглобулин-подобный домен 2 VEGF-рецептора Flt1, иммуноглобулин-подобный домен 3 VEGF-рецептора Flk1 или Flt4 и мультимеризующий компонент, представленный либо доменом Fc IgG, либо тяжелой цепью IgG. Путем экспрессии предложенной химерной последовательности или двух ее последовательно связанных копий в клетке-хозяине получают, соответственно, мономер или димер слитого полипептида, которые предлагается использовать для подавления активности VEGF у млекопитающих, в частности у человека. Новые ингибиторы VEGF отличаются от известных улучшенной фармакокинетикой. 9 н. и 14 з.п. ф-лы, 67 ил., 1 табл.
Реферат
Настоящая заявка заявляет приоритет предварительной заявки США №60/138133, поданной 8 июня 1999 г. В данной заявке содержатся ссылки на разные публикации. Указанные публикации в полном объеме включены в данную заявку в качестве ссылки.
Введение
Настоящее изобретение относится к модифицированным полипептидам с улучшенной фармакокинетикой. В частности, данное изобретение относится к полипептидам рецепторов Flt1, которые модифицированы с целью улучшения их фармакокинетического профиля. Данное изобретение относится также к способам получения и применения модифицированных полипептидов, которые включают использование модифицированных полипептидов для уменьшения или подавления потери плазмы и/или проницаемости сосудов у млекопитающего, но не ограничиваются указанным применением.
Предпосылки изобретения
Способность полипептидных лигандов связываться с клетками и таким образом вызывать фенотипическую реакцию, такую как рост, сохранение жизнеспособности, секреция продуктов жизнедеятельности или дифференцировка клеток, часто опосредована трансмембранными рецепторами на клетках. Внеклеточный домен таких рецепторов (то есть часть рецептора, расположенная на поверхности клетки) является наиболее выраженной частью молекулы, так как он содержит белок, способный связываться с лигандом. Связывание лиганда с внеклеточным доменом обычно вызывает трансдукцию сигнала, благодаря которой биологический сигнал передается к внутриклеточным мишеням. Трансдукция сигнала обычно происходит через каталитический внутриклеточный домен. Определенная совокупность элементов последовательности указанного каталитического внутриклеточного домена определяет его доступ к потенциальным субстратам киназы (Mohammadi, et al., 1990, Mol. Cell. Biol. 11:5068-5078; Fantl, et al., 1992, Cell 69:413-413). Примерами рецепторов, трансдуцирующих сигналы через каталитические внутриклеточные домены, являются рецепторные тирозинкиназы (RTK), в частности семейство рецепторов Trk, которое обычно ограничивается клетками нервной системы, семейство рецепторов цитокинов, включая трехчленный рецепторный комплекс CNTF (Stahl & Yancopoulos, 1994, J. Neurobio, 25:1454-1466), которое также ограничено клетками нервной системы, рецепторы, связанные с G-белком, такие как β2-адренергический рецептор, обнаруженный, например, на клетках сердечной мышцы, и мультимерный рецептор FcεRI с высоким сродством к иммуноглобулину Е (IgE), который находится в основном на тучных клетках и базофилах (Sutton & Gould, 1993, Nature 366:421-428).
Все вышеописанные рецепторы, по-видимому, подвержены димеризации, мультимеризации или некоторым родственным структурным изменениям, происходящим в результате связывания лиганда (Schlessinger, J., 1988, Trend Biochem. Sci. 13:443-447; Ullrich & Schlessinger, 1990, Cell 61:203-212; Schlessinger & Ullrich, 1992, Neuron 9:383-391), при этом межмолекулярные взаимодействия между димеризуемыми внутриклеточными доменами ведут к активации каталитической функции. Например, в случае полученного из тромбоцитов фактора роста (PDGF) лиганд является димером, который связывает молекулы двух рецепторов (Hart, et al., 1988, Science, 240:1529-1531; Heldin, 1989, J. Biol. Chem. 264:8905-8912), а в случае эпидермального фактора роста (EGF) лиганд является мономером (Weber, et al., 1984, J. Biol. Chem. 259:14631-14636). В случае рецептора FcεRI лиганд IgE связан с FcεRI как мономер и активируется только тогда, когда антиген связывается с комплексом IgF/FcεRI и образует поперечные сшивки с соседними молекулами IgE (Sutton & Gould, 1993, Nature 366:421-428).
Распределение конкретного рецептора в тканях высших организмов часто позволяет выявить биологическую функцию данного рецептора. В некоторых факторах роста и дифференцировки, таких как фактор роста фибробластов (FGF), сильно экспрессированы RTK, из чего следует, что они играют определенную роль в росте и сохранении тканей. Члены семейства рецепторов Trk RTK (Glass & Yancopoulos, 1993, Trends in Cell Biol. 3:262-268), как правило, ограничены клетками нервной системы, и семейство факторов роста нервной ткани, включающее фактор роста нервной ткани (NGF), выделяемый из головного мозга нейротрофический фактор (BDNF), нейротрофин-3 (NT-3) и нейротрофин-4/5 (NT-4/5), которые связывают рецепторы семейства Trk RTK, стимулируют дифференцировку разных групп нейронов в головном мозге и периферической системе (Lindsay, R.M., 1993, in Neurotrophic Factors, S.E. Loughlin & J.H.Fallon, eds., pp.257-284, San Diego, CA, Academic Press). Рецептор FcεRI находится в очень ограниченном числе типов клеток, таких как тучные клетки и базофилы. Тучные клетки продуцируются линией полипотентных кроветворных стволовых клеток костного мозга, но созревают в ткани после миграции из кровотока (см. Janeway & Travers, 1996, in Immunobiology, 2d. Edition, M. Robertson & E. Lawrence, eds., pp.1:3-1:4, Current Biology Ltd., London, UK, Publisher) и принимают участие в аллергической реакции.
Многие исследования показывают, что внеклеточный домен рецептора обладает свойством связывания специфических лигандов. Кроме того, клеточная среда, в которой экспрессирован рецептор, может влиять на биологическую реакцию, возникающую при связывании лиганда с рецептором. Например, воздействие на нервную клетку, экспрессирующую рецептор Trk, нейротрофином, который связывается с данным рецептором, обусловливает выживаемость и дифференцировку нейронов. Когда тот же рецептор экспрессирован фибробластом, под действием нейротрофина происходит пролиферация фибробластов (Glass, et al., 1991, Cell 66:405-413).
Идентифицирован класс выделяемых из клеток димерных митогенов с избирательностью в отношении эндотелиальных клеток сосудов, который назван фактором роста эндотелиальных клеток сосудов (VEGF). VEGF выделен из кондиционированной питательной среды клеток глиомы крыс [Conn et al., (1990), Proc. Natl. Acad. Sci. U.S.A., 87. pp.2628-2632]; кондиционированной питательной среды звездчатых клеток гипофизарных фолликул крупного рогатого скота [Ferrara and Henzel, (1989), Biochem. Biophys. Res. Comm., 161, pp.851-858; Gozpadorowicz et al., (1989), Proc. Natl. Acad. Sci. U.S.A., 86, pp.7311-7315] и кондиционированной питательной среды клеток U937 человека [Connolly, D.T. et al. (1989), Science, 246, pp.1309-1312]. VEGF является димером со средней молекулярной массой около 46 кДа, при это каждая субъединица имеет среднюю молекулярную массу около 23 кДа. VEGF имеет некоторое структурное сходство с полученным из тромбоцитов фактором роста (PDGF), который является митогеном для клеток соединительной ткани и не является митогеном для эндотелиальных клеток крупных сосудов.
Установлено, что мембраносвязанный рецептор тирозинкиназы, известный как Flt, является рецептором VEGF [DeVries, С. et al., (1992), Science, 255, pp.989-991]. Рецептор Flt связывает VEGF, который индуцирует митогенез. Известно, что другая форма рецептора VEGF, именуемая KDR, также связывает VEGF и индуцирует митогенез. Кроме того, известна неполная последовательность кДНК и почти полноразмерная белковая последовательность KDR [Terman. B.I. et al., (1991), Oncogene 6, pp.1677-1683; Terman, В.I. et al., (1992), Biochem. Biophys. Res. Comm. 187. pp.1579-1586].
Постоянный ангиогенез может стать причиной возникновения или обострения некоторых заболеваний, таких как псориаз, ревматоидный артрит, гемангиома, ангиофиброма, диабетическая ретинопатия и неоваскулярная глаукома. Ингибитор активности VEGF должен быть полезен для лечения таких заболеваний и других типов VEGF-индуцированного патологического ангиогенеза, а также заболеваний, связанных с проницаемостью сосудов, таких как васкуляризация опухоли. Настоящее изобретение относится к ингибитору VEGF на основе рецептора Flt1 VEGF.
Потеря плазмы, которая является основным показателем воспалительного процесса, возникает в отдельной совокупности микрососудов. В частности, потеря плазмы в большинстве органов происходит в венулах. В отличие от артериол и капилляров потеря плазмы из венул возникает под действием многочисленных медиаторов воспаления, включая гистамин, брадикинин и серотонин. Одной отличительной особенностью воспаления является потеря плазмы, которая происходит из межклеточных брешей, образующихся в эндотелии венул. Экспериментальные модели воспалительного процесса показывают, что указанные межклеточные бреши возникают между эндотелиальными клетками посткапиллярных и собирающих венул (Baluk, P., et al., Am. J. Pathol. 1998, 152:1463-76). Установлено, что определенные лектины можно использовать для обнаружения очагов потери плазмы, эндотелиальных брешей и патологических процессов на границах эндотелиальных клеток в воспаленных венулах (Thurston, G., et al., Am. J. Physiol, 1996, 271: Н2547-62). В частности, растительные лектины используют для визуализации морфологических изменений на границах эндотелиальных клеток в воспаленных венулах, например, трахеи крыс. Лектины, такие как конконавалин А и рицин, которые очагово связываются с воспаленными венулами, позволяют обнаружить области в стенке субэндотелиального сосуда с брешами, соответствующими местам потери плазмы (Thurston, G., et al., Am. J. Physiol, 1996, 271: H2547-62).
Капиллярные сосуды характеризуются динамическими свойствами. Хронические воспалительные заболевания обусловлены, в частности, изменением микрососудов, включая ангиогенез и увеличение капиллярных микрососудов. Капиллярные сосуды могут также измениться в результате приобретения неправильных фенотипических свойств. В мышиной модели хронического воспаления дыхательных путей капилляры дыхательных путей приобретают свойства венул, выражающиеся в увеличении диаметра сосудов, повышенной иммунореактивности на фактор фон Виллебранда и повышенной иммунореактивности на Р-селектин. Кроме того, просачиваемость измененных сосудов может возникать под воздействием таких воспалительных медиаторов, которые не оказывают влияния на аналогичные сосуды дыхательных путей у здоровых мышей.
Установлено, что определенные вещества уменьшают или подавляют проницаемость сосудов и/или потерю плазмы. Например, мистиксины являются синтетическими полипептидами, которые подавляют потерю плазмы, не блокируя образование эндотелиальных брешей (Baluk, P., et al., J. Pharmacol. Ехр. Ther., 1998, 284: 693-9). Кроме того, формотерол - агонист бета-2-адренергических рецепторов - уменьшает просачиваемость капиллярных сосудов, подавляя образование эндотелиальных брешей (Baluk, P., and McDonald, D.M., Am. J. Physiol., 1994, 266:L461-8).
Ангиопоэтины и члены семейства факторов роста эндотелиальных клеток сосудов (VEGF) являются единственными факторами роста, которые, как известно, являются в высшей степени специфичными для эндотелиальных клеток сосудов. Исследования по инактивации гена-мишени у мышей показывают, что VEGF необходим на ранних стадиях развития сосудов и Ang-1 необходим на поздних стадиях изменения сосудов.
В патенте США №6011003, выданном 4 января 2000 г. фирме Metris Therapeutics Limited, описана измененная растворимая форма полипептида FLT, способная связываться с VEGF и оказывать таким образом ингибирующее действие на указанный фактор, причем данный полипептид содержит пять или меньше полных доменов иммуноглобулина.
В патенте США №5712380, выданном 27 января 1998 г. фирме Merck & Co., описаны ингибиторы фактора роста эндотелиальных клеток сосудов (VEGF), которые представляют собой природные или полученные методом рекобинантных ДНК растворимые формы, содержащие или не содержащие С-концевую трансмембранную область рецептора для VEGF.
Фирме Merck & Со. принадлежит также заявка РСТ № WO 98/13071, опубликованная 2 апреля 1998 г., в которой описаны методы гемотерапии для подавления первичного роста опухоли и метастазов путем переноса генов нуклеотидной последовательности, кодирующей растворимый рецепторный белок, связывающийся с VEGF.
В заявке фирмы Genentech, Inc. PCT № WO 97/44453, опубликованной 27 ноября 1997 г., описаны новые химерные белки рецепторов VEGF, содержащие аминокислотные последовательности, полученные из рецепторов Flt1 и KDR фактора роста эндотелиальных клеток сосудов (VEGF), включая мышиный гомолог рецептора FLK1 KDR человека, в которых указанные химерные белки рецепторов VEGF связываются с VEGF и оказывают антагонистическое действие на пролиферативную и ангиогенную активность эндотелиальных клеток.
В заявке фирмы Toa Gosei Co., LTD PCT № WO 97/13787, опубликованной 17 апреля 1997 г., описан низкомолекулярный ингибитор VEGF, используемый для лечения болезней, сопровождающихся образованием новых сосудов, таких как солидные опухоли. Полипептид, содержащий первый и второй иммуноглобулиноподобные домены во внеклеточной области рецептора FLT VEGF, но не имеющий шестого и седьмого иммуноглобулиноподобных доменов, оказывает ингибирующее действие на VEGF.
Sharifi, J. et al., 1998, The Quarterly Jour. of Nucl. Med. 42:242-249, указывают, что, поскольку моноклональные антитела (MAb) являются основными, положительно заряженными белками, а клетки млекопитающего заряжены отрицательно, то электростатическое взаимодействие между указанными элементами может вызывать более высокие уровни фонового связывания, что ведет к низкому соотношению между объемом опухоли и нормального органа. Чтобы преодолеть указанных эффект, исследователи попытались увеличить выведение MAb разными методами, в частности при помощи вторичных агентов, а также химической модификации и изменения заряда самого MAb.
Jensen-Pippo, et al., 1996, Pharmaceutical Research 13:102-107, указывают, что обработка полиэтиленгликолем лечебного белка, рекомбинантного гранулоцитарного колониестимулирующего фактора (PEG-G-CSF) человека увеличивает стабильность и сохраняет биологическую активность in vivo при интра-дуоденальном способе введения.
Tsutsumi, et al., 1997, Thromb Haemost. 77:168-73, описывают эксперименты, в которых тромбопоэтическую активность in vivo модифицированного полиэтиленгликолем интерлейкина-6 (MPEG-IL-6), в котором 54% 14 аминогрупп лизина в IL-6 связано с PEG, сравнивали с активностью природного IL-6.
Yang, et al., 1995, Cancer 76:687-94, указывают, что конъюгируя полиэтиленгликоль с рекомбинантным интерлейкином-2 (IL-2) человека, можно получить соединение, а именно модифицированный полиэтиленгликолем IL-2 (PEG-IL-2), которое сохраняет in vitro и in vivo активность IL-2, но характеризуется значительно более продолжительным периодом полужизни в кровотоке.
R. Duncan and F. Spreafico, Clin. Pharmacokinet. 27: 290-306, 296 (1994), описывают эксперименты по увеличению периода полужизни в плазме аспарагиназы путем конъюгирования с полиэтиленгликолем.
В международной патентной заявке № WO 99/03996 фирмы Regeneron Pharmaceuticals, Inc. и правления Калифорнийского университета, опубликованной 28 января 1999 г., описаны модифицированные полипептиды человека с делениями областей основных аминокислот. Установлено, что модифицированные "ноггин" - полипептиды человека сохраняют биологическую активность, обладая более низким сродством к гепарину и более высокой фармакокинетикой в сыворотке животного по сравнению с немодифицированными "ноггин" - полипептидами человека.
Краткое изложение существа изобретения
Настоящее изобретение относится к антагонистам VEGF с улучшенными фармакокинетическими свойствами. Предпочтительный вариант осуществления изобретения относится к выделенной молекуле нуклеиновой кислоты, кодирующей слитый полипептид, способный связывать полипептид VEGF, включающий (а) нуклеотидную последовательность, кодирующую компонент рецептора VEGF, функционально связанный с (b) нуклеотидной последовательностью, кодирующей мультимеризующий компонент, и в котором компонент рецептора VEGF является единственным компонентом рецептора VEGF слитого полипептида и при этом нуклеотидная последовательность (а) состоит по существу из нуклеотидной последовательности, кодирующей аминокислотную последовательность домена 2 Ig внеклеточного домена первого рецептора VEGF, и из нуклеотидной последовательности, кодирующей аминокислотную последовательность домена 3 Ig внеклеточного домена второго рецептора VEGF.
В другом варианте осуществления изобретения выделенная нуклеиновая кислота первого рецептора VEGF является Flt1.
В другом варианте осуществления изобретения выделенная нуклеиновая кислота второго рецептора VEGF является Flk1.
В другом варианте осуществления изобретения выделенная нуклеиновая кислота второго рецептора VEGF является Flt4.
В другом предпочтительном варианте осуществления изобретения нуклеотидная последовательность, кодирующая домен 2 Ig внеклеточного домена первого рецептора VEGF, расположена выше нуклеотидной последовательности, кодирующей домен 3 Ig внеклеточного домена второго рецептора VEGF.
В другом предпочтительном варианте осуществления изобретения нуклеотидная последовательность, кодирующая домен 2 Ig внеклеточного домена первого рецептора VEGF, расположена ниже нуклеотидной последовательности, кодирующей домен 3 Ig внеклеточного домена второго рецептора VEGF.
В предпочтительном варианте осуществления изобретения мультимеризующий компонент содержит домен иммуноглобулина.
В другом варианте осуществления изобретения домен иммуноглобулина выбирают из группы, состоящей из домена Fc IgG, тяжелой цепи IgG и легкой цепи IgG.
Предпочтительные варианты осуществления изобретения относятся к выделенной молекуле нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую модифицированный слитый полипептид рецептора Flt1, в которой кодирующая область молекулы нуклеиновой кислоты состоит из нуклеотидной последовательности, выбираемой из группы, состоящей из:
(a) нуклеотидной последовательности, показанной на фиг. 13A-13D;
(b) нуклеотидной последовательности, показанной на фиг. 14А-14С;
(c) нуклеотидной последовательности, показанной на фиг. 15А-15С;
(d) нуклеотидной последовательности, показанной на фиг. 16A-16D;
(e) нуклеотидной последовательности, показанной на фиг. 21А-21С;
(f) нуклеотидной последовательности, показанной на фиг. 22А-22С;
(g) нуклеотидной последовательности, показанной на фиг. 24А-24 С и
(h) нуклеотидной последовательности, которая вследствие вырожденности генетического кода отличается от нуклеотидной последовательности (а), (b), (с), (d), (е), (f) или (g) и которая кодирует молекулу слитого полипептида, обладающую биологической активностью модифицированого слитого полипептида рецептора Flt1.
В другом варианте осуществления изобретения слитый полипептид кодируется вышеописанными выделенными молекулами нуклеиновой кислоты.
Предпочтительный вариант осуществления изобретения относится к композиции, способной связывать молекулу VEGF с образованием нефункционального комплекса, содержащего мультимер слитого полипептида.
Кроме того, предпочтительной является композиция, в которой мультимер является димером.
В другом варианте осуществления изобретения указанная композиция находится в носителе.
Другой вариант осуществления изобретения относится к вектору, который содержит вышеописанные молекулы нуклеиновой кислоты, включая экспрессирующий вектор, содержащий описанные молекулы нуклеиновой кислоты, в котором молекула нуклеиновой кислоты функционально связана с регулирующей экспрессию последовательностью.
Другие варианты осуществления изобретения относятся к системе вектор-хозяин, предназначенной для продуцирования слитого полипептида, которая содержит экспрессирующий вектор в приемлемой клетке-хозяине; к системе вектор-хозяин, в которой приемлемая клетка-хозяин является бактериальной клеткой, дрожжевой клеткой, клеткой насекомого или клеткой млекопитающего; к системе вектор-хозяин, в которой приемлемая клетка-хозяин является Е.Coli; к системе вектор-хозяин, в которой приемлемая клетка-хозяин является клеткой COS; к системе вектор-хозяин, в которой приемлемая клетка-хозяин является клеткой СНО.
Другой вариант осуществления изобретения относится к способу получения слитого полипептида, который включает выращивание клеток системы вектор-хозяин в условиях, обеспечивающих продуцирование и выделение таким образом полученного слитого полипептида.
Дополнительные варианты осуществления изобретения относятся к слитому полипептиду, кодируемому нуклеотидной последовательностью, показанной на фиг. 10A-10D или 24А-24С, который модифицирован ацетилированием или обработкой полиэтиленгликолем, причем ацетилирование производят по крайней мере при 100-кратном молярном избытке ацетилирующего реагента или при молярном избытке ацетилирующего реагента в пределах от примерно 10-кратного молярного избытка до около 100-кратного молярного избытка либо обработку этиленгликолем производят при использовании PEG с молекулярной массой 10000 или 20000.
Предпочтительный вариант осуществления изобретения относится к способу уменьшения или подавления потери плазмы у млекопитающего, который включает введение млекопитающему вышеописанного слитого полипептида, включая варианты осуществления изобретения, в которых млекопитающее является человеком, слитый полипептид ацетилирован или обработан полиэтиленгликолем.
Другие варианты осуществления изобретения относятся к слитому полипептиду, который специфически связывает лиганд рецептора VEGF.
Предпочтительный вариант осуществления изобретения относится к способу блокирования роста кровеносных сосудов у человека, который включает введение эффективного количества вышеописанного слитого полипептида.
Кроме того, предпочтительным является способ подавления активности лиганда рецептора VEGF у млекопитающего, который включает введение млекопитающему эффективного количества вышеописанного слитого полипептида.
Предпочтительные варианты осуществления изобретения относятся к указанным способам, в которых млекопитающее является человеком.
Другие варианты осуществления изобретения относятся к способам замедления или предотвращения роста опухоли у человека; уменьшения или предотвращения отека у человека, в частности отека мозга; уменьшения или предотвращения образования асцита у человека, в частности асцита, обусловленного раком яичника.
Предпочтительные варианты осуществления изобретения относятся к слитому полипептиду, способному связывать полипептид VEGF, который включает: (а) компонент рецептора VEGF, функционально связанный с (b) мультимеризующим компонентом, причем компонент рецептора VEGF является единственным компонентом рецептором VEGF в слитом полипептиде и состоит по существу из аминокислотной последовательности домена 2 Ig внеклеточного домена первого рецептора VEGF и аминокислотной последовательности домена 3 Ig внеклеточного домена второго рецептора VEGF.
Другой вариант осуществления изобретения относится к слитому полипептиду, в котором первый рецептор VEGF является Flt1.
Другой вариант осуществления изобретения относится к слитому полипептиду, в котором второй рецептор VEGF является Flk1.
Другой вариант осуществления изобретения относится к слитому полипептиду, в котором второй рецептор VEGF является Flt4.
Предпочтительные варианты осуществления изобретения относятся к слитому полипептиду, в котором аминокислотная последовательность домена 2 Ig внеклеточного домена первого рецептора VEGF расположена выше от аминокислотной последовательности домена 3 Ig внеклеточного домена второго рецептора VEGF, и к слитому полипептиду, в котором аминокислотная последовательность домена 2 Ig внеклеточного домена первого рецептора VEGF расположена ниже от аминокислотной последовательности домена 3 Ig внеклеточного домена второго рецептора VEGF.
В другом варианте осуществления изобретения мультимеризующий компонент слитого полипептида содержит домен иммуноглобулина, включая вариант осуществления изобретения, в котором домен иммуноглобулина выбирают из группы, включающей домен Fc IgG, тяжелую цепь IgG и легкую цепь IgG.
Предпочтительные варианты осуществления изобретения относятся к слитому полипептиду, содержащему аминокислотную последовательность модифицированного рецептора Flt1, причем аминокислотную последовательность выбирают из группы, состоящей из:
(а) аминокислотной последовательности, показанной на фиг. 13A-13D;
(b) аминокислотной последовательности, показанной на фиг. 14А-14С;
(с) аминокислотной последовательности, показанной на фиг. 15А-15С;
(d) аминокислотной последовательности, показанной на фиг. 16A-16D;
(е) аминокислотной последовательности, показанной на фиг. 21А-21С;
(f) аминокислотной последовательности, показанной на фиг. 22А-22С; и
(g) аминокислотной последовательности, показанной на фиг. 24А-24С.
Другой предпочтительный вариант осуществления изобретения относится к способу уменьшения или подавления потери плазмы у млекопитающего, который включает введение указанному млекопитающему вышеописанного слитого полипептида.
Альтернативный предпочтительный вариант осуществления изобретения относится к способу подавления активности лиганда рецептора VEGF у млекопитающего, который включает введение млекопитающему эффективного количества вышеописанного слитого полипептида.
Краткое описание чертежей
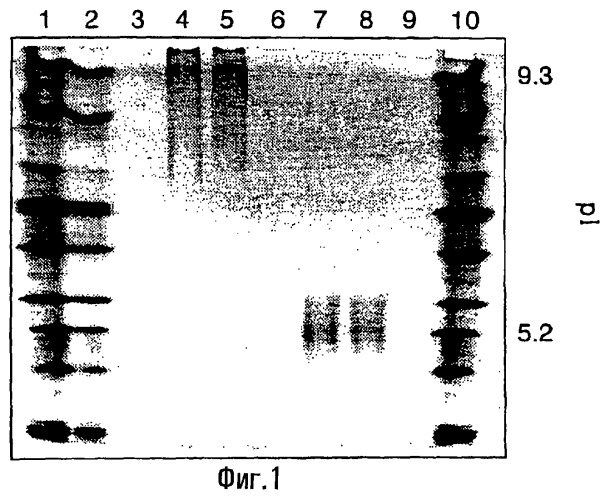
Фиг. 1. IEF-анализ в геле немодифицированного и ацетилированного белка Flt1(1-3)-Fc. Немодифицированный белок Flt1(1-3)-Fc не способен проникать в гель из-за своего показателя pl>9,3, в то время как ацетилированный белок Flt1(1-3)-Fc проникает в гель и уравновешивается при pl 5/2.
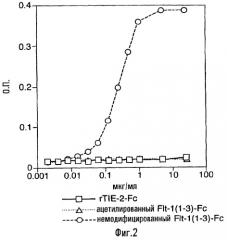
Фиг. 2. Связывание немодифицированного и ацетилированного белка Flt1(1-3)-Fc с планшетами, покрытыми Matrigel®. Немодифицированный белок Flt1(1-3)-Fc хорошо связывается с компонентами внеклеточного матрикса в Matrigel®, в то время как ацетилированный белок Flt1(1-3)-Fc не связывается с указанными компонентами.
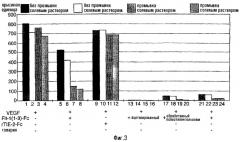
Фиг. 3. Связывание немодифицированного, ацетилированного и обработанного полиэтиленгликолем белка Flt1(1-3)-Fc при выполнении анализа на основе Biacore. Ацетилированный белок (столбцы 13-16), обработанный полиэтиленгликолем белок (столбцы 17-20) и обработанный гепарином белок Flt1(1-3)-Fc (столбцы 21-24) способны успешно конкурировать со связанным с чипом Biacore белком Flt1(1-3)-Fc по связыванию с VEGF по сравнению с контрольным белком (столбцы 1-4) и посторонним белком (столбцы 5-8). Немодифицированный белок Flt1(1-3)-Fc (столбцы 5-6), по-видимому, лишь частично конкурируют со связанным с чипом Biacore белком Flt1(1-3)-Fc по связыванию с VEGF.
Однако в результате промывки связанных образцов 0,5 М раствором NaCl (столбцы 7-8) получают профиль связывания, аналогичный модифицированным формам Flt1(1-3)-Fc, который свидетельствует о том, что немодифицированный белок проявляет неспецифическое связывание с чипом, которое можно разрушить, производя промывку солевым раствором.
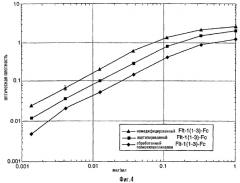
Фиг. 4. Связывание немодифицированного, ацетилированного и обработанного полиэтиленгликолем белка Flt1(1-3)-Fc с VEGF при выполнении твердофазного иммуноферментного анализа (ELISA). Обработанные полиэтиленгликолем и ацетилированные белки Flt1(1-3)-Fc связываются с VEGF со сродством, приближающимся к значению, характерному для немодифицированного белка Flt1(1-3)-Fc.
Фиг. 5. Фармакокинетические профили немодифицированного, ацетилированного и обработанного полиэтиленгликолем белка Flt1(1-3)-Fc. Мышам Balb/с (23-28 г) подкожно инъецируют 4 мг/кг немодифицированного, ацетилированного или обработанного полиэтиленгликолем белка Flt1(1-3)-Fc. У мышей из хвоста берут кровь через 1, 2, 4, 6, 24 часа, 2 дня и 3 дня после инъекции белка и анализируют сыворотку, выполняя стандартный анализ ELISA, предназначенный на обнаружения белка Flt1(1-3)-Fc. Тmax для всех белков Flt1(1-3)-Fc находится в интервале от 6 до 24 часов. Сmax для разных белков имеет следующие значения: немодифицированный белок: 0,06 мкг/мл - 0,15 мкг/мл; ацетилированный белок: 1/5 мкг/мл - 4,0 мкг/мл и обработанный полиэтиленгликолем белок: примерно 5 мкг/мл.
Фиг. 6А-6В. IEF-анализ в геле немодифицированного и ступенчато ацетилированного белка Flt1(1-3)-Fc. Немодифицированный белок Flt1(1-3)-Fc не способен проникать в гель из-за своего показателя pl>9,3, в то время как большинство образцов ступенчато ацетилированного белка Flt1(1-3)-Fc (образцы, ацетилированные 30-100-кратным молярным избытком) проникают в гель и уравновешиваются при pl 4/55-8,43 в зависимости от степени ацетилирования.
Фиг. 7. Связывание немодифицированного и ступенчато ацетилированного белка Flt1(1-3)-Fc с планшетами, покрытыми Matrigel®. Как и в случае постороннего контрольного белка, rTie2-Fc, ступенчато ацетилированный белок Flt1(1-3)-Fc (образцы, ацетилированные 20- и 30-кратным молярным избытком) не связываются с планшетом, покрытым Matrigel, в то время как неацетилированный белок Flt1(1-3)-Fc характеризуется значительным связыванием. Образец, ацетилированный 10-кратным молярным избытком, отличается пониженным связыванием, но данная степень ацетилирования не является достаточной для полного блокирования связывания с компонентами внеклеточного матрикса.
Фиг.8. Связывание немодифицированного и ступенчато ацетилированного белка Flt1(1-3)-Fc при выполнении анализа на основе Biacore. При субстехиометрическом соотношении (0,5 мкг/мл немодифицированного или ступенчато ацетилированного белка Flt1(1-3)-Fc на 0,2 мкг/мл VEGF) в растворе недостаточно белка Flt1(1-3)-Fc (немодифицированного или ступенчато ацетилированного белка) для полного связывания VEGF. При концентрации 1,0 мкг/мл, которая приближается к стехиометрическому соотношению 1:1, как немодифицированный белок, так и ступенчато ацетилированный белок Flt1(1-3)-Fc лучше конкурируют за преимущественное связывание с VEGF, но при этом по-прежнему недостаточно белка Flt1(1-3)-Fc (немодифицированного или ступенчато ацетилированного белка) для полного насыщения имеющегося VEGF. Однако при концентрации 5, 0 мкг/мл, которая в несколько раз выше стехиометрического соотношения 1:1, как белок Flt1(1-3)-Fc, так и ступенчато ацетилированный белок Flt1(1-3)-Fc способны насыщать VEGF независимо от степени ацетилирования.
Фиг. 9. Фармакокинетические профили немодифицированного и ступенчато ацетилированного белка Flt1(1-3)-Fc. Мышам Balb/c (23-28 г) подкожно инъецируют 4 мг/кг немодифицированного белка или ступенчато ацетилированных 10-, 20-, 40-, 60-и 100-кратным избытком белков Fit1(1-3)-Fc (3 мыши для немодифицированного белка и образцов, ацетилированных 10-, 20- и 40-кратным избытком, 2 мыши для образцов, ацетилированных 60-и 100-кратным избытком). У мышей из хвоста берут кровь через 1, 2, 4, 6, 24 часа, 2 дня и 3 дня после инъекции. Сыворотку анализируют при помощи стандартного анализа на основе ELISA, предназначенного на обнаружения белка Flt1(1-3)-Fc. Тmax для всех испытанных белков Flt1(1-3)-Fc соответствует 6 часам. Сmax имеет следующие значения: немодифицированный белок Flt1(1-3)-Fc - 0/06 мкг/мл; образец, ацетилированный 10-кратным избытком, - 0/7 мкг/мл, образец, ацетилированный 20-кратным избытком, - 2 мкг/мл, образец, ацетилированный 40-кратным избытком, - 4 мкг/мл, образец, ацетилированный 60-кратным избытком, - 2 мкг/мл, образец, ацетилированный 100-кратным избытком, - 1 мкг/мл.
Фиг. 10A-10D. Нуклеотидная и выведенная аминокислотная последовательность белка Flt1(1-3)-Fc.
Фиг. 11. Схематическое изображение структуры Flt1.
Фиг. 12А и 12В. Анализ гидрофильности аминокислотных последовательностей домена 2 Ig и домена 3 Ig Flt1.
Фиг. 13A-13D. Нуклеотидная и выведенная аминокислотная последовательность Mut1:
Фиг. 14А-14С. Нуклеотидная и выведенная аминокислотная последовательность Mut2;
Фиг. 15А-15С. Нуклеотидная и выведенная аминокислотная последовательность Mut3: Flt1(2-3)-Fc.
Фиг. 16A-16D. Нуклеотидная и выведенная аминокислотная последовательность Mut4:
Фиг. 17. Связывание немодифицированного белка Flt1(1-3)-Fc, мутантного белка с делецией основной области Flt1(1-3)-Fc и мутантного белка при выполнении анализа на основе Biacore. При субстехиометрическом соотношении (0,25 мкг/мл Flt1(1-3)-Fc немодифицированных, ацетилированных или генетически модифицированных образцов на 0,1 мкг/мл VEGF) белка Flt1(1-3)-Fc недостаточно для блокирования связывания VEGF с белком Flt1(1-3)-Fc, иммобилизованным на чипе Biacore. При концентрации 0,5 мкг/мл немодифицированного, ацетилированного или генетически модифицированного белка Flt1(1-3)-Fc стехиометрическое соотношение приближается к 1:1 и при этом возрастает способность блокировать связывание VEGF с чипом Biacore. При концентрации 1,0 мкг/мл немодифицированного, ацетилированного или генетически модифицированного белка Flt1(1-3)-Fc, которая примерно соответствует стехиометрическому соотношению 10:1, белки Flt1(1-3)-Fc способны блокировать связывание VEGF с чипом Biacore, но их действие не является эквивалентным. Немодифицированный и ацетилированный белок, а также мутантный белок Mut1: по существу одинаково блокируют связывание VEGF, в то время как мутантный белок Mut4: блокирует связывание менее эффективно.
Фиг. 18. Связывание немодифицированного белка Flt1(1-3)-Fc, Mut1: , Mut2: и Flt1(2-3) мутантных белков с планшетами, покрытыми Matrigel®. Немодифицированный белок Flt1(1-3)-Fc интенсивно связывается с указанными лунками, белок Mut3: Flt1(2-3)-Fc связывается несколько слабее, белок Mlt1; связывается еще слабее и белок Mut2: имеет лучший профиль, связываясь гораздо слабее, чем любые другие мутантные белки. Гликозилированный мутантный белок Mut4: характеризуется минимальным преимуществом при выполнении анализа с использованием Matrigel.
Фиг. 19. Связывание немодифицированного белка Flt1(1-3)-Fc, Mut1: , Mut2: и Flt1(2-3) мутантных белков при выполнении анализа на основе ELISA. При испытанных концентрациях немодифицированный белок Flt1(1-3)-Fc и мутантные белки Mut1: , Mut2: и Flt1(2-3) одинаково связывают VEGF.
Фиг. 20. Фармакокинетические профили немодифицированного белка Flt1(1-3)-Fc, Mut1: , Mut2: и Flt1(2-3) мутантных белков. Указанные реагенты имеют следующие значения Cmax: немодифицированный белок Flt1(1-3)-Fc - 0,15 мкг/мл; белок Flt1(1-3)-Fc, ацетилированный 40-кратным молярным избытком, - 1,5 мкг/мл; и Mut1: - 0,7 мкг/мл.
Фиг. 21А-21С. Нуклеотидная и выведенная аминокислотная последовательность модифицированного рецептора Flt1, обозначенного Flt1D2.Flk1D3.FcΔС1 (а).
Фиг. 22А-22С. Нуклеотидная и выведенная аминокислотная последовательность модифицированного рецептора Flt1, рецептора Flt1, обозначенного Flt1D2.VEGFR3D3.FcΔC1 (a).
Фиг. 23. Анализ внеклеточного матрикса (ЕСМ). Результаты данного анализа показывают, что белки Flt1D2.Flk1D3.FcΔC1 (а) и Flt1D2.VEGFR3D3.FcΔC1 (а) значительно хуже связываются с ЕСМ, чем белок Flt1(1-3)-Fc.
Фиг. 24А-24С. Нуклеотидная и выведенная аминокислотная последовательность модифицированного рецептора Flt1, обозначенного VEGFR1R2-FcΔC1 (a).
Фиг. 25А-25С. Анализ фосфорилирования. При 1,5-молярном избытке белка Flt1(1-3)-Fc, Flt1(1-3)-Fc (A40) или временно экспрессированного белка Flt1D2F1k1D3.FcΔC1 (а) полностью блокируется стимуляция рецептора тремя вышеуказанными модифицированными рецепторами Flt1 по сравнению со стимуляцией контрольной средой. В отличие от этого временно экспрессированный белок Flt1D2VEGFR3D3.FcΔC1 (а) не вызывает существенного блокирования при указанном молярном избытке по сравнению со стимуляцией положительным контрольным белком VEGF. Аналогичные результаты показаны на фиг. 25В, где модифицированные рецепторы Flt использованы в трехкратном молярном избытке относительно лиганда VEGF165. На фиг. 25С, где модифицированные рецепторы Flt1 использованы в шестикратном молярном избытке относительно лиганда VEGF165, показано, что временно экспрессированный белок Flt1D2VEGFR3D3.FcΔC1 (а) частично блокирует обусловленную VEGF165 стимуляцию рецепторов на поверхности клетки.
Фиг. 26А-26В. Анализ фосфорилирования. Обнаружение при помощи вестерн-блоттинга фосфорилированного тирозином белка VEGFR2(Flk1) в результате стимуляции лигандом VEGF165 показывает, что рецепторы на поверхности клетки не фосфорилируются стимулирующими образцами, содержащами VEGF165, который предварительно инкубируют с 1- и 2-кратным молярным избытком (фиг. 26А) или 3- или 4-кратным молярным избытком (фиг. 26В) временно экспрессированного белка Flt1D2Flk1D3.FcΔС1 (а), постоянно экспрессированного белка Flt1D2Flk1D3.FcΔC1 (а) или временно экспрессированного белка VEGFR1R2-FcΔC1 (a). При всех испытанных концентрациях модифицированного рецептора Flt1 происходит полное связывание лиганда VEGF165 во время предварительной инкубации, в результате чего отсутствует детектируемая стимуляция рецепторов на поверхности клеток несвязанным VEGF165 по сравнению со стимуляцией контрольной средой.
Фиг. 2