Способ моделирования туберкулезного омартрита
Иллюстрации
Показать всеИзобретение относится к моделированию в медицине и может быть применимо для моделирования туберкулезного омартрита. Перфорируют кортикальный слой у края суставной капсулы плечевого сустава. Формируют канал в губчатом веществе головки плечевой кости. Рассверливают отверстие в кортикальном слое под суставным хрящом, подготавливая ложе для субхондрального очага. Вводят в подготовленное ложе при помощи троакара культуру микобактерий туберкулеза на гемостатической губке. Способ позволяет создать модель туберкулеза, последовательно распространяющегося из субходрального очага, предотвратить рассеивание и вымывание микобактерий. 9 ил.
Реферат
Изобретение относится к медицине, а именно к фтизиатрии, и может быть использовано для разработки способов хирургического лечения туберкулеза плечевого сустава.
Вопросы хирургического лечения туберкулеза плечевого сустава разработаны недостаточно, в литературе имеется крайне ограниченное число работ, посвященных этой проблеме. Одним из препятствий в решении этих вопросов является отсутствие экспериментальной модели данного заболевания.
Известен способ моделирования туберкулезного остита вблизи коленного сустава в экспериментах на кроликах (Беллендир Э.Н. Экспериментальная модель туберкулезного остита вблизи коленного сустава // Патогенез и саногенез очаговых и деструктивных форм туберкулеза. - М., 1967), который заключается в применении хирургического доступа к внутреннему мыщелку бедренной кости разработанным автором способом - освобождении костной площадки в области эпиметафиза бедра, высверливании отверстия диаметром 1 мм, длиной 5 мм, через которое на кончике иглы вносится культура микобактерий туберкулеза (МБТ) в дозе 0,5 мг. В связи с возможным инфицированием мягких тканей рана обрабатывается противотуберкулезным препаратом в порошкообразной форме для подавления жизнеспособности МБТ. Отверстие пломбируется стоматологическим цементом, кожа зашивается наглухо.
Недостатки описанного способа моделирования:
не позволяет получить быстрое туберкулезное поражение сустава, так как патологический процесс локализован в толще губчатой кости; существует опасность рассеивания туберкулезной культуры в мягкие ткани операционной раны (подкожная клетчатка и мышцы) в момент внесения инфекта в костный канал; возможность развития кровотечения из костной ткани на начальном или последующих этапах операции; неприменим для моделирования туберкулеза плечевого сустава (особенности анатомии и хирургической техники).
Задачей предлагаемого способа является создание модели костного туберкулезного поражения, последовательно распространяющегося из субхондрально расположенного костного очага на плечевой сустав, адекватного развитию туберкулезного омартрита у человека, а также предотвращение инфицирования культурой МВТ окружающих мягких тканей операционной раны на этапе внутрикостной инокуляции инфекта и предупреждение кровотечения, ведущего к вымыванию МВТ из создаваемого внутрикостного очага.
Поставленная задача решается тем, что перфорируют кортикальный слой у края суставной капсулы плечевого сустава, формируют канал в губчатом веществе головки плечевой кости, рассверливают отверстие в кортикальном слое под суставным хрящом, подготавливая ложе для субхондрального очага, куда при помощи троакара вводят культуру микобактерий туберкулеза на гемостатической губке, которая, пропитываясь кровью, увеличивается в объеме и заполняет полость образованного канала в губчатом веществе головки плечевой кости, что способствует не только остановке кровотечения, но и предотвращению выноса культуры МВТ в рану с ее последующим инфицированием.
Способ поясняется чертежами:
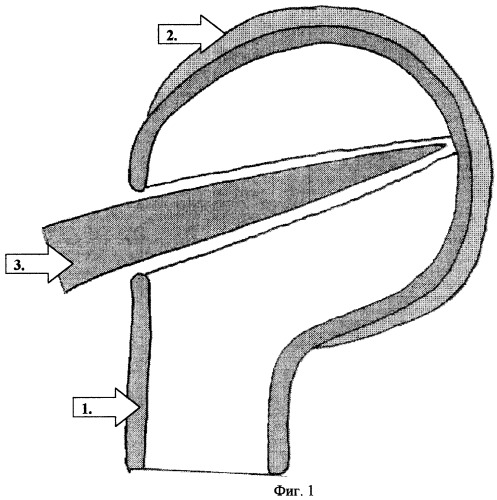
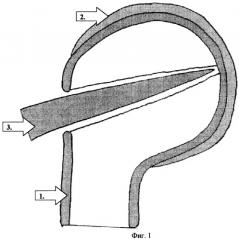
Фиг.1.:
1. Кортикальный слой.
2. Суставной хрящ.
3. Острие шила.
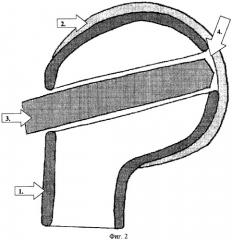
Фиг.2.:
1. Кортикальный слой.
2. Суставной хрящ.
3. Сверло.
Субхондральный дефект кортикального слоя.
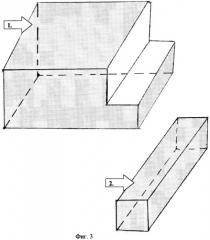
Фиг.3.:
1. Гемостатическая губка.
2. Фрагмент губки, заготовленный для троакара.
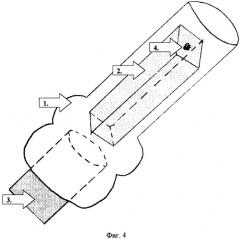
Фиг.4.
1. Троакар.
2. Фрагмент гемостатической губки.
3. Мандрен для троакара.
4. Зона внесения культуры МБТ.
Фиг.5.:
1. Чашка Петри.
2. Сухая, распределенная на дозы культура МБТ.
3. Инъекционная игла с мандреном для забора МБТ.
Фиг.6.:
1. Фрагмент гемостатической губки.
2. Инъекционная игла с мандреном.
3. Сухая культура МБТ, внедренная в губку.
Фиг.7.:
1. Культура МБТ в субхондральном слое головки плечевой кости на фрагменте гемостатической губки.
2. Цементная пробка.
Иллюстрации к экспериментальному примеру:
Фиг.8.:
1. Плечевая кость кролика.
2. Субхондральный очаг в головке плечевой кости.
Фиг.9.:
1. Плечевая кость кролика.
2. Цементная пробка.
3. Формирующийся туберкулезный очаг в головке плечевой кости.
Заявляемый способ позволяет:
1. Обеспечивать моделирование омартрита благодаря распространению специфического туберкулезного воспаления из субхондрально созданного очага на сустав и развитию патологического процесса, адекватного в организме больного человека.
2. Не применять местно туберкулостатический препарат, так как при данном способе предупреждается рассеивание инфекции в момент заражения.
3. Получить туберкулезный омартрит путем субхондрального введения культуры МВТ при использовании меньшей заражающей дозы и более точной локализации инфекта.
4. Предупредить кровотечение и вторичное инфекционное обсеменение за счет использования свойств гемостатической губки в момент заражения.
Способ осуществляется следующим образом:
Анальгезирующий эффект обеспечивается путем внутримышечного введения 2% раствора промедола в объеме, соответствующем массе животного. Кролик фиксируется на станке в боковом положении при максимально вытянутых верхних и нижних конечностях.
1-й Этап - подготовка и осуществление хирургического доступа. Кожа в области лопатки и плеча освобождается от шерсти и обрабатывается йодом. Операционное поле отграничивается стерильными салфетками. Производится разрез кожи длиной около 4.0 см от латеральной трети ости лопатки до границы верхней и средней трети плеча по передне-наружному краю. После рассечения кожи обнажается дельтовидная мышца и пальпаторно определяется большой бугорок. Рассекается поверхностная фасция и тупо расслаивается по ходу волокон дельтовидная мышца до суставной капсулы. В области большого бугорка, ориентировочно на 0.5 см ниже суставной щели, по направлению кпереди сдвигается надкостница и капсула сустава, которая в данном месте наиболее тонкая (в отличие от боковых отделов, где капсула усилена сухожилиями мышц).
2-й Этап - формирование канала в губчатом костном веществе головки плечевой кости. После тщательного гемостаза в области освобожденной площадки шилом перфорируется кортикальный слой и формируется канал шириной 1.5-2.0 мм и глубиной около 10 мм (фиг.1). Затем при помощи сверла он расширяется, приобретая форму цилиндрического в губчатой кости, рассверливается субхондральный кортикальный слой. Угол заточки сверла должен максимально приближаться к 180° во избежание повреждения острым конусом хрящевого покрова и проваливания сверла в полость сустава (фиг.2). Наблюдавшееся при этом иногда значительное кровотечение из губчатой кости временно останавливается при помощи тампонады турундой с перекисью водорода.
3-й Этап - введение культуры МБТ в субхондральный слой. Фрагмент гемостатической губки (фиг.3) вводится в троакар, который представляет собой сточенную иглу для плевральной пункции с мандреном (фиг.4). Затем берется игла для заражения животных, которая являет собой инъекционную иглу со сточенным острием (перпендикулярно ее длиннику) и хорошо пригнанным мандреном. Перед зарядкой инфектом периферический конец иглы освобождается от мандрена на 1.0-2.0 мм, после этого игла погружается в заранее приготовленную культуру МБТ. Для этих целей используется ослабленная человеческая культура - штамм 320 ЛИХТ в дозе 0.3 мг (фиг.5). Культура вводится в дистальный конец гемостатической губки (фиг.6).
На завершающем 4-м этапе турунда с перекисью водорода извлекается из костного канала и в глубину вводится троакар. Гемостатическая губка выталкивается мандреном в субхондральную часть сформированного канала, через несколько секунд после увеличения губки в объеме троакар извлекается. Канал в губчатом веществе эпифиза кости закрывается приготовленной цементной пломбой в условиях хорошего гемостаза (фиг.7). После тщательного удаления остатков цемента из мягких тканей рана зашивается наглухо кетгутом погружным швом.
В экспериментальных исследованиях доказано, что в случаях применения указанной техники заражения у подопытных животных через 1 месяц закономерно формируется субхондрально расположенный туберкулезный очаг, который вскоре распространяется на плечевой сустав.
При этом развиваются в начале реактивные воспалительные изменения в суставе, а дальнейшем - разрушение суставного хряща и поражение синовиальной оболочки с образованием выпота в суставе. Патологический процесс, полученный у кроликов, полностью соответствует патологии, наблюдаемой при аналогичном заболевании у человека. Состоятельность полученной экспериментальной модели подтверждена на 5 кроликах, что позволяет в дальнейшем проводить разработку хирургических методов лечения туберкулезного омартрита.
Пример:
Кролик №6 породы шиншилла, пол - самец, исходная масса - 2780 г, температура 39.0°С.
Внутримышечно введен 1.0 мл 2% раствора промедола. Кролик фиксирован к станку в правом боковом положении. После подготовки операционного поля произведен передне-наружный доступ к левому плечевому суставу. В проекции большого бугорка, ориентировочно на 0.5 см ниже суставной щели, по направлению кпереди сдвинута надкостница и капсула сустава. После тщательного гемостаза в области освобожденной площадки шилом выполнен канал шириной 1.5-2.0 мм и глубиной около 10 мм. Затем при помощи сверла сформирован цилиндрический костный канал, рассверлен субхондральный кортикальный слой. Наблюдавшееся при этом кровотечение из губчатой кости временно остановлено при помощи тампонады турундой с перекисью водорода. Следующий этап - введена культура МБТ в субхондральный слой губчатой кости по описанному выше способу. Канал в губчатом веществе эпифиза кости закрыт цементной пломбой в условиях гемостаза. После тщательного удаления остатков цемента из мягких тканей рана зашита наглухо кетгутом погружным швом.
После операции за животным проводилось ежедневное наблюдение с детальным клиническим осмотром, взвешиванием, исследованием функции сустава. После заживления операционной раны клинический осмотр осуществлялся 1-3 раза в неделю, в зависимости от общего состояния животного, характера местных изменений. При клиническом обследовании животного учитывались его подвижность, поза и характер передвижения, после произведенного общего осмотра прооперированный сустав сравнивался с "контрольным" контрлатеральным суставом. Верхняя конечность осматривалась, начиная с плечевого сустава, обращалось внимание на такие детали, как положение конечности, общий вид ее по сравнению с противоположной стороной, контуры сустава и т.д. Пальпация расширяла и дополняла полученные данные сведениями о состоянии кожных покровов, мягких тканей, окружающих сустав (связках и капсуле), эпиметафизах костей и содержимом полости сустава. В дальнейшем определялась функциональная способность, измерялся объем движений в суставе.
Проведенные наблюдения показали, что кролик непосредственно после операции был малоактивным, щадил оперированную конечность, плохо принимал пищу, в первые 8-10 суток его масса незначительно снижалась. Местно в области вмешательства был незначительный воспалительный отек и инфильтрация мягких тканей, которые через 10-12 суток полностью прошли, и рана зажила первичным натяжением. Однако в первые 10 суток подвижность в оперированном суставе уменьшилась, кролик щадил оперированную конечность. В дальнейшем воспалительные изменения в области операции были слабо выражены, объем движений в суставе временно увеличился. Стихание реактивных воспалительных явлений после операции и заживление операционной раны сопровождались улучшением общего состояния животного. Он вновь легко передвигался и уже через 20 суток набрал исходную массу, которая сохранилась вплоть до выведения кролика из опыта. После 20-х суток объем движений постепенно уменьшался.
После эвтаназии животного (1 месяц после операции) при макроскопической оценке костного препарата оценивались:
1) состояние миелоидного костного мозга вблизи головки плечевой кости - без видимых признаков дегенеративно-дистрофического процесса;
2) состояние суставной поверхности плечевой кости - наблюдалась поверхностная краевая изъеденность хряща; по всей его поверхности наступило изменение цвета - он приобрел синюшный оттенок; прозрачность хряща изменилась только над белесовато-тусклыми очагами в центре суставной поверхности (диаметр просветления около 0.3 см).
При осмотре других органов и систем признаков туберкулезного поражения не отмечалось. Рентгенологически к 1-му месяцу после заражения в месте введения культуры отмечалось наличие очага деструкции размером около 1.0 мм (фиг.9).
При гистологическом исследовании: в проксимальном эпифизе плечевой кости определялся субхондрально расположенный туберкулезный очаг диаметром около 3.0 мм, состоящий из казеозно-некротических масс в центре с распространением специфического процесса на сустав. Суставной хрящ над областью очага был фиброзно изменен, отмечались грубые коллагеновые волокна в его толще, местами были видны дистрофические изменения - исчезновение клеток и беспорядочное расположение изогенных групп рядом с участками нормального хряща. На отдельных участках суставной хрящ отслаивался вследствие развития субхондрального туберкулезного процесса (фиг.8).
Таким образом, при использовании предлагаемого способа у кроликов было получено туберкулезное поражение плечевого сустава, близкое к естественному течению патологического процесса у человека, позволяющее решать вопросы его хирургического лечения.
Экспериментальная модель туберкулезного омартрита, полученная по разработанному нами способу, позволяет проследить процесс распространения туберкулезного воспаления из внутрикостного очага на сустав у мест прикрепления синовиальной оболочки. Установлена закономерность патологических процессов в последней с развитием фиброза и деформирующих изменений в суставе. Этим определена необходимость своевременной операции на суставе в объеме некрэктомии, замещения операционного дефекта трансплантатом и восстановления хрящевого покрова, в частности путем перихондриопластики.
Способ моделирования туберкулезного омартрита путем местного заражения животных культурой микобактерий туберкулеза, при этом перфорируют кортикальный слой у края суставной капсулы плечевого сустава, формируют канал в губчатом веществе головки плечевой кости, рассверливают отверстие в кортикальном слое под суставным хрящом, подготавливая ложе для субхондрального очага, куда при помощи троакара вводят культуру микобактерий туберкулеза на гемостатической губке.