Способ диагностики жизнеспособности миокарда
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности к кардиологии. Способ позволяет повысить точность диагностики жизнеспособности миокарда посредством позитронной эмиссионной томографии (ПЭТ). Проводят ПЭТ с 18F-фтордезоксиглюкозой (18F-ФДГ), при этом при определении жизнеспособности миокарда у пациентов с нарушением углеводного обмена им предварительно в течение 8-12 дней ежедневно 3 раза в день вводят перорально триметазидин в дозе 20 мг, за сутки до ПЭТ - исследования исключают из пищевого рациона кофеинсодержащие продукты и лекарственные средства и при захвате 18F-ФДГ в миокарде 50% и более от величины ее максимального накопления диагностируют жизнеспособный миокард, менее 50% - нежизнеспособный. 8 ил.
Реферат
Изобретение относится к медицине, точнее к кардиологии, и может найти применение в диагностике и выборе тактики лечения ишемической болезни сердца (ИБС), в том числе у пациентов с сахарным диабетом или нарушением толерантности к углеводам, перенесших инфаркт миокарда.
Исследование жизнеспособности миокарда чрезвычайно важно для определения тактики ведения и прогноза хирургического лечения больных ИБС с тяжелой систолической дисфункцией левого желудочка, осложненной недостаточностью кровообращения.
У больных ИБС, перенесших инфаркт миокарда, нарушения сегментарной сократимости миокарда могут быть обратимыми, когда кардиомиоциты сохраняют свою жизнеспособность, и необратимыми, когда эти нарушения обусловлены фиброзными или рубцовыми изменениями.
Известно, что больные с жизнеспособным миокардом при консервативном лечении имеют более неблагоприятный прогноз заболевания по сравнению с больными, у которых нарушение сократимости обусловлено только рубцовыми изменениями.
В связи с этим выявление жизнеспособности миокарда является очень важным критерием для определения тактики лечения больных с регионарными нарушениями сократимости левого желудочка. В частности, жизнеспособность миокарда наряду с информацией о состоянии коронарного русла и фракцией выброса может иметь решающее значение при определении показаний к оперативному лечению ИБС, поскольку своевременная хирургическая реваскуляризация жизнеспособных дисфункционирующих участков восстанавливает их сократимость, снижает вероятность сердечной недостаточности и улучшает прогноз. Выявление жизнеспособного миокарда наиболее актуально для больных, имеющих выраженные нарушения систолической функции с фракцией выброса 35% и менее, так как в этом случае риск оперативного вмешательства оправдывается потенциальной возможностью улучшения как регионарной, так и глобальной сократимости левого желудочка.
Следует отметить, что особую группу составляют пациенты с нарушением углеводного обмена (больные сахарным диабетом и с нарушением толерантности к углеводам), поскольку риск развития у них интра- и послеоперационных осложнений намного выше, чем у больных с нормальным углеводным обменом. В связи с этим определение тактики ведения этой группы больных требует высочайшей точности оценки жизнеспособности миокарда для установления необходимости и возможности оперативного лечения.
Жизнеспособный миокард характеризуется несколькими признаками: целостностью клеточных мембран, сохраненной метаболической активностью и инотропным резервом. Эти характеристики формируют основу различных современных методов исследования, применяемых для выявления жизнеспособности миокарда.
Наиболее апробированным методом выявления миокардиальной жизнеспособности является перфузионная сцинтиграфия миокарда с 201Tl-хлоридом. Однако несмотря на хорошую чувствительность данного метода, при выполнении сцинтиграфии с 201Tl-хлоридом наблюдается относительно высокий процент ложноположительных результатов, за счет чего снижается его специфичность [Вах J.J., Cornel J.H., Visser F.V., et al. Prediction of recovery of regional ventricular dysfunction following revasculariztion; Comparison of FIS-fluorodeoxyglucose SPECT, thallium-201 stress-reinjection SPECT and dobutomine echocardiography. // J. Am. Coil Cardiol. 1996; 28, P. 558-564]. Кроме того, длинный период полураспада изотопа 201Tl (73,1 часа) создает высокую лучевую нагрузку на пациента.
Одним из наиболее распространенных и доступных методов выявления жизнеспособности миокарда является стресс-эхокардиография с добутамином - синтетическим инотропным бета-адреностимулятором [Дядык А.И., Багрий А.Э., Лебедь И.А., Ватутин Н.Т., Тарадин Г.Г., Щукина Е.В. Стресс - эхокардиография. Сообщение 1 // Кардиология. - 1996. - Т. 36. - №1. - С.57-60, Afridi I., Kleiman N.S., Raizer A.E. et al. Dobutamine echocardiography in myocardial hibernation. Optimal dose and accuracy in predicting recovery of ventricular function after coronary angioplasty // Circulation. - 1995. - Vol.91. - P.663-670].
Метод нагрузочной эхокардиографии с добутамином, как отмечают авторы, имеет существенное значение в выявлении участков жизнеспособного миокарда. Эти данные важны не только с точки зрения знаний о патофизиологии миокарда, но и прогнозирования гемодинамического успеха таких вмешательств как транслюминальная балонная ангиопластика коронарных сосудов или операция аортокоронарного шунтирования, а также для правильного выбора терапевтической тактики.
Добутамин в малых дозах (5-10 мкг/кг мин) способен временно восстановить или улучшить сократимость гипо- или акинетичных участков миокарда, имеющих инотропный резерв. Стресс-тесты с малыми дозами добутамина, как правило, не индуцируют ишемию миокарда и поэтому могут использоваться даже у пациентов с тяжелой стенокардией и сердечной недостаточностью.
Признаком жизнеспособности дисфункционирующих сегментов миокарда является улучшение их сократимости и при инфузии высоких доз добутамина, когда после временного улучшения сократимости вновь появляются участки регионарной дисфункции (так называемый двухфазный ответ). Считается, что более надежным маркером жизнеспособности миокарда является его способность к ишемизации, которая определяется лишь при введении высоких доз добутамина. Между тем, введение высоких доз его при выраженной левожелудочковой дисфункции противопоказано и исследование приходится ограничивать введением малых доз препарата. С особой осторожностью стресс-эхокардиографию с добутамином следует выполнять пациентам с желудочковыми нарушениями ритма, так как введение даже малых доз препарата может вызвать у данной категории пациентов жизнеугрожающие осложнения: гемодинамически значимую желудочковую тахикардию или фибрилляцию желудочков.
Достаточно эффективным в диагностике жизнеспособности миокарда является сочетанное исследование перфузии и метаболизма глюкозы в миокарде. Marshall с соавт. впервые предложили метод установления жизнеспособности миокарда путем определения сохранности метаболизма 18F-ФДГ в дисфункционирующих сегментах со сниженной перфузией [Marshall R.S., Tilisch J.H., Phelps M.E. et al. Identification and differentiation of resting myocardial ischemia and infarction in man with positron emission tomography, 18-F-labeled fluorodeoxyglucose, and N-13-ammonia. //Circulation. - 1983. - №67. - P.766-778]. Проведенные исследования свидетельствуют о высокой прогностической ценности одновременной оценки перфузии и метаболизма глюкозы в миокарде у пациентов с ИБС. Однако сочетанное изотопное исследование перфузии и метаболизма миокарда всегда сопряжено с повышением финансовых затрат на исследования и увеличением лучевой нагрузки на пациента.
Ввиду достаточно серьезных недостатков у вышеперечисленных методов оценки жизнеспособности миокарда в последние годы в мировой практике более широкое распространение получила позитронная эмиссионная томография (ПЭТ). На сегодняшний день она является, по мнению многих авторов, наиболее точным методом выявления метаболической активности в миокарде.
Как известно, в условиях недостаточного поступления кислорода увеличивается утилизация глюкозы как метаболического субстрата кардиомиоцитов за счет ее большой «кислородной эффективности» и усиления процессов анаэробного гликолиза. ПЭТ исследования у больных ИБС позволили предположить, что накопление 18F-фтордезоксиглюкозы (18F-ФДГ) - синтетического аналога нативной глюкозы в дисфункционирующих участках миокарда со сниженным коронарным кровотоком свидетельствует об их жизнеспособности, что и было затем подтверждено многочисленными работами. Однако ПЭТ с 18F-ФДГ имеет ряд недостатков, связанных с неравномерностью накопления РФП в нормальном миокарде. Большое влияние на захват 18F-ФДГ в миокарде оказывают свободные жирные кислоты, которые являются основным метаболическим субстратом кардиомиоцитов в условиях достаточного поступления кислорода. Поэтому участки гипометаболизма глюкозы могут быть обусловлены не только нежизнеспособным миокардом, но быть следствием субстратного приоритета жирных кислот.
Методологически возможны два способа исследования метаболизма 18F-ФДГ: натощак и на фоне искусственной эугликемии гиперинсулинемии, которые достигаются инфузией глюкозо-инсулиновой смеси в течение 2-х часов перед исследованием. В норме ПЭТ исследование с 18F-ФДГ натощак обнаруживает низкое накопление в миокарде, так как в условиях достаточного поступления кислорода основным энергетическим источником для кардиомицитов являются жирные кислоты. Такой способ оказался высокочувствительным в обнаружении в дисфункциональных участках миокарда жизнеспособных очагов малого размера, выявляемых как зоны с повышенным захватом глюкозы на фоне пониженного накопления РФП в здоровых регионах, а также в участках некроза.
Однако исследования натощак недостаточно информативны. В условиях достаточного поступления кислорода к сердечной мышце при ПЭТ - исследовании с 18F-ФДГ, выполненном натощак, миокард определяется на фоновом уровне, что затрудняет его визуализацию. Соотношение накопления миокард/кровь у здоровых пациентов после 12 часового голода составляет 1,5, тогда как в условиях искусственной гипергликемии оно достигает 3. Кроме того, при выполнении исследования натощак наблюдается гетерогенность накопления 18F-ФДГ, что затрудняет правильную интерпретацию данных ПЭТ исследования. Некоторые авторы отмечают несостоятельность попыток прогнозирования восстановления сократимости в зонах региональной дисфункции левого желудочка, если ориентироваться на сохранный метаболизм в небольших участках миокарда, обнаруживаемых при исследовании с 18F-ФДГ натощак, так как для восстановления сократительной функции после реваскуляризации требуется сохранность не менее 70% зоны поражения, в то время как этот способ не позволяет ее точно определить.
По этим причинам наиболее широко применяется исследование с 18F-ФДГ после предварительного перорального или внутривенного введения глюкозы с целью увеличения концентрации субстрата в крови и сдвига метаболизма в миоцитах в сторону гликолиза. Наиболее апробированной является методика введения глюкозо-инсулиновой смеси (hyperinsulinemic-euglycemic clamping), инфузия которой увеличивает накопление 18F-ФДГ в миокарде вследствие повышения процессов гликолиза и синтеза гликогена, а также, в большей степени, за счет угнетения липолитических процессов и снижения уровня жирных кислот в крови. Однако методика введения глюкозо-инсулиновой смеси очень трудоемкая, т.к. необходим постоянный контроль уровня глюкозы плазмы крови у пациента во избежание гипогликемического состояния, что особенно опасно для пациентов с сахарным диабетом. Кроме того, длительность инфузии составляет более 2-х часов, требуется наличие специальной аппаратуры в отделении: два перфузора для дозированных внутривенных иньекций, глюкометр, тест-полоски.
Такая методика позволяет получить изображение миокарда хорошего качества преимущественно у больных с нормальным углеводным обменом, у больных же с нарушением углеводного обмена даже при соблюдении всех этих условий хорошее изображение миокарда удается получить далеко не у всех пациентов.
Альтернативой методики введения глюкозо-инсулиновой смеси считается пероральный прием препарата «Аципимокс» (производное никотиновой кислоты), который уменьшает концентрацию свободных жирных кислот в плазме крови и тем самым повышает утилизацию глюкозы кардиомиоцитами. Однако в России и ряде других стран данный препарат не зарегистрирован, и его использование в подготовке перед ПЭТ исследованием невозможно. Внутривенная иньекция никотиновой кислоты или пероральный прием препарата «Никошпан» субъективно плохо переносится пациентами в связи с выраженной кожной гиперемической реакцией.
Следует еще раз отметить, что методологические трудности в выполнении и интерпретации ПЭТ исследования миокарда с 18F-ФДГ наиболее часто наблюдаются в группе пациентов с нарушением углеводного обмена: сахарным диабетом и нарушением толерантности к углеводам. Как известно, транспорт нативной глюкозы и ее синтетического аналога 18F-ФДГ в кардиомиоциты осуществляется инсулин-зависимым рецептором-транспортером (GLUT IV). Абсолютная недостаточность инсулина у пациентов с сахарным диабетом 1 типа и снижение плотности инсулиновых рецепторов, а также снижение их чувствительности к инсулину при сахарном диабете 2 типа и при нарушении толерантности к углеводам уменьшают захват 18F-ФДГ кардиомиоцитами, что приводит к неудовлетворительной визуализации левого желудочка и делает невозможной достоверную интерпретацию ПЭТ изображений. В то же время, определение жизнеспособности миокарда у пациентов с сахарным диабетом и нарушением толерантности к углеводам наиболее актуально, так как своевременная реваскуляризация жизнеспособного дисфункционирующего миокарда у данной категории пациентов приводит к увеличению продолжительности жизни, снижению риска развития острых коронарных осложнений и сердечной недостаточности. Однако риск развития интраоперационных и послеоперационных осложнений у больных с сахарным диабетом, как уже отмечалось, намного выше, чем в группе пациентов с нормальным углеводным обменом. Поэтому точная оценка жизнеспособности дисфункционирующего миокарда позволяет корректно определить показания к оперативному лечению ишемической болезни сердца у пациентов с сахарным диабетом.
В связи с этим в последние годы большое внимание уделяется диагностическим возможностям ПЭТ с мечеными жирными кислотами или 11С-ацетата для диагностики жизнеспособности миокарда. Groppler с соавторами [Gropler R.J., Geltman E.M., Sampathkumaran К. et al. /Comparison of carbon-11-acetate with fluorine-18-deoxyglucose for delineating viable myocardium by positron emission tomography. // J. Am. Coll. Cardiol - 1993 - №22 - P.1587-1597] установили, что прогностическая точность в определении жизнеспособности миокарда у некоторых пациентов при исследовании с 11С-ацетатом выше, чем с 18F-ФДГ, так как в 15% случаев участки миокарда, показавшие гиперметаболизм глюкозы, оказались нежизнеспособными в связи с тем, что анаэробный метаболизм был не в состоянии длительно поддерживать их жизнеспособность. Поскольку утилизация 11C-ацетата не зависит от уровня потребляемых миокардом метаболических субстратов и точно отражает уровень окислительного метаболизма, его применение, возможно, является оптимальным при оценке жизнеспособности миокарда. Однако период полураспада изотопа 11С невелик (20 минут), поэтому его использование возможно лишь в крупных ПЭТ-центрах, оснащенных медицинским циклотороном и радиохимической лабораторией. Лаборатории радиоизотопных методов исследования, в которых установлены позитронные томографы и однофотонные томографы с высокоэнергетическими коллиматорами для регистрации фотонной энергии в 511 КЭв (энергия, образующаяся при аннигиляции позитрона и электрона при реакции испускания позитрона) и блоками совпадения, в повседневной практике используют РФП, меченные позитрон-излучающим изотопом 18F, т.к. период полураспада данного радионуклида составляет 2 часа, что позволяет осуществлять транспортировку меченных 18F РФП из радиохимических лабораторий. Поэтому 18F-ФДГ до сих пор сохраняет свои позиции в качестве «золотого стандарта» жизнеспособности миокарда.
Наиболее близким к предлагаемому является способ диагностики жизнеспособного миокарда посредством ПЭТ с 18F-фтордезоксиглюкозой (18F-ФДГ), описанный в статье [Schmidta M., Votha E., Schneiderb C.A., et al. F-18-FDG uptake is a reliable predictory of functional recovery of akinetic but viable infarct regions as defined by magnetic resonance imaging before and after revascularization // Magnetic Resonance Imaging. - 2004. - V. 22. - P.229-236]. В данном исследовании изучалась информативность ПЭТ с 18F-ФДГ в диагностике жизнеспособного миокарда у пациентов с нарушениями регионарной сократимости левого желудочка вследствие постинфарктного кардиосклероза. Исследование выполнялось на позитронном эмиссионном томографе «ЕСАТ EXACT 921» Siemens CTI.
За 1 час до внутривенного введения 18F-ФДГ пациенты перорально получали 50 г глюкозы. 18F-ФДГ вводилась внутривенно струйно в дозе 370 МБк. Через 30 минут после инъекции 18F-ФДГ выполнялось эмиссионное сканирование длительностью 30 минут, которому предшествовало трансмиссионное исследование для коррекции рассеивания излучения, что способствует уменьшению количества артефактов. Полученные в результате сканирования синограммы были реконструированы в трансаксиальные срезы с использованием способа фильтрации "Back projection" с фильтром Hanning 0,4. Для получения изображения левого желудочка по короткой и двум длинным осям трансаксиальные срезы были реориентированы. Оценка полученных сканов выполнялась с использованием полуколичественного анализа, для чего использовался метод полярного картирования. На первом этапе построения полярной карты на томографических срезах, выполненных по короткой оси сердца, автоматически выявлялась область с максимальным накоплением радиофармацевтического препарата (РФП), затем автоматически выполнялось построение функциональных изображений сторальных диаграмм миокарда от верхушки до базальных отделов. В результате получалось изображение левого желудочка (полярная карта), на котором интегрально визуализировался относительный захват РФП в каждом отделе миокарда, выраженный в процентах. В качестве референтного сегмента, относительно которого производился расчет захвата РФП в миокарде, выбирался участок левого желудочка с максимальным накоплением 18F-ФДГ, нормальной сократимостью и относящийся к бассейну коронарной артерии со степенью стеноза не более 75%. Основываясь на уровне захвата РФП в процентном отношении к его накоплению в референтном сегменте левого желудочка, дисфункционирующие сегменты были разделены на 2 группы: жизнеспособные (накопление РФП ≥50% от максимального накопления в референтном сегменте) и нежизнеспособные (накопление РФП <50% от максимального накопления в референтном сегменте).
Авторы статьи продемонстрировали высокую информативность ПЭТ с 18F-ФДГ в дифференциальной диагностике жизнеспособного и нежизнеспособного дисфункционирующего миокарда у пациентов с постинфарктным кардиосклерозом, которая подтверждалась улучшением систолической функции левого желудочка после хирургической реваскуляризации. В связи с невозможностью получения достоверных данных у больных с сахарным диабетом и нарушением толерантности к углеводам в условиях исследования авторы работы таких пациентов в исследование не включали.
Таким образом, этот метод, как и другие известные методы определения состояния миокарда в постинфарктном периоде посредством ПЭТ, имеет существенное ограничение, поскольку делает невозможной достоверную интерпретацию ПЭТ изображений у пациентов с сахарным диабетом и нарушением толерантности к углеводам, что значительно снижает его ценность.
Технический результат настоящего изобретения состоит в повышении точности ПЭТ диагностики жизнеспособности миокарда за счет возможности использования его с получением достоверных результатов у пациентов с нарушением углеводного обмена.
Этот результат достигается тем, что перед выполнением ПЭТ пациентам с нарушением углеводного обмена в течение 8-12 дней ежедневно 3 раза в день вводят перорально триметазидин в дозе 20 мг, за сутки до ПЭТ-исследования исключают из пищевого рациона кофеинсодержащие продукты и лекарственные средства и при захвате 18F-ФДГ в миокарде 50% и более от величины ее максимального накопления диагностируют жизнеспособный миокард, менее 50% - нежизнеспособный.
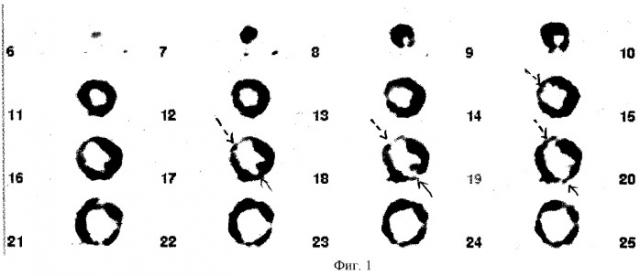
Занимаясь в течение ряда лет диагностикой ИБ методом ПЭТ с 18F-ФДГ, в том числе определением жизнеспособности миокарда, нередко получали ложноположительные результаты, когда низкий захват 18F-ФДГ обнаруживался в жизнеспособном миокарде. Так, при исследовании метаболизма миокарда у пациента с постинфарктным кардиосклерозом нижне-задней локализации на томосцинтиграммах по короткой оси левого желудочка определялись два участка выраженного снижения метаболизма глюкозы, один из которых был расположен в постинфарктной области (базальных сегментах нижней и задней стенок левого желудочка) (фиг.1, стрелка), а второй - в средних сегментах передней стенки левого желудочка и межжелудочковой перегородки (фиг.1, стрелка-пунктир) и по локализации не соответствовал бассейну инфаркт-связанной коронарной артерии. При последующем выполнении ПЭТ с перфузионным РФП 13N-аммонием в базальных сегментах нижней и задней стенок левого желудочка определялось выраженное снижение перфузии миокарда (согласованный дефект перфузии и метаболизма), что подтверждало нежизнеспособность миокарда в данной области (фиг.2, стрелка), однако в средних сегментах передней стенки левого желудочка и межжелудочковой перегородки нарушения перфузии выявлены не были, что нехарактерно для нежизнеспособного миокарда в данной области (фиг.2, стрелка-пунктир). Следует отметить, что одним из аспектов данной научной работы было изучение влияния различных видов противоишемической консервативной терапии на перфузию и метаболизм миокарда. При этом было отмечено, что у больных, принимавших антиишемический препарат «Триметазидин», при выполнении ПЭТ наблюдалось равномерное распределение РФП в участках жизнеспособного миокарда и отсутствие его захвата в зонах постинфарктного кардиосклероза, что значительно облегчало у них дифференциальную диагностику жизнеспособного и нежизнеспособного миокарда. Также было отмечено, что у пациентов, не употребляющих кофеинсодержащие продукты (чай, кофе, шоколад), также улучшалось качество визуализации миокарда левого желудочка.
Это побудило вышеизложенному пациенту повторить ПЭТ-исследование метаболизма миокарда после 10-дневного приема им препарата "Триметазидин", назначение которого было согласовано с лечащим кардиологом. Повторное ПЭТ исследование было выполнено через 11 дней. На серии томограмм левого желудочка при исследовании метаболизма глюкозы визуализировался только один участок выраженного снижения метаболизма глюкозы, расположенный в базальных сегментах нижней и задней стенок левого желудочка (фиг.3, стрелка), что соответствовало нежизнеспособному миокарду и совпадало с данными фиг.2, стрелка. В оставшихся сегментах левого желудочка отмечалось равномерное распределение 18F-ФДГ, и захват РФП составлял более 50% от максимального накопления, что позволило расценить миокард указанных сегментов как жизнеспособный и уточнить диагноз.
На основании установленного диагноза пациенту была выполнена хирургическая реваскуляризация в средних сегментах передней стенки левого желудочка и межжелудочковой перегородки, что привело к стабилизации его состояния.
В связи с вышеизложенным решили попробовать провести аналогичное исследование у пациента с нарушением углеводного обмена, а именно выполнить ПЭТ до и на фоне приема триметазидина.
У пациента Т. при анализе электрокардиограмм (ЭКГ) в динамике в отведениях, характеризующих переднюю стенку левого желудочка, были обнаружены изменения, характерные для очагового поражения миокарда, поэтому был заподозрен постинфарктный кардиосклероз, инфаркт миокарда неизвестной давности. Биохимический анализ крови обнаружил повышение концентрации глюкозы в плазме крови до 6,5 ммоль/л. По результатам глюкозо-толерантного теста у пациента было диагностировано нарушение толерантности к углеводам. Учитывая возраст пациента (77 лет), наличие жалоб кардиологического плана, факторов риска ИБС (наследственная предрасположенность, артериальная гипертензия, возраст, пол, нарушение толерантности к углеводам), электрокардиографические указания на перенесенный инфаркт миокарда, пациенту было выполнено комплексное исследование сердечно-сосудистой системы. При стандартном эхокардиографическом исследовании сердца обнаружено снижение показателей глобальной сократимости левого желудочка, диффузная гипокинезия всех отделов миокарда с преимущественным вовлечением передней стенки и межжелудочковой перегородки. Неинвазивная многослойная спиральная компьютерная томография показала тотальный атеросклероз коронарных артерий. Для оценки объема жизнеспособного миокарда пациенту была рекомендована ПЭТ с 18F-ФДГ.
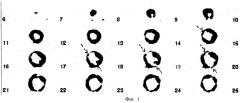
ПЭТ исследование метаболизма миокарда с 18F-ФДГ было выполнено 02.11.2004 г. на позитронном томографе «High Resolution+» через 0,5 часа после введения 372 МБк РФП. За 1 час до исследования пациенту было предложено принять углеводную пищу. Инъекция инсулина перед исследованием не выполнялась, учитывая нормальное значение концентрации глюкозы в плазме крови (6,2 ммоль/л). В методику ПЭТ сканирования входило исследование грудной клетки (10-ти минутная трансмиссия и 20-ти минутная эмиссия). Реконструкция исходных данных выполнялась в on-line режиме с использованием Zoom 2,5 и фильтра "Back projection". На серии левого желудочка при исследовании метаболизма глюкозы отмечалось выраженное диффузно-неравномерное распределение РФП. Отмечался высокий остаточный фон РФП в полости левого желудочка, что очень затрудняло интерпретацию полученных результатов (фиг.4).
После этого пациенту был назначен препарат «Триметазидин» в дозировке по 20 мг 3 раза ежедневно, и через 8 дней ПЭТ исследование миокарда с 18F-ФДГ повторили. За сутки до исследования пациенту было рекомендовано воздержаться от употребления в пищу кофеинсодержащих продуктов. При повторном ПЭТ исследовании на серии томограмм левого желудочка при исследовании метаболизма глюкозы отмечено равномерное распределение РФП, в среднем сегменте передней стенки левого желудочка определялся небольшой участок снижения захвата РФП, по площади занимавший 1/3 сегмента, захват РФП в этой области составлял 49% от максимального накопления, что позволило расценить его как нежизнеспособный (фиг.5). При последующем выполнении ПЭТ с перфузионным РФП 13N-аммонием определялся согласованный дефект перфузии и метаболизма в среднем сегменте передней стенки левого желудочка, что подтверждало наличие нежизнеспособного миокарда в этой области. На основании установленного диагноза больному было рекомендовано консервативное лечение.
Получение таких убедительных положительных результатов после приема больными триметазидина позволило в дальнейшей работе успешно использовать эту простую методику для выполнения ПЭТ больным с ИБС, регионарной и глобальной систолической дисфункцией левого желудочка и нарушением углеводного обмена.
Сущность способа заключается в следующем.
За 8-12 дней до ПЭТ исследования пациенту назначается пероральный прием препарата "Триметазидин" в дозе 20 мг 3 раза в день. За сутки до исследования пациенту рекомендуется воздержаться от употребления в пищу кофеинсодержащих продуктов. В день исследования разрешается легкий углеводный завтрак. Не рекомендуется отмена пероральных антидиабетических препаратов или инсулина в день исследования. За 1 час до инъекции 18F-ФДГ пациенту назначается прием углеводной пищи, если концентрация глюкозы плазмы крови не превышает значения 9 ммоль/л. При превышении данного показателя пациенту дополнительно выполняется подкожная иньекция простого инсулина в дозе 4-6 стандартных единиц. Согласно международным рекомендациям ПЭТ сканирование с 18F-ФДГ осуществляется через 30 минут после внутривенного введения РФП в дозе из расчета 180 МБк/м2· площадь поверхности тела (м2). ПЭТ исследование выполняется в горизонтальном положении на спине. Осуществляется сканирование одной анатомической зоны (грудной клетки). Традиционно для коррекции рассеиванию излучения, что способствует уменьшению количества артефактов, методика ПЭТ миокарда предусматривает выполнение трансмиссии с использованием 68Ge/68Ga источников, которая предшествует эмиссионному сканированию. Длительность исследования определяется международными стандартами, при этом трансмиссионное сканирование составляет 10 минут, и за ним следует эмиссионное сканирование длительностью 20 минут. Реконструкция исходных данных выполняется в on-line режиме с использованием Zoom 2,5 и фильтра "Back projection". Визуальная оценка равномерности распределения РФП в миокарде проводится по срезам, построенным по вертикальной, горизонтальной и короткой осям левого желудочка, толщина среза - 1,5 см. Полуколичественная оценка выполняется по унифицированным 9-сегментарной или 16-сегментарной моделям левого желудочка (в зависимости от программного обеспечения позитронного томографа для постпроцессинговой обработки результатов) с использованием методики полярного картирования, выполняющейся программным комплексом автоматически. Равномерность распределения РФП в различных сегментах миокарда оценивается в процентном отношении к величине максимального накопления, и если захват 18F-ФДГ миокарде составляет 50 и более процентов от величины ее максимального накопления, то диагностируется жизнеспособный миокард, менее 50% - нежизнеспособный.
Сущность метода поясняется следующими примерами.
Пример 1. Пациентка Р., 1943 г.р., обследована в отделении ПЭТ ЦНИРРИ. Диагноз: гипертоническая болезнь 2 ст., риск 4. ИБС, постинфарктный кардиосклероз, трансмуральный инфаркт миокарда передней локализации. Сахарный диабет 2 типа, инсулинопотребный.
Из анамнеза: В декабре 2003 года перенесла обширный трансмуральный инфаркт миокарда передней локализации без предшествующей стенокардии. Постинфарктный период протекал без осложнений. В январе 2004 года была выписана из кардиологического стационара, где получала лечение по поводу инфаркта миокарда, для амбулаторного наблюдения. При эхокардиографическом исследовании, выполненном в амбулаторных условиях, были выявлены нарушения регионарной сократимости левого желудочка в области верхушки, передне-перегородочной области левого желудочка. Больная была проконсультирована кардиохирургом для решения вопроса о целесообразности хирургического лечения ишемической болезни сердца в связи с сопутствующим сахарным диабетом 2 типа. Учитывая наличие регионарных нарушений сократимости левого желудочка, пациентке было рекомендовано выполнение ПЭТ с 18F-ФДГ для оценки объема жизнеспособного миокарда.
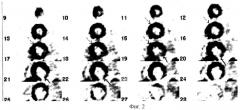
Так как среди сопутствующей патологии у пациентки был обнаружен сахарный диабет 2 типа, ей был назначен препарат «Триметазидин» в дозировке 20 мг 3 раза в сутки ежедневно и через 12 дней было выполнено ПЭТ исследование метаболизма миокарда с 18F-ФДГ позитронном томографе «High Resolution+» через 0,5 часа после введения 302 МБк РФП. Утром в день исследования пациентке были выполнены инъекции инсулина «Протофан» - 2 стандартные единицы и инсулина «Актрапид» - 4 стандартные единицы, которые пациентка получала ежедневно по назначению лечащего эндокринолога. За 1 час до исследования пациентке было предложено принять 50 г глюкозы. Концентрация глюкозы плазмы крови составила 6,3 ммоль/л. В методику ПЭТ сканирования входило исследование грудной клетки (10-ти минутная трансмиссия и 30-ти минутная эмиссия). Полученные в результате сканирования синограммы реконструированы в трансаксиальные срезы с использованием способа фильтрации "Back projection" с фильтром Harming 0,4 и Zoom 2,5. На серии левого желудочка при исследовании метаболизма глюкозы визуализировался участок выраженного снижения метаболизма глюкозы (захват РФП составлял 31% от максимального накопления) в верхушечном и среднем сегментах передней стенки левого желудочка и межжелудочковой перегородки, что соответствовало зоне акинезии миокарда по данным эхокардиографии (фиг.6, стрелка). Миокард в этом участке был расценен как нежизнеспособный. Учитывая отсутствие клинических проявлений ИБС, а также наличие нежизнеспособного миокарда в бассейне инфаркт-связанной коронарной артерии пациенте в оперативном лечении было отказано в связи с отсутствием показаний.
При последующем выполнении ПЭТ с перфузионным РФП 13N-аммонием в верхушечном и среднем сегментах передней стенки левого желудочка определялось выраженное снижение перфузии миокарда (согласованный дефект перфузии и метаболизма), что совпадало с данными ПЭТ с 18F- ФДГ о нежизнеспособности миокарда в данной области (фиг.7, стрелка).
Больная находилась на консервативном лечении. При динамическом наблюдении за пациенткой в течение 7 месяцев ухудшения самочувствия у нее не наблюдалось, не отмечалось рецидива стенокардии и манифестации острых коронарных осложнений.
Пример 2. Пациентка Б., 1946 г.р., обследована в отделении ПЭТ ЦНИРРИ. Диагноз: гипертоническая болезнь 3 ст., риск 4. ИБС, стенокардия напряжения III функционального класса, постинфарктный кардиосклероз, нетрансмуральный инфаркт миокарда в 1999 г., аорто-коронарное шунтирование в 1999 г. Нарушение толерантности к углеводам.
Из анамнеза: В феврале 1999 года перенесла нетрансмуральный инфаркт миокарда передне-боковой локализации без предшествующей стенокардии. В постинфарктном периоде отмечает появление болевого синдрома, соответствующего стенокардии напряжения IV функционального класса. Учитывая неэффективность терапии антиишемическими препаратами, в октябре 1999 года была выполнена хирургическая реваскулярицация миокарда. В течение последующих 4 лет самочувствие пациентки было удовлетворительным, она отмечала хорошую переносимость физической нагрузки, болевой синдром не рецидивировал. В апреле-мае 2004 года пациентка вновь отмечает появление ишемического болевого синдрома, что побудило ее обратиться за медицинской помощью к кардиологу в поликлинику по месту жительства, который направил ее на консультацию к кардиохирургу для выполнения коронаро-шунтографии. Коронаро-шунтография выявила нефункционирующий шунт правой коронарной артерии, шунты передней межжелудочковой, диагональной и огибающей ветвей левой коронарной артерии функционировали хорошо. При эхокардиографическом исследовании, выполненном в амбулаторных условиях, была выявлена гипокинезия задней части межжелудочковой перегородки, принадлежащей к бассейну правой коронарной артерии. Пациентке было рекомендовано выполнение ПЭТ 18F-ФДГ для определения жизнеспособного миокарда в бассейне правой коронарной артерии, чтобы в последующем решить вопрос о целесообразности повторного хирургического лечения.
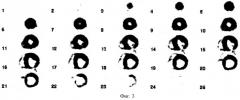
Пациентке был назначен препарат «Триметазидин» в дозировке 20 мг 3 раза в сутки ежедневно и через 12 дней 19.10.2004 г. было выполнено ПЭТ исследование метаболизма миокарда с 18F-ФДГ на позитронном томографе «High Resolution+» через 0,5 часа после введения 379 МБк РФП. За 1 час до исследования пациентке было предложено принять 50 г глюкозы. Концентрация глюкозы плазмы крови перед исследованием составила 5,2 ммоль/л. В методику ПЭТ сканирования входило исследование грудной клетки (10-ти минутная трансмиссия и 30-ти минутная эмиссия). Полученные в результате сканирования синограммы реконструировались в трансаксиальные срезы с использованием способа фильтрации "Back projection" с фильтром Harming 0,4 и Zoom 2,5. На серии левого желудочка при исследовании метаболизма глюкозы участок выраженного снижения метаболизма глюкозы (менее 50% от максимального накопления в интактном миокарде) не определялся. На основании результатов ПЭТ миокард во всех отделах левого желудочка, в том числе в дисфункционирующем миокарде, был расценен как жизнеспособный (фиг.8). Наличие жизнеспособного миокарда в бассейне правой коронарной артерии послужило показанием к проведению повторного оперативного лечения, которое было выполнено в декабре 2004 года. В настоящее время состояние пациентки удовлетворительное, исчез болевой синдром, улучшилась переносимость физических нагрузок. В июне 2005 года планируется выполнение повторной эхокардиографии.
К настоящему времени предлагаемым способом проведено обследование 11 пациентов с ишемической болезнью сердца, регионарной и глобальной систолической дисфункцией левого желудочка и нарушением углеводного обмена. Из них у 2 пациентов был диагностирован сахарный диабет 2 типа, у 1 пациентки - сахарный диабет 1 типа, у 2 пациентов - нарушение толерантности к углеводам.
Предлагаемый способ по сравнению с известными имеет ряд существенных преимуществ.
1. Обеспечивает достоверную диагностику жизнеспособности миокарда у всех б