Способ воздействия на нейродегенеративное нарушение или нарушение миелинизации
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно фармакотерапии. Применяют пептид, содержащий аминокислотную последовательность Thr-R1-Lue-Ile-Asp-Asn-Asn-Ala-Thr-Glu-Glu-Ile-Leu-Tyr, где R1 является D-аланином (SEQ ID N:2) для воздействия на нейродегенеративные нарушения и нарушения миелинизации. Для этого субъекту вводят эффективное количество этого пептида. Указанными нарушениями, при которых полезен заявляемый препарат, являются: полиневропатия, мононевропатия, неврома, сдавливание нерва, травма нерва, контузия, опухоль или неполное пересечение спинного мозга, инфаркт или травма стволового мозга, таламуса или коры головного мозга, сдавливание, разрыв или воспаление дорсальных корней ганглиев, постполиосиндром, травматическое или ишемическое нарушение центральной или периферической нервной системы, рассеянный склероз. Способ расширяет арсенал лекарственных средств для лечения расстройств, связанных с нарушением миелинизации и пациентов с нейродегенеративными нарушениями. 5 з.п. ф.лы. 6 табл., 3 ил.
Реферат
Область техники, к которой относится изобретение
Данное изобретение, главным образом, относится к области терапии болезненных состояний и, более конкретно, к применению пептидов, являющихся производными просапозина, для лечения нейропатической боли.
Уровень техники
Нейропатическая боль является результатом повреждения нерва. В отличие от немедленно развивающейся боли, вызванной повреждением тканей, нейропатическая боль может развиваться в течение дней или месяцев после травматического повреждения. Кроме того, тогда как продолжительность боли, вызванной повреждением тканей, обычно ограничивается периодом восстановления ткани, нейропатическая боль зачастую является длительной или хронической. Более того, нейропатическая боль способна возникать спонтанно или как результат воздействия стимула, который в норме боли не вызывает.
Клинические причины нейропатической боли многочисленны и включают в себя как травму, так и заболевание. Например, травматическое сдавливание или размозжение нерва и травматическое повреждение головного мозга или спинного мозга являются обычными причинами нейропатической боли. Кроме того, большинство травматических повреждений нервов вызывает также развитие невров, в которых боль возникает в результате нарушенной регенерации нерва. В дополнение к этому, связанная со злокачественными опухолями нейропатическая боль возникает, когда в результате опухолевого роста сдавливаются находящиеся поблизости нервы, головной или спинной мозг. Нейропатическая боль также связана с такими заболеваниями, как сахарный диабет или алкоголизм.
К несчастью, нейропатическая боль зачастую оказывается устойчивой к проводимым доступным курсам медикаментозного лечения. В дополнение к этому, проводимые в настоящее время курсы лечения обладают серьезными побочными эффектами, включая, например, нарушения внимания (cognitive changes), седативный эффект, тошноту и, в случае наркотических средств, пристрастие. Многие пациенты, страдающие от нейропатических болей, являются пожилыми или страдают от иных патологических состояний, которые особенно ограничивают их толерантность к побочным эффектам, связанным с проведением доступных курсов медикаментозного лечения. Неспособность проводимых в настоящее время курсов лечения обеспечить ослабление нейропатической боли без вызывания непереносимых побочных эффектов зачастую проявляется в развитии депрессии и суицидальных наклонностей пациентов, страдающих хроническими болями.
Способы ослабления нейропатической боли улучшили бы качество жизни многих людей, страдающих болями, вызванными травмой или заболеванием. Однако в настоящее время не существует эффективных лекарственных средств, которые ослабляли бы нейропатичекую боль без вызывания нежелательных побочных эффектов, таких как седативный эффект и пристрастие. Таким образом, существует потребность в способах воздействия на нейропатическую боль без вызывания нежелательных побочных эффектов. Настоящее изобретение как удовлетворяет данную потребность, так и обеспечивает связанные с этим преимущества.
Сущность изобретения
Настоящее изобретение относится к способу воздействия на нейропатическую боль, приводящему к облегчению этой боли или к ее предотвращению у субъекта путем введения этому субъекту эффективного количества активного фрагмента просапозина. Более конкретно данное изобретение относится к способу воздействия на нейродегенеративные нарушения и нарушения миелинизации у субъекта путем введения субъекту, нуждающемуся в этом, эффективного количества пептида, содержащего аминокислотную последовательность Thr-R1-Lue-Ile-Asp-Asn-Asn-Ala-Thr-Glu-Glu-Ile-Leu-Tyr, где R1 является D-аланином (SEQ ID N:2).
Указанными нарушениями, при которых полезен заявляемый способ, являются: полиневропатия, мононевропатия, неврома, сдавливание нерва, травма нерва, контузия, опухоль или неполное пересечение спинного мозга, инфаркт или травма стволового мозга, таламуса или коры головного мозга, сдавливание, разрыв или воспаление дорсальных корней ганглиев, постполиосиндром, травматическое или ишемическое нарушение центральной или периферической нервной системы, рассеянный склероз.
Примером полиневропатологии могут являться, в частности, диабетическая периферийная невропатология и периферийная невропатология, приобретенная в результате хемиотерапии.
Предпочтительно указанные выше нарушения являются ишемическими нарушениями в центральной или периферической нервной системе.
В качестве пути введения пептида может быть использовано внутривенное, внутримышечное, внутрикожный, подкожный, интракраниальный, в цереброспинальную жидкость, местный, пероральный, чрескожный трансмукозальный или интраназальный пути.
Краткое описание чертежей
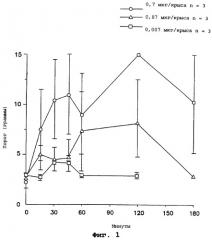
На Фигуре 1 показан порог тактильной allodynia до (время 0) и по прошествии различных сроков после болюсного введения 22-мерного пептида, являющегося производным просапозина (ПОСЛ. ИД. №1), в модели Chung на крысах.
На Фигуре 2 показан порог тактильной allodynia до (время 0) и по прошествии различных сроков после болюсного введения 14-мерного пептида, являющегося производным просапозина (ПОСЛ. ИД. №2), в модели Chung на крысах.
На Фигуре 3 показаны суммарные реакции на 0,5% формалин после внутрибрюшинного введения 14-мерного пептида, являющегося производным просапозина (ПОСЛ. ИД. №2), или физиологического раствора крысам, страдающим сахарным диабетом.
Подробное описание изобретения
Настоящее изобретение относится к способу воздействия на нейропатическую боль у субъекта путем введения нуждающемуся субъекту эффективного количества активного фрагмента просапозина. Как описано здесь, способ по данному изобретению позволяет облегчать нейропатическую боль у субъекта в течение 30 минут после введения. Такой способ применим для облегчения нейропатической боли, являющейся следствием заболевания периферического нерва, спинно-мозговых ганглиев, спинного мозга, ствола мозга, талямуса или коры.
Пептид, применимый в данном изобретении, является производным просапозина, который представляет собой белок, состоящий из 517 аминокислот, первоначально идентифицированный как предшественник четырех сфинголипид-активирующих белков (Kishimoto et al., J. Lipid Res., 33:1255-1267 (1992)). В лизосомах четыре смежных тандемных домена просапозина подвергаются протеолитическому процессингу с образованием сапозинов А, В, С и D, которые активируют гидролиз гликосфинголипидов лизосомальными гидролазами (O'Brien and Kishimoto, FASEB J., 5:301-308 (1991)).
Непроцессированная форма просапозина обнаружена в высоких концентрациях в головном мозге человека и крысы, где она локализуется в поверхностных мембранах нейронов. В период эмбрионального развития мРНК, кодирующая просапозин, в больших количествах присутствует в головном мозге и спинно-мозговых ганглиях. Кроме того, просапозин с высоким сродством связывается с ганглиозидами, которые стимулируют рост нейритов, и облегчает транспорт ганглиозидов из мицелл в мембраны.
Нейротрофная активность просапозина согласуется с его локализацией в популяциях нейронов (O'Brien et al., Proc. Natl. Acad. Sci. USA, 91:9593-9596 (1994); Sano et al., Biochem. Biophys. Res. Commun., 204:994-1000 (1994)). Просапозин стимулирует рост двигательных нейритов in vitro и in vivo и увеличивает активность холин-ацетилтрансферазы, которая является маркером дифференцировки нейронов. В дополнение к этому, просапозин предотвращает клеточную гибель среди нейробластомных клеток (O'Brien et al., supra, 1994; O'Brien et al., FASEB J., 9:681-685 (1995)).
Нейротрофную активность просапозина приписывают сапозину С, домену из 80 аминокислот. 22-Мерный пептид, соответствующий аминокислотам (с 8 по 29) домена сапозина С (ПОСЛ. ИД. №1), стимулирует рост нейритов и активность холин-ацетилтрансферазы и предотвращает клеточную гибель среди нейробластомных клеток (O'Brien et al., supra, 1995).
Просапозин или производный от просапозина 22-мерный пептид (ПОСЛ. ИД. №1), например, способен влиять на функционирование нейрона посредством стимулирования роста нейронов. Однако до настоящего изобретения не было известно, способен ли просапозин или пептидный фрагмент просапозина влиять на функционирование сенсорных нейронов. Более того, нейротрофная активность просапозина или производного от просапозина пептида в стимулировании роста двигательных нейритов становится очевидной лишь по прошествии от 24 до 48 часов (см., например, O'Brien et al., supra, 1994). Нейротрофная активность просапозина или производного от просапозина пептида в течение предшествующего периода времени продемонстрирована не была.
Напротив, настоящее изобретение обеспечивает способ облегчения нейропатической боли, которая включает как сенсорный, так и двигательный нейрональный компоненты. Кроме того, способ по данному изобретению является эффективным для облегчения нейропатической боли через минуты, в отличие от часов или суток, которые, как было ранее продемонстрировано, требуются для проявления нейротнофной активности просапозина или производного от просапозина пептида. Эффективность способа по данному изобретению в облегчении нейропатической боли была продемонстрирована с применением хорошо известной модели Chung периферической невропатии на крысах. В модели Chung на крысах частичная перевязка левых спинно-мозговых нервов на уровне L-5 и L-6 приводит к стойкой гиперчувствительности к легкому давлению на затронутую левую заднюю конечность. Гиперчувствительность является сходной с болью, испытываемой людьми, страдающими невропатическим состоянием каузалгией, как описано в Kirn and Chung, Pain 50:355-36 3 (1992).
До введения активного фрагмента просапозина крысы в модели Chung имели порог от 3,0 до 4,0 г до того, как затронутая конечность была отдернута в ответ на давление (волоски Von Frey) (см. Фигуру 1). После введения активного фрагмента просапозина (производного от просапозина 22-мерного; ПОСЛ. ИД. №:1) нейропатическая боль облегчалась, что заметно по большей толерантности к давлению до того, как затронутая конечность была отдернута. Эффект активного фрагмента просапозина возникал в течение 15 минут и поддерживался в течение 3 часов после введения, как показано на Фигуре 1. Данное быстрое облегчение нейропатической боли сходится в полной противоположности с отсроченными нейротрофными эффектами, ранее описанными для просапозина и пептидов, являющихся производными просапозина.
Введение активного фрагмента просапозина, такого как производный от просапозина пептид ПОСЛ. ИД. №:2, также облегчало боль в модели на крысах, страдающих болезненной диабетической невропатией. Как описано в Примере III, введение пептида ПОСЛ. ИД. №:2 снижало allodynia у крыс, страдающих кратковременным (преходящим) инсулинзависимым сахарным диабетом, вызванным избирательным токсином, тропным к β-клеткам, стрептозотоцином. Таким образом, активный фрагмент просапозина или производный от просапозина пептид по данному изобретению может быть применен для облегчения различных типов нейропатической боли, включая механическую боль, примером чего является модель Chung на крысах, и метаболическую боль, что проиллюстрировано с помощью применения данных пептидов для облегчения боли у крыс, страдающих диабетом.
Как здесь используется, термин "нейропатическая боль" означает боль, являющуюся результатом повреждения нерва. Нейропатическую боль отличают от ноцицептивной боли, которая представляет собой боль, вызванную острым повреждением тканей, включающих в себя небольшие кожные нервы или небольшие нервы, иннервирующие мышечную или соединительную ткань. Боль, задействующая ноцицептивный механизм, обычно ограничена по длительности периодом восстановления ткани и обычно облегчается с помощью применения доступных анальгетиков или опиоидов, как описано в Myers, Regional Anesthesia 20:173-184 (1995).
Нейропатическая боль обычно является длительной или хронической и зачастую развивается в течение дней или месяцев после исходного острого повреждения тканей. Нейропатическая боль способна включать персистирующую спонтанную боль, равно как и allodynia, которая представляет собой болезненную реакцию на воздействие стимула, который в норме боли не вызывает. Нейропатическая боль также может быть охарактеризована гиперальгезией, при которой существует выраженная реакция на болезненный стимул, который обычно является незначительным, такой как укол булавкой. В отличие от ноцицептивной боли нейропатическая боль обычно устойчива к терапии опиоидами (Myers, supra, 1995).
Способ по данному изобретению применим для облегчения нейропатической боли, являющейся следствием заболевания периферического нерва, спинно-мозговых ганглиев, спинного мозга, ствола мозга, талямуса или коры. Как здесь используется, термин "заболевание" означает любую травму, повреждение, болезнь или состояние, приводящее к возникновению нейропатической боли.
Способ по данному изобретению применим для облегчения нейропатической боли невзирая на этиологию боли. Например, способ по данному изобретению может быть применен для облегчения нейропатической боли, являющейся следствием заболевания периферического нерва, такого как неврома; сдавления нерва; размозжения нерва, растяжения нерва или неполного пересечения нерва; мононевропатии или полиневропатии. Способ по данному изобретению также может быть применен для облегчения нейропатической боли, являющейся следствием такого заболевания, как сдавление спинно-мозгового ганглия; воспаление спинного мозга; ушиб, опухоль или гемисекция спинного мозга; опухоли ствола головного мозга, талямуса или коры; или травмы ствола головного мозга, талямуса или коры (см., например, Таблицу 1).
Способ по данному изобретению может быть применим, например, для облегчения нейропатической боли, являющейся следствием невромы, которая вполне может развиться после травматического повреждения нерва, особенно когда целый нерв серьезно размозжен либо пересечен. В невроме рост нейритов, который в норме регенерирует периферический нерв, является нарушенным и неправильно направленным благодаря, например, наличию физического препятствия, такого как рубцовая ткань. Таким образом, регенерирующееся нервное волокно находится в окружении, в котором механические и физические факторы способствуют возникновению аномальной электрофизиологической активности и боли (Myers, supra, 1995). Ампутационная неврома, например, способна вызывать фантомные боли либо способна вызывать боль, запускаемую при применении протеза конечности. Как описано здесь, такая нейропатическая боль может быть облегчена путем введения активного фрагмента просапозина по методу данного изобретения.
| Таблица 1. |
| НервНеврома (ампутация, пересечение нерва)Сдавление нерва (невропатии ущемления, опухоли)Размозжение, растяжение или неполное пересечениенерва (травма)МононевропатияСахарный диабетОблучениеИшемияВаскулитПолиневропатияПостполиомиелитический синдромСахарный диабетАлкогольАмилоидТоксиныВИЧГипотиреоидизмУремияВитаминные недостаточностиХимиотерапия (винкристин, цисплатин, паслитаксел)ddC (залцитабин)Болезнь Фабри |
| Спинномозговой ганглийСдавление (диск, опухоль, рубцовая ткань)Авульсия корешка |
| Воспаление (постгерпетическая невралгия) |
| Спинной мозгУшибОпухольНеполное пересечение |
| Ствол головного мозга, талямус, кораИнфаркт, опухоли, травма |
Сдавление нерва также приводит к возникновению нейропатической боли, которую можно лечить, применяя способ по данному изобретению. Сдавление нерва может быть резким, как в случае с травматическим размозжением нерва, либо длительным и умеренно выраженным, вторичным по отношению к росту опухоли или образованию рубца вблизи от основного нервного пучка. Компрессионная невропатология может развиваться как следствие изменений кровоснабжения нерва, вызывая тяжелую ишемию и последующее повреждение (Myers, supra, 1995).
Введение активного фрагмента просапозина в соответствии со способом по данному изобретению также способно облегчить нейропатическую боль, являющуюся результатом мононевропатии или полиневропатии. Как здесь используется, невропатия представляет собой функциональное расстройство или патологическое изменение периферической нервной системы и клинически характеризуется дисфункцией сенсорного или двигательного нейрона. Термин "мононевропатия" указывает на то, что затронут единственный периферический нерв, тогда как термин "полиневропатия" указывает на то, что затронуто несколько периферических нервов.
Этиология невропатии может быть известна или неизвестна (см., например, Myers, supra, 1995; Galer, Neurology 45 (suppl 9):S17-S25 (1995); Stevens and Lowe, Pathology, Times Mirror International Publishers Limited, London (1995)). Известные этиологии включают осложнения заболевания или токсического состояния; например, наиболее распространенным метаболическим нарушением, вызывающим невропатию, является сахарный диабет. Применение способа по данному изобретению облегчает нейропатическую боль при мононевропатии, являющуюся результатом сахарного диабета, облучения, ишемии или васкулита. Применение способа по данному изобретению также облегчает нейропатическую боль при полиневропатии, являющейся результатом влияния постполиомиелоитического синдрома, сахарного диабета, алкоголя, амилоида, токсинов, ВИЧ, гипотиреоидизма, уремии, витаминных недостаточностей, химиотерапии, ddC или болезни Фабри (см. Таблицу 1). Способ по данному изобретению является особенно применимым для ослабления постполиомиелитической миалгии. Применение способа по данному изобретению также способно облегчить нейропатическую боль неизвестной этиологии.
Как описано здесь, активный фрагмент просапозина также может быть применен для облегчения нейропатической боли или для стимулирования роста нейритов, ингибирования гибели нейронов, стимулирования миелинизации или ингибирования демиелинизации или для ингибирования развития сенсорной (чувствительной) невропатии. Термин "активный фрагмент просапозина", как здесь используется, означает пептид, который обладает аминокислотной последовательностью, соответствующей аминокислотной последовательности просапозина, и который обладает активностью облегчения нейропатической боли или с стимулирования роста нейритов, ингибирования гибели нейронов, стимулирования миелинизации или ингибирования демиелинизации или для ингибирования развития чувствительной или двигательной невропатии.
Как используется здесь, термин "облегчение нейропатической боли" означает уменьшение тяжести нейропатической боли. У субъекта-человека активный фрагмент просапозина уменьшает тяжесть нейропатической боли настолько, что страдания объекта уменьшаются и качество жизни улучшается. Применение активного фрагмента просапозина также может облегчить нейропатическую боль в любой из ряда хорошо известных животных моделей нейропатической боли, как описано здесь ниже (также см. Bennet, Muscle & Nerve, 16:1040-1048 (1993)). Как используется здесь, термин "активный фрагмент просапозина" является синонимом термина "производный от просапозина пептид".
Активный фрагмент просапозина предпочтительно содержит аминокислотную последовательность Leu-Ile-Asp-Asn-Asn-Lys-Thr-Glu-Lys-Glu-Ile-Leu (ПОСЛ. ИД. №:3), которая соответствует аминокислотам (с 18 по 29) сапозина С. Более предпочтительно, активный фрагмент просапозина обладает аминокислотной последовательностью Cys-Glu-Phe-Leu-Val-Lys-Glu-Val-Thr-Lys-Leu-Ile-Asp-Asn-Asn-Lys-Thr-Glu-Lys-Glu-Ile-Leu (ПОСЛ. ИД. №1), которая соответствует аминокислотам (с 8 по 29) сапозина С, или аминокислотной последовательностью Thr-D-Ala-Leu-Ile-Asp-Asn-Asn-Ala-Thr-Glu-Glu-Ile-Leu-Tyr (ПОСЛ. ИД. №2), 17 которая соответствует аминокислотам (с 16 по 29) сапозина С, но которая модифицирована замещением лизина D-аланином в положении 2; замещением лизина аланином в положении 8; делецией лизина в положении 11 и добавлением С-концевого тирозинового остатка (см. Таблицу 2). Такие модификации могут быть применимы для повышения стойкости пептида или уровня проницаемости через гематоэнцефалический барьер, как описано ниже. Как здесь используется, D-аланин может быть представлен как D-Ala или X.
Активный фрагмент просапозина может содержать от приблизительно 12 аминокислот до приблизительно 80 аминокислот, что представляет собой полноцепочечный сапозин С. Предпочтительно активный фрагмент просапозина содержит от приблизительно 12 аминокислот до приблизительно 40 аминокислот и более предпочтительно от приблизительно 14 аминокислот до приблизительно 22 аминокислот.
| Таблица 2 | ||
| Пептид | Последовательность | ПОСЛ. ид. №: |
| Производный от просапозина 22-мерный | CEFLVKEVTKLIDNNKTEKEIL | 1 |
| Производный от просапозина 14-мерный | TXLIDNNATEEILY | 2 |
| Производный от просапозина 12-мерный | LIDNNKTEKEIL | 3 |
| где Х=D-аланин |
Для применения в облегчении нейропатической боли у субъекта-человека предпочтительным является активный фрагмент человеческого просапозина, такой как ПОСЛ. ИД. №:1 и ПОСЛ. ИД. №:2. Однако активный фрагмент просапозина иного млекопитающего также является применимым для облегчения нейропатической боли в соответствии со способом по данному изобретению. Так, например, активный фрагмент мышиного просапозина, крысиного просапозина, просапозина морской свинки или бычьего просапозина, такой как ПОСЛ. ИД. №: с 4 по 7 включительно, также может быть применим для облегчения нейропатической боли у субъекта.
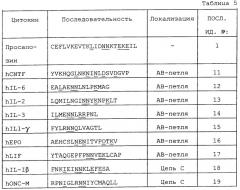
Как показано в Таблице 3, аминокислотная последовательность активного фрагмента человеческого просапозина (ПОСЛ. ИД. №:1), которая соответствует аминокислотам (с 8 по 29) сапозина С, является высококонсервативной среди других видов. В частности, соседние аспарагиновые (N) остатки являются консервативными в просапозинах человека, мыши, крысы, морской свинки и быка. В дополнение к этому, лейциновый (L) остаток консервативно располагается в 3 или 4 остатках от N-конца из двух аспарагиновых остатков, а один или несколько заряженных остатков (аспарагиновой кислоты (D), лизина (К), глютаминовой кислоты (Е) или аргинина (R)) консервативно располагаются в от 2 до 8 остатках от С-конца из двух аспарагиновых остатков. Каждый из данных высококонсервативных остатков подчеркнут в Таблице 3.
Высококонсервативные соседние аспарагиновые остатки, лейциновый остаток и заряженные остатки, описанные выше, могут представлять важность для активности активного фрагмента просапозина в облегчении нейропатической боли или в стимулировании роста нейритов ингибировании гибели нейронов, стимулировании миелинизации, или ингибировании демиелинизации, или в ингибировании развития двигательной невропатии. Например, производный от просапозина 22-мерный (ПОСЛ. ИД. №:1) или производный от просапозина 14-мерный (ПОСЛ. ИД. №:2) пептиды являются активными фрагментами просапозина, которые уменьшают болезненную allodynia, наблюдаемую в модели Chung периферической невропатии на крысах, как описано в примере 1 (см. Фигуры 1 и 2). Напротив, мутантный 22-мерный пептид (ПОСЛ. ИД. №:8), который отличается от ПОСЛ. ИД. №:1 наличием остатка аспарагиновой кислоты (D) вместо первого консервативного аспарагина (см. Таблицу 4), не обладает активностью в облегчении нейропатической боли, что было определено с применением модели Chung на крысах (см. пример 1).
Активность пептида в облегчении нейропатической боли также может коррелировать с нейротрофной активностью. Например, производный от просапозина 22-мерный (ПОСЛ. ИД. №:1) и производный от просапозина 14-мерный (ПОСЛ. ИД. №:2) пептиды облегчают нейропатическую боль и обладают нейротрофной активностью. В дополнение к этому, мутантный 22-мерный пептид (ПОСЛ. ИД. №:8) не обладает активностью в облегчении нейропатической боли, как описано выше, и не обладает нейротрофной активностью, далее указывая на то, что активность в облегчении нейропатической боли может коррелировать с нейротрофной активностью. Мутантный 14-мерный пептид М-1 (ПОСЛ. ИД. №:9), в котором имеется замена второго консервативного аспарагинового остатка, не обладает нейротрофной активностью, что указывает на то, что ПОСЛ. ИД. №:9 также не обладает активностью в облегчении нейропатической боли. Мутантный 14-мерный пептид М-2 (10), в котором имеется замена консервативного лейцинового остатка, не обладает нейротрофной активностью, что указывает на то, что ПОСЛ. ИД. №:10 также не обладает активностью в облегчении нейропатической боли. Напротив, производный от просапозина 12-мерный пептид (ПОСЛ. ИД. №:3), который содержит консервативные соседние аспарагины, лейцин и заряженные остатки, описанные выше, обладают активностью нейротрофного фактора. Таким образом, производный от просапозина 12-мерный пептид (ПОСЛ. ИД. №:3) также способен облегчать нейропатическую боль в соответствии со способом по данному изобретению.
Производные от просапозина пептиды и их нейротрофные аналоги имеют значительные терапевтические приложения в ускорении функционального восстановления после токсических, травматических, ишемических, дегенеративных или наследственных поражений периферической или центральной нервной системы. В дополнение к этому, данные пептиды способны стимулировать миелинизацию или ингибировать демиелинизацию, противодействуя таким образом воздействию демиелинизирующих заболеваний. Кроме того, такие пептиды стимулируют рост нейритов и ингибируют запрограммированную клеточную гибель в нервной ткани. Активные нейротрофные и миелинотрофные пептиды по данному изобретению содержат от приблизительно 12 или 14 до приблизительно 50 аминокислот и, предпочтительно, включают не встречающуюся в природе (искусственную) последовательность просапозина, показанную в ПОСЛ. ИД. №:2. Например, активные нейротрофные и миелинотрофные пептиды по данному изобретению содержат от 14 до приблизительно 50 аминокислот и включают искусственную последовательность просапозина, показанную в ПОСЛ. ИД. №:2.
В другом предпочтительном варианте осуществления настоящее изобретение относится к способу стимулирования роста нейритов, ингибирования гибели нейронов, стимулирования миелинизации или ингибирования демиелинизации среди дифференцированных и недифференцированных нервных клеток путем введения в нервные клетки эффективного количества пептида, способствующего росту нейритов и образованию миелина, содержащего от приблизительно 12 до приблизительно 50 аминокислот и, предпочтительно, включающего пептид, показанный в ПОСЛ. ИД. №:2. В способах по данному изобретению для стимулирования роста нейритов, ингибирования гибели нейронов, стимулирования миелинизации или ингибирования демиелинизации может быть применено эффективное количество пептида, содержащего, например, от 14 до приблизительно 50 аминокислот и включающего пептид, показанный в ПОСЛ. ИД. №:2.
Способность любого такого пептида стимулировать рост нейритов, ингибировать гибель нейронов, стимулировать миелинизацию или ингибировать демиелинизацию может быть легко определена специалистом в данной области с применением методик, описанных в примерах с IV по VII. Способы анализа способностей данных пептидов стимулировать миелинизацию или ингибировать демиелинизацию изложены далее в примерах VI и VII.
Настоящее изобретение также относится к способу ингибирования чувствительной невропатии путем воздействия на нервные клетки композиции, содержащей эффективное ингибирующее количество активного фрагмента просапозина, изобретение относится, например, к методу ингибирования сенсорной нейропатии путем взаимодействия нейронов с композицией, содержащей эффективное ингибирующее количество пептида, обладающего последовательностью, показанной как ПОСЛ. ИД. №:1 или ПОСЛ. ИД. №:2.
Как описывается здесь в примере X, производный от просапозина пептид может быть применим для ингибирования чувствительной невропатии. В модели на мышах, у которых чувствительную невропатию вызывают путем введения таксола, обычно наблюдается потеря термической чувствительности. Однако у обработанных таксолом мышей, получавших 100 мкг/кг пептида ПОСЛ. ИД. №:1, потеря термической чувствительности ингибировалась. Данные результаты указывают на то, что производные от просапозина пептиды могут являться нейротрофным фактором как для чувствительных, так и для двигательных нейронов.
Пептид, применимый в способах по данному изобретению, также может представлять собой, например, ПОСЛ. ИД. №№: с 11 по 19 включительно (см. Таблицу 5). Например, выравнивание последовательности производного от просапозина 22-мерного пептида ПОСЛ. ИД. №:1 с последовательностями цитокинов и факторов роста указывает на гомологичность последовательности с рядом человеческих (h) цитокинов, включая hCNTF, hIL-6, hIL-2, hIL-3, Hill-γ эритропоэтин (hEPO), человеческий лимфоцит-ингибирующий фактор (hLIF), β-цепь hIL-1 и онкостатин-М (hONC-M). ПОСЛ. ИД. №№: с 11 по 19 включительно, как и активный фрагмент просапозина ПОСЛ. ИД. №:1, содержат два аспарагиновых остатка, которые являются смежными либо разделены одной аминокислотой. В дополнение к этому, производные от цитокинов пептидные последовательности могут содержать лейциновый (L) или изолейциновый (I) остаток в 3 или 4 остатках от N-конца из двух аспарагиновых остатков, а один или несколько заряженных остатков (аспарагиновой кислоты (D), лизина (К), глютаминовой кислоты (Е) или аргинина (R)) располагаются в от двух до восьми остатках от С-конца из двух аспарагиновых остатков, что наблюдается в активном фрагменте просапозина (22-мерный; ПОСЛ. ИД. №:1). Каждый из данных остатков подчеркнут в Таблице 5.
Модели цитокин-рецепторного связывания (Sprang and Bazan, Curr. Opin. Struct. Biol., 3:816 (1993)) выявили эволюционный консерватизм в четырехцепочечной структуре, характерной для многих цитокинов. Все последовательности цитокинов и факторов роста, родственные производной от просапозина последовательности ПОСЛ. ИД. №:1, локализованы между цепями А и В (в АВ-петле) или в цепи С цитокина.
Структурно родственные производные от цитокинов и факторов роста пептиды ПОСЛ. ИД. №№: с 11 по 19 включительно также могут быть применимы в способах для облегчения нейропатической боли. Пептиды ПОСЛ. ИД. №№: с 11 по 19 включительно могут быть проанализированы на предмет активности в облегчении нейропатической боли с применением, например, модели Chung на крысах, описанной в примере 1; модели диабетической невропатии, как описано в анализах из примера III, описанных Wall et al., Pain 7:103-113 (1979); Bennet and Xie, Pain, 33:87-107 (1988); Lekan et al., Soc. Neurosci. Abstr. 18:287 (1992) или Palacek et al., Soc. Neurosci. Abstr. 18:287 (1992); или других исследований нейропатической боли.
Производные цитокинов и факторов роста пептиды ПОСЛ. ИД. №№: с 11 по 19 включительно также могут быть применимы в способах стимулирования роста нейритов, ингибирования гибели нейронов, стимулирования миелинизации или ингибирования демиелинизации или в способах ингибирования чувствительной или двигательной невропатии. Пептид, содержащий от приблизительно 14 до приблизительно 50 аминокислот и включающий фрагмент, обладающий нейротрофной активностью, содержащийся в одной из ПОСЛ. ИД. №№: с 11 по 19 включительно, может быть проанализирован на предмет способности стимулировать рост нейритов, как описано в примере IV; или может быть проанализирован на предмет способности ингибировать гибель нейронов, как описано в примере V; или на предмет способности стимулировать миелинизацию, как описано в примере VI; или на предмет способности ингибировать демиелинизацию, как описано в примере VII; или на предмет способности ингибировать чувствительную невропатию, как описано в примере Х.
Активный фрагмент просапозина или пептид, применимый для облегчения нейропатической боли, может быть идентифицирован с помощью скрининга большой коллекции или банка, случайных пептидов или интересующих пептидов с применением, например, одной из ряда моделей нейропатической боли на животных. Такие интересующие пептиды могут представлять собой, например, производные от цитокинов и факторов роста пептиды ПОСЛ. ИД. №№: с 11 по 19 включительно, которые обладают аминокислотными последовательностями, гомологичными последовательности активного фрагмента просапозина (ПОСЛ. ИД. №:1). Интересующие пептиды могут также представлять собой, например, популяцию пептидов, гомологичных по аминокислотной последовательности ПОСЛ. ИД. №:1 в том, что они содержат консервативные аспарагиновые остатки, остаток лейцина/изолейцина и один или несколько заряженных остатков в положениях, соответствующих таковым, в которых данные остатки находятся в ПОСЛ. ИД. №:1, но также содержат и одну или несколько аминокислот, которые отличаются от аминокислот из ПОСЛ. ИД. №:1.
Банки пептидов включают, например, снабженные химическим описанием пептидов банки, содержащие пептиды и пептидомиметики. Банки пептидов также содержат пептиды, полученный с применением методов экспрессии с помощью фагов. Методы экспрессии с помощью фагов включают в себя экспрессию пептидных молекул на поверхности фага, равно как и другие методы, с помощью которых белковый лиганд ассоциируется или может ассоциироваться с нуклеиновой кислотой, которая его кодирует. Способы создания банков с применением методов экспрессии с помощью фагов, включая векторы и способы клонирования популяции пептидов, которые были экспрессированы, хорошо известны в данной области (см., например. Smith and Scott, Methods Enzymol. 217:228-257 (1993); Scott and Smith, Science 249:386-390 (1990); и Huse, WO 91/07141 и WO 91/07149). Данные или иные хорошо известные способы могут быть применены для создания банков с применением методов экспрессии с помощью фагов, пептиды экспрессированные в которых могут быть выделены и проанализированы на предмет активности в облегчении нейропатической боли или другой нейротрофной или миелинотрофной активности, как здесь описано. При желании, популяция пептидов может быть исследована на предмет активности, и активная популяция может быть подразделена, а анализ повторен в целях выделения из популяции активного пептида. Другие методики получения пептидов, применимые по данному изобретению, включают, например, рациональное конструирование и мутагенез, основанные на аминокислотных последовательностях активных фрагментов просапозина, таких как, например, ПОСЛ. ИД. №:1 и ПОСЛ. ИД. №:2.
Как здесь описано, активный фрагмент просапозина или пептид, применимый для облегчения нейропатической боли, может быть идентифицирован по его активности в облегчении нейропатической боли в любой из ряда прочно устоявшихся моделей нейропатической боли на животных (Bennett, supra, 1993). Например, активный фрагмент просапозина может быть идентифицирован с применением экспериментальной модели периферической невропатии, вызванной перевязкой сегментарного спинно-мозгового нерва, у крысы. Модель Chung на крысах имитирует симптомы пациентов - людей, страдающих каузалгией, или жгучую боль при повреждении периферического нерва (Kim and Chung, supra, 1992). Хирургическая операция по Kim и Chung позволяет получить стойкую гиперальгезию к высокой температуре и механическую allodynia затронутой конечности. Как описано в примере 1, крысы со спинно-мозговым нервом, перевязанным в соответствии с методикой, разработанной Chung и Kim, применимы для идентификации активного фрагмента просапозина для применения в облегчении нейропатической боли.
Активный фрагмент просапозина или пептид, применимый для облегчения нейропатической боли, также может быть идентифицирован по его активности в облегчении нейропатической боли в модели болезненной диабетической невропатии на крысах. Также сообщалось о гиперальгезии в ответ на термические, механические и химические отрицательный стимулы у крыс-диабетиков, страдающих преходящим инсулин-зависимым сахарным диабетом, вызванным избирательными токсинами, тропными к β-клеткам, такими как стрептозотоцин (Calcutt et al., Pain 68:293-299 (1996)). Такая модель на крысах представляет боль, наблюдаемую у людей, страдающих сахарным диабетом, у которых может проявляться множество искаженных ощущений, включая спонтанную боль, боль, вызванную легким прикосновением, и гиперальгезию. Крысы, обработанные стрептозотоцином или иным избирательным токсином, тропным