Вакцины рекомбинантных внутриклеточных патогенов и способы их применения
Иллюстрации
Показать всеИзобретение относится к медицине и касается вакцины рекомбинантных внутриклеточных патогенов, а именно: вакцины, содержащей рекомбинантную бациллу Кальметта-Герена (БЦЖ), и способа профилактики заболеваний, вызванных внутриклеточным патогеном Mycobacterium tuberculosis. Сущность изобретения заключается в разработке вакцины, содержащей рекомбинантную БЦЖ, имеющую внехромосомную ДНК, содержащую ген, который кодирует главный внеклеточный белок Mycobacterium tuberculosis в 30 кДа, а также в разработке способа профилактики заболеваний, вызванных внутриклеточным патогеном Mycobacterium tuberculosis у млекопитающих посредством введения рекомбинантной БЦЖ, экспрессирующей рекомбинантные иммуногенные антигены. Преимущество изобретения заключается в повышении эффективности БЦЖ. 3 н. и 3 з.п. ф-лы, 7 табл., 5 ил.
Реферат
Область техники
Настоящее изобретение в целом относится к иммунотерапевтическим агентам и вакцинам внутриклеточных патогенных организмов, таких как бактерии, простейшие, вирусы и грибы. Более конкретно, в отличие от вакцин и иммунотерапевтических агентов предшествующего уровня техники, основанных на патогенных субъединицах, уничтожающих патогены и ослабляющих природные патогены, в настоящем изобретении применяются рекомбинантные ослабленные патогены или близкородственные виды, которые экспрессируют и секретируют иммуногенные детерминанты выбранного патогена, стимулируя эффективный иммунный ответ у млекопитающих-хозяев. Иммуностимуляторные вакцины и иммунотерапевтические агенты согласно изобретению являются производными рекомбинантных ослабленных патогенов или близкородственных видов, которые экспрессируют иммунологические детерминанты in situ.
Предпосылки к созданию изобретения
Давно известно, что микроорганизмы-паразиты обладают способностью инфицировать животных, в результате этого вызывая болезнь и часто смерть хозяина. Патогенные агенты веками были лидирующей причиной смерти и продолжают причинять большие страдания. Несмотря на то, что в течение последних ста лет наблюдаются существенные успехи в профилактике и лечении многих инфекционных заболеваний, сложные взаимодействия между паразитом и хозяином все еще ограничивают универсальную эффективность терапевтических мер. Трудности противостояния изощренным инвазивным механизмам, проявляемым многими патогенными организмами, доказываются возрождением различных заболеваний, таких как туберкулез, а также появлением многочисленных штаммов бактерий и вирусов, устойчивых к лекарствам.
Среди данных патогенных агентов существенного эпидемиологического значения внутриклеточные бактерии, как установлено, являются особенно трудно поддающимися в плане терапевтических или профилактических мероприятий. Внутриклеточные бактерии, включая род Mycobacterium и род Legionella, проводят весь или часть своего жизненного цикла в клетках инфицированного организма хозяина, а не внеклеточно. Во всем мире внутриклеточные бактерии каждый год являются причиной миллионов смертей и бесчисленных страданий. Туберкулез во всем мире является лидирующей причиной смерти от единственного агента, вызывающего болезнь, с 10 миллионами новых случаев и 2,9 миллионами смертей каждый год. Кроме того, внутриклеточные бактерии являются причиной миллионов случаев проказы. Другие истощающие заболевания, передаваемые внутриклеточными агентами, включают в себя подкожный и висцеральный лейшманиоз, американский трипаносомоз (болезнь Чагаса), листериоз, токсоплазмоз, гистоплазмоз, трахому, пситтакоз, Q-лихорадку и легионеллез. К настоящему времени относительно мало может быть сделано для профилактики истощающих инфекций у чувствительных к ним индивидуумов, контактирующих со многими из данных организмов, из-за невозможности эффективной защиты популяций от таких внутриклеточных патогенов, что ведет к заболеваемости и смертности человека и животных, причиной которых являются такие агенты, туберкулез представляет собой одно из наиболее важных заболеваний, с которым борется человечество.
Специалисты в данной области техники должны понимать, что последующий пример обсуждения M. tuberculosis является иллюстрацией указаний настоящего изобретения и никоим образом не должен рассматриваться как ограничение объема настоящего изобретения лечением от M. tuberculosis. Сходным образом представленные здесь указания никак не ограничиваются лечением туберкулезных инфекций. Наоборот, данное изобретение может быть использовано для успешного обеспечения безопасных и эффективных вакцин и иммунотерапевтических агентов любого патогенного агента с помощью применения рекомбинантных ослабленных патогенов или рекомбинантных невирулентных организмов для экспрессии и, что не менее важно, для высвобождения иммунологически значимых белков патогенного организма.
В настоящее время считается, что приблизительно одна треть всемирной популяции заражена M. tuberculosis, что ведет к миллионам случаев туберкулеза легких ежегодно. Более конкретно, туберкулез легких человека, вызываемый первично M. tuberculosis, является главной причиной смерти в развивающихся странах. Способный к выживанию внутри макрофагов и моноцитов, M. tuberculosis может вызывать хроническую внутриклеточную инфекцию. M. tuberculosis относительно успешно обходит обычные защитные системы организма-хозяина в результате того, что могут укрыться внутри клеток, которые в первую очередь отвечают за выявление чужеродных элементов и последующую активацию иммунной системы. Более того, многие из лидирующих химиотерапевтических агентов, применяемых для лечения туберкулеза, обладают относительно низкой активностью против внутриклеточных организмов по сравнению с внеклеточными формами. Такие одинаковые патогенные свойства ранее препятствовали развитию всесторонне эффективных иммунотерапевтических агентов или вакцин против туберкулезных инфекций.
Несмотря на то, что данное заболевание является особенно острой проблемой здравоохранения в развивающихся странах Латинской Америки, Африки и Азии, оно становится также более распространенной в экономически развитых странах. В Соединенных Штатах повышенным риском отмечены определенные популяции, особенно городские малоимущие, иммунодефицитные индивидуумы и иммигранты из областей с высокой степенью заболеваемости. Главным образом из-за эпидемии СПИДа, в последние годы число случаев туберкулеза выросло в экономически развитых странах, часто в форме M. tuberculosis, устойчивой ко многим лекарствам.
В последнее время устойчивость туберкулеза к одному или более лекарствам выявлена в 36 из 50 штатов Америки. В Нью-Йорке одна треть всех протестированных случаев была устойчива к одному или более основных лекарств. Хотя не обладающий устойчивостью туберкулез можно лечить с помощью длительного курса антибиотиков, перспективы в отношении устойчивых к лекарствам штаммам остаются открытыми. Больные, инфицированные штаммами, устойчивыми к двум или более основным антибиотикам, характеризуются приблизительно 50% смертностью. В соответствии с этим безопасные и эффективные вакцины таких вариантов M. tuberculosis крайне необходимы.
Первичное инфицирование M. tuberculosis почти всегда наступает в результате вдыхания аэрозольных частиц, так как патоген может оставаться жизнеспособным в течение недель или месяцев во влажной или сухой слюне. Хотя первичным очагом инфекции являются легкие, организм может также вызывать инфекцию практически в любом органе, включая, но не ограничиваясь ими, кости, селезенку, почку, оболочки мозга и кожу. В зависимости от вирулентности конкретного штамма и устойчивости хозяина, инфекция и соответствующее повреждение ткани может быть небольшим или обширным. В случае человека первоначальная инфекция контролируется у большинства индивидуумов, контактировавших с вирулентными штаммами бактерий. Развитие приобретенного иммунитета после первичного заражения снижает пролиферацию бактерий, что ведет к излечиванию повреждений и оставляет субъекта практически бессимптомным.
Когда M. tuberculosis не контролируется инфицированным субъектом, это часто ведет к обширной деструкции легочной ткани. У восприимчивых индивидуумов повреждения обычно образуются в легком, так как бациллы туберкулеза воспроизводятся в альвеолярных или легочных макрофагах. Как только организмы размножились, они могут распространяться через лимфатическую систему к дистальным лимфатическим узлам и - через кровеносную систему - к верхушкам легких, костному мозгу, почке и оболочкам, окружающим мозг. В первую очередь в результате клеточных ответов иммунной системы по типу гиперчувствительности возникают грануломатозные повреждения или туберкулы, пропорционально тяжести инфекции. Эти повреждения состоят из эпителиодных клеток, окруженных моноцитами, лимфоцитами и фибробластами. В большинстве случаев повреждение или туберкула со временем становится некротическим и подвергается казеозу (превращению поврежденных тканей в мягкую субстанцию, напоминающую сыр).
В то время как M. tuberculosis является существенным патогеном, другие виды рода Mycobacterium также вызывают заболевание у животных, включая человека, и, несомненно, входят в объем настоящего изобретения. Например, M. bovis является близко родственной M. tuberculosis и отвечает за туберкулезные инфекции у домашних животных, таких как крупный рогатый скот, свиньи, овцы, лошади, собаки и кошки. Далее, M. bovis может инфицировать человека через кишечный тракт обычно при употреблении сырого молока. Местная кишечная инфекция, в конечном счете, распространяется до дыхательных путей, и за этим через короткое время следуют классические симптомы туберкулеза. Другим важным патогенным вектором рода Mycobacterium является M. leprae, которая вызывает миллионы случаев старинного заболевания проказы. Другие виды данного рода, которые вызывают заболевание у животных и человека, включают в себя M. kansasii, M. avium intracellulare, M. fortuitum, M. marinum, M. chelonei и M. scrofulaceum. Патогенные виды микобактерий часто проявляют высокую степень гомологии в соответствующих им последовательностях ДНК и соответствующих ей последовательностях белка, и некоторые виды, такие как M. tuberculosis и M. bovis, являются близкородственными.
По очевидным практическим и этическим соображениям исходная работа на человеке для определения эффективности экспериментальных композиций в отношении таких бедствий является неосуществимой. В соответствии с этим, на ранних этапах разработки любого лекарства или вакцины стандартной процедурой является применение подходящих животных моделей по причинам безопасности и экономичности. Успех применения в качестве моделей лабораторных животных предполагается на основе того, что иммуногенные эпитопы часто активны у хозяев различных видов. Таким образом, иммуногенная детерминанта у одних видов, например, у грызунов или морской свинки, должна быть обычно иммунореактивной у других видов, таких как человек. Только после достаточной разработки подходящих животных моделей должны проводиться клинические испытания на человеке для дополнительной демонстрации безопасности и эффективности вакцины у человека.
В отношении альвеолярного или легочного инфицирования M. tuberculosis морская свинка в качестве модели во многих отношениях очень сходна с человеком по патологии заболевания. Соответственно, специалистам в данной области понятно, что уместно экстраполировать модель данного заболевания на морской свинке, на человеке и других животных. Как и люди, морские свинки восприимчивы к туберкулезному инфицированию низкими дозами патогена человека M. tuberculosis в виде аэрозоля. В отличие от человека, у которого первичная инфекция обычно контролируется, у морских свинок при инфицировании патогеном в виде аэрозоля закономерно развивается диссеминированное заболевание, что ускоряет последующий анализ. Далее, и морские свинки, и человек проявляют кожные реакции гиперчувствительности замедленного типа, характеризующиеся развитием твердого уплотнения из мононуклеарных клеток или ригидной зоны в коже на месте тестирования. Наконец, характерные повреждения в виде туберкул у человека и морских свинок имеют сходную морфологию, включая присутствие гигантских клеток Langhans. Так как морские свинки более восприимчивы к первичной инфекции и прогрессии данного заболевания, чем человек, любая защита, подтвержденная в экспериментах с применением данной животной модели, убедительно указывает на то, что такой же защитный иммунитет может быть выработан у человека или других менее восприимчивых животных. Соответственно, только с целью объяснения, но не ограничения, настоящее изобретение должно быть в первую очередь продемонстрировано в виде примера на морских свинках в качестве млекопитающего-хозяина. Специалисты в данной области техники должны понимать, что настоящее изобретение может быть применено на других млекопитающих-хозяевах, включая человека и домашних животных.
Любое животное или человек, инфицированные патогенным организмом, в частности внутриклеточным организмом, представляет собой трудную задачу для иммунной системы хозяина. Несмотря на то, что многие инфекционные агенты могут эффективно контролироваться в результате гуморального ответа и соответствующей продукции защитных антител, данные механизмы эффективны в первую очередь только против тех патогенов, которые находятся во внеклеточной жидкости организма. В частности, опсонизирующие антитела взаимодействуют с внеклеточными чужеродными агентами, тем самым делая их чувствительными к фагоцитозу и последующему внутриклеточному уничтожению. Для других патогенов это не характерно. Например, предшествующие исследования показали, что гуморальный иммунный ответ, видимо, не играет существенной защитной роли в отношении инфицирования внутриклеточными бактериями, такими как M. tuberculosis. Однако настоящее изобретение дает возможность генерировать благоприятный иммунный ответ на патоген-мишень, и по существу его эффективность не ограничивается любым специфическим компонентом вызванного иммунного ответа.
Более конкретно, опосредованная антителами защита, по-видимому, не предотвращает первичного инфицирования внутриклеточными патогенами и становится неэффективной как только бактерии изолируются внутри клеток хозяина. Как водорастворимые белки, антитела могут распространяться во внеклеточной жидкости и крови, но для них затруднена миграция через липидные мембраны клеток. Далее, продукция опсонизирующих антител против структур бактериальной поверхности может фактически помогать внутриклеточным патогенам входить в клетку хозяина. Соответственно, любое эффективное профилактическое мероприятие против внутриклеточных агентов, таких как Mycobacterium, должно включать сильный компонент ответа клеточного иммунитета, ведущий к быстрой пролиферации антигенспецифических лимфоцитов, которые активируют затронутые фагоциты или цитотоксически уничтожают их. Однако, как будет подробно обсуждаться ниже, индукция ответа клеточного иммунитета не равняется индукции защитного иммунитета. Хотя клеточный иммунитет может исходно требоваться для защитного иммунитета, получение вакцин в соответствии с указаниями настоящего изобретения требует исследований с контрольным заражением на животных.
Такой клеточно-опосредованный иммунный ответ обычно включает в себя две стадии. Первоначальная стадия, сигнализирующая об инфицировании клетки, осуществляется с помощью специальных молекул (молекул главного комплекса гистосовместимости, или МНС), которые доставляют части патогена к клеточной поверхности. Такие молекулы МНС связывают небольшие фрагменты бактериальных белков, которые подверглись деградации в инфицированной клетке, и представляют их на поверхности клетки. Их представление Т-клеткам стимулирует иммунную систему хозяина в отношении уничтожения инфицированной клетки хозяина или стимуляции клетки хозяина в плане уничтожения поселившихся в ней бактерий.
Попытки избавления от туберкулеза с применением вакцин были начаты в 1921 году после того, как Кальметт и Герен успешно ослабили вирулентный штамм M. bovis, применяя способ серийных пассажей. Полученная живая вакцина, разработанная в институте Пастера в Лилле, Франция, известна как вакцина бациллы Кальметта и Герена, или БЦЖ. Примерно восьмидесятью годами позже, уже в настоящее время, данная вакцина остается для применения только в виде профилактического лечения туберкулеза. Действительно, все вакцины БЦЖ, имеющиеся в настоящее время, происходят из первоначального штамма M. bovis, полученного Кальметтом и Гереном в институте Пастера.
Всемирная организация здравоохранения рассматривает вакцину БЦЖ как существенный фактор снижения туберкулеза в мире, особенно в развивающихся странах. Теоретически вакцина БЦЖ дает клеточный иммунитет против ослабленной микобактерии, которая иммунологически близка к M. tuberculosis. Полученный иммунный ответ должен предотвращать первичный туберкулез. Таким образом, если предотвращается первичный туберкулез, не могут наступить латентные инфекции и избегается повторная активация заболевания.
Однако контролируемые клинические испытания выявили значительные вариации в эффективности вакцины. Описанные степени эффективности варьировались между 0-80%. Испытания вакцины на детях английской школы показали, что степень защиты через десять лет после вакцинации превышала 78%. Однако при сходном испытании в Южной Индии БЦЖ оказалась неспособной защитить против подтвержденного на культуре первичного туберкулеза в первые пять лет после инокуляции. Недавний мета-анализ эффективности БЦЖ в отношении предотвращения туберкулеза установил, что в целом профилактическая эффективность составляла приблизительно 50% (Colditz, G.A., T.F.Brewer, C.S.Berkey, M.E.Wilson, E.Burdick, H.V.Fineberg, and F.Mosteller. 1994. JAMA 271:698-702).
Данное значительное несоответствие в описанных степенях эффективности остается досадной проблемой для работников здравоохранения и практических врачей, которые должны определить, когда и как применять вакцину БЦЖ. Вовлечено множество факторов, которые могут отвечать за данные наблюдаемые несоответствия в эффективности, включая различия в способах получения, схемах инокуляции и характеристиках популяций и окружающих условиях, в которых применялись вакцины. Последняя работа предполагает, что случайный контакт с микобактериями окружающей среды может вести к "природной вакцинации", которая мешает реципиенту вакцины выработать эффективный ответ к природным белкам БЦЖ.
Для того чтобы свести к минимуму вариации иммуногенности БЦЖ, производители вакцины поддерживают контрольные запасы первоначальных штаммов вакцин в лиофилизованном (высушенном при замораживании) состоянии. Каждый получаемый штамм, происходящий из них, в свою очередь, называют в честь места производства, компании или бактериального штамма, например: БЦЖ-Лондон, БЦЖ-Копенгаген, БЦЖ-Connaught или БЦЖ-Tice (продаваемая в мировом масштабе Organon Inc.). Пытаясь стандартизовать способы получения, в Соединенных Штатах центр биологического образования и исследования (CBER) федерального министерства по лекарствам и пищевым добавкам (FDA) регулирует получение вакцин. Отдел CREB FDA установил, что каждый лиофилизованный штамм БЦЖ, применяемый для вакцинации, должен обладать способностью индуцировать определенную туберкулиновую кожную тест-реакцию у морских свинок и человека. К сожалению не показано, что индуцированная туберкулиновая чувствительность коррелирует с защитным иммунитетом.
В настоящее время вакцины БЦЖ предлагают в виде лиофилизованных культур, которые регидрируют в стерильном разбавителе непосредственно перед введением. Вакцину БЦЖ дают при рождении, в младенчестве или раннем детстве в странах, которые практикуют вакцинацию БЦЖ, включая развивающиеся и промышленно развитые страны. Посещающие эндемические районы взрослые индивидуумы, которые могут контактировать с высокими дозами инфекционных микобактерий, могут получить БЦЖ в качестве профилактического доказательства того, что они не реагируют на кожный тест. Побочные реакции на вакцину являются редкими и обычно ограничиваются изъязвлениями кожи и лимфаденитом в районе места введения. Однако, несмотря на редкие побочные реакции, вакцина БЦЖ имеет беспримерную историю безопасности при введении более трех миллиардов доз во всемирном масштабе с 1930 года.
С разработки вакцины БЦЖ прошло восемьдесят лет, и сейчас сохраняется недостаточность в приемлемых альтернативных вакцинах. Недавно изобретатели настоящего изобретения добились существенного прогресса в выделении, характеристике и рекомбинантной экспрессии внеклеточных белков, секретируемых внутриклеточными патогенами. Например, изобретатели патента США №5108745, зарегистрированного 28 апреля 1992 г., и нескольких ожидающих решения патентных заявок США предлагают вакцины и способы получения защитного иммунитета против L. pneumophila и M. tuberculosis, а также других внутриклеточных патогенов. Указанные вакцины предшествующего уровня техники в широком смысле основаны на внеклеточных продуктах, исходно происходящих из белковых компонентов, секретируемых во внеклеточную среду бактериями, находящимися в инфицированных клетках хозяина in vivo. Вакцины, предлагаемые здесь, избирательно основаны на идентификации внеклеточных продуктов или их аналогов, которые стимулируют сильный иммунный ответ против патогена-мишени у млекопитающего-хозяина.
Вакцины, полученные из отобранных внеклеточных продуктов M. tuberculosis, в настоящее время оптимизируются для применения в качестве профилактической терапии человека. Исследуются коктейли белков и индивидуальные белковые препараты с применением как рекомбинантных, так и экспрессирующихся в природе белков. Одной целью текущих исследований является доведение до максимума основного иммунного ответа путем оптимизации презентации иммуногена (белка). К настоящему времени сделано более 100 различных препаратов, включая 38 различных сочетаний белков, 26 различных адъювантов, 10 различных концентраций белков и семь различных режимов дозировки. Белки-кандидаты на вакцину были также привязаны к белкам, не происходящим из M. tuberculosis, включая бычий сывороточный альбумин, главный секреторный белок Legionella sp. и столбнячный токсин. Данный перечень не включает в себя способы, применяемые авторами настоящего изобретения для презентации внеклеточных белков внутриклеточных патогенов животным-хозяевам; скорее он иллюстрирует огромную сложность и присущее им разнообразие, связанные с оптимизацией вакцины. Однако, несмотря на данную и другую активность, никакое сочетание внеклеточных белков, адъювантов, белков-носителей, концентраций или частоты введения доз, приводящее к защитному иммунному ответу у морских свинок, не сравнимо или не превышает БЦЖ.
Недавно существенное внимание было сфокусировано на применении трансформированных штаммов БЦЖ для получения вакцин, которые экспрессируют различные связанные с клетками антигены. Например, C.K.Stover, et al. описали вакцину против болезни Лайма с применением рекомбинантной БЦЖ (рБЦЖ), которая экспрессирует связанный с мембраной липопротеин OspA Borrelia burgdorferi. Сходным образом, тот же автор также получил вакцину рБЦЖ, экспрессирующую белок поверхности пневмококка (PsPA) Sreptococcus pneumoniae. (Stover, C.K., G.P.Bansal, S.Langerman, and M.S.Hanson. 1994. Protective Immunity Elicited by rBCG Vaccines. In: Brown F. (ed): Recombinant Vectors in Vaccine Development. Dev Biol Stand. Dasel, Karger, Vol.82, 163-170.)
Патент Соединенных Штатов номер (USPN) 5504005 ("патент 005") и USPN 5854055 ("патент 055"), оба выпущенные B.R.Bloom et al., раскрывают теоретические векторы рБЦЖ, экспрессирующие широкий диапазон гибридных белков, ассоциированных с клетками, из многих штаммов микроорганизмов. Теоретические векторы, описанные в данных патентах, являются или направленными к гибридным белкам, ассоциированным с клетками, в виде противопоставления внеклеточным негибридным белкам-антигенам, и/или рБЦЖ гипотетически экспрессирует гибридные белки из отдаленно родственных штаммов. Более того, гибридные белки, ассоциированные с рекомбинантными клетками, экспрессируемые в данных моделях, кодируются ДНК, которая интегрирована в геном хозяина и находится под контролем промоторов белков теплового шока. Следовательно, экспрессируемые антигены являются гибридными белками, и экспрессия ограничивается уровнями, приблизительно равными или меньшими, чем природные белки векторов.
Более того, ни в одном из патентов "005 и 055" не раскрыта животная модель тестирования безопасности, развития иммунного ответа или защитного иммунитета в животной системе, которая наиболее близко имитирует болезнь человека. Кроме того, в "005 и 055" раскрыты только теоретические векторы рБЦЖ, экспрессирующие гибридные белки M. tuberculosis, никакие действующие вакцины не разработаны. Те модели вакцин M. tuberculosis, которые раскрыты, направлены на связанные с клетками гибридные белки теплового шока, а не на внеклеточные негибридные белки.
В патенте Соединенных Штатов номер 5830475 ("патент 475") также раскрыты теоретические микобактериальные вакцины, применяемые для экспрессии гибридных белков. ДНК, кодирующая данные гибридные белки, находится во внехромосомных плазмидах под контролем промоторов микобактериального белка теплового шока и промоторов белков стресса. Раскрытые вакцины предназначены для индукции иммунного ответа у животных, не являющихся человеком, с целью продукции у них антител, и не показано предотвращения заболеваний, вызванных внутриклеточными патогенами у млекопитающих. Более того, "патент 475" не раскрывает рекомбинантные вакцинирующие агенты, которые используют специфичные для белка промоторы для экспрессии внеклеточных негибридных белков.
Изобретатели настоящего изобретения предполагают без ограничения, что главные внеклеточные негибридные белки внутриклеточных патогенов могут быть важными молекулами иммунной защиты. Во-первых, внеклеточные негибридные белки, благодаря свойству их секреции патогеном во внутриклеточную среду клетки хозяина, доступны для процессинга и презентации иммунной системе в виде фрагментов, связанных с молекулами МНС на поверхности клетки хозяина. Данные комплексы пептид-МНС служат для предупреждения иммунной системы о присутствии в клетке хозяина спрятанных другим способом инвазивных патогенов, давая возможность иммунной системе создать подходящий противомикробный ответ против инвазивного патогена. Во-вторых, эффективная иммунизация внеклеточными белками способна индуцировать популяцию иммунных клеток, которые узнают те же самые комплексы пептид-МНС через некоторое время в будущем, когда комплексы экспонируются на клетках хозяина, инвазированных относящимся к этому внутриклеточным патогеном. Иммунные клетки становятся, таким образом, способными направляться к инфицированным клеткам хозяина и либо активировать их цитокинами, в результате чего они становятся способными ограничить рост внутриклеточного патогена, либо лизировать их, лишая таким способом патоген внутриклеточной среды, в которой он размножается. В-третьих, среди внутриклеточных белков главные, т.е. те, которые продуцируются в наибольших количествах, должны представляться наиболее важными в качестве иммунозащитных молекул, так как они обычно должны обеспечивать самую обширную презентацию комплексов пептид-МНС иммунной системе.
Следовательно, остается потребность в рекомбинантных вакцинах внутриклеточных патогенов, которые экспрессируют главные внеклеточные негибридные белки внутриклеточных патогенов, являющиеся близкородственными вакцинирующему агенту. Более того, существует потребность в рекомбинантных вакцинах внутриклеточных патогенов, которые способны гиперэкспрессировать рекомбинантные внеклеточные негибридные белки благодаря нехромосомной ДНК, имеющей промоторы, отличные от промоторов генов белков теплового шока, или промоторы, отличные от промоторов генов белков стресса.
Конкретно, остается срочная необходимость получения вакцин внутриклеточных патогенов, которые обеспечивают реципиентов защитой от заболеваний, которая превосходит защиту реципиентов, создаваемую вакциной БЦЖ. Более того, существует срочная необходимость предоставления как промышленно развитым, так и развивающимся странам реального по цене иммунотерапевтического и профилактического лечения туберкулеза и борьбы с другими внутриклеточными патогенами.
Следовательно, целью настоящего изобретения является предоставление терапевтических и профилактических вакцин для лечения и профилактики заболевания, вызванного внутриклеточными патогенами.
Другой целью настоящего изобретения является предоставление вакцин для профилактики болезней, вызываемых внутриклеточными патогенами, с применением внутриклеточных патогенов, которые трансформированы для экспрессии главных рекомбинантных иммуногенных антигенов того же самого патогена, другого внутриклеточного патогена или их обоих.
Еще одной целью настоящего изобретения является предоставление вакцин для лечения и профилактики микобактериальных заболеваний с применением рекомбинантной БЦЖ, которая экспрессирует внеклеточные белок(белки) патогенной микобактерии.
Другой целью настоящего изобретения является предоставление вакцин для лечения и/или профилактики туберкулеза с применением рекомбинантных штаммов БЦЖ, которые экспрессируют и секретируют один или более главных внеклеточных белков Mycobacterium tuberculosis.
Краткое изложение существа изобретения
Настоящее изобретение преследует описанные выше и другие цели путем предоставления нового класса вакцин и иммунотерапевтических агентов, а также способов лечения и профилактики заболеваний, вызываемых внутриклеточными патогенами, у млекопитающих. Исторически вакцины внутриклеточных патогенов и иммунотерапевтические агенты получали из самого внутриклеточного патогена или близкородственных видов. Данные старые модели вакцин состояли из целого микроорганизма или его субъединиц. Например, первая и к настоящему времени единственная пригодная вакцина Mycobacterium tuberculosis является ослабленной живой вакциной, полученной от близкородственного внутриклеточного патогена M. bovis. Недавно изобретатели настоящего изобретения обнаружили, что специфические внеклеточные продукты внутриклеточных патогенов, которые секретируются в ростовые среды, могут быть использованы для вызова защитных иммунных ответов у млекопитающих либо в виде индивидуальных субъединиц, либо в виде сочетаний субъединиц. Однако данные вакцины субъединиц не обеспечивали преимуществ по сравнению с исходной ослабленной вакциной, полученной из M. bovis.
Настоящее изобретение подробно описывает вакцины и иммунотерапевтические агенты, состоящие из рекомбинантных ослабленных внутриклеточных патогенов (вакцинирующих агентов), которые трансформированы для экспрессии внеклеточного(ых) белка(белков) (рекомбинантных иммуногенных антигенов) другого или того же самого внутриклеточного патогена. В одном осуществлении вакцины настоящего изобретения сделаны с применением рекомбинантных штаммов бациллы Кальметта и Герена или БЦЖ. В данном осуществлении рекомбинантная БЦЖ экспрессирует главные внутриклеточные белки патогенных микобактерий, включая, но не ограничиваясь этим, M. tuberculosis, M. leprae и M. bovis, называя некоторые из них.
Главные внеклеточные белки, экспрессируемые рекомбинантной БЦЖ, включают в себя, не ограничиваясь ими, 12 кДа, 14 кДа, 16 кДа, 23 кДа, 23,5 кДа, 30 кДа, 32А кДа, 32В кДа, 45 кДа, 58 кДа, 71 кДа, 80 кДа и 110 кДа Mycobacterium sp. и соответствующих аналогов, гомологов и их субъединиц, включая рекомбинантные негибридные белки, гибридные белки и их производные. Специалисту в данной области понятно, что молекулярные массы, применяемые для идентификации главных внеклеточных белков Mycobacteria и других внутриклеточных патогенов, обозначены только приблизительно. Специалисты в области рекомбинантной технологии и молекулярной биологии должны понимать, что возможна коэкспрессия (котрансляция) данных белков с дополнительными аминокислотами, полипептидами и белками, так же, как можно экспрессировать данные белки в укороченных формах. Полученные модифицированные белки все еще рассматриваются как входящие в объем настоящего изобретения, обозначаются ли они как нативные, негибридные белки, слитые белки, гибридные белки или химерные белки. В целях настоящего изобретения гибридные (слитые) белки определены как включающие в себя, но не ограничивающиеся ими, продукты двух или более кодирующих последовательностей от различных генов, которые совместно клонировались и которые после трансляции образуют единую полипептидную последовательность.
В настоящем изобретении также описываются вакцинирующие агенты рекомбинантных ослабленных внутриклеточных патогенов, которые гиперэкспрессируют негибридные белки по меньшей мере от одного другого внутриклеточного патогена. Это усовершенствуется применением внехромосомных нуклеиновых кислот для экспрессии по меньшей мере одного рекомбинантного гена иммуногенного антигена и помещения данного гена(ов) под контроль генных промоторов, отличных от белков теплового шока, или генных промоторов, отличных от белков стресса, предпочтительно последовательностей промотора, специфичных для белка. Соответственно, предлагаются вакцины, имеющие негибридные рекомбинантные иммуногенные антигены, экспрессируемые в количествах, больших, чем это возможно, когда гены, кодирующие рекомбинантные иммуногенные антигены, стабильно интегрированы в геномную ДНК вакцинирующего агента. В результате этого предлагаются вакцины внутриклеточных патогенов, имеющие неожиданно превосходящую специфичность и эффективность по сравнению с существующими вакцинами субъединиц или ослабленных патогенов.
Более того, настоящее изобретение описывает способы лечения и профилактики заболеваний млекопитающих, вызываемых внутриклеточными патогенами с применением вакцин настоящего изобретения. Частичное перечисление многих внутриклеточных патогенов, которые могут быть использованы в качестве ослабленных вакцинирующих агентов и/или источника рекомбинантных иммуногенных антигенов, включает в себя, не ограничиваясь ими, Mycobacterium bovis, M. tuberculosis, M. leprae, M. kansasii, M. avium, Mycobacterium sp., Legionella pneumophila, L. longbeachae, L. bozemanii, Legionella sp., Rickettsia rickettsii, Rickettsia typhi, Rickettsia sp., Ehrlichia chaffeensis, Ehrlichia phagocytophyla geno group, Ehrlichia sp., Coxiella burnetii, Leishmania sp., Toxpolasma gondii, Trypanosoma crusi, Chlamydia pneumoniae, Chlamydia sp., Listeria monocytogenes, Listeria sp. и Histoplasma sp. В одном осуществлении настоящего изобретения рекомбинантную БЦЖ, экспрессирующую 30 кДа главный внеклеточный белок M. tuberculosis, вводят млекопитающим с применением внутрикожных инокуляций. Однако понятно, что вакцины согласно изобретению могут быть введены с применением любого способа, который будет вести к соответствующему иммунному ответу, включая, но не ограничиваясь этим, подкожный, внутримышечный, интраназальный, внутрибрюшинный, пероральный способ введения или же с помощью ингаляции. После соответствующего постинокуляционного периода млекопитающих нагружали аэрозолем инфекционных M. tuberculosis. Млекопитающие, получавшие вакцину согласно изобретению, были заметно менее подвержены заболеванию по сравнению с млекопитающими, получавшими только БЦЖ, только главный внутриклеточный белок или любые их сочетания.
Другие цели, особенности и преимущества настоящего изобретения будут очевидны для специалистов после рассмотрения подробного описания предпочтительных иллюстративных осуществлений, взятых в сочетании с чертежами, которые вначале будут описаны в краткой форме.
Краткое описание чертежей
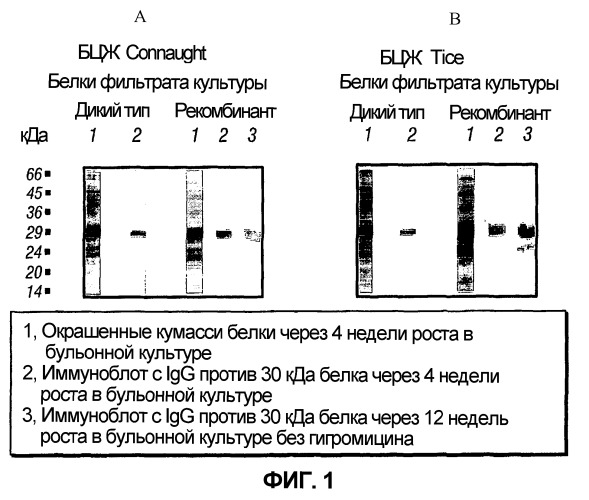
На фиг.1 отображены окрашенные Кумасси синим гели, обозначенные 1A и 1B, иллюстрирующие секрецию рекомбинантного Mycobacterium tuberculosis 30 кДа трансформированными штаммами БЦЖ из фильтратов культур.
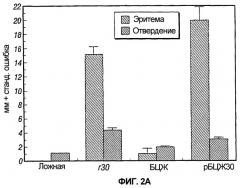
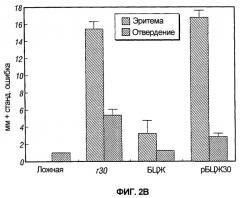
На фиг.2 графически представлены результаты двух экспериментов, обозначенных как 2A и 2B, предназначенных для сравнения результатов кожных тестов у морских свинок, инокулированных рекомбинантной вакциной БЦЖ, экспрессирующей главный внеклеточный белок 30 кДа M. tuberculosis, одной БЦЖ, одним рекомбинантным белком 30 кДа или пустой вакциной.
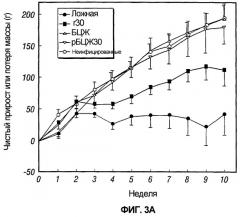
На фиг.3 графически отображено изменение массы морских свинок, обозначенных как 3A и 3B, после постиммунизационного контрольного заражения M. tuberculosis.
На фиг.4A графически представлены колониеобразующие единицы (CFU) инфекционного M. tuberculosis, обнаруженные в легких морских свинок после постиммунизационного заражения M. tuberculosis.
На фиг.4B графически представлены колониеобразующие единицы (CFU) инфекционного M. tuberculosis, обнаруженные в селезенке морских свинок после постиммунизационного заражения M. tuberculosis.
На фиг.5 графически изображена кожная реакция морских свинок в ответ на пустую вакцину, в ответ на одну только БЦЖ, и в ответ на БЦЖ, введенную вместе с 30 кДа M. tuberculosis.
Подробное описание изобретения
Настоящее изобретение направлено в целом на вакцины и иммунотерапию для лечения и профилактики инфекций у человека и животных, вызванных внутриклеточными патогенами. Ко