Антитела к антигену эпителиальных опухолей желудочно-кишечного тракта человека, родственному альфа 6 бета 4 интегрину
Иллюстрации
Показать всеИзобретение относится к области иммунобиотехнологии и может быть использовано в медицинской практике. Описано антитело или его производное, или его фрагмент, имеющие структуру, связывающую структуру мишени. Антитело расположено внутри и на поверхности опухолевых эпителиальных клеток желудочно-кишечного тракта человека и в субпопуляции нормальных эпителиальных клеток желудочно-кишечного тракта. Указанные связывающие структуры включают в себя последовательности определяющей комплементарность области (CDR) в легкой цепи, содержащие в основном аминокислоты под номером 23-33 (CDR1), 49-55 (CDR2), 88-98 (CDR3) аминокислотной последовательности, представленной в SEQ ID NO:2, и последовательности CDR в тяжелых цепях, содержащие в основном аминокислоты под номером 158-162 (CDR1), 177-193 (CDR2), 226-238 (CDR3) аминокислотной последовательности, представленной в SEQ ID NO:2, или другие связывающие структуры с подобными уникальными связывающими свойствами. Также описана структура-мишень, расположенная внутри или на поверхности опухолевых клеток: вакцинная композиция, предназначенная для лечения злокачественного заболевания у человека, содержащая вышеупомянутое антитело. Описаны также способы лечения и диагностики злокачественного заболевания. Использование изобретения позволяет получать антитела, которые облегчают идентификацию новых фенотипспецифических антигенов, связанных с опухолью, и прогнозировать и лечить метастатические заболеваний человека. 12 н. и 25 з.п. ф-лы, 8 ил., 4 табл.
Реферат
Настоящее изобретение относится к антителу или его производному, или его фрагменту, имеющему структуру, связывающую структуру мишени, находящейся на клеточной поверхности и в клетках эпителиальных опухолей желудочно-кишечного тракта человека и в субпопуляции нормальных эпителиальных клеток желудочно-кишечного тракта; и к структурам-мишеням, находящимся в опухолевых клетках или на их поверхности; к вакцинным композициям; к фармацевтическим композициям; а также к способам, относящимся к злокачественным заболеваниям человека.
ОСНОВА ИЗОБРЕТЕНИЯ
Хирургия является основным способом лечения колоректального рака, приводящим к выживанию в течение пяти лет в 90-40 процентах случаев в зависимости от стадии развития опухоли от А до С по [классификации] Dukes. Традиционная дополнительная терапия, которая включает в себя радиационную и химиотерапию, способна снизить скорость наступления смерти еще приблизительно на 30% (1). Несмотря на эти достижения, рак ободочной кишки является основной причиной смерти среди раковых заболеваний человека. Широко предпринимались попытки иммунологического лечения. Однако рак ободочной кишки обычно устойчив к иммунотерапии и, как полагают, обладает низкой иммуногенностью. Больные с раком ободочной кишки не поддаются ни IL-2 лечению, ни лечению, связанному с адоптивным переносом культивируемых in vitro лимфоцитов, инфильтрирующих опухоль, которые в других случаях обладают другой активностью у больных с иммуногенными злокачественными заболеваниями, такими как меланома. Тем не менее наиболее обнадеживающими являются сообщения Riethmuller и др. о 32-процентном снижении скорости наступления смерти в течение семи лет для колоректального рака Dukes на стадии С при лечении после резекции первичной опухоли чистыми мышиными mAb, направленными против опухоли и против связанного с нормальным эпителием антигена (Ер-САМ)(2), показывающие, что другие иммунотерапевтические методики могут быть эффективны.
Значительное усовершенствование методов дополнительной иммунотерапии и лечения более поздних стадий рака требует более сильных эффекторных механизмов, чем обеспечивают чистые mAb. В принципе, повышенная эффективность должна быть связана с повышенной избирательностью антитела в отношении опухоли-мишени.
Ограниченное количество антигенов, связанных с раком ободочной кишки, обнаружено с использованием гибридомы, продуцирующей мышиные mAb в результате ксеногенной иммунизации опухолями человека (3).
Можно ожидать, что использование обширной библиотеки распределения фагов для идентификации новых связанных с опухолью антигенов, значительно убыстрит процесс обнаружения молекул-мишеней, пригодных для опухолевой иммунотерапии и диагностики. Такая идентификация молекул-мишеней может быть осуществлена путем отбора и скрининга библиотеки фаговых антител на культивируемых опухолевых клетках и тканевых срезах для получения специфических реагентов, определяющих in vitro и in vivo экспрессируемые антигены (4). Создана технология размещения фагов, как эффективный инструмент для производства моноклональных антительных реагентов для различных очищенных антигенов, и в нескольких исследованиях описаны конструкция и успешная селекция, полученная на основе иммунных, интактных и синтетических библиотек фаговых антител (5).
Неиммунные библиотеки удобны с точки зрения возможности их обычного использования, что снимает необходимость в уникальных библиотеках для каждой отдельной мишени. С другой стороны, достаточно большие и высококачественные неиммунные библиотеки создают трудности для конструирования, и процесс обнаружения мишени с использованием этих библиотек должен требовать эффективных способов исключающего отбора на основе комплексных антигенов.
В настоящее время создана библиотека фагов более умеренного размера от человекообразных приматов, иммунизированных комплексными человеческими антигенами. Такой подход создает преимущества предварительной селекции репертуара in-vivo. Подобные библиотеки должны обогащаться с позиций специфичности в отношении опухолеспецифических эпитопов в сниженной фоновой реактивности в отношении ксеногенных антигенов (6). Кроме того, в отличие от мышиных, антитела приматов с последовательностью, в высокой степени гомологичной человеческим антителам, не должны быть иммуногенны для человека (7).
В настоящее время определены новые антитела приматов из библиотеки фагов, которые определяют избирательно экспрессируемые антигены, связанные с раком ободочной кишки. Терапевтический потенциал, продемонстрированный путем опосредованного Т-клетками уничтожения культивированных клеток рака ободочной кишки, покрытых двумя из этих конденсированных антител, слитых со сконструированными суперантигенами, сравним с таковым суперантигенов, слитых с мышиными Fab фрагментами, специфичными в отношении антигенов, связанных с раком ободочной кишки, таких как ЕР-САМ, для которых ранее было установлено наличие терапевтических свойств в экспериментальных системах (8).
Также предлагается способ эффективного положительного и исключающего клеточного отбора фаговых антител, которые должны облегчить в будущем идентификацию новых фенотипспецифических антигенов, включая антигены, связанные с опухолью, с использованием антител из обширных фаговых библиотек.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится в первом аспекте к антителу или к его производному, или к его фрагменту, имеющим структуру, связывающую структуру мишеней, расположенных на поверхности или внутри клеток гастроинтестинальной эпителиальной опухоли желудочно-кишечного тракта человека и в субпопуляции нормальных эпителиальных клеток желудочно-кишечного тракта человека, причем указанная связывающая структура включает в себя последовательность определяющей комплементарность области (CDR) в легкой цепи, содержащие в основном аминокислоты 23-33 (CDR1), 49-55 (CDR2), 88-98 (CDR3) аминокислотной последовательности, приведенной в SEQ ID NO:2, и последовательности CDR в тяжелой цепи, содержащие в основном аминокислоты 158-162 (CDR1), 177-193 (CDR2), 226-238 (CDR3) последовательности аминокислот, показанных в SEQ ID NO:2, или другие связывающие структуры с подобными уникальными связывающими свойствами.
В одном воплощении антитело представляет собой отобранный фаг. В другом воплощении последовательности происходят от Масаса fascicularis. Еще один аспект изобретения связан с производным указанного антитела человеческого происхождения. Последовательность предпочтительно по меньшей мере на 84% идентична соответствующим последовательностям человеческого происхождения. Предпочтительно антитело имеет низкую иммуногенность или отсутствие имуногенности для человека.
Еще в одном воплощении антитело дериватизировано в результате генетического связывания с другими полипептидами и/или путем химической конъюгации с органическими или неорганическими химическими молекулами, и/или путем ди-, олиго- или мультимеризации.
Еще в одном воплощении указанное антитело является генетически связанным или химически конъюгированным с цитотоксическими полипептидами или с цитотоксическими органическими или неорганическими полипептидами или с цитотоксическими органическими или неорганическими химическими молекулами.
Еще в одном воплощении указанное антитело является генетически связанным или химически конъюгированным с биологически активными молекулами.
Еще в одном воплощении указанное антитело является генетически связанным или химически конъюгированным с иммуноактивирующими молекулами.
В другом воплощении указанное антитело изменено для повышения или снижения его авидности и/или сродства.
Еще в одном воплощении указанное антитело изменено для повышения выхода при его продукции.
Еще в одном воплощении указанное антитело изменено для воздействия на его фармакокинетические свойства.
Еще в одном воплощении указанное антитело изменено для получения новых фармакокинетических свойств.
Еще в одном воплощении указанное антитело является меченным, и его связывание подавляется немеченной формой указанного антитела, а не другими связывающими структурами, при этом не подавляя связывания других связывающих структур, имеющих другую специфичность.
Еще одно воплощение представляет собой антитело, связывающая структура которого распознает невосстановленную форму α6β4-интегрина.
В другом аспекте изобретение относится к структурам-мишеням, расположенным в опухолевых клетках или на их поверхности, причем указанные структуры мишени
a) обладают способностью специфически блокироваться и специфически блокировать связывающую структуру антитела, как определено в любом из пунктов 1-14, и другие связывающие структуры со сходной специфичностью связывания,
b) расположены в эпителиальных клетках желудочно-кишечного тракта человека или на их поверхности,
c) имеют существенную степень гомологии с α6- и/или β4-интегриновыми цепями или их вариантами, представляющими собой широко распространенный или уникальный эпитоп,
d) являются высоко экспрессируемыми в высокой степени на поверхности опухолевых клеток, и
е) являются мишенью для цитотоксических эффекторных механизмов.
В данном контексте выражение "существенная гомология" означает гомологию в тех частях структуры-мишени, которые являются подходящими для связывания антитела.
В одном воплощении указанной структуры-мишени связывающая структура является меченной, и ее связывание ингибируется немеченой формой указанной связывающей структуры, а не другими связывающими структурами, и не подавляет связывание других связывающих структур, имеющих другую специфичность связывания.
Еще в одном воплощении указанной структуры-мишени указанная связывающая структура содержит одну или более из последовательностей области, определяющей комплементарность (CDR), включающих в себя в основном аминокислоты номер 23-33, 49-55, 88-98, 158-162, 177-193, 226-238 последовательности аминокислот SEQ ID NO: 2, или другие связывающие структуры со сходными уникальными связывающими свойствами.
Еще в одном воплощении указанной структуры-мишени указанной связывающей структурой является антитело, которое еще в одном воплощении содержит вариабельную область легкой цепи, включающую в себя в основном аминокислоты номер 1-109 последовательности аминокислот SEQ ID NO: 2, и вариабельную область тяжелой цепи, включающую в себя в основном аминокислоты номер 128-249 аминокислотной последовательности SEQ ID NO: 2.
Указанная структура-мишень еще в одном воплощении экспрессируется гомогенно в эпителиальных клетках ободочной кишки человека и в меньшей степени - в клетках протока поджелудочной железы и желчного протока.
Еще в одном воплощении экспрессия указанной структуры-мишени коррелирует с дифференцировкой желудочно-кишечного эпителия.
В другом воплощении указанная структура-мишень включает в себя последовательность аминокислот α6β4-интегрина, α6-часть которой показана в SEQ ID NO: 3, а β4-часть приведена в SEQ ID NO: 4. Другое воплощение структуры-мишени включает в себя гомо- или гетеромономеры или гомо- или гетеромультимеры указанного α6β4-интегрина и/или указанных одного или более фрагментов и/или субъединиц. Предпочтительно указанные структуры-мишени имеют кажущийся молекулярный вес в своей невосстановленной форме от 90 до 140 кДа, более предпочтительно - от 80 до 160 кДа.
Еще в одном воплощении структура-мишень включает в себя пептид или полипептид(ы), содержащие в основном последовательности аминокислот, приведенные в SEQ ID NO: 5-51, или содержит молекулу, образующую комплекс с указанным(и) полипептидом(ами).
В том случае, когда структура-мишень включает в себя последовательность аминокислот из α6β4-интегрина, еще в одном воплощении указанная структура-мишень может кроме того распознаваться, исключительно или нет, в своей не восстановленной форме с помощью связывающей структуры, включенной антителом, как определено выше.
Еще в одном аспекте изобретение относится к субстанции, которая связывается со структурой-мишенью, как определено выше, которая представляет собой органическую химическую молекулу или пептид. В одном воплощении указанная субстанция является анти-идиотипом указанной структуры-мишени. Указанный анти-идиотип может быть специфически блокирован и может специфически блокировать связывающую структуру, имеющую сходную специфичность связывания указанной структуры-мишени.
Еще в одном аспекте изобретение относится к субстанции, которая блокирует функцию структуры-мишени, как определено выше, являющейся органической молекулой или пептидом.
В другом аспекте изобретение относится к связывающей структуре, которая распознает структуру-мишень, как определено выше, и которая имеет органическую химическую природу.
Еще в одном аспекте изобретение относится к фармацевтической композиции, содержащей в качестве активного начала антитело, как определено выше, или структуру-мишень, как определено выше, или субстанцию, как определено выше.
Еще в одном аспекте изобретение относится к вакцинной композиции, содержащей в качестве активного начала abn антитело, как определено выше, или структуру-мишень, как определено выше, или субстанцию, как определено выше.
Еще в одном аспекте изобретение относится к способу терапии для лечения состояний, в основе которых лежит анти-ангиогенный механизм, где человеку вводится антитело, определяемое выше, или структура-мишень, определяемая выше, или субстанция, определяемая выше.
В другом аспекте изобретение относится к способу лечения метастатических заболеваний человека, где человеку вводится определяемое выше антитело.
Еще в одном аспекте изобретение относится к способу проведения in vitro гистопатологической диагностики и определения прогноза злокачественного заболевания человека, где образец контактирует с антителом, определяемым выше, и с индикатором.
Воплощения указанного способа включают в себя определение типа опухоли, скрининг опухоли, диагноз и прогноз, а также контроль предраковых состояний.
Еще в одном аспекте изобретение относится к способу проведения in vitro диагностики и определения прогноза злокачественных заболеваний человека, где исследуется концентрация антигена в жидкостях организма, включая структуру-мишень, определяемую выше, или анти-идиотип указанной структуры-мишени, определяемой выше.
Еще в одном воплощении изобретение относится к способу проведения in vitro диагностики и определения прогноза злокачественных заболеваний человека, где исследуются концентрации определяемых выше антител в жидкостях организма.
Еще в одном аспекте изобретение относится к способу проведения in vitro диагностики и определения прогноза злокачественных заболеваний человека, где исследуется концентрация в жидкостях организма комплекса а) антигена, включающего в себя структуру-мишень, определяемую выше, или анти-идиотип указанной структуры-мишени, определяемой выше, и b) антитела, определяемого выше.
Еще в одном аспекте изобретение относится к способу проведения in vitro диагностики и определения прогноза злокачественных заболеваний человека, где определяется локализация антитела, определяемого выше, относительно расположения опухоли у человека. Указанное антитело предпочтительно вводится субъекту перед определением. В одном воплощении указанное антитело накапливается в опухолевой ткани. Еще в одном воплощении указанный способ является количественным.
Другой аспект изобретения относится к способу лечения злокачественных заболеваний человека, где человеку вводится антитело, определяемое выше. В одном воплощении этого способа названое антитело модифицируется путем генетического связывания с молекулой, что дает измененные фармакокинетические свойства комбинированной молекулы. В другом воплощении указанное антитело заменено на его производное.
Подробное описание изобретения
Идентификация новых связанных с опухолью антигенов (ТАА) является основным моментом для развития в области иммунотерапии и диагностики опухолей. В связи с настоящим изобретением были впервые разработаны на основе проточной цитометрической оценки и использовании мини-библиотеки, состоящей из клонов специфических антител, связанных с различными маркерами устойчивости к антибиотикам, способы положительного и исключающего отбора фаговых антител, с использованием интактных клеток в качестве источника антигенов. scFv библиотека фагов (2,7×107) сконструирована у приматов (Масаса fascicularis), иммунизированных пулом карцином ободочной кишки человека. Эта библиотека выбрана путем трехкратного проведения связывания с Соlо205 клетками аденокарциномы ободочной кишки, и протеолитической элюции, с последующей амплификацией фагов.
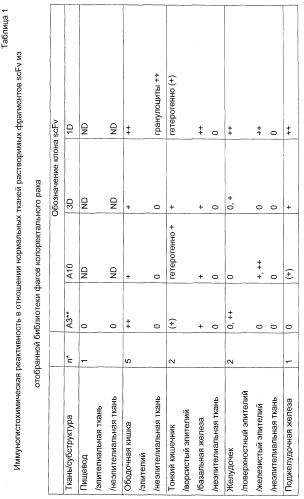
Несколько антител, взаимодействующих с карциномой ободочной кишки и с ограниченной реакционной способностью в отношении нескольких типов нормальных эпителиальных тканей, идентифицировали с помощью иммуногистохимиии. Один клон, A3 scFv, распознавал эпитоп, который был гомогенно экспрессирован в 11 из 11 исследованных карцином ободочной кишки и в 4 из 4 исследованных карцином поджелудочной железы, при этом его экспрессия в нормальных тканях ограничивалась подтипами эпителия желудочно-кишечного тракта. A3 scFv обладал кажущейся общей аффинностью, примерно в 100 раз более высокой, чем A3 Fab, что указывает на связывание scFv гомодимеров. Плотность A3 эпитопов на клеточной поверхности, подсчитанная на основании Fab связывания, была исключительно высокой, приблизительно 3 миллиона на клетку.
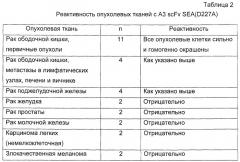
Также описано эффективное опосредованное Т-клетками уничтожение раковых клеток ободочной кишки, покрытых As scFv, слитых с суперантигеном мутантной SEA (D227A) с низким сродством к МНС класса II. Идентифицированная A3 молекула, таким образом, представляет собой ТАА-молекулу со свойствами, которые позволяют предложить использование в иммунотерапии рака ободочной кишки и поджелудочной железы.
ОБСУЖДЕНИЕ
В связи с настоящим изобретением разработана эффективная схема отбора фагов из обширной библиотеки фагов для использования в идентификации фрагментов антител, специфичных для определяемого фенотипа клеток. Мишеневая специфичность для представленного в примерах использования была представлена для антигенов, связанных с опухолью ободочной кишки.
Сначала анализировали частоту поверхностного слитого протеина распределения pIII-scFv в популяции фагов, используя присутствующую здесь фагмидную конструкцию для распространения фага. Достигается более высокий уровень расположения С215 scFv по сравнению с предыдущими сообщениями. Это должно благоприятно сказываться на эффективности исключающего отбора, а также повышать вероятность авидного отбора из библиотек антител с низким аффинитетом.
С очевидностью продемонстрирована специфичность связывания С215 scFv фага с клетками Соlо205 аденокарциномы ободочной кишки. Связанный фаг может быть эффективно элюирован с использованием протеазы Genenase, которая специфически расщепляет последовательность-мишень между фаговым протеином III и scFv антителом, оставляя после элюации клетки интактными. Этот способ нехимической элюции должен с одинаковой эффективностью элюировать как фаговые антитела независимо от их связывающего сродства, так и только фаг, связанный scFv связями, добавляя к специфичности процесса.
Обогащение, достигаемое после трех кругов отбора на Сlоn205-клетках (500 000х) с использованием этой схемы отбора, подобно обогащению, описанному другими авторами для отбора комплексных антигенов.
После подтверждения выполнения различных методологических шагов к отбору библиотеки применялась комбинированная методика с использованием Соlо205 клеток.
Библиотеку конструировали из видов человекообразных, иммунизированных опухолями человека. Пул антител, полученный таким путем, возможно включает в себя аффинно зрелые антитела к опухолеспецифичным антигенам с ограниченным фоном ксено реактивности к широко распространенным нормальным антигенам тканей человека (6). Идентифицированные антитела распознавали антигены опухоли и тканевой дифференцировки с ограниченным распределением нормальных тканей. Все отобранные антитела, идентифицированные как реактивные при первичном скрининге в отношении ткани рака ободочной кишки, также взаимодействуют с жизнеспособными клетками Соlо205 в проточной цитометрии. Это ограничение специфичности клеточной поверхности должно отражать процесс отбора, а не состав библиотеки, если для иммунизации используется суспензия смеси компонентов опухолевой ткани.
В подобном предыдущем исследовании вне- и внутриклеточную специфичность идентифицировали в антимеланомной библиотеке, полученной таким же путем и отобранной с использованием тканевых срезов в качестве источника антигена (4). Тканевые срезы резецированных колоректальных опухолей и нормальной ободочной кишки человека (помещенных в одну и ту же лунку) использовали для первичного скрининга, используя иммуногистохимию, чтобы гарантировать клиническое соответствие выбранных специфичностей для повышения эффективности и для получения более качественной информации по сравнению со скринингом методом проточной цитометрии.
Отобранные антитела можно было классифицировать в четыре антителоспецифические группы, отличающиеся по характеру реактивности к эпителию различных органов (смотри пример 1, таблица 1). Среди этих групп специфичности A3scFv определяла большинство из отобранных опухолевых антигенов. Такой A3 ТАА был в высокой степени гомогенно и часто экспрессирован в образцах первичного и метастатического рака ободочной кишки и рака поджелудочной железы. Более того, уровень его экспрессии на клеточной поверхности, определяемый с помощью слитого протеина A3 Fab (3 миллиона эпитопов/клетку), был исключительно высоким и доступным для опосредованных клеточной поверхностью цитотоксических эффектов.
Немногие, если вообще таковые есть, из определяемых часто экспрессируемых опухолевых антигенов человека являются опухолеспецифичными, они обычно относятся к тканевой дифференцировке, как например A3 и Ер-САМ. Однако повышенная экспрессия этих антигенов в опухолях должна обеспечить основу для терапевтически активного интервала доз. Доступность поступления из циркуляции нормальных тканевых компартментов, экспрессирующих антиген, может также быть более ограниченной в результате ограниченной капиллярной проницаемости и локализации их экспрессии в организме (например, экспозиция апикальной стороны эпителиальных клеток кишки для циркулирующих антител должна быть очень ограничена).
Клинический опыт с пан-эпителиальными Ер-САМ-реактивным 17-1A-mAb подтверждает возможность идентификации эффективной нетоксичной дозы антител. Ограниченная экспрессия в эпителии всех отобранных в этой работе клонов scFv указывает на то, что эти клоны можно принципиально расценивать как кандидаты для иммунотерапевтического применения, аналогично 17-1А, например, как полномерные mAb. Однако особое преимущество A3 ТАА по сравнению с Ер-САМ состоит в отсутствии экспрессии в большинстве видов нормального эпителия, такого как эпителий легких и почек, хотя экспрессия в ободочной кишке такая же.
Тканевое распределение подтипов нормального эпителия поддерживается избирательной экспрессией в подтипах карцином, происходящих из желудочно-кишечного тракта (смотри пример 2, таблица 2).
Несколько из ранее хорошо известных антигенов, ассоциированных с раком ободочной кишки (СЕА, СА50, СА19-9, СА242, Tag-72) (3), по сравнению с А3-эпитопом, равным образом или несколько ограниченно экспрессируются в нормальных тканях. Однако в отличие от A3 и С213 Ер-САМ они более гетерогенно экспрессированы в опухолях.
Использование антител к Ер-САМ давало хорошие клинические результаты, включая преимущество в выживании у больных с раком ободочной кишки, при проведении адъювантной терапии. Чтобы вызвать опухолевый ответ даже у больных с более поздней стадией, можно ввести сильные эффекторные молекулы в сочетании с этим антителом, что вызовет "устойчивость нормальной ткани", наблюдаемую при лечении чистым 17-1А mAb. В доклинических исследованиях это можно было изучить на модельных системах, используя токсин-конъюгированные антитела, специфичные в отношении мышиной версии этого антигена, или на животных, трансгенных для антигенов, связанных с раком ободочной кишки человека.
Ранее иммунотоксины антител успешно использовались для лечения мышей в моделях с метастатически растущими опухолями, экспрессирующими ксено (человеческие) опухолевые антигены не экспрессируемые в тканях мышей (10). Однако использованные ТАА являются действительно опухолеспецифичными, и модели не отражают потенциальной токсичности в отношении нормальной ткани-мишени.
В предыдущих исследованиях авторы сообщали о возможных суперантигенах в качестве иммуностимуляторных токсинов для опухолевой иммунотерапии (8). Опосредованное антителом нацеливание суперантигенов привлекало большое число цитотоксичных и цитокин-продуцирующих Т клеток к участку расположения опухоли. Суперантиген SEA (D227A), мутированный с целью приобретения низкой аффинности связывания МНС класса II был генетически связан с нацеленными на опухоль антителами. Этот "опухолеселективный" агент применяли к молодым Т-клеткам, независимо от экспрессии МНС в опухоли, таким образом уменьшая проблемы, связанные с МНС регулирования и полиморфизмом, которые являются значительным препятствием для других активных иммунотерапевтических подходов.
Мини-библиотека полученных клонов антител "опухолеселективного", 1F scFv-фага, "широкореактивного" С215-фага, и неспецифического D1.3-фага явилась существенной основой для разработки схемы эффективного исключающего отбора. Требование этого исключающего правила состоит в том, что за отрицательным выбором следует "спасение" фага и амплификация, благодаря высокой частоте не распределенных фаговых частиц. Альтернативно, не распределенный фаг можно сделать незаразным путем избирательного протеолиза (G. Winter, pers. Comm.). Подобная методика дает возможность создания "инертных библиотек", то есть библиотек, которые предварительно отобраны путем экстенсивно отрицательной селекции (например, по отношению к клетке в состоянии покоя или способной к трансфекции родительской клетке).
В заключение, "нежелательная" модель фаговой специфичности может быть избирательно исключена из популяции фагов приблизительно с коэффициентом 100 в каждом цикле отбора. Дальнейший исключающий отбор с помощью разработанной схемы в сочетании с использованием большой неиммунной библиотеки фагов для идентификации антигенов, дифференциально экспрессируемых на клеточной поверхности, покажет, окажется ли такой подход лучше стратегии, которую использовали авторы изобретения в этом исследовании, то есть положительный отбор с использованием in vivo пре-селективного иммунного репертуара, включая ограничения и смещения, такие как иммунодоминирование (4). Низкое сродство и высокая плотность эпитопов, показанные в случае связывания A3 Fab с опухолевыми клетками, по сравнению со слитым протеином A3 scFv, предполагает образование scFv-мультимеров, которые взаимодействуют с эпитопами, которые образуют кластеры на поверхности клеток. Следует разработать одновалентные варианты A3 Fab с более высоким сродством или - альтернативно стабильные двухвалентные конструкции, такие как полноразмерные привитые mAb A3 Fv, сравнимые с A3 с предполагаемой низкой иммуногенностью. Такие конструкции будут подходящими для нацеливания соответствующих эффекторных молекул на эти экспрессируемые в большом количестве антигены, ассоциированные с опухолями желудочно-кишечного тракта.
Далее изобретение иллюстрируется следующей неограничивающей экспериментальной частью описания.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
Животные
Обезьян cynomolgus Macaque (Macaca fascicularis) содержали и иммунизировали в шведском Институте Контроля Инфекционных Заболеваний (SIIDC), Стокгольм. Воду и питье животные всегда получали ad libitum. Четырех обезьян иммунизировали подкожно 2 мл неочищенной суспензии тканей рака ободочной кишки в 10% нормальной сыворотке в PBS. Усиливающие дозы вводили на 21, 35 и 49 дни. Антительные ответы были получены у двух обезьян, где антиген смешивали с адъювантом, содержащим квасцы. Всех животных содержали в соответствии со шведским законодательством, и эксперименты были одобрены местным этическим комитетом.
Ткани и клетки
Образцы опухолей и нормальных тканей человека получали из Национального университетского госпиталя Главного госпиталя Malmö, Швеция. Колоректальные клетки человека линии Соlо205, В клетки лимфомы человека линии Raji и мышиную клеточную линию В16 меланомы получали из американской коллекции культур тканей (АТСС, Rockville, MD). Клетки меланомы мыши В16-С215+ подвергают трансфекции вектором экспрессии pKGE839, содержащим ген Ер-САМ-1 (С215), описанный ранее (9).
Клетки человека культивировали в среде RPMI1640 (Gibco, Middlesex, UK), снабженной 10% инактивированной нагреванием фетальной бычьей сывороткой (Gibco) и 0,1% мг/мл гентамицинсульфата (Biological Industries, Kibbutz Beit Haemek, Israel). Мышиные клетки культивировали в среде, дополненной 1 мМ глутамина (HyClone, Cramlington, UK), 5×10-5 M β-меркаптоэтанола (ICN, Costa Mesa, CA), 0,2% NaHCO3 (Seromed Biochrome, Berlin, Germany), 1 × 10-2 M HEPES (HyClone, UT) и 1 × 10-3 M пирувата натрия (HyClone). Клетки повторно тестировали на загрязнение микоплазмой с помощью теста генной пробы Mycoplasma Т.С. (San Diego, CA).
Фагмидный вектор и конструирование библиотеки фагов
Общую РНК селезенки экстрагировали у одной из отвечающих обезьян, используя набор для выделения РНК из Promega (Mannheim, Germany), и кДНК амплифицировали, используя набор для ПЦР РНК от РЕ Biosystems (Стокгольм, Швеция). Праймеры для синтеза кДНК генов легких цепей лямбда и тяжелых цепей и для объединения этих генов в scFv-гены были опубликованы ранее (4). scFv-кДНК лигировали в фагмидный вектор (4) при слиянии с остатками 249-406 М13 гена III. scFv-gIII-ген экспрессировали из промотора phoA, и полученный в результате протеин направлялся теплостабильным сигнальным пептидом токсина II Е. Coli.
Повторная электропорация 7 мкг библиотеки векторов со вставками гена scFv приводит к первичному росту в количестве 2,7×107 трасформированных Е. Coli TG-1 в виде колоний на минимальных агаровых плашках. Колонии снимали с плашек и растили в 2×YT при 150 об/мин и 37°С в течение 1 часа.
Культуру суперинфицировали хелперным фагом М13К07 (Promega) в 50-кратном избытке. Добавляли ампициллин до концентрации 100 мг/л и культуру растили еще в течение часа. После добавления канамицина до концентрации 70 мг/л культуру растили в течение 15 часов при 30°С и 250 об/мин. Фаговые частицы собирали из культурального супернатанта путем двух повторных PEG/NaCl осаждений. Осажденный фаг растворяли в PBS с 1% БСА.
Вестерн-блоттинг
Серии двукратного разведения scFv-С215-частиц фага (из неразведенного исходного ПЭГ-осажденного/концентрированного фага) наносили для разделения на восстанавливающий 12% полиакриламидный гель с 1% и 2% β-меркаптоэтанолом. Затем протеин с помощью электрофореза переносили на нитроцеллюлозную мембрану (Bio-Rad, Hercules, CA). Мембрану блокировали 5% молоком с низкой жирностью (Semper АВ, Стокгольм, Швеция) а затем инкубировали с кроличьей антисывороткой против пептидной последовательности AEGDDPAKAAFNSLQASATEC, полученной из протеина III, конъюгированной с гемоцианином молюска блюдечко. Вторичные конъюгированные с пероксидазой хрена (HRP) козьи антикроличьи антитела (Bio-Rad) инкубировали в течение 30 минут. Между любыми этапами мембрану промывали 3 раза в течение 5 минут в PBS/0,5% Твин 20. Мембрану инкубировали в субстрате (Amersham Pharmacia Biotech, Little Chalfon Buckinghamshire, UK) в течение 1 минуты. Светочувствительную пленку (ECL hyperfilm, Amersham) экспонировали на мембране и выдерживали в течение 0,5-5 мин.
Таким же образом, для анализа целостности очищенного Fab (A3, включая cynomolgus CH1 и С-лямбда домены), scFv- и Fab (включая мышиный CH1 м С-каппа) -SEA (D227A) слитых протеинов (полученных, как описано ранее (9)), предпринимали 12% SDS-PAGE. Мембраны с перенесенными протеинами инкубировали с очищенными поликлональными кроличьими анти-SEA-антителами с последующими стадиями обработки, описанными выше.
Выбор модели и библиотеки фагов на клетках
Суспензии фагов библиотеки легкой цепи лямбда (или модели фага), 1012 в 100 мкл PBS/1% БСА инкубировали с 3 миллионами Соlо205 клеток в течение 1 часа на льду. Клетки промывали 3 раза, включая 10-минутную инкубацию с использованием 2 мл PBS/1% БСА для каждого промывания. Фаг элюировали, добавляя 50 мкл 33 мкг/мл гененазы (Genenase) к клеточному осадку, и инкубовали в течение 15 минут. Гененаза, которая представляет собой мутант BPN- субтилизина, S24C/H64A/E156S/G169A/Y217L, была любезно предоставлена Dr. Paul Carter (Сан-Франциско, СА). После центрифугирования супернатант переносили в новую пробирку и добавляли 250 мкл 1% БСА в PBS. Для "спасения" и амплификации отобранной библиотеки (и модели частиц фага в многоразовом эксперименте) элюированным фаговым частицам позволяли заражать 1 мл Е. coli DH5αF' (OD600нм=1,0). Зараженную бактериальную культуру разбавляли в 100 раз средой 2×YT, обогащенной подходящим антибиотиком, и культивировали до OD>1,0 (вплоть до 2 дней).
Наконец, для получения растворимого scFv амбер-супрессорный штам НВ2151 Е coli инфицировали библиотекой, отобранной из второго и третьего цикла. После роста на агаровых планшетах, содержащих ампициллин, единичные колонии культивировали в 96-луночном микропланшете в 2×YT среде, дополненной ампициллином, при 30°С в течение 17 часов. После центрифугирования, удаления супернатанта, к которому добавляли равный объем PBS/1% БСА, отдельные scFv анализировали на иммунореактивность по отношению к срезам опухолевых и нормальных тканей человека. Вкратце, С-концевую метку ATPAKSE определяли, используя кроличью антисыворотку, а затем биотинилированные козьи антикроличьи антитела (DAKO A/S, Копенгаген, Дания) и СтрептАВкомплекс HRP (DAKO A/S) (смотри "Иммуногистохимия").
Иммуногистохимия
Замороженные криосрезы (8 мкм) сушили воздухом на предметных стеклах, фиксировали ацетоном при -20°С в течение 10 минут и регидрировали в 20% фетальной бычьей сыворотке в PBS (FBS). Эндогенный биотин блокировали авидином (разведенным 1/6) в течение 15 минут, и затем биотином (разведенным 1/6) в течение 15 минут (Vector Laboratories, Burlingame, CA). Аффинно очищенные и биотинилированные кроличьи анти-SEA-антитела, 5 мкг/мл, инкубировали в течение 30 минут с последующим добавлением СтрептАВкомплекса HRP (DAKO A/S, Копенгаген, Дания), разведенного 1/110 50 мМ Трис рН 7,6 в течение 30 минут. Между всеми стадиями срезы промывали 3 раза в TBS. Окрашивание проводили в течение 8 минут в 0,5 мг/мл 3,3'-диаминобензидинтетрагидрохлорида (Sigma), растворенного в Трис, рН 7,6 с 0,01% Н2O2. После 10 минут окрашивания в 0,5% метиловом зеленом предметные стекла промывали в течение 10 минут водопроводной водой и постепенно дегидрировали в 70-99% этаноле и ксилоле перед помещением в среду DPX (Sigma).
Проточная цитометрия
Клетки Соlо205 рака ободочной кишки человека разъединяли с помощью 0,02% вес/объем EDTA и промывали PBS. Чтобы получить развитие антительного ответа у обезьян, клетки инкубировали последовательно с разведенной сывороткой в течение 1 часа при 4°С, биотинилированными кроличьими античеловеческими IgG-антителами (Southern Biotechnology Ass. Inc., A1, USA) в течение 30 минут и, наконец, с авидином-РЕ (Becton Dickinson, Mountain View, CA) в течение 30 минут.
Связывание модельного фага с клетками анализировали с использованием кроличьих анти-М13-антител (полученных путем иммунизации кроликов частицами М13) и FITC-конъюгированных ослиных антикроличьих антител (Amersham Pharmacia Biotech). Связывание антител, слитых с SEA (D227A), определяли, используя биотинилированные кроличьи анти-SEA-антитела и авидин РЕ. Все реагенты разводили в PBS/1% БСА. Клетки промывали дважды PBS/1% БСА после инкубаций с реагентами и трижды, включая 10-минутные инкубации после связывания частиц фага.
Проточный цитометрический анализ проводили с использованием проточного цитометра FACSort (Becton Dickinson).
Определение сродства на культивированных клетках
Слитые протеины A3 scFv-SEA(D227A), A3 Fab-SEA(D227A) и 1F scF