Электрохимический способ измерения скоростей химических реакций
Иллюстрации
Показать всеИзобретение относится к аналитической химии. Технический результат изобретения: упрощение способа и расширение его применения за счет обеспечения возможности использования для определения скоростей также относительно медленных реакций. Сущность: способ содержит стадии: фиксируют реагент в электрохимической ячейке на минимальном расстоянии от рабочего электрода, при этом расстояние является таким, что перенос электрохимически активного вещества из этой области к рабочему электроду является диффузионно контролируемым, затем помещают образец жидкости в электрохимическую ячейку таким образом, что образец жидкости находится в контакте с реагентом, рабочим электродом и противоэлектродом, осуществляют взаимодействие компонента с реагентом с получением электрохимически активного вещества; прикладывают потенциал между рабочим электродом и противоэлектродом, при этом потенциал является достаточным для электрохимического взаимодействия электрохимически активного вещества на рабочем электроде, затем измеряют ток электрохимической реакции на рабочем электроде для получения меры скорости химической реакции. 2 н. и 29 з.п. ф-лы, 3 ил.
Реферат
Область изобретения
Настоящее изобретение относится к измерению протекания химической реакции, которая генерирует электрохимически активный реакционный продукт, который впоследствии амперометрически или кулонометрически детектируется на электроде. Способ является пригодным для использования в тех применениях, где является желательным отслеживать ход химической реакции, в особенности, в применениях, относящихся к сенсорам, где протекание реакции анализируемого вещества может быть пригодным для использования при определении концентрации анализируемого вещества.
Известный уровень техники
В амперометрической электрохимии ток, протекающий на электроде, может быть использован в качестве меры концентрации электрохимически активного вещества, которое электрохимически взаимодействует на рабочем электроде. В кулонометрии ток, протекающий на электроде, интегрируется по времени с получением общего количества прошедшего заряда, который дает меру количества электрохимически активного материала, взаимодействующего на рабочем электроде. Протекающий на электроде ток (или заряд, прошедший за любое время) зависит от скорости переноса электрохимически активного вещества к рабочему электроду. Когда вблизи электрода устанавливается значительная концентрация электрохимически активного вещества и к электроду прикладывается электрический потенциал, достаточный для электрохимического взаимодействия электрохимически активного вещества на границе раздела электрод/раствор, сначала протечет более высокий ток, который будет понижаться со временем. Для изолированного электрода, где потенциал, приложенный к электроду, является достаточным для эффективного взаимодействия электрохимически активного вещества непосредственно при достижении электрода, и перенос электрохимически активного вещества к электроду контролируется диффузией, ток будет описываться кривой, известной в данной области техники как уравнение Котрелла. В соответствии с этим уравнением ток изменяется обратно пропорционально квадратному корню из времени. Это дает ток, который затухает со временем, поскольку концентрация электрохимически активного вещества, которое взаимодействует на электроде, истощается вблизи электрода, и поэтому электрохимически активное вещество должно приходить с все возрастающего расстояния, чтобы достичь электрода, по мере того, как проходит время.
Если, в дополнение к электрохимическому взаимодействию электрохимически активного вещества на электроде, электрохимически активное вещество генерируется и вблизи рабочего электрода с помощью химического взаимодействия, форма тока, протекающего на электроде, становится более сложной. Электродная реакция стремится к понижению концентрации электрохимически активного вещества вблизи рабочего электрода, в то время как химическая реакция стремится к повышению концентрации электрохимически активного вещества в этой области. Зависимое от времени поведение этих двух процессов накладывается друг на друга, и по этой причине является сложным измерять кинетику химических реакций с помощью тока, протекающего (или заряда, прошедшего) на электроде.
По этой причине в опубликованной литературе скорости химических реакций, как правило, не измеряются электрохимически, за исключением специальных применений с использованием специального оборудования. Пример такого оборудования является известным в данной области техники как вращающийся кольцевой/дисковый электрод. Это устройство применимо только к относительно быстрой кинетике реакции и требует, чтобы электрод вращался с известной контролируемой скоростью при хорошо определенной гидродинамике жидкости.
Сущность изобретения
Предлагаемый способ дает возможность извлечения информации о скорости химической реакции с использованием простого электрохимического способа и устройства.
В первом аспекте предлагается способ измерения скорости химической реакции между компонентом образца жидкости и реагентом, причем реакция производит электрохимически активное вещество, включающий в себя: обеспечение наличия электрохимической ячейки, содержащей рабочий электрод, противоэлектрод и по меньшей мере одну стенку; фиксирование (иммобилизацию), по существу, реагента в электрохимической ячейке в некоторой области на минимальном расстоянии от рабочего электрода, при этом расстояние является таким, что перенос электрохимически активного вещества из этой области к рабочему электроду является диффузионно контролируемым; помещение образца жидкости в электрохимическую ячейку таким образом, что образец жидкости находится в контакте с реагентом, с рабочим электродом и противоэлектродом; взаимодействие компонента с реагентом с получением электрохимически активного вещества; приложение потенциала между рабочим электродом и противоэлектродом, при этом потенциал является достаточным для электрохимического взаимодействия электрохимически активного вещества на рабочем электроде; и измерение тока, производимого электрохимической реакцией на рабочем электроде, с получением меры скорости химической реакции.
В одном из аспектов настоящего варианта воплощения рабочий электрод и противоэлектрод достаточным образом отделены друг от друга для того, чтобы продукт электрохимической реакции, протекаемой на противоэлектроде, не достигал рабочего электрода в то время, когда измеряется ток. Рабочий электрод и противоэлектрод могут быть отделены друг от друга расстоянием, большим, чем примерно 500 микрон; в пределах между примерно 500 микронами и примерно 5 мм; или в пределах между примерно 1 мм и примерно 2 мм. Рабочий электрод и противоэлектрод могут быть расположены на одной и той же плоскости.
В другом аспекте настоящего варианта воплощения область и рабочий электрод разделены минимальным расстоянием, находящимся в пределах от примерно 10 микрон до примерно 5 миллиметров; от примерно 50 микрон до примерно 500 микрон; или от примерно 100 микрон до примерно 200 микрон.
В другом аспекте настоящего варианта воплощения противоэлектрод является способным к функционированию в качестве комбинированного противоэлектрода/электрода сравнения. Электрохимическая ячейка может дополнительно включать в себя электрод сравнения.
В другом аспекте настоящего варианта воплощения рабочий электрод функционирует в качестве анода и может включать в себя платину, палладий, углерод, углерод в сочетании с одним или несколькими инертными связующими, иридий, оксид индия, оксид олова, сочетание оксидов индия и олова и их смеси.
В другом аспекте настоящего варианта воплощения рабочий электрод функционирует в качестве катода и может включать в себя платину, палладий, углерод, углерод в сочетании с одним или несколькими инертными связующими, иридий, оксид индия, оксид олова, сочетание оксидов индия и олова, сталь, нержавеющую сталь, медь, никель, серебро, хром и их смеси.
В другом аспекте настоящего варианта воплощения противоэлектрод содержит платину, палладий, углерод, углерод в сочетании с инертными связующими, иридий, оксид индия, оксид олова, сочетание оксидов индия и олова, сталь, нержавеющую сталь, медь, никель, хром, серебро и их смеси. Противоэлектрод может также включать в себя серебро, покрытое по существу нерастворимой солью серебра, такой как хлорид серебра, бромид серебра, йодид серебра, ферроцианид серебра и феррицианид серебра.
В другом аспекте настоящего варианта воплощения область располагается на противоэлектроде или на стенке. Область и рабочий электрод могут быть расположены на одной и той же плоскости или в плоскости, обращенной к и по существу параллельной рабочему электроду.
В другом аспекте настоящего варианта воплощения реагент содержится в полимерной матрице, прикрепленной к поверхности в электрохимической ячейке; является химически связанным с поверхностью в электрохимической ячейке; является физически связанным с поверхностью в электрохимической ячейке; или является высушенным на поверхности в электрохимической ячейке и проявляет достаточно низкую подвижность в образце жидкости, так что реагент по существу не мигрирует в то время, когда измеряется ток.
В другом аспекте настоящего варианта воплощения способ дополнительно включает в себя медиатор окисления-восстановления. медиатор окисления-восстановления может включать в себя ферроциний, комплексы осмия с бипиридином, бензофенон и феррицианид.
В другом аспекте настоящего варианта воплощения образец может включать в себя цельную кровь. Компонент может включать в себя глюкозу. Реагент может включать в себя фермент, такой как PQQ (от англ. Pyroloquinoline quinone - пирроллохинолин хинон) - зависимая глюкозодегидрогеназа, NAD (от англ. Nicotinamid-adenine-dinucleotide-никотинамид-аденин-динуклеотид) - зависимая глюкозодегидрогеназа, глюкозооксидаза, лактатдегидрогеназа и алкогольдегидрогеназа.
В другом аспекте настоящего варианта воплощения потенциал предпочтительно находится в пределах между +50 и +500 мВ, и более предпочтительно составляет примерно +300 мВ.
Во втором варианте воплощения предлагается способ измерения скорости химической реакции между глюкозой и PQQ-зависимой глюкозодегидрогеназой в цельной крови, включающий в себя обеспечение наличия электрохимической ячейки, имеющей рабочий электрод, противоэлектрод, по меньшей мере одну стенку, медиатор окисления-восстановления, включающий в себя феррицианид и содержащийся внутри электрохимической ячейки, и реагент, включающий в себя PQQ-зависимую глюкозодегидрогеназу, причем реагент является по существу фиксированным (иммобилизованным) в электрохимической ячейке в некоторой области на минимальном расстоянии от рабочего электрода; помещение образца цельной крови в электрохимическую ячейку таким образом, что образец находится в контакте с реагентом, медиатором окисления-восстановления, рабочим электродом и противоэлектродом; взаимодействие глюкозы с PQQ-зависимой глюкозодегидрогеназой с получением восстановленной PQQ-зависимой глюкозодегидрогеназы, причем восстановленная PQQ-зависимая глюкозодегидрогеназа, в свою очередь, взаимодействует с феррицианидным медиатором окисления-восстановления с образованием ферроцианида; приложение потенциала между рабочим электродом и противоэлектродом, при этом потенциал является достаточным для электрохимического взаимодействия ферроцианида на рабочем электроде; и измерение тока, производимого электрохимической реакцией ферроцианида на рабочем электроде, при этом измерение является показателем скорости химической реакции между глюкозой и PQQ-зависимой глюкозодегидрогеназой.
Краткое описание чертежей
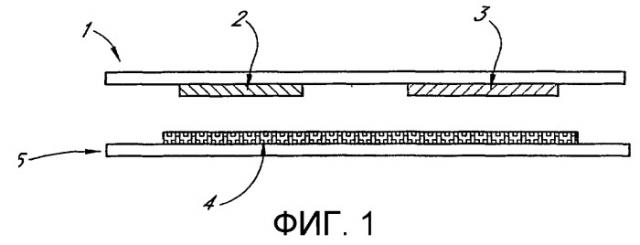
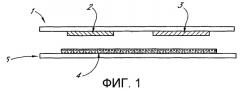
Фиг.1 изображает электрохимическую ячейку, где реагент расположен на стенке ячейки, обращенной к рабочему электроду.
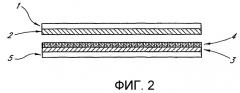
Фиг.2 изображает электрохимическую ячейку, где реагент расположен на противоэлектроде.
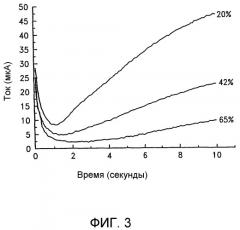
Фиг.3 изображает ток как функцию времени для трех образцов цельной крови для реакционной системы, включающей в себя глюкозу, PQQ-зависимую глюкозодегидрогеназу и медиатор окисления-восстановления из феррицианида калия. Три образца крови имеют уровни гематокрита 20%, 42% и 65% соответственно, где гематокрит представляет собой объемный процент эритроцитов в образце.
Подробное описание предпочтительных вариантов воплощения
Следующее далее описание и примеры подробно иллюстрируют предпочтительные варианты воплощения настоящего изобретения. Специалист в данной области техники заметит, что существуют многочисленные вариации и модификации настоящего изобретения, которые охватываются его сущностью. В соответствии с этим описание предпочтительного варианта воплощения не должно рассматриваться как ограничение сущности настоящего изобретения.
В соответствии с настоящим изобретением информация, относящаяся к скорости химической реакции, которая генерирует по меньшей мере один электрохимически активный продукт, может быть получена с использованием электрохимической ячейки в том случае, если обеспечить локализацию химической реакции в некоторой области, удаленной от электрода, используемого для электрохимического взаимодействия электрохимически активного продукта (продуктов).
Способы и устройства для получения электрохимических измерений образцов жидкости обсуждаются дополнительно в совместной заявке на патент США № 09/615691, поданной 14 июля 2000 года и озаглавленной "ANTIOXIDANT SENSOR", в совместной заявке на патент США № 09/616512, поданной 14 июля 2000 года и озаглавленной "HEMOGLOBIN SENSOR" и в совместной заявке на патент США № 09/616433, поданной 14 июля 2000 года и озаглавленной "IMMUNOSENSOR", каждая из которых включается сюда в качестве ссылки во всей своей полноте.
Область химической реакции является достаточно удаленной от электрода, так что массоперенос электрохимически активного вещества из области химической реакции к электроду эффективно контролирует ток, протекающий на электроде в любой момент времени. Это расположение обеспечивает по существу линейное изменение (градиент) концентрации электрохимически активного вещества между областью химической реакции и электродом. Концентрация электрохимически активного вещества на электроде поддерживается фактически равной нулю благодаря электрохимической реакции, имеющей там место. Поэтому изменение со временем величины этого градиента концентрации будет определяться по существу только зависимостью от времени концентрации электрохимически активного вещества в области химической реакции и коэффициентом (коэффициентами) диффузии электрохимически активного продукта (продуктов) реакции в жидкой среде. Поскольку ток, протекающий на электроде, является пропорциональным градиенту концентрации электрохимически активного вещества на электроде, зависимость от времени этого тока будет отражать зависимость от времени химической реакции, происходящей в отдаленной области. Это предоставляет возможность для использования тока, измеряемого на электроде (или прошедшего заряда, если ток интегрируется), в качестве удобной меры скорости и степени (завершенности) химической реакции, имеющей место.
Пример соответствующего способа для обеспечения удаленности химической реакции от рабочего электрода представляет собой иммобилизацию, т.е. фиксирование в неподвижном состоянии одного или нескольких компонентов реакции на твердой поверхности, удаленной от электрода. Компонент (компоненты) реакции могут быть иммобилизованы путем включения их в полимерную матрицу, которая высушивается или иным способом закрепляется на твердой поверхности. Компонент (компоненты) реакции могут также быть связаны непосредственно с твердой поверхностью с помощью либо химической, либо физической связи. Альтернативно, один или несколько из компонентов реакции могут просто быть высушены на твердой поверхности без специальных средств иммобилизации. В этой ситуации один или несколько из компонентов реакции обладают, по существу, низкими подвижностями в жидкой матрице, заполняющей электрохимическую ячейку, так что они по существу не мигрируют из положения, где они высушены, в течение того периода времени, когда электрохимический ток может подходящим образом отслеживаться для осуществления необходимого измерения. В этом контексте существенная миграция означает, что движущийся медленнее всех компонент, который требуется для химической реакции, подходит достаточно близко к рабочему электроду, так что на зависимость тока, протекающего на электроде, от времени компонент начинает оказывать влияние кинетика истощения типа Котрелла.
Диапазон дистанций между областью химической реакции и рабочим электродом в предпочтительных вариантах воплощения желательно является меньшим, чем примерно 1 см, предпочтительно меньшим, чем 5 мм, более предпочтительно находится в пределах между 5, 10, 50, 100, 200, 500 микронами и 5 мм, еще более предпочтительно между 5, 10, 50, 100, 200 и 500 микронами, и наиболее предпочтительно между 5, 10, 50, 100 и 200 микронами.
Кроме рабочего электрода предусматривается по меньшей мере один противоэлектрод в контакте с образцом жидкости для замыкания электрохимической цепи. По необходимости противоэлектрод может функционировать в качестве комбинированного противоэлектрода/электрода сравнения, или может быть предусмотрен отдельный электрод сравнения. В предпочтительном варианте воплощения рабочий электрод и противоэлектрод желательно отделяются расстоянием, большим, чем примерно 300 микрон, предпочтительно расстоянием, большим, чем примерно 500 микрон, более предпочтительно расстоянием в пределах между примерно 500 микронами и 10 мм, еще более предпочтительно расстоянием в пределах между примерно 500 микронами и 1, 2, 5 мм, и наиболее предпочтительно между 1 мм и 2, 5, 10 мм.
Рабочий электрод конструируется из материалов, которые химически не взаимодействуют с любым компонентом, с которым он будет приходить в контакт во время использования, до такой степени, чтобы искажать отклик электрода в виде тока. Если рабочий электрод должен использоваться в качестве анода, тогда примерами пригодных для использования материалов являются платина, палладий, углерод, углерод в сочетании с инертными связующими, иридий, оксид индия, оксид олова, смеси оксидов индия и олова. Если рабочий электрод должен использоваться в качестве катода, тогда, в дополнение к материалам, перечисленным выше, другие пригодные для использования материалы представляют собой сталь, нержавеющую сталь, медь, никель, серебро и хром.
Примеры материалов, пригодных для использования в качестве противэлектрода, представляют собой платину, палладий, углерод, углерод в сочетании с инертными связующими, иридий, оксид индия, оксид олова, смесь оксидов индия и олова, сталь, нержавеющую сталь, медь, никель, хром, серебро и серебро, покрытое по существу нерастворимой солью серебра, такой как хлорид серебра, бромид серебра, йодид серебра, ферроцианид серебра, феррицианид серебра.
Область химической реакции может быть локализована на гладкой стенке или на противоэлектроде, удаленном от рабочего электрода. Область химической реакции может быть расположена на той же плоскости, что и рабочий электрод или более предпочтительно, в плоскости, обращенной к рабочему электроду по существу параллельной рабочему электроду.
Фиг.1 изображает устройство, пригодное для использования вместе с одним из вариантов воплощения. На фиг.1 рабочий электрод 2 и противоэлектрод 3 размещены на электрически изолирующей подложке 1. На второй подложке 5 помещается слой химических реагентов 4, где по меньшей мере один из реагентов является по существу иммобилизованным на подложке 5. При использовании пространство между стенками 1 и 5 заполняется жидкостью, содержащей вещество, которое является способным к взаимодействию с реагентами 4 с получением по меньшей мере одного электрохимически активного вещества. Продукты химической реакции диффундируют к рабочему электроду 2, где электрохимически активное вещество (частицы этого вещества) электрохимически реагируют с получением тока. Величина тока или заряда, прошедшего за конкретное время, или зависимость от времени тока или прошедшего заряда затем могут быть использованы для получения меры скорости или степени завершенности химической реакции, протекаемой в слое 4 реагента.
Фиг.2 изображает другое воплощение. Нумерация компонентов на фиг.2 соответствует компонентам на фиг.1. На фиг.2 реагенты 4 размещены на противоэлектроде 3, который расположен на обладающей большим электрическим сопротивлением подложке 5. В настоящем варианте воплощения материалы конструкции противоэлектрода 3 являются инертными относительно взаимодействия с любым из компонентов реагентов 4, размещенных на электроде 3.
Пример химии и механизма реакции, которая является пригодной для использования в предпочтительном варианте воплощения, представляет собой измерение глюкозы в цельной крови с использованием фермента PQQ-зависимой глюкозодегидрогеназы (GDHpqq) и медиатора окисления-восстановления. В этой реакции глюкоза в крови взаимодействует с GDHpqq с образованием глюконовой кислоты. В этом процессе PQQ в ферменте восстанавливается. Затем медиатор, такой как феррицианид калия, окисляет PQQ в ферменте и образует ферроцианид. После фермент в окисленной форме может далее взаимодействовать с оставшейся глюкозой. Суммарный эффект этой реакции представляет собой получение двух молекул ферроцианида на каждую прореагировавшую молекулу глюкозы. Ферроцианид представляет собой электрохимически активное вещество и поэтому может быть окислен на электроде с получением тока. Другие пригодные для использования ферменты для этой реакции представляют собой глюкозооксидазу (GOD) или NAD-зависимую глюкозодегидрогеназу. Для других реакций могут быть использованы лактатдегидрогеназа и алкогольдегидрогеназа. Другие пригодные для использования медиаторы окисления-восстановления включают в себя ферроциний, комплексы осмия с бипиридином и бензофенон.
Взаимодействие глюкозы в цельной крови с ферментом может быть медленным, занимая до завершения вплоть до нескольких минут. Кроме того, чем выше гематокрит в образце крови, тем медленнее реакция. Гематокрит крови представляет собой объемную долю эритроцитов (красных кровяных телец) в образце цельной крови. В этом примере была сконструирована электрохимическая ячейка в соответствии с фиг.2. Раствор, содержащий 50 мг/мл GDHpqq, 0,9 M феррицианида калия и 50 мМ буфера при pH 6,5, был нанесен на противоэлектрод, а вода удалена, оставив высушенный слой реагента. В этом слое GDHpqq является достаточно большим и поэтому эффективно иммобилизируется на противоэлектроде, в то время как феррицианид может перемешиваться более однородно в жидкости в электрохимической ячейке. Образец крови вводится в ячейку, и сразу же прикладывается потенциал +300 мВ между рабочим электродом и противоэлектродом. Хотя потенциал +300 мВ является наиболее предпочтительным для окисления ферроцианида, потенциал, желательно, находится в пределах между +40 мВ и +600 мВ, предпочтительно между +50 мВ и +500 мВ, и более предпочтительно, между +200 мВ и +400 мВ. В ячейке рабочий электрод состоит из слоя золота, напыленного на подложку из сложного полиэфира, а противоэлектрод состоит из слоя палладия, напыленного на подложку из сложного полиэфира.
Графики тока, записанные для образцов крови с различными гематокритами и демонстрирующие более высокую скорость реакции при более низком гематокрите крови, приведены на фиг.3. Число в конце каждой линии представляет собой процент гематокрита в используемом образце крови, то есть 20%, 42% и 65% соответственно. Уровень глюкозы в каждом образце крови является примерно одинаковым, а именно 5,4 мм для образца с гематокритом 65%, 5,5 мм для образца с гематокритом 42% и 6,0 мм для образца с гематокритом 20%.
Ток, изображенный на фиг.3, может быть приблизительно описан с помощью уравнения:
i = -FADC/L,
где i представляет собой ток, F представляет собой постоянную Фарадея (96486,7 Кл/моль), A представляет собой площадь электрода, D представляет собой коэффициент диффузии ферроцианида в образце, C представляет собой концентрацию ферроцианида в области реакции и L представляет собой расстояние между областью реакции и электродом, скорость реакции, которая определяется скоростью изменения C со временем, следовательно, записывается как:
dC/dt = -(L/FAD)di/dt
Для реакций, показанных на фиг.3, в пределах между 6 и 8 секундами для образцов с гематокритом 20%, 42% и 65%, среднее значение di/dt составляет соответственно 3,82, 2,14 и 1,32 микроампер/секунду. Коэффициент диффузии ферроцианида для этих образцов составляет 2,0·10-6, 1,7·10-6 и 1,4·10-6 см2/сек для образцов с гематокритом 20%, 42% и 65% соответственно. Площадь электрода составляет 0,1238 см2, и L составляет 125 микрон. Эти значения дают скорости реакции 2,0, 1,3 и 0,99 мм/сек, для образцов с гематокритом 20%, 42%, и 65% соответственно.
Способ, описанный выше, может быть использован вместе с любой пригодной для использования электрохимической системой. Например, способ может быть использован для измерения оксидантов или антиоксидантов в образцах жидкостей. Способ может быть применен к любому оксиданту или антиоксиданту, который существует в пригодной для измерения репрезентативной концентрации в образце жидкости. Антиоксиданты, которые могут быть проанализированы, включают в себя, например, диоксид серы и аскорбиновую кислоту. Оксиданты, которые могут быть проанализированы, включают в себя, например, хлор, бром, йод, пероксиды, гипохлорит и озон. Водонерастворимые оксиданты или антиоксиданты также могут быть проанализированы, если может быть приготовлена водная форма, например, путем использования детергента для приготовления эмульсии водонерастворимого реакционно-способного при реакциях окисления-восстановления анализируемого вещества. Способ может также применяться к реакциям антитело/антиген или к анализу гемоглобина.
Приведенное выше описание описывает несколько способов и материалов по настоящему изобретению. Настоящее изобретение является восприимчивым к модификациям способов и материалов, а также к изменениям способов и устройств. Такие модификации становятся понятными для специалиста в данной области из рассмотрения настоящего описания или применения изобретения, описанного здесь. Следовательно, не предполагается, что настоящее изобретение является ограниченным конкретными вариантами воплощения, описанными здесь, но предполагается, что оно охватывает все модификации и альтернативы, находящиеся в пределах истинной сущности и духа настоящего изобретения, раскрытых в прилагаемой формуле изобретения.
1. Способ измерения скорости химической реакции между компонентом образца жидкости и реагентом, где реакция производит электрохимически активное вещество, содержащий стадии, на которых обеспечивают наличие электрохимической ячейки, имеющей рабочий электрод, противоэлектрод и по меньшей мере одну стенку; по существу, фиксируют реагент в электрохимической ячейке В некоторой области на минимальном расстоянии от рабочего электрода, при этом расстояние является таким, что перенос электрохимически активного вещества из этой области к рабочему электроду является диффузионно контролируемым; помещают образец жидкости в электрохимическую ячейку таким образом, что образец жидкости находится в контакте с реагентом, рабочим электродом и противоэлектродом;
осуществляют взаимодействие компонента с реагентом с получением электрохимически активного вещества;
прикладывают потенциал между рабочим электродом и противоэлектродом, при этом потенциал является достаточным для электрохимического взаимодействия электрохимически активного вещества на рабочем электроде; измеряют ток, производимый электрохимической реакцией на рабочем электроде, для получения меры скорости химической реакции.
2. Способ по п.1, где рабочий электрод и противоэлектрод достаточным образом отделяют друг от друга, так что продукт электрохимической реакции, протекаемой на противоэлектроде, не достигает рабочего электрода в то время, когда измеряют ток.
3. Способ по п.2, где рабочий электрод и противоэлектрод отделяют друг от друга расстоянием, большим, чем примерно 500 мкм.
4. Способ по п.2, где расстояние находится в пределах между примерно 500 мкм и примерно 5 мм.
5. Способ по п.2, где расстояние находится в пределах между примерно 1 мм и примерно 2 мм.
6. Способ по п.2, где рабочий электрод и противоэлектрод располагают на одной и той же плоскости.
7. Способ по п.1, где область и рабочий электрод разделяют минимальным расстоянием, находящимся в пределах от примерно 10 мкм до примерно 5 мм.
8. Способ по п.7, где минимальное расстояние находится в пределах от примерно 50 мкм до примерно 500 мкм.
9. Способ по п.7, где минимальное расстояние находится в пределах от примерно 100 мкм до примерно 200 мкм.
10. Способ по п.1, где противоэлектрод способен функционировать в качестве комбинированного противоэлектрода/электрода сравнения.
11. Способ по п.1, где электрохимическая ячейка дополнительно содержит электрод сравнения.
12. Способ по п.1, где рабочий электрод функционирует в качестве анода.
13. Способ по п.12, где рабочий электрод содержит материал, выбранный из группы, состоящей из платины, палладия, углерода, углерода в сочетании с одним или несколькими инертными связующими, иридия, оксида индия, оксида олова, оксида индия в сочетании с оксидом олова и их смесей.
14. Способ по п.1, где рабочий электрод функционирует в качестве катода.
15. Способ по п.1, где противоэлектрод содержит серебро, покрытое, по существу, нерастворимой солью серебра.
16. Способ по п.15, где соль серебра выбирают из группы, состоящей из хлорида серебра, бромида серебра, йодида серебра, ферроцианида серебра и феррицианида серебра.
17. Способ по п.1, где область располагают на противоэлектроде.
18. Способ по п.1, где область располагают на стенке.
19. Способ по п.1, где область и рабочий электрод располагают на одной и той же плоскости.
20. Способ по п.1, где область располагают в плоскости, обращенной к, по существу, параллельной рабочему электроду.
21. Способ по п.1, где реагент содержится внутри полимерной матрицы, прикрепленной к поверхности в электрохимической ячейке.
22. Способ по п.1, где реагент является химически связанным или физически связанным с поверхностью в электрохимической ячейке.
23. Способ по п.1, где реагент высушивают на поверхности в электрохимической ячейке, причем реагент демонстрирует достаточно низкую подвижность в образце жидкости, так что реагент, по существу, не мигрирует в то время, когда измеряют ток.
24. Способ по п.1, дополнительно содержащий медиатор окисления-восстановления.
25. Способ по п.24 где медиатор окисления-восстановления выбирают из группы, состоящей из ферроциния, комплексов осмия с бипиридином, бензофенона и феррицианида.
26. Способ по п.1, где образец содержит цельную кровь.
27. Способ по п.1, где компонент содержит глюкозу.
28. Способ по п.1, где реагент содержит фермент, выбранный из группы, состоящей из PQQ-зависимой глюкозодегидрогеназы NAD-зависимой глюкозодегидрогеназы, глюкозооксидазы, лактатдегидрогеназы и алкогольдегидрогеназы.
29. Способ по п.1, где потенциал находится в пределах между примерно +50 мВ и +500 мВ.
30. Способ по п.1, где потенциал составляет примерно +300 мВ.
31. Способ измерения скорости химической реакции между глюкозой и PQQ-зависимой глюкозодегидрогеназой в цельной крови, содержащий стадии, на которых обеспечивают наличие электрохимической ячейки, имеющей рабочий электрод, противоэлектрод, по меньшей мере одну стенку, медиатор окисления-восстановления, содержащий феррицианид и содержащийся внутри электрохимической ячейки, и реагент, содержащий PQQ-зависимую глюкозодегидрогеназу, причем реагент является, по существу, фиксированным в электрохимической ячейке в некоторой области на минимальном расстоянии от рабочего электрода; помещают образец цельной крови в электрохимическую ячейку, так что образец находится в контакте с реагентом, медиатором окисления-восстановления, рабочим электродом и противоэлектродом; осуществляют взаимодействие глюкозы с PQQ-зависимой глюкозодегидрогеназой с получением восстановленной PQQ-зависимой глюкозодегидрогеназы, причем восстановленная PQQ-зависимая глюкозодегидрогеназа, в свою очередь, взаимодействует с феррицианидным медиатором окисления-восстановления с образованием ферроцианида; прикладывают потенциал между рабочим электродом и противоэлектродом, причем потенциал является достаточным для электрохимического взаимодействия ферроцианида на рабочем электроде; измеряют ток, производимый электрохимической реакцией ферроцианида на рабочем электроде, причем измерение является показателем скорости химической реакции между глюкозой и PQQ-зависимой глюкозодегидрогеназой.