Трансгенез у млекопитающих путем интрацитоплазматической инъекции спермы
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии, в частности к способам получения трансгенного эмбриона. Способ предусматривает инкубирование экзогенной нуклеиновой кислоты и головки спермия с разрушенной или удаленной мембраной. Далее получают трансгенный оплодотворенный ооцит путем совместного введения экзогенной нуклеиновой кислоты и головки спермия в неоплодотворенный ооцит. В заключение развивают оплодотворенный ооцит в трансгенный эмбрион. Другой вариант способа предусматривает предварительное получение головок спермиев с разрушенной или удаленной мембраной. Предложенные способы позволяют повысить эффективность трансгенного переноса и повысить выход трансгенных животных. Изобретение может быть использовано для получения методами генетической инженерии скота и других крупных животных, которые могут быть использованы для получения фармацевтических «фабрик» и как источник органов или клеток для ксенотрансплантации. 2 н. и 18 з.п. ф-лы, 7 ил., 2 табл.
Реферат
В данной заявке испрошен приоритет по заявкам США №60/096,078, поданной 11 августа 1998 года и №60/133,970, поданной 13 мая 1999 года.
Правительство США имеет в данном изобретении оплаченную лицензию и право, в ограниченных обстоятельствах, требовать от владельца патента выдачи на разумных условиях лицензии другим лицам, как это предусмотрено условиями контракта №HD-34362, заключенного с National Institute of Child's Health and Human Development.
Трансгенные животные важны для целей науки, фармацевтики и сельского хозяйства. Скот, полученный методами генной инженерии и используемый для получения чужеродных белков в молоке, считают подходящей системой для получения терапевтически активных рекомбинантных протеинов. Более того, введение человеческих генов в геном животных, таких как свиньи, может позволить таким животным играть роль живого органа или клеточных "фабрик" для органов или клеток человека, которые не будут отторгнуты иммунной системой человека.
Существует ряд документированных способов получения трансгенных млекопитающих путем введения чужеродной ДНК в их соматические и зародышевые клетки. Один из этих способов, нашедший широкое применение, пронуклеарная микроинъекция, впервые был разработан на модели мыши в начале 1980-х. Пронуклеарная микроинъекция предусматривает инъекцию трансгенной (тг) ДНК в пронуклеус одноклеточного эмбриона {(J.W.Gordon, et al., Proc. Natl. Acad. Sci. USA. 77,7380 (1980); J.W.Gordon and F.H.Ruddle, Science 214, 1244 (1981); R.D.Palmiter and R.L.Brinster, Ann.Rev.Genet.20, 465 (1986); and J.W.Gordon Int. Rev. Cytol. 115, 171 (1989)}. Хотя получение пронуклеарных зигот оказалось простым у мышей, это не всегда справедливо для видов - представителей крупных коммерчески разводимых животных. Например, зиготы представляют собой сложные объекты для инъекции пронуклеуса, если насыщенность липидами делает их непрозрачными, как это имеет место у скота и свиней; хотя в отличие от этого зиготы мышей прозрачны.
Трансгенные эмбриональные стволовые клетки (ЭС), полученные трансфекцией конструкциями ДНК, были использованы для получения животных-химер у скота, овец и им подобных. Этот способ предусматривает инъекцию полученных методами генной инженерии ЭС клеток, несущих желаемую мутацию в оплодотворенные эмбрионы, находящиеся в эмбриональном развитии на стадии морулы (примерно от 20 до 50 клеток) или на стадии бластоциста (примерно 100 клеток). После имплантации такие эмбрионы часто дают животные-химеры, последующее скрещивание которых с животными дикого типа с различной частотой (часто равной нулю), приводит к передаче зародышевым путем генома, происходящего из ЭС клеток. Поскольку эффективность передачи гена низка, а также вследствие того, что для пересадки эмбрионов требуется большое количество животных-реципиентов, получение крупных трансгенных животных этим способом оказалось сложным.
Ни описанный выше способ пронуклеарной микроинъекции, ни способ трансфекции ЭС клеток до сих пор не позволяют контролировать или предсказывать результат трансгенного введения, поскольку введение гетерологической ДНК в клетку часто приводит к эффектам нежелательного "положения" или числа копий, вызванным квази-случайным характером, с которым трансген или его множественные копии встраиваются в геном хозяина (J.W.Gordon, supra). Поэтому эффективность этих способов при получении крупных трансгенных животных оказалась низкой.
Есть данные, свидетельствующие о том, что более строгий контроль за результатом трансгенной интеграции можно осуществить при использовании линии ЭС клеток мыши, трансфецированных конструкциями ДНК, способными к гомологической рекомбинации {(M.J.Evans and M.H.Kaufman, Natura 292, 154 (1981); M.Kuehn, et.al., ibid. 326, 295 (1987)}. Этими "генетически нацеленными" ЭС клетками являются такие клетки, в которых один или более специфических генов удалены или модифицированы строго определенным способом, который не влияет ни на какой другой локус во всем геноме. "Бессмертные" трансгенные линии ЭС клеток были созданы и хорошо изучены in vitro для того, чтобы определить место внедрения конструкции. Однако генетическое нацеливание в настоящее время ограничено одним видом, для которого существуют зародышевые линии ЭС клеток, - мышью.
Недостатки существующих способов модификации генетических линий млекопитающих послужили толчком к поиску альтернативных способов, включая использование рекомбинантных ретровирусов для инфицирования ооцитов или предимплантационных эмбрионов {D.Jahner, et al., Proc. Natl. Acad. Sci. USA, 82, 6927 (1985): A.W.S.Chan et al., ibid., 95, 14028 (1998)} и использование репликационно-недостаточных, передаваемых аденовирусами, систем доставки {Y.Kanegal et al., Nucleic Acids Res. 23, 3816 (1995)}. Однако методика с применением вирусов подразумевает необходимость проведения дополнительных операций при клонировании, что влечет за собой потребность в специализированном оборудовании для тех рекомбинантных аденовирусов и ретровирусов, которые должны быть созданы. Доставка вируса этими способами все еще требует либо оборудования для микроинъекций, либо удаления зоны пеллюцида ооцита.
Также есть данные о том, что в качестве средств доставки ДИК во время оплодотворения in vitro (in vitro fertilization, IVF), можно использовать сперматозоиды {M.Lavitrano et al., Cell 57, 717 (1998)}. В данном случае в качестве вектора in vitro введения рекомбинантной ДНК в ооцит используют живые сперматозоиды. Несмотря на то, что опосредованный сперматозоидами перенос ДНК потомкам потенциально может значительно упростить получение трансгенных животных, существуют серьезные разногласия относительно эффективности способов с использованием живых сперматозоидов при осуществлении трансгенеза вследствие его ненадежности с точки зрения стабильности воспроизведения трансгенных животных {М. Lavitrano, et al., Mol. Reprod. Dev.50, 406 (1998)}. Так, в одной из работ было показано, что экзогенная ДНК связывается с интактным сперматозоидом обратимым образом {М. Lavitrano, et al., Mol. Reprod. Dev.31, 161 (1992)}, что указывает на то, что мембранные структуры могут служить барьером для стабильной ассоциации головок спермиев с чужеродной рекомбиногенной ДНК. В другой работе живые сперматозоиды мыши, инкубированные in vitro в течение двух часов с плазмидной ДНК, показали незначительное включение экзогенной ДНК в ядро, так же как и в плазменную мембрану. Сперма vas deferens, в которую за шесть часов до этого инъецировали плазмидную ДНК, также показала незначительное включение ее в ядро. Однако ни один из этих сперматозоидов не был использован для оплодотворения ооцитов {Е. Huguet and P.Esponda, Mol. Reprod. Dev.51, 42 (1998)}.
Поэтому все еще существует потребность в способе эффективного трансгенного переноса, который можно надежно использовать для получения трансгенных животных. В частности, существует потребность в эффективном способе получения методами генной инженерии скота или других крупных животных для использования в качестве фармацевтических "фабрик" и как источник человеческих органов или клеток для ксенотрансплантации.
Согласно изобретению предложен способ получения трансгенного эмбриона, включающий стадии совместного введения экзогенной нуклеиновой кислоты и головки спермия с разрушенной мембраной или головки спермия с удаленной мембраной в цитоплазму неоплодотворенного ооцита для образования трансгенного оплодотворенного ооцита и предоставление возможности трансгенному оплодотворенному ооциту развиться в трансгенный эмбрион и, при желании, в живого потомка. Стадия совместного введения предпочтительно включает подстадию преинкубации головки спермия с разрушенной мембраной или удаленной мембраной с экзогенной нуклеиновой кислотой в течение времени от примерно 30 с до примерно 5 мин, обычно примерно от 45 с до примерно 3 мин, чаще от примерно 1 мин до примерно 2 мин. Совместное введение головки спермия и экзогенной нуклеиновой кислоты в ооцит проводят микроинъекцией, предпочтительно микроинъекцией, проводимой пьезоэлектрически. Экзогенная нуклеиновая кислота в смеси с головками спермиев с нарушенной мембраной или с удаленной мембраной может нести более одного трансгена для получения эмбриона, который будет трансгенным более чем по одному трансгену.
Головки спермиев с разрушенными мембранами, которые подходят для использования в изобретении, можно получить из замороженных/размороженных сперматозоидов или регидратированных лиофилизированных сперматозоидов. Способ сохранения сперматозоидов лиофилизированием и использование получающихся в результате этого восстановленных лиофилизированных сперматозоидов для оплодотворения ооцитов in vitro с целью получения эмбрионов и живых потомков является предметом нашей заявки на патент США №09/177,391 от 23 октября 1998 года, описание которой, таким образом, включено здесь в виде ссылки. Головки спермиев с удаленной мембраной, включающие ядро и перинуклеарные материалы и пригодные для использования в изобретении, можно получить, обрабатывая свежие сперматозоиды детергентами, как это описано ниже.
Способ изобретения можно использовать для получения трансгенных эмбрионов или живых потомков млекопитающих, таких как приматы, овцы, быки, свиньи, медведи, кошачьи, псовые, лошади и грызуны. Способ также можно использовать для получения трансгенных беспозвоночных, таких как, но не ограничиваясь, морские ежи, лобстер, оболочник или моллюски. Способ также можно использовать для получения трансгенных рыб, амфибий, рептилий и птиц. При этом было обнаружено, что живые трансгенные потомки (животные-родоначальники), полученные в процессе реализации изобретения, сами способны производить трансгенных потомков, демонстрируя стабильную интеграцию тг в первоначальный геном и плодовитость родоначальника.
Описанный здесь способ трансгенеза млекопитающих отличается от предыдущих in vitro способов, предусматривающих пронуклеарнуто инъекцию экзогенной ДНК в оплодотворенные ооциты или смешивание живых интактных сперматозоидов с экзогенной ДНК, и использование этих обработанных сперматозоидов для оплодотворения ооцитов для образования трансгенных эмбрионов. Использование неоплодотворенных Мет II ооцитов по способу изобретения представляет сильно упрощенный и ускоренный способ по сравнению со способами, которые требуют использования зигот. Более того, трансгенез посредством интрацитоплазматической инъекции спермия (ВЦИС), может преодолеть некоторые недостатки пронуклеарной микроинъекции. Например, применение микроинъекционных пипеток, имеющих примерно в 100 раз большее отверстие на конце (т.е. примерно 0,78 мкм для пронуклеарной микроинъекции при кончике диаметром 1 мкм, по сравнению с примерно 78 мкм2 для ВЦИС, при кончике диаметром 10 мкм) ускорит обработку крупных конструкций, таких как дрожжи или искусственные хромосомы млекопитающих. Более того, по способу изобретения ассоциация тг ДНК с головками спермиев с разрушенными мембранами или удаленными мембранами предполагает дальнейшую стабилизацию и защиту ее первичной и вторичных структур.
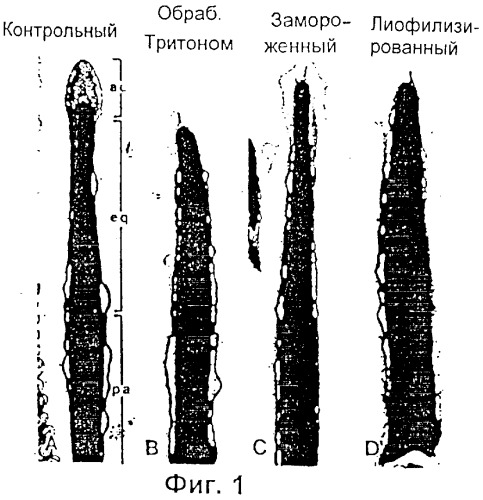
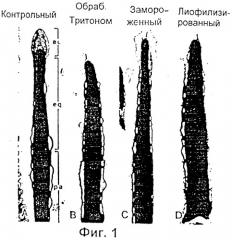
Фиг.1 представляет собой микрофотографию, показывающую сагиттальное сечение через головки сперматозоидов мыши, которые были либо интактными (свежими) (А), либо сперматозоидами, мембраны которых были разрушены Тритоном Х-100 (В), замораживанием-размораживанием (С), или лиофилизированием (D): ас - акросомальная шапочка, eq - экваториальный сегмент, pa - постакросомальный район.
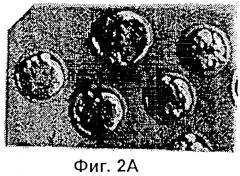
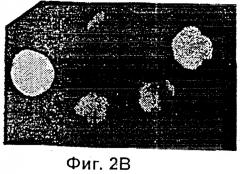
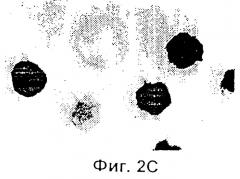
Фиг.2 представляет собой микрофотографию, показывающую трансгенные эмбрионы, полученные двойным трансгенезом при однократной инъекции. Ооциты микроинъецировали сперматозоидами, которые были проинкубированы со смесью pCX-LacZ и pCX-EGFP тг ДНК. Те же самые эмбрионы (х 400) показаны через 3,5 суток под Hoffman modulation контрастным микроскопом неокрашенными (Фиг.2А), под длинноволновым (480 нм) ультрафиолетовым (УФ) светом для экспрессии GFP (Фиг.2В); и окрашенными X-gal для экспрессии β-галактозидазы (Фиг.2С).
Фиг.3 представляет собой микрофотографию, показывающую результат анализа биопсий, взятых из кончика хвоста трансгенных родоначальников и нетрансгенных контрольных животных. (Фиг.3 А) Флуоресцентная стерео микроскопия (х 40) кончиков хвостов нетрансгенной (а) (мышь 16) и тг, зеленая флюоресценция (в) (мышь 3) линий. Флюоресцирующую зеленым кожу можно рассмотреть через незеленые шерстинки. (Фиг.3В) Анализ по методу Southern blot общей ДКН контроля B6D2F1 (wt, дикий тип, дт) (0) и мыши номер 3 (5-9), 19 (>50), 28 (5-9) и 41 (2) с применением фрагмента рСХ-EGFP в качестве пробы. Результаты определения числа копий тг на геном приведены в скобках. (Фиг.3 С) PCR анализ общей ДНК мыши номер 16, 17, 30, 36, 47, 49, контроля B6D2F1 (дт), мыши номер 3, 19, 28 и 41.
В соответствии с изобретением предложен способ получения трансгенного эмбриона путем совместного введения экзогенной нуклеиновой кислоты и головки спермия с разрушенной мембраной или головки спермия, лишенной мембраны в неоплодотворенный ооцит. Способ изобретения включает следующие стадии: (1) получение сперматозоида, имеющего разрушенную мембрану, или головки сперматозоида, лишенной мембраны, (2) смешивание сперматозоида, имеющего разрушенную мембрану, или головки сперматозоида, лишенной мембраны, с экзогенной нуклеиновой кислотой, несущей желаемый ген, и (3) совместное введение экзогенной нуклеиновой кислоты и головки спермия с разрушенной мембраной или лишенной мембраны головки спермия в изолированный неоплодотворенный ооцит для получения трансгенного эмбриона, экспрессирующего желаемый трансген. Способ далее может включать стадию имплантации трансгенного эмбриона в матку суррогатной матери и предоставление возможности эмбриону развиться до живого трансгенного потомка.
Примеры реализации отдельных стадий и подстадий способа изобретения представлены далее более подробно.
Приготовление свежих сперматозоидов.
Свежие сперматозоиды беспозвоночных и позвоночных животных получают способами, хорошо известными специалистам. Например, зрелые сперматозоиды грызунов, таких как мышь, золотой (Сирийский) хомяк, морская свинка, кролик и им подобных, можно получить из каудального эпидидимиса, тогда как у других видов, таких как люди, свиньи, лошади, быки, козлы, петухи и им подобные, зрелые сперматозоиды можно выделить из свежеэякулированного семени плодовитых самцов. Сперматозоиды рыб (например, мечехвоста Xiphophorus helleri) и беспозвоночных, таких как морские ежи (Tripneustis gratilla), можно получить из яичек зрелых самцов.
Далее следует пример способа получения сперматозоидов из каудального эпидидимиса. У зрелого (примерно 8 педель после рождения или старше) самца мыши удаляют каудальный эпидидимис. С поверхности каудального эпидидимиса убирают кровь и жировую ткань. Затем его сдавливают, чтобы высвободить плотную массу сперматозоидов. Каплю (примерно 2 мкл, μл) массы спермы помещают на дно 1,5 миллилитровой (мл) полипропиленовой центрифужной пробирки и заливают 0,5 мл теплой физиологической среды, такой как среда CZB (состав которой описан ниже), фосфатно забуференный физраствор или изотонический физраствор. По прошествии примерно 10-20 мин при 37°С, из надосадочной жидкости отбирают подвижные сперматозоиды.
Далее следует пример способа получения сперматозоидов из семенной жидкости. Свежеэякулированной семенной жидкости человека позволяют разжижиться в течение примерно 30 мин при комнатной температуре (около 25°С). Затем семенную жидкость разбавляют примерно 10 мл физраствора и фильтруют примерно через два слоя фильтровальной бумаги для удаления загрязнений. Затем фильтрат центрифугируют при 400 × g в течение примерно 10 мин и осадок сперматозоидов ресуспензируют в физиологическом растворе в желаемой концентрации.
Далее следует пример получения сперматозоидов из яичек. Удаленные яички помещают в эритроцит-лизирующий буфер (например, 155 миллимолярный (мМ) NH4Cl, 10 мМ КНСО3, 2 мМ EDTA, рН 7,2-7,4), измельчают при помощи острых ножниц и, для того, чтобы удалить загрязнения, фильтруют через примерно два слоя фильтровальной бумаги. Затем фильтрат центрифугируют (например, 700 × g, 5 мин) и осадок ресуспензируют в физиологическом растворе в желаемой концентрации.
Полученные таким способом сперматозоиды мыши, имеющие интактные плазменные и акросомальные мембраны, показаны на Фиг.1 (А), которая является микрофотографией типичного сагиттального сечения через головку сперматозоида мыши, где "ас" это акросомальная шапочка, "eq" - экваториальный сегмент и "pa" - постакросомальный район. Сперматозоиды суспензированы в физиологической среде, описанной ниже, в момент подготовки к процессам замораживания-размораживания или лиофилизации.
Альтернативно, сперматозоиды можно подвергнуть дальнейшей обработке для получения лишенных мембран головок спермиев.
Приготовление сперматозоидов с разрушенными мембранами
Свежие сперматозоиды с разрушенными мембранами
Мембраны свежих сперматозоидов, полученных, как описано выше, можно разрушить механическим способом, таким как отделение головок спермиев от хвостов в микроинъекционной пипетке приложением единичного импульса от прибора для пьезоэлектрически проводимых микроинъекций, как это будет описано ниже. Используемый в данном случае термин "свежие" сперматозоиды относится к сперматозоидам с разрушенной мембраной, которые используют для микроинъекции в неоплодотворенные ооциты, и каковые отличают от, и каковые имеют отличие от "живых" сперматозоидов, используемых как носитель для доставки ДНК в предыдущих работах по IVF.
Замороженные - размороженные сперматозоиды
Замораживание и размораживание сперматозоидов приводит к разрушению плазменной мембраны, как это подтверждают методиками прижизненного окрашивания, которые способны различать клетки с интактной плазменной мембраной (живые) и с разрушенной плазменной мембраной (мертвые), как это детально описано ниже. Такие замороженные - размороженные сперматозоиды с разрушенной плазменной мембраной в обычном смысле считаются "мертвыми". Замороженные-размороженные сперматозоиды можно приготовить в соответствии со способами, описанными у T.Wakayama, et al., J. Reprod. Fert. 112, 11 (1996) и у S. Kuretake, et al., Biology of Reproduction 55, 789 (1996). В частности, сперматозоиды эпидидимиса мыши, суспензированные перед охлаждением до минус 20°С или минус 50°С, или минус 196°С в среде CZB с добавлением или без добавления криопротекторов, таких как 18% (масс./об.) раффиноза, и хранившиеся в замороженном состоянии до размораживания в течение от одного до 28 дней, поддерживали развитие нормальных плодовитых живых потомков после того, как их головки были микроинъецированы в неоплодотворенные ооциты.
В типичном способе замораживания сперматозоидов эпидидимиса мыши концентрация сперматозоидов в среде CZB составляет примерно от 3 до 10×106/мл. Порции суспензии спермиев, по 100 микролитров каждая, переносят в 1,5 мл полипропиленовые микроцентрифужные пробирки (Fisher Scintific, Pittsburg, PA) и тщательно перемешивают с рапным объемом среды CZB с добавлением или без добавления 36% (мас./об.) D (+) - раффинозы (задавая конечную концентрацию раффинозы 18%). Порции этой суспензии, по 50 микролитров каждая, помещают в снабженные этикетками 1 мл криогенные флаконы (A/S NUNS, Copenhagen). Флаконы плотно закупоривают и помещают непосредственно в минус 20°С или минус 50°С, морозильник или жидкий азот (минус 196°С). Образцы можно хранить в течение времени от одного дня до четырех недель.
Для размораживания флаконы вынимают из морозильника или жидкого азота и помещают в воду или оставляют на воздухе при температуре от 24°С до 26°С примерно на 10 мин. Размороженная суспензия спермиев теперь готова для интрацитоплазматической инъекции спермиев (ВЦИС), как это описано ниже.
Хотя способ получения замороженной - размороженной спермы был в данном случае описан для сперматозоидов эпидидимиса мыши, любой специалист сможет приспособить способ к сперматозоидам других позвоночных и беспозвоночных без проведения дополнительных экспериментов.
Регидратированные лиофилизированпые сперматозоиды
Лиофилизирование сперматозоидов приводит к разрушению плазменной мембраны, как это подтверждают методиками прижизненного окрашивания, которые способны различать клетки с интактной плазменной мембраной (живые) и с разрушенной плазменной мембраной, которые в обычном смысле считаются "мертвыми". Лиофилизированные сперматозоиды можно приготовить в соответствии со способами, описанными у T.Wakayama and R. Yanagimachi, Nature Biotechnology 16, 639, (1998) и в нашей заявке на патент США №09/177,391 поданной 23 октября 1998. В частности, заявка на патент раскрывает основные способы, которые можно использовать для лиофилизирования сперматозоидов позвоночных и беспозвоночных животных. В типичном способе сперматозоиды эпидидимиса мыши перед замораживанием в жидком азоте и высушиванием до содержания воды около нуля процентов, суспензированные в (1) среде CZB без этилендиаминтетрауксусной кислоты (EDTA), содержащей 4 мг/мл BSA, или (2) в модифицированной Dulbecco среде Eagle (DMEM), с добавкой 10% (об./об.) фетальной сыворотки быка (Hyclone, Logan, UT) и хранившиеся до регидратации в лиофилизироваином состоянии вплоть до 6 месяцев, поддерживали развитие нормальных плодовитых живых потомков после того, как их регидратировали и их головки вводили способом микроинъекции в неоплодотворештые ооциты.
В типичном способе замораживания эпидимисных сперматозоидов мыши концентрация спермиев в средах CZB или DMEM составляет примерно от 3 до 10×10 на мл. Порцию (100 мкл) суспензии спермиев помещают в 2 мл ампулу (Wheaton Scientific, Millville, NJ, Catalogue №651506), которую погружают непосредственно в жидкий азот. Через 10 мин ампулы помещают в предварительно охлажденную (минус 50°С) морозильную колбу, подсоединенную к лиофилизирующей системе (модель 10-020, VicTis Co., Gardner, NY). Давление на выходе приблизительно равно 1 млТорр. Примерно через 12 ч колбу после того, как ее заполняют аргоном, подаваемым через систему осушки газа, вынимают из системы (Fisher Scientific, Pittsburg, PA Catalogue №09-204). Каждую ампулу подсоединяют к вакуумному насосу и после того, как из нее откачивают более 99% газа, запаивают. Ампулы по отдельности заворачивают в алюминиевую фольгу и, до использования, хранят в темноте при комнатной температуре (примерно 25°С) или при 4°С до года.
Для регидратации упомянутой выше лиофилизировапной спермы ампулу, содержащую лиофилизированную сперму, приготовленную, как описано выше, вскрывают и, для получения восстановленной суспензии спермиев, добавляют 100 мкл дистиллированной воды.
Хотя способ получения регидратироваппой лиофилизированной спермы был описан здесь на примере эпидидимисных сперматозоидов мыши, любой специалист может применить способ к сперматозоидам других позвоночных и беспозвоночных животных без проведения дополнительных экспериментов, как описано в заявке на патент США №09/177,391.
Было отмечено, что процент активации ооцита и нормального оплодотворения вслед за инъекцией головки спермия, как оказалось, уменьшается с увеличением времени после регидратации лиофилизированпой спермы. Допустимый период времени между регидратацией и инъекцией может варьировать у разных видов, однако, в качестве примера, это время для сперматозоидов мыши предпочтительно составляет один час или менее.
Приготовление лишенных мембран головок спермиев
Лишенные мембран головки спермиев - это извлеченные детергентом головки, у которых отсутствуют все мембраны, включая плазменную мембрану и внутреннюю и наружную акросомальные мембраны, но сохранено ядро и перинуклеарный материал. Например, головки спермиев можно лишить мембран обработкой Тритоном Х-100 с добавлением или без добавления SDS (sodium dodecyi sylfate, додецилсульфата натрия). Тритон Х-100 - это хорошо известный неионный сурфактант, который широко используют для удаления мембранных компонентов в условиях без денатурации. SDS является анионным детергентом, используемым для растворения различных протеинов, включая мембранные протеины. Было показано, что у мыши головки спермиев, лишенные мембран при помощи Тритона Х-100, способны активировать ооциты, что ведет к нормальному эмбриональному развитию.
Далее следует типичный способ удаления мембран головок спермиев. Часть суспензии спермиев, приготовленной как описано выше, сонифицируют. Например, сперматозоиды, полученные из каудального эпидидимиса, яичек или семени, как это описано выше, можно суспензировать в 5 мл ВМ буфера (75 мМ NaCl, 24 мМ EDTA и 50 мМ Трис-HCl, рН 7.2) и сонифицировать в течение 30 секунд при 70%-80% мощности соникатора Biosonic (Bronwill Scientific, Rochester, NY). При такой обработке обезглавливается более 95% сперматозоидов. Для того чтобы удалить мембрану с головок спермиев, сонифицированную суспензию спермиев центрифугируют при 700 × g в течение 5 мин и осадок промывают ВМ буфером и затем, при комнатной температуре, обрабатывают в течение 5 мин 1% Тритоном Х-100 в среде NIM (среда NIM состоит из 123,0 мМ KCl, 2,6 мМ NaCl, 7,8 мМ КН2РО4, 3 мМ Na2EDTA и имеет рН 7.2). Затем головки тщательно промывают средой NIM и ресуспендируют в среде для суспензирования спермы.
Определение жизнеспособности спермы
Микрофотография на Фиг.1 (В), (С) и (D), изображающая продольное сечение через переднюю часть головок спермиев, показывает, что плазменная и акросомальные мембраны, кроме расположенных в районе экватора, в сперматозоидах, обработанных Тритоном Х-100 (детергент) (В), замороженых/размороженных (С) или лиофилизированных (D) отсутствуют или разрушены. Жизнеспособность сперматозоидов можно определить при помощи любого метода окрашивания, который способен различать сперматозоиды, которые в обычном смысле являются живыми или мертвыми. Коммерчески доступным подходящим для использования в изобретении тестом на жизнеспособность является Live/Dead FertiLight, который можно приобрести у Molecular Probes, Eugene, Oregon, и который позволяет различать клетки с интактными плазменными мембранами (живые) и нарушенными плазменными мембранами (мертвые) по характеру флюоресценции под ультрафиолетовым (УФ) микроскопом после окрашивания иодидом пропидия/SYBR 14. Ядра "живых" сперматозоидов с интактной плазменной мембраной флюоресцируют зеленым, тогда как ядра "мертвых" сперматозоидов флюоресцируют ярким оранжево-красным. Ожидается, что все сперматозоиды, приготовленные способом физического разрушения мембраны или замораживанием/размораживанием, лиофилизированием и процедурами удаления мембран, описанными выше, будут "мертвыми" в обычном смысле этого слова.
Отбор и подготовка экзогенной нуклеиновой кислоты, содержащей трансген
Генетическая трансформация в соответствии с изобретением представляет собой стабильную интеграцию экзогенной чужеродной ДНК в геном зиготы и включает интеграцию чужеродной ДНК в ядерную ДНК клетки хозяина и/или в экстрапуклеарную ДНК митохондрии. Чужеродная ДНК представляет собой генетический материал, которые не является врожденным (т.е. который в норме отсутствует) в зиготе до трансформации, или в норме представлен не более чем одной копией. Однако "чужеродная" ДНК может включать добавочные копии врожденного гена или генетической последовательности, которые вводят с целью взаимоподавления.
Чужеродный генетический материал может включать в себя ДНК из любого источника, включая, но, не ограничиваясь, растениями, бактериями, вирусами, бактериофагами, плазмидами, пластидами, млекопитающими и синтетическими конструкциями ДНК. ДНК может быть в кольцевой или линейной форме и может быть одинарной цепочкой или двойной спиралью. ДНК может быть введена в ДНК клетки хозяина в смысловой или антисмысловой конфигурации и в форме одинарной или двойной спирали. Вся или часть ДНК, вводимая в клетку-хозяина, может интегрироваться в геном хозяина.
Отбор и/или синтетическое построение плазмид и других векторов клонирования, содержащих специфические гены, хорошо известны в науке. Синтетические конструкции химерных плазмид содержат ген или интересующий нас ген и часто, для ускорения внедрения в геном хозяина, включают промоутер и/или лидерную последовательность, полученные из различных источников. Хотя последовательности прокариотического вектора клонирования не оказывают видимого влияния на частоту интеграции микроинъецированных генов, было отмечено, что они могут значительно подавлять экспрессию эукариотических генов, внедренных в зародышевую линию млекопитающих, таких как мышь {см. B.Hogan et al., Manipulating the Mouse Embryo, Section E, Второе изд., Cold Spring Harbor Laboratory Press, p.22 (1994)}. Вследствие этого, если желательна оптимальная экспрессия гена, можно порекомендовать удалять большей частью все векторные последовательности из клонируемого гена до внедрения его в зародышевую линию млекопитающих, таких как мышь. Векторные последовательности можно удалять в соответствии с сайтами ограничения, представленными на векторе, путем использования рестриктаз, известными методами, с получением фрагментов, несущих желаемый ген, промоутеров, усиливающих агентов и тому подобное. Уровень экспрессии интродуцированного гена в основном зависит от силы промоутера и количества копий интегрированной ДНК в трансфектированных клетках. Поэтому в векторах экспрессии применяют очень сильные промоутеры, такие как передний или задний промоутер SV40 (SV40 early или late), непосредственно передний(СМУ-ГЕ) промоутер цитомегаловируса, промоутер цитоплазматического β-актина и основной задний промоутер аденовируса.
Успешность доставки ДНК в клетку можно предварительно оценить по экспрессии гена "репортера". Ген репортер является компонентом ДНК, используемым для трансформации, и может быть таким же или иным, чем трансген, придающий другое желаемое свойство. Свойство, придаваемое трансформированной клетке или ткани геном репортером, обычно легко прослеживается (выявляется) при помощи гистохимических или флуоресцентных анализов. Для количественного определения эффективности транссфекции существует ряд часто используемых in vitro генов-репортеров, а также большое число плазмид и векторов клонирования, содержащих репортерные гены, коммерчески доступных от хорошо известных специалистам источников, таких как Stratogene, Inc., LaJolla, СА и Clontech Laboratories, Inc., Palo Alto, СА. Образцы генов-репортеров для использования в настоящем изобретении включают, но не ограничены секретируемой щелочной фосфатозой (secreted alkaline phosphatase, SEAP), β-галактозидазой (β-gal), люциферазой светлячка и хлорамфеникол ацетилтрансферазой (chloramphenicol acetyltransferase GUS), а люциферазные тесты также пригодны для in situ обнаружения переноса гена либо в фиксированных клетках либо на гистологических срезах. Эти методики позволяют, после окрашивания энзиматическими субстратами или антителами, визуализировать трансфектные клетки. Из этих in situ методик широко используемым способом, благодаря его простоте и чувствительности, является окрашивание β-gal после экспрессии гена LacZ в Escherichia coli. В данной методике реакция β-gal с X-gal субстратом дает яркий голубой цвет, который легко заметен под оптическим микроскопом и обеспечивает прямое определение эффективности переноса.
Флуоресцирующий зеленым белок (GFP) медузы Aequorea victoria стал важным репортером для мониторинга экспрессии генов и локализации белков в самых разных клетках и организмах {R.Y.Tsien, Annu. Rev. Biochem., 67, 509 (1998); G.Zhang et al., Biochemical and Biotechnology 15, 458-460 (1997)}. Поскольку для выявления GFP не нужно никакого субстрата, он может быть походящим маркером для отбора трансгенных эмбрионов. GFP, экспрессированный в эукариотических клетках, проявляет зеленую флюоресценцию, когда клетки возбуждают УФ или синим светом. Хромофор в GFP присущ первичной структуре протеина, и флюоресценция GFP не требует дополнительных кофакторов, субстратов или дополнительных генетических продуктов. Флуоресценция GFP стабильна, не зависит от вида и может отслеживаться без внутреннего вмешательства, с применением методик флуоресцентной микроскопии, поточной цитометрии и визуально под микроскопом. Для увеличения интенсивности флуоресценции GFP при возбуждении синим светом был разработан усиленный вариант GFP (EGFP) (pEGFP-Cl, можно приобрести в Clontech Laboratories), который, для запуска экспрессии EGFP гена в клетках млекопитающих, содержит немедленный ранний промоутер сигналов полиадениляции CMW и SV40 человека.
Смешивание сперматозоидов с векторным фрагментом, содержащим желаемый трансген
Приготовленные, как описано выше, сперматозоиды можно смешать с фрагментом вектора без дальнейшей подготовки (свежие) или после того, как они были подвергнуты одному из трех описанных выше способов разрушения мембраны. В типичном способе смешивания, 1 мкл раствора ДНК, содержащей фрагмент вектора (примерно 2,5 нг/мкл) смешивают с 9 мкл суспензии, содержащей примерно от 2 до 5×105 сперматозоидов в физиологической среде, такой как CZB или NIM и перемешивают пипеттированием для получения конечной концентрации фрагментов ДНК, равной 7 нг/мкл. Смесь инкубируют при комнатной температуре (примерно 25°С) или на льду в течение от примерно 30 с до примерно 5 мин, обычно от примерно 45 с до примерно 3 мин, чаще от примерно одной до примерно 3 мин, предпочтительно около 1 мин. Концентрацию спермиев и фрагментов ДНК можно варьировать, так же как и время инкубации и температуры, в зависимости от размера фрагмента или размера спермия и тому подобного, как это известно специалистам.
Микроинъекцию смеси сперматозоидов и фрагментов ДНК обычно проводят при комнатной температуре в течение одного часа после смешивания спермиев и ДИК или в течение одного часа после удаления мембран спермиев.
Ооциты-реципиенты
Ооциты - реципиенты, которые можно использовать по способу изобретения, включают как незрелые (т.е. стадия GV), которые впоследствии дозревают in vitro, так и зрелые (т.е. стадия Мет II) ооциты, которые отбирают у животных. Зрелые ооциты можно получить, например, вызвав суперовуляцию у животных путем инъекции гонадотропных или других гормонов (например, последовательным назначением лошадиного и человеческого хорионального гонадотропина) и хирургическим отбором яиц вскоре после овуляции (т.е. через 80-84 часа после начала эструса у домашней кошки, через 72-96 часов после начала эструса у коровы и через 13-15 часов после начала эструса у мыши). Там, где возможно получение только незрелых ооцитов, их культивируют в ускоряющей созревание среде до тех пор, пока они не достигнут стадии Метафазы II, этот процесс известен как вызревание in vitro (in vitro maturation, "TVM"). Способы для IVM незрелых ооцитов коровы описаны в W098/07841, а для незрелых ооцитов мыши - Eppig and Telfer (Methods in Embriology 225, 77-84, Academic Press, 1993).
Ранее было известно, что стадия созревания ооцитов in vitro очень важна для успешного применения способов in vitro пересадки ядер для получения эмбрионов. Известно, что химизм цитоплазмы ооцита меняется в процессе созревания. Например, активность цитоплазмы, связанная с созреванием, фактор ускорения метафазы (metaphase promoting factor, "MPF"), высок в незрелых ооцитах на стадии метафазы первого мейотического деления, снижается с образованием и выталкиванием первого полярного тельца и снова достигает высоких значений на стадии Метафазы II. Активность MPF остается высокой у ооцитов, задержанных на стадии Метафазы II, и быстро снижается после активации ооцитов. В общем, работы по пересадке ядер у млекопитающих описывают использование в качестве реципиентов ооцитов на стадии Метафазы II. Ооциты на стадии Метафазы II относятся к типу, готовому быть активированными оплодотворяющими сперматозоидами. Когда ядро вводят в цитоплазму неоплодотворенного ооцита на стадии Метафазы II (т.е. ооцита с высокой активностью MPF), оболочка ядра (если она имеется) клетки разрушается и хроматин конденсируется, что приводит к образованию метафазных хромосом.
Ооциты реципиенты хирургически отбирают из яйцеводов в виде комплексов ооцитов и клеток кумулюса и помещают в забуференную среду, такую как среда Hepez-CZB (приведена ниже). Клетки кумулгоса диспергируют при помощи диспергирующих 4 ферментов, таких как 0,1% гиалуронидаза яичек быка (например, 300 USP единиц/мг, ICN Pharmaceuticals, Costa Mesa, CA). Предпочтительно хранить освобожденные от клеток кумулюса ооциты при 37°С под минеральным маслом (таким, какое можно приобрести у E.R.Squibb and Sons, Princeton, NJ) в среде, такой как среда CZB, уравновешенная при 5% (об./об.) СО2 в воздухе, в течение времени не более одного часа до дальнейшей обработки.
Компоненты спермия, необходимые для успешного оплодотворения in vitro
Известно, что нормального оплодотворения у мыши можно добиться путем инъекции изолированных головок сперматозоидов в ооциты и что плазменные и акрос